Università “Primo Levi”
Primo Levi 2013
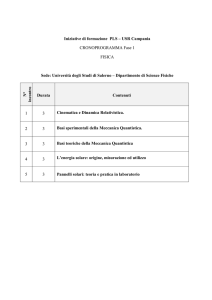
Le forze fondamentali e la fisica dei quanta
INAF Osservatorio Astronomico di Bologna
via Ranzani, 1 40127 - Bologna - Italia
Tel, 051-2095721 Fax, 051-2095700
http://www.bo.astro.it/~bedogni/primolevi
Email :[email protected]
Meccanica quantistica
La meccanica quantistica o fisica quantistica è un complesso di teorie fisiche
formulate nella prima metà del ventesimo secolo che descrivono il comportamento
della materia a livello microscopico
cioè a lunghezze inferiori o dell'ordine di quelle dell'atomo (~10
dove viene meno la meccanica classica deterministica
-8
cm)
Essa permette di interpretare e quantificare fenomeni che, nell'opinione della
maggior parte dei fisici contemporanei, non possono essere descritti con la
meccanica classica.
Il quanto di azione
L'idea di Planck del «quanto di azione» è basta sul fatto che la radiazione emessa dal
corpo nero è costituita da una serie discontinua di atti elementari, ad ognuno dei quali
è associata un di pacchetto di energia proporzionale alla frequenza della radiazione
E=hν,
tramite la costante universale, che è la costante di Planck
h=6,626 ·10 -27 erg sec
Il quanto di azione è la più piccola quantità di energia presente in natura.
, e per questo viene detta “elementare”
Essa determina un “discontinuità” nella misura dell’energia.
Non esiste un’energia che sia un frazione dell’energia del quanto di azione !
L’effetto fotoelettrico
Solo dopo che gli elettroni furono ufficialmente riconosciuti, mediante le misure
della carica e della massa fatte da Thomson, si capì che il fenomeno, chiamato
poi effetto fotoelettrico, era dovuto all’emissione elettronica provocata nel
metallo da radiazioni elettromagnetiche di opportuna frequenza.
In sintesi quando una superficie metallica viene colpita da radiazioni di
frequenza
sufficientemente elevata, come raggi X, raggi ultravioletti e
radiazioni luminose, essa emette elettroni.
L’effetto fotoelettrico -luce ed elettroni
1.
2.
Si ha emissione elettronica solo se la frequenza della radiazione incidente è
maggiore di un certo valore limite ν0, dipendente dalla natura del modello,
chiamato soglia fotoelettrica (E = W > h ν 0 )
Due fatti sono evidenti nello studio dell’effetto fotoelettrico:
L’energia cinetica degli elettroni emessi dipende dalla frequenza della
radiazione incidente e non dalla sua intensità
Il numero degli elettroni emessi per unità di tempo aumenta all’aumentare
dell’intensità della radiazione elettromagnetica incidente.
La spiegazione di Einstein dell’effetto fotoelettrico
La relazione introdotta da Einstein portò alla spiegazione dell’effetto fotoelettrico
utilizzando il quanto di azione già introdotto da Planck per il corpo nero:
(E=½ m v max2 )= h ν - w0
dove w0 rappresenta il lavoro di estrazione degli elettroni dal metallo
fotosensibile, e vmax la velocità massima con cui gli elettroni sono emessi.
Ponendo w0 = h ν 0 si deduce che ν0 rappresenta la frequenza minima, cioè la
soglia fotoelettrica, che deve possedere la radiazione per estrarre un elettrone
dal metallo. Una volta fissata la natura della placca fotosensibile, l’energia con cui
escono gli elettroni dipende esclusivamente dalla frequenza ν della radiazione.
La fisica atomica- il modello atomico di Bohr
Alla fine del 19esimo secolo la fisica aveva già gettato le basi della conoscenza di
molecole ed atomi ma mancava ancora un modello della struttura atomica.
Si sapeva che la forza che teneva “attaccati” gli elettroni al nucleo atomico era
la forza elettromagnetica ma non era chiaro come ne potessero risultare degli
atomi “stabili”.
Infatti un elettrone, orbitando attorno al nucleo atomico secondo un’orbita
simile a quella di un pianeta attorno al Sole, avrebbe perso la sua energia
andando a “cadere” prima o poi sul nucleo atomico.
L’atomo di Idrogeno
Fu Niels Bohr che, recependo l’idea di Planck, e quantizzando le orbite possibili
degli elettroni intorno al nucleo riuscì, come nel caso semplice dell’atomo di
Idrogeno (un solo elettrone che orbita attorno ad un protone) a rendere stabile
l’atomo ed a spiegarne l’emissione spettrale.
Modelli quantistici
Principio di complementarietà
Il corpo nero mette in evidenza come la luce è quantizzata e presenta
una doppia natura ondulatoria- corpuscolare
Ma l’esperimento più importante fu quello di Davison e Germer nel 1929
che mise in evidenza la natura ondulatorio- corpuscolare dell’elettrone con
un esperimento di diffrazione elettronica!
Modelli quantistici
Principio di complementarietà
Questa doppia natura è confermata in maniera ancor più marcata
dall’effetto fotoelettrico e prende il nome di dualità onda-corpuscolo ed è
spesso considerata come una caratteristica fondamentale della teoria
quantistica.
NB vale sia per la luce che per le particelle elementari dotate di massa
come l’elettrone
E’ quindi un principio che tocca nel profondo la natura nel
mondo microscopico
Onda-corpuscolo
L. De Broglie
(1892, 1987)
Louis-Victor de Broglie scoprì che tutte le particelle con una quantità di moto
hanno una lunghezza d'onda, chiamata lunghezza d'onda di de Broglie. Per una
particella relativistica, questa lunghezza d'onda λ è data da:
dove h è la costante di Planck, p è la quantità di moto della particella, m è la
massa della particella, v la velocità della particella e c la velocità della luce.
La Meccanica Quantistica
M. Born
La Meccanica Quantistica
sovrapposizione degli stati”
E. Fermi
ha
come
fondamento
il
“principio
di
Gli stati fisici Æ sono rappresentati come “sovrapposizione di funzioni di
onda”
Solo applicando allo “stato fisico” un “operatore” se ne realizza lo stato
quantico con associato un determinato “livello di probabilità”.
Non esiste separazione tra l’operatore che effettua la misura del sistema
fisico ed lo stato fisico su cui la misura è stata effettuata
Misura e probabilità
“Non mi piace, e mi spiace di
averci avuto a che fare” (Erwin
Schrödinger, parlando della
meccanica quantistica)
“Penso si possa tranquillamente
affermare che nessuno capisce la
meccanica quantistica” (Richard P.
Feynman)
La natura probabilistica della Meccanica Quantistica si manifesta all'atto
della misura.
Esistono in Meccanica Quantistica osservabili incompatibili: si tratta di
coppie di osservabili in cui la conoscenza completa di una delle due porta
ad una «ideterminazione» sull'altra.
Questa non-commutatività si traduce, in termini più facilmente
comprensibili, nel principio di indeterminazione di Heisenberg:
che NB è una conseguenza del Principio di Sovrapposizione da cui può
essere ricavato
Il principio di indeterminazione di Heisenberg
In termini matematici si può scrivere
come:
Δ E · Δ t > (1/2) h dove
¾h=h/2π=1,054·10-27 erg sec è la
costante di Planck ridotta
¾ΔE rappresenta l'incertezza sulla
misura della energia di una
particella
¾Δt rappresenta l'incertezza sulla
misura del tempo di una particella
Analogamente alla coppia tempo-energia il principio di Heisenberg vale
anche per la coppia posizione-impulso
Dal valore estremamente piccolo di questa costante, h, si può facilmente
comprendere che l'effetto di tale principio è irrilevante nel mondo
"macroscopico" in cui viviamo.
Determinismo ed indeterminismo
La Meccanica Quantistica non è una "teoria deterministica" e questa èuna
proprietà fondamentale ed ineliminabile del mondo atomico.
Il fatto che non possiamo conoscere contemporaneamente posizione e moto
oppure energia e tempo di una particella non deve essere considerata un
effetto d'incapacità sperimentale o di una mancanza di risoluzione degli
strumenti ma dipende intrinsecamente dalla natura delle cose.
La struttura sub-atomica secondo la QCD
Proprietà delle interazioni fondamentali
Teoria
Interazione
Mediatore
Intensità
relativa
Andamento
Raggio
d’azione
10
Cromo
dinamica
Forte
gluone
10
38
1
Elettro
dinamica
Elettromagnetica fotone
10
36
1/r
Sapore
dinamica
Debole
10
25
1/r to 1/r
Geometro Gravità
dinamica
We
Z bosoni
gravitoni
0
10
2
5
1/r
2
-15
m
infinito
7
10
-16
m
infinito
Le “dimensioni” in fisica atomica
Il mondo microscopico può essere definito secondo alcune semplici scale e
dimensioni:
1. Raggio di Bohr : r
Bohr
~ 5,29 x 10-9 cm ~ 5,29 x 10-11 m
2. Il raggio dell’elettrone: r
elettrone
3. Il raggio di Fermi : r
~ 10-15
Fermi
~ 2,81 x 10-13 cm ~ 2,81 x 10
-15
m
Il Modello Standard delle particelle elementari
I fisici hanno elaborato una teoria, chiamata Modello Standard, che vuole
descrivere sia la materia che tutte le forze dell'universo (esclusa la gravità).
La sua bellezza sta nella capacità di spiegare centinaia di particelle e
interazioni complesse con poche particelle e interazioni
Fusione nucleare – effetto tunnel
Fusione nucleare – effetto tunnel
+
Forza di Repulsione
Coloumbiana
R0
<10—13
cm
R
Forza di attrazione
NUCLEARE
R
+