
INDICE
ZELO BUON PERSICO
PREMESSA
LA STORIA PASSATA
STORIA RECENTE E RIQUALIFICAZIONE DEL TERRITORIO
IL PERCORSO DELL’ACQUA
I FONTANILI
I PESCI E GLI OSSERVATORI SUBACQUEI
ANGUILLA
BARBO
CARASSIO DORATO O PESCE ROSSO
CARPA ERBIVORA O AMUR
CARPA KOI
CARPA REGINA, A SPECCHIO, NUDA
CAVEDANO
LUCCIO
PESCE GATTO
PERSICO
PERSICO TROTA O BOCCALONE
SALMERINO DI FONTE
SILURO
STORIONI
TEMOLO
TINCA
TROTA FARIO
TROTA GIALLA O GIAPPONESE
TROTA IRIDEA
TROTA MORMORATA
UCCELLI
AIRONE CENERINO
FOLAGA
GALLINELLA D’ACQUA
CIGNI NERI
ANFIBI
RETTILI
RECINTO DAINI E ANATIDI VARI
MINIFATTORIA
GLI ALBERI E GLI ARBUSTI
LA VEGETAZIONE ACQUATICA
LA CATENA ALIMENTARE
STRUTTURE A PARCO GIOCHI
I NOSTRI PRODOTTI
PAGINA SPONSOR
PIANTINA DEL PARCO
3
4
5
7
9
11
13
15
16
17
18
19
20
21
22
23
24
25
26
27
28
32
33
34
35
36
37
38
40
42
43
44
45
46
47
48
49
52
54
58
59
60
30-31
3
4
ZELO BUON PERSICO
Zelo Buon Persico un tempo era chiamato Agellum
Gomperticum cioè “piccolo podere di Gomberto” poiché ai tempi dei
Romani era situato tra due grandi tenute agricole: Agrum Marcianum
(da cui l’odierna Marzano) e Agrum Mutianum ( oggi Muzzano).
Oltre alle gentes (famiglie) Marcia e Mutia che diedero il nome ai loro
poderi Marcianum e Mutianum, altre famiglie si insediarono nella zona
dando vita ad altri agri come Balbianum (Balbiano) e Villam
Pulpignanam ( Villa Pompeiana).
Il lavoro di bonifica e di regimazione delle abbondanti acque fluviali e
di risorgiva presenti nella zona permise alle gentes di trasformare il
teritorio di Zelo Buon Persico in un fiorente paese agricolo.
Ancora oggi Zelo Buon Persico si può considerare un tradizionale centro agricolo grazie alle diverse amministrazioni che si sono sempre
impegnate affinché lo sviluppo del territorio mantenesse la sua tradizionale vocazione agricola.
Il nostro paese può vantare inoltre un ambiente di grande interesse
naturalistico caratterizzato soprattutto dalla presenza del fiume Adda
e dei numerosi fontanili che danno vita ai tipici ecosistemi delle zone
umide ricchi di specie faunistiche e vegetazionali.
La vocazione naturalistica e agricola del nostro territorio ha portato in
questi ultimi anni all’istituzione del Parco dell’Adda Sud come garante
della valorizzazione e conservazione di tutta l’area interessata dal
fiume.
In questo contesto anche il Parco Ittico Paradiso contribuisce attualmente alla protezione del nostro ambiente offrendo inoltre un laboratorio didattico all’aperto dove i visitatori possono approfondire le loro
conoscenze naturalistiche.
5
PREMESSA
Il presente volumetto vuole essere solo una piccola guida che si
prefigge lo scopo di accompagnare per mano il visitatore durante la permanenza al Parco Ittico Paradiso illustrandogli in
maniera semplice e didattica le cose più interessanti e visibili
che possono essere osservate lungo il percorso.
Lo stesso pertanto, anche a causa della sua brevità, non ha alcuna pretesa di scientificità.
6
LA STORIA PASSATA
Nei tempi passati, cioè fin verso il 1100, dove oggi c’è Zelo
Buon Persico, esisteva un ampio lago chiamato Gerundo alimentato
dalle acque dell’Adda, dell’Oglio e delle risorgive di terrazzo, che si
estendeva in un’ampia depressione della pianura padana, tra paludi ed
acquitrini nell’area compresa fra l’attuale corso dell’Adda ed il territorio cremasco.
Secondo un’antica leggenda medievale il lago era abitato dal drago
Tarantasio che terrorizzava le popolazioni locali.
Sulle sponde del lago e precisamente in località Villa Pompeiana, alcuni studiosi ipotizzano vi fosse l’esistenza di un porto fluviale e una Villa
romana fatta costruire, intorno al 120 a.c. dal patrizio Gneo Pompeo
Strabone, padre di Pompeo Magno di cui però si sono perse le tracce.
Intorno al 222 a.c. i Romani si insediarono sul territorio con numerose
famiglie iniziando a bonificare il terreno, a prosciugare gli acquitrini e
a canalizzare le acque.
L’attuale canale muzzetta risale ad epoca romana e prende il nome
dalla famiglia Mutia che lo realizzò dandogli il nome di Acqua Mutiana.
Dopo i periodi bui delle invasioni barbariche la cura del territorio riprese slancio con l’avvento degli ordini monastici, i frati benedettini prima
e i frati cistercensi poi, che contribuirono in maniera determinante alla
integrale bonifica di tutto il territorio regimentando e canalizzando le
acque di superficie e prosciugando le zone paludose ed acquitrinose.
L’assetto definitivo della zona è del periodo 1220-1230 con la costruzione di una grande opera di ingegneria idraulica, recuperando un
ramo seminterrato del fiume Adda detto Addetta.
Il nuovo canale fu chiamato Adda Nuova ma ben presto rubò il nome
all’Acqua Mutia prendendo il nome di Muzza mentre il preesistente
canale romano a causa delle sue ridotte dimensioni fu ribattezzato
Muzzetta.
Nomi ancora attuali.
7
8
STORIA RECENTE
E RIQUALIFICAZIONE DEL TERRITORIO
Il Parco Ittico Paradiso è esteso 130.000 mq e molto tempo fa era parte
integrante del fiume Adda, il quale ad un certo punto della sua storia
ha deviato il suo corso, lasciando quest’ansa abbandonata ricca di ghiaia e sabbia ma povera di humus.
Negli anni 80, essendo il terreno scadente sotto il profilo agricolo e
grazie all’ottima qualità dell’acqua sorgiva di cui è ricco il territorio è
stato realizzato un allevamento ittico per la piscicoltura intensiva, scavando 3 canali paralleli e numerosi stagni.
Questo allevamento ha lavorato per vari anni finchè nuove tecniche
industriali della piscicoltura
hanno soppiantato gli allevamenti tradizionali rendendoli
antieconomici ed obsoleti.
Intanto il territorio si era arricchito di numerose piante ripariali,
quali tifa maggiore e minore,
sparganio, cannucce, carici e
giunchi e da varie piante acquatiche caratteristiche delle aste
dei fontanili.
Una discreta fauna selvatica
costituita da gallinelle d’acqua,
folaghe, tuffetti e saltuariamente
anatidi oltre che numerosi aironi
cenerini e nitticore e una modesta varietà di avifauna minore fra
cui martin pescatore, pendolino
e falco pescatore in cerca di
prede lungo i canali e gli stagni
si era insediata.
Queste osservazioni hanno fatto
sorgere l’idea della possibilità di
9
trasformare l’allevamento in una struttura naturalistica culturale,
destinata alla pubblica fruizione.
Furono modificati i percorsi dei canali destinati alla piscicoltura, troppo rettilinei ed uniformi, con la creazione di anse, biforcazioni e
laghetti, realizzando un apposito percorso che riproduceva le differenti zonizzazioni biologiche di un fiume, sia attraverso la scelta selettiva
delle essenze arboree da piantumare sulle sponde, che ripopolando i
canali con le specie ittiche proprie delle specifiche zone del corso di
un fiume.
Per rendere più interessante l’osservazione dell’ittiofauna furono realizzati alcuni osservatori subacquei in modo da poter ammirare i pesci
nel loro ambiente naturale. La possibilità di osservare i pesci sott’acqua, in ambienti molto simili a quelli dei corpi idrici naturali capovolge l’abituale logica degli acquari in quanto, nel caso del Parco Ittico
Paradiso, sono i visitatori e non i pesci ad essere ospiti temporanei di
vasche dalle quali osservare pesci di varie specie, caratteristici dei differenti ambienti del fiume, in movimento libero, in spazi di ampie
dimensioni, realizzando di fatto il primo allestimento del genere in
Italia e con ogni probabilità in Europa.
10
IL PERCORSO DELL’ACQUA
Le acque che alimentano il Parco Ittico Paradiso, circa 1000
litri/secondo, nascono in Comune di Zelo Buon Persico in località
Casolate e Mignete dal colo della grande palude del Mortone alimentata a sua volta da varie risorgenze idriche di terrazzo.
Le acque sono di ottima qualità, hanno caratteristiche chimico
fisiche costanti unitamente alla portata e alla temperatura che si
aggira sui 13 gradi.
Queste caratteristiche consentono la permanenza nei canali del
parco di numerose specie di pesci che avrebbero esigenze vitali
diverse ma che hanno in comune la possibilità di poter vivere
alla suddetta temperatura.
Infatti mentre per i salmonidi le acque risultano leggermente
calde per i ciprinidi risultano leggermente fredde.
L’acqua derivata dal Mortone
entra all’estremità del Parco ove
è ubicata la “Sorgente del
Paradiso” per alimentare i tre
canali in cui si articola e si sviluppa l’intero percorso.
Nello slargo, dal quale partono i
tre canali, è posizionata una
idrovora che, quando necessario
solleva l’acqua ad un sovrastante stagno di carico dal quale, per
mezzo di tubazioni e per semplice caduta, viene convogliata in tutti gli stagni di riproduzione.
Tutte le acque, sia quelle dei canali che quelle degli stagni in
occasione del loro vuotamento, confluiscono in unico collettore
che si versa nel canale Muzzetta che a sua volta si scarica nel
fiume Adda.
11
12
I FONTANILI
All’interno del Parco Ittico Paradiso sono osservabili alcuni fontanili dai
quali sgorga un’ottima acqua che si solleva di alcuni centimetri al di
sopra dell’acqua dei canali.
Ve ne raccontiamo la storia. Le acque defluenti dalle Prealpi vengono
assorbite dalle rocce calcaree sprofondando fino ai sedimenti ghiaiosi
e sabbiosi della pianura per formare le falde acquifere sotterranee che
penetrano nel sottosuolo verso la pianura ed il Po.
Le acque quindi migrano verso la pianura padana che è una conca
depressa, compresa fra le Alpi e gli Appennini.
La base della stessa è formata da rocce sulle quali si sono stratificati
vari depositi ghiaiosi, sabbiosi o argillosi variamente permeabili.
Quando le acque sotterranee incontrano la spessa barriera di strati di
argilla impermeabile che costituisce la pianura padana sono costrette a risalire verso la superficie
affiorando.
La risalita in superficie o risorgenza,
da cui anche il nome di risorgiva,
dà luogo ad un fenomeno idrogeologico tipico che prende il nome di
fontanili che risulta la prova palese
degli importanti rapporti intercorrenti tra l’alta pianura, piovosa e in
gran parte permeabile e la bassa pianura meno piovosa ed impermeabile tuttavia ricca di corsi d’acqua superficiali alimentati dalle acque
piovane dell’alta pianura.
La portata dei fontanili è molto variabile e risulta compresa fra pochi
litri/secondo e un massimo di 1000 litri/secondo.
Per agevolare e convogliare l’affioramento delle acque sotterranee le
stesse vengono raggiunte da tubi in ferro il cui diametro inferiore è
maggiore della bocca di uscita attraverso la quale l’acqua si sopraeleva di alcuni centimetri al di sopra del pelo dell’acqua
circostante.
13
Poiché tali acque sono di provenienza sotterranea profonda mantengono anche d’inverno una temperatura sensibilmente più elevata di
quella esterna non consentendo alla stessa di gelare anche durantegli inverni molto rigidi.
Le oscillazioni termiche massime riscontrate raggiungono valori intorno ai 6 gradi centigradi essendo contenute fra i 10 gradi di minima,
durante il mese di marzo, e i 16 gradi di massima durante il mese di
ottobre.
La temperatura dell’acqua dei fontanili presenti nel Parco Ittico
Paradiso è costante e si aggira sui 13 gradi risultando ottimale anche
per la sua elevata purezza per la vita di tutti i pesci presenti nel parco.
14
I PESCI E GLI OSSERVATORI SUBACQUEI
I pesci appartengono ad una superclasse di vertebrati acquatici eterotermi, cioè con una temperatura corporea simile a quella dell’ambiente circostante, forniti di uno scheletro interno. Dispongono di mascelle
ossee.
A seconda dei tipi di pesce e delle loro diete alimentari gli stessi possono avere denti più o meno sviluppati e numerosi disposti sulla mandibola, sulla mascella, sulla lingua e sul palato oppure dei denti faringei che si trovano sulle ossa faringee inferiori.
La respirazione normalmente avviene attraverso le branchie che sono
costituite da una serie di numerose lamelle abbondantemente irrorate di sangue in comunicazione con la bocca e protette sull’esterno dagli
opercoli.
In Africa esistono delle specie che oltre alla respirazione branchiale
possiedono anche una respirazione polmonare sussidiaria.
Il corpo del pesce può essere suddiviso in tre parti principali:
la testa che va dall’inizio del muso fino al margine
posteriore dell’opercolo
il tronco che va dalla fine dell’opercolo all’ano
la coda che va dall’ano al termine della coda
Organi particolari ed esclusivi dei pesci sono:
la vescica natatoria che è un organo interno preposto
all’equilibrio.
Essa è piena di azoto, ossigeno e anidride carbonica, svolge una funzione idrostatica ed il pesce vi immette od espelle
aria, sia per
adattarsi alle diverse pressioni dell’ambiente acquatico che per andare
verso la superficie od il fondo;
la linea laterale che è un organo sensoriale costituito da una serie di minuscoli forellini disposti lungo la linea
mediana del fianco (in molti casi evidente e ben visibile) in
collegamento con terminazioni nervose che recepiscono sia i
movimenti dell’acqua che le variazioni di pressione mettendo
il pesce in grado di percepire cosa avviene attorno a lui pur
in presenza di buio totale ed in assenza di qualsiasi suono.
15
Gli organi di propulsione, direzione ed equilibrio sono costituiti dalle
pinne che sono delle sottili membrane sostenute da raggi generalmente rigidi.
Le pinne a seconda della loro posizione nel corpo si distinguono in:
pinne pettorali, poste sui fianchi subito dopo l’opercolo
pinne ventrali, poste sul ventre fra la testa e la pinna anale
pinna anale, posta sul ventre tra l’ano e la coda
prima pinna dorsale, posta sul dorso fra la testa e la
seconda pinna dorsale
seconda pinna dorsale, posta fra la prima pinna dorsale e
la pinna caudale
pinna caudale o coda
La suddetta divisione non è rigida in quanto non tutti i pesci possiedono il medesimo numero di pinne.
Dagli osservatori il più attento e paziente visitatore non ha solo la possibilità di vedere i pesci più grandi e appariscenti, osservando attentamente, noterà anche depositi di micro uova, di ragni acquatici, di
parassiti dei pesci ma anche insetti e crostacei.
16
ANGUILLA (Anguilla anguilla)
FAMIGLIA: Anguillidi
MORFOLOGIA: corpo molto allungato e serpentiforme, colorazione molto
scura sul dorso, giallastra o grigia sul ventre; pinna dorsale, caudale ed
anale fuse in un’unica pinna; mancano le pinne ventrali; squame piccolissime e cute molto scivolosa per l’abbondanza di muco prodotto da
apposite cellule cutanee.
TAGLIA: può raggiungere 150 cm di lunghezza. Il peso può raggiungere,
eccezionalmente, i 6 kg. Le femmine (capitoni) possono arrivare ai 40
anni di vita, i maschi superano raramente i 15 anni.
DISTRIBUZIONE: nelle acque salmastre costiere ed in ogni tipo di acque
interne, non oltre i 400 metri s.l.m..
HABITAT: per riprodursi migra dalle acque interne al mare, pertanto è
specie“catadroma”. predilige gli ambienti con fondali melmosi, ma si
adatta a qualunque ambiente d’acqua dolce.
ALIMENTAZIONE: invertebrati acquatici, piccoli pesci ed uova di pesce in
attesa di schiusa, rane girini, vermi.
RIPRODUZIONE: è stato verificato che la riproduzione dell’anguilla europea avviene nell’Oceano Atlantico, nel Mar dei Sargassi.
Le larve, dette “leptocefali”, vengono trasportate dalle correnti marine
verso le coste europee, per un viaggio della durata di 2 o 3 anni.
Raggiunte le foci dei grandi fiumi europei, subiscono una metamorfosi e assumono l’aspetto di anguille trasparenti, misurando circa 6-8 cm;
in questa fase sono dette “cieche”.
In primavera/estate, risalgono i fiumi ripopolando le acque interne,
i maschi si accrescono fino al raggiungimento della maturità sessuale, che avviene intorno agli 8-10
anni, quando misurano circa 40-45
cm.
Le femmine, invece, raggiungono
la loro maturità sessuale solo dopo
diversi
anni
dai
maschi.
All’approssimarsi del periodo riproduttivo iniziano la migrazione verso
il mare.
17
BARBO (Barbus plebejus)
FAMIGLIA: Ciprinidi
MORFOLOGIA: forma affusolata, profilo dorsale maggiormente convesso di quello ventrale; testa appuntita rivolta verso il basso con
bocca inferiore e labbra carnose, presenza di quattro barbigli; colorazione verdastra sul dorso più o meno punteggiata di nero (soprattutto neigiovani), giallo dorata sui fianchi e biancastra sul ventre.
TAGLIA: eccezionalmente supera i 60 cm di lunghezza e i 4 kg di peso;
raramente vengono catturati esemplari che superano i 2 kg.
DISTRIBUZIONE: nelle acque dolci italiane,escluse le isole.
HABITAT: acque limpide non troppo fredde,ben ossigenate a correnteveloce con fondo ghiaioso. Il barbo è un ottimo nuotatore potente
ed instancabile.
ALIMENTAZIONE: invertebrati di fondo, materiale vegetale, crostacei,
larve d’insetti, molluschi e uova di pesci.
RIPRODUZIONE: avviene da aprile a giugno, in acque limpide e abbastanza profonde, a seconda delle condizioni ambientali.
Nel periodo della “frega” i barbi si riuniscono in grossi branchi. Le
uova deposte, di colore giallastro, per un numero di circa 5/10.000
per ogni kg di peso vivo della femmina, aderiscono alla ghiaia, dove
vengono poi fecondate. L’accrescimento è lento, ad un anno di età
raggiunge una lunghezza di circa 8-9 cm e la maturità viene raggiunta intorno ai 4 anni.
18
CARASSIO DORATO O PESCE ROSSO
(Carassius carassius, Carassius auratus)
FAMIGLIA: Ciprinidi
MORFOLOGIA: Specie alloctona originaria dell’Asia orientale. Molto
simile alla carpa dalla quale si differenzia per l’attaccatura della pinna
dorsale che si genera dall’apice dorsale e per la pinna caudale che ha
un margine leggermente concavo. Nel carassio, inoltre, non sono presenti i barbigli. Gli esemplari selvatici del carassio dorato (auratus)
hanno colorazioni molto simili al carassio comune, mentre nelle razze
domestiche il colore tende al rosso dorato.
TAGLIA: eccezionalmente raggiunge 50 cm di lunghezza e i 3 kg di
peso, può raggiungere e superare i 30 anni di vita.
DISTRIBUZIONE: introdotto accidentalmente, è presente in gran parte
della rete delle acque interne. Il pesce rosso (Carassius auratus), simile al carassio, ma di origine cinese, è stato introdotto in Europa, per
scopi ornamentali, da circa 400 anni.
HABITAT: acque ferme o a corso lento e con fondo fangoso. Molto resistente, vive a minime percentuali di ossigeno e sopporta, “infangandosi” temperature molto basse, anche se per riprodursi ha necessità di
acque temperate.
ALIMENTAZIONE: invertebrati di fondo, vegetali,lombrichi, zooplancton
e larve di insetti.
RIPRODUZIONE: per ottenere la riproduzione nel Parco Ittico Paradiso,
dove la temperatura dei canali è relativamente bassa, per la presenza
acque di risorgiva, è necessario trasferire gliesemplari idonei negli stagni dove avverrà riproduzione,
dove l’acqua, nel periodo della
“frega”, che coincide con i mesi da
maggio a giugno, raggiunge la
temperatura di circa 20 gradi. Le
uova deposte dai pesci in numero
di 100/200.000 per kg di peso vivo
aderiscono alla vegetazione del
fondo o delle rive.
19
CARPA ERBIVORA O AMUR
(Ctenopharyngodon idella)
FAMIGLIA: Ciprinidi
MORFOLOGIA: pesce dal corpo robusto, molto allungato, che ricorda il
cavedano. Il dorso è rettilineo ed il muso arrotondato. La bocca senza
barbigli. Il corpo è ricoperto da grandi squame molto evidenti, la sua
livrea è argentata, il ventre è chiaro.
TAGLIA: può raggiungere lunghezze superiori al metro e un peso di
oltre 40 kg.
DISTRIBUZIONE: originario dei grandi fiumi russi e cinesi.
HABITAT: in Italia lo si può trovare nei canali e nei laghetti o in altri
siti dove è stato immesso, anche al fine di contenere il proliferare
della vegetazione acquatica. Vive in acque calme o ferme a percentuali molto basse di ossigeno disciolto. Ha una grande potenza ed è
un ottimo nuotatore.
ALIMENTAZIONE: il “giovane” amur si nutre di zooplancton, mentre da
adulto predilige cibarsi di piante acquatiche, comunque è un pesce
onnivoro.
RIPRODUZIONE: nelle sue acque originarie, in Asia orientale, la riproduzione avviene da aprile e agosto, ad una temperatura di circa 2528° C.
Nelle nostre acque, non si riproduce, a causa delle condizioni climatiche sfavorevoli; la sua riproduzione avviene tramite la fecondazione
artificiale, in ambiente controllato.
20
CARPA KOI
(Cyprinus carpio)
FAMIGLIA: Ciprinidi
ORIGINE: Giappone
Le carpe koi sono in tutto e per tutto simili alle comunissime carpe, sia
nella morfologia che nelle abitudini alimentari e caratteristiche,differiscono dalle stesse in maniera eclatante per la colorazione che può
essere in tinta unita, a due o tre colori.
Si dice che non esistano due koi uguali tra loro.
La storia delle carpe koi inizia intorno al 1600 in Giappone. I ricchi proprietari terrieri importavano le carpe dalla Cina che venivano poi
immesse in bacini di irrigazione e utilizzate a scopo alimentare nei lunghi e freddi inverni.
Nel corso degli anni tra le innumerevoli carpe iniziarono a comparire
esemplari colorati, con riflessiblu o con macchie caratteristiche. A queste carpe i contadini cominciarono a risparmiare la vita per tenerle per
proprio diletto. Nel XVIII secolo ormai venivano allevate non più per
scopo alimentare ma solo a scopo ornamentale. Negli anni 60 con la
comparsadei contenitori di plastica e le bombole d’ossigeno le carpe
koi cominciarono a conquistare il mondo con laloro bellezza, varietà e
spettacolarità prima viaggiando in treno e poi in aereo per sbarcare e
stabilirsi sia in Europa che in America.
In Giappone le carpe ornamentali si differenziano in ben 75 colorazioni differenti.
21
CARPA REGINA
(Cyprinus carpio, C. c. var. specularis, C. c. var. nudus)
FAMIGLIA: Ciprinidi
MORFOLOGIA: Corpo massiccio con dorso arcuato, bocca protrattile con
labbra carnose munite di quattro barbigli, che utilizza nella ricerca del
cibo; squamatura grossa e regolare nelle forme selvatiche; nella varietà a “specchi” è grossa e distribuita irregolarmente sul dorso mentre
quella “nuda” è completamente priva di squame. Ha colorazione
bruno-verde sul dorso, spesso con riflessi bronzei, gialla sul ventre.
TAGLIA: Può raggiungere lunghezze ben superiori al metro e otrepassare i 45 kg di peso. Le femmine vivono più a lungo dei maschi.
Normalmente la vita delle carpe è di 20-22 anni, ma sporadicamente
può arrivare ai 30.
DISTRIBUZIONE: Specie di origine asiatica, è presente, comunque,
nella maggior parte delle nostre acque, a seguito dei massicci e prolungati ripopolamenti di cui è stata oggetto. È da sempre allevata, in
tutto il mondo, per scopi alimentari.
HABITAT: Predilige acque calme e profonde con fondo fangoso ricco di
piante acquatiche. Vive nei grandi laghi,fiumi, ma anche negli stagni e
nelle morte. Sopporta acque con percentuali di ossigeno molto basse.
ALIMENTAZIONE: invertebrati di fondo, larve di insetti, vegetali, vermi,
molluschi, ma anche anfibi ed avannotti.
RIPRODUZIONE: ha luogo in Maggio-Luglio in acque molto basse la cui
temperatura supera i 18/19 gradi. La deposizione avviene, in natura,
in prossimità delle rive, e anche sui prati invasi dalle esondazioni dei
fiumi, qui le uova aderiscono alla
vegetazione sommersa. Vista l’alta
temperatura delle acque, circa 1920°, la schiusa delle uova avviene
dopo soli 5-6-giorni.
NOTE: le carpe, accoppiandosi con i
carassi, danno origine ad ibridi
muniti di due soli barbigli.
22
CAVEDANO
(Leuciscus cephalus)
FAMIGLIA: Ciprinidi
MORFOLOGIA: è probabilmente il pesce più diffuso nei corsi d’acqua
di fondo valle e nei grandi fiumi di pianura.
Ha il corpo cilindrico e affusolato, la bocca grande e il capo massiccio;
le squame sono regolari; la livrea è di colore grigio uniforme con
riflessi argentati o dorati.
TAGLIA: gli esemplari che vivono in acque lacustri, possono superare
i 60 cm di lunghezza e i 3-4 kg di peso.
DISTRIBUZIONE: è presente in tutte le acque dolci interne.
HABITAT: ama acque correnti anche veloci, limpide e sempre ben
ossigenate. I giovani hanno abitudini gregarie, gli adulti hanno sono
più solitari.
ALIMENTAZIONE: praticamente onnivoro; si nutre di larve, insetti,
molluschi, uova, frutti. Gli esemplari adulti diventano predatori, cibandosi di piccoli pesci, in special modo di alborelle.
RIPRODUZIONE: Il periodo riproduttivo “frega” va da aprile a luglio,
ma può variare a seconda delle condizioni ambientali. Il branco si condensa in siti dal fondo sassoso, con acque basse e calme, dove una
femmina di taglia media depone 20/30.000 uova. Dopo un anno
dalla schiusa i cavedani misurano circa 9 cm, di lunghezza; la maturità sessuale è raggiunta dai maschi intorno ai 3-4 anni e dalle femmine ai 4-5 anni.
NOTE: Il cavedano riveste un interesse particolare per la pesca dilettantistica, in quanto presente ovunque.
23
LUCCIO
(Esox lucius)
FAMIGLIA: Esocidi
MORFOLOGIA: corpo allungato, muso prominente ed appiattito con una
caratteristica forma a “becco d’anatra”. La bocca è munita di circa 600
robusti denti disseminati su mascelle, palato, lingua e sulle arcate branchiali e ne fanno un temibile e vorace predatore. Il ventre è biancastro,
la livrea è mimetica e in quanto varia a seconda dell’ambiente.
Le pinne sono abbastanza piccole, la pinna dorsale, posta perpendicolare alla pinna anale, forma con la pinna caudale un potente propulsore che consente al luccio scatti brucianti e improvvisi che gli permettono di catturare le prede.
TAGLIA: può superare il metro di lunghezza e i 25 Kg di peso.
DISTRIBUZIONE: in Italia, è presente in tutte acque di pianura.
HABITAT: ama acque a corrente
lenta o stagnate come le lanche o
morte, con presenza di ricca vegetazione sommersa.
ALIMENTAZIONE: è esclusivamente
carnivora ed è costituita per la maggior parte da altri pesci, oltre che da
anfibi, rettili e piccoli mammiferi. Il
luccio, come predatore, può essere
messo al vertice della catena alimentare dell’ambiente acquatico.
RIPRODUZIONE: all’avvicinarsi del periodo della “frega”, che solitamente avviene da febbraio ad aprile, il luccio risale le acque dei fontanili,
dove in presenza di abbondante vegetazione acquatica la femmina
depone 30/40.000 uova per ogni Kg del proprio peso vivo, che sono
subito fecondate dai maschi.
NOTE: è una specie non facile da allevare in quanto già dai primi giorni vita necessita di alimento vivo. Per la sua aggressività, essendo
anche “cannibale”, non può essere allevato in grandi quantità, ma solo
in allevamenti in estensivo.
24
PESCE GATTO, ALBINO
(Ictalurus melas – I. natalis – I. nebulosus)
FAMIGLIA: Ictaluridi
MORFOLOGIA: corpo arrotondato, testa assai larga e schiacciata. Attorno
all’ampia bocca sono situati 8 barbigli suddivisi in gruppi di due. Gli occhi
sono molto piccoli. Il colore è grigio scuro, quasi nero con sfumature verdastre.
Il pesce gatto ha sia sulla pinna dorsale che sulle pinne pettorali una spina
molto pericolosa, le sue ferite sono dolorose e di difficile emarginazione,
per cui bisogna, se vivo, porre molta attenzione nel maneggiarlo.
TAGLIA: nei suoi luoghi di origine, supera i 50 cm lunghezza ed un peso
superiore ai 2 kg.
In Europa, raggiunge i 40 cm e un peso di circa 1,5 kg.
DISTRIBUZIONE: specie originaria del Nord America, in Europa è stato
introdotto agli inizi del 1900;
HABITAT: preferisce acque calde ed a corso lento con fondo fangoso ed
abbondante vegetazione acquatica.
ALIMENTAZIONE: vorace predatore notturno, si ciba di animali di fondo,
uova, avannotti, invertebrati e anfibi.
RIPRODUZIONE: da marzo a Luglio, in relazione alla temperatura dell’acqua. La femmina depone le uova in un nido ricavato sul fondo tra la
vegetazione. Alla nascita i piccoli nuotano molto vicini tra loro originando una “simpatica” e caratteristica “nuvola” nera. Negli allevamenti italiani, si sta sperimentando l’introduzione di una nuova specie di pesce
gatto, l’Ictalurus punctatus, sempre originario degli Stati Uniti, più facile
da allevare.
25
PESCE PERSICO
(Perca fluviatilis)
FAMIGLIA: Percidi
MORFOLOGIA: il corpo è compresso lateralmente, la pinna dorsale
ben sviluppata con i raggi molto evidenti. La bocca è piccola e munita di piccoli denti. Il colore è variabile, il dorso ed i fianchi sono grigio
verdastri con evidenti e marcate bande verticali nere. Le pinne ventrali ed anali sono colorate dal giallo carico al rosso arancione.
TAGLIA: Può raggiungere i 40/45 cm di lunghezza e Il peso di 2 kg.
Gregario, da giovane forma banchi numerosi.
DISTRIBUZIONE: specie autoctona.
HABITAT: predilige acque lente ed ossigenate, ricche di ghiaia e di
vegetazione acquatica. Popola anche i laghi, le lanche e gli stagni. E’
sensibile all’inquinamento.
ALIMENTAZIONE: in età giovanile si nutre principalmente di zooplancton, di invertebrati acquatici, crostacei, larve e insetti mentre da
adulto preda avannotti, pesci e anfibi.
RIPRODUZIONE: avviene da marzo a luglio ad una temperatura dell’acqua prossima ai 14 gradi: la femmina depone fino a 200.000 minuscole uova per kg di peso, che fissa alla vegetazione del fondo.
NOTE: le sue carni sono apprezzate per la loro prelibatezza.
26
PERSICO TROTA O BOCCALONE
(Micropterus salmoides)
E’ compresso lateralmente; capo grosso e massiccio, bocca molto ampia
con la mandibola inferiore prominente, munita di denti talvolta presenti anche sulla lingua. Pinna dorsale ben sviluppata, con raggi spinosi e
appuntiti. La colorazione è bruna verdastra con una serie di macchie
scure di forma romboidale. Il ventre biancastro, la fascia longitudinale
nerastra è ben delineata, soprattutto nei giovani esemplari.
TAGLIA: raggiunge una lunghezza di 60 cm e il peso di 6-7 kg.
DISTRIBUZIONE: specie originaria Nord America e del Messico
Settentrionale; è più presente nell’Italia del nord.
HABITAT: ambienti lacustri e fluviali con corrente molto lenta, ricchi di
vegetazione acquatica.
ALIMENTAZIONE: prevalentemente carnivora. E’ infatti un predatore
vorace; le sue prede sono principalmente costituite da: pesci, girini,
anfibi, che cattura stando in agguato fra la vegetazione.
RIPRODUZIONE: il periodo di frega coincide va da aprile a giugno, la
femmina depone le uova in una “buca” (nido) preparato dal maschio,
ricavato scavando nella sabbia/ghiaietto del fondo, ripulendolo dal
fango, che protegge fino alla schiusa delle uova.
NOTE: introdotto per la prima volta in Germania nel 1883, oggi, è più
o meno abbondante in tutta Europa.
27
SALMERINO DI FONTE
(Salvelinus alpinus)
FAMIGLIA: Salmonidi
MORFOLOGIA: Il salmerino alpino è la specie autoctona.
MORFOLOGIA: Il Salmerino di fonte o di torrente, differisce dal primo
soprattutto per la colorazione, per il corpo affusolato, il capo massiccio e la bocca ampia. Inoltre, il dorso e la parte superiore dei fianchi
presentano vermicolature bianco-giallastre e verde oliva; la parte
inferiore dei fianchi presenta piccole macchie giallastre ed alcune
rosse con un alone azzurro; il ventre è grigio aranciato, rosso vivo
durante il periodo riproduttivo; le pinne aranciate o rossastre hanno
il primo raggio bianco seguito da una linea nera.
TAGLIA: la lunghezza del salmerino di fonte può superare i 40 cm e
può raggiungere il peso di 3 kg.
DISTRIBUZIONE: il salmerino di fonte si presta bene ad essere allevato in cattività al pari della trota iridea e come l’iridea utilizzato
come pesce di “pronta pesca”, nei ripopolamenti.
HABITAT: il fontinalis predilige acque fredde e correnti ben ossigenate di torrenti e fiumi pedemontani. Non sopporta l’inquinamento,
pertanto funge da buon indicatore biologico della qualità delle
acque.
ALIMENTAZIONE: si nutre principalmente di altri pesci, larve, insetti,
invertebrati e molluschi.
RIPRODUZIONE: tra novembre e febbraio, quando la femmina depone le uova in una buca preparata nel letto del corso d’acqua
NOTE: Specie originaria del
Nordamerica, risulta essere stata
introdotta in Europa nel 1884 e
successivamente, nel 1891, in
Italia, nel Lago d’Idro.
28
PESCE SILURO
(Silurus glanis)
FAMIGLIA: Silurici
MORFOLOGIA: tronco conico, ricoperto di una sostanza viscida e gelatinosa, capo massiccio e appiattito munito di 6 lunghi barbigli molto
mobili, che usa per localizzare la preda.
La bocca è molto ampia e munita di numerosi piccoli denti disposti su
due placche mandibolari. Gli occhi sono piccoli, ma è dotato di un buon
olfatto. La colorazione è variabile, da bruno nerastra sul dorso fino a
schiarirsi sui fianchi, e grigio chiaro del ventre. Le pinna dorsale è
molto piccola e formata da soli 3/5 raggi, mentre la pinna anale è lunghissima e composta da un centinaio di raggi. Anch’esso come il pesce
gatto possiede una spina velenosa che infligge ferite dolorose.
TAGLIA: Può raggiungere taglie
notevoli, bel oltre il metro di
lunghezza e il quintale di peso
DISTRIBUZIONE: purtroppo, introdotto abbastanza recentemente
dall’Est Europa in alcuni stagni
dell’Emilia e nel Po;
HABITAT: ha ormai colonizzato
laghi, fiumi, canali, paludi e altri
corsi d’acqua con acque lente e non
troppo fredde.
ALIMENTAZIONE: si nutre prevalentemente molluschi, crostacei, avannotti di pesci e pesci adulti, uccelli
acquatici che riesce a predare, anfibi e quant’altro riesca ad afferrare.
RIPRODUZIONE: solitamente da maggio a giugno, ma anche in altro
periodo e alle condizioni ambientali. La seconda la femmina depone le
uova in un nido costruito dal maschio, protetto da detriti vegetali. Le
uova vengono sorvegliate dal maschio che le protegge fino al momento della loro schiusa.
NOTE: Dalla Regione Lombardia è considerata specie altamente indesiderata in quanto compromissoria dell’quilibrio biologico delle specie
autoctone presenti nelle proprie acque
29
STORIONI GIGANTI
(Huso huso, Acipenser naccarii, Acipenser sturio, Acipenser trasmontanus)
STORIONE SIBERIANO
(Acipenser Baeri)
FAMIGLIA: Acipenseridi
MORFOLOGIA: gli storioni sono dei veri e propri fossili viventi. La loro
presenza è datata intorno ai 2/300 milioni di anni fa. I caratteri che li
contraddistinguono sono la forma squaliforme, l’incompleta ossificazione dello scheletro che è cartilagineo, la pinna caudale con il lobo
superiore molto più sviluppato di quello inferiore, le cinque serie di
placche o scudi ossei posti longitudinalmente a protezione del corpo.
La bocca, tubiforme e protrattile, serve per aspirare il cibo.
Anteriormente alla bocca sono presenti quattro barbigli,
sfrangiati,sensibilissimi, che servono per sondare il fondo alla ricerca
del cibo. La pelle, che è nuda, è in genere di colore grigio scuro sul
dorso e più chiaro sui fianchi, mentre il ventre è bianco o giallastro.
Nello Storione ladano e comune il muso è allungato. Nello Storione
30
cobice e nello storione bianco del Pacifico il muso è arrotondato.
TAGLIA: lo storione ladano vive oltre i 100 anni e raggiunge oltre i 6
metri di lunghezza e i 1300 kg di peso. È il pesce, in assoluto, più grosso delle nostre acque. Il cobice può arrivare ai 150 cm di lunghezza e
ai 60 kg di peso e lo storione comune ai 2 metri di lunghezza e ai 100
kg di peso. Entrambi vivono fino ai 100 anni. Lo s.bianco del pacifico
vive fino a 100 anni e può superare i 5 metri di lunghezza e pesare
alcuni quintali.
DISTRIBUZIONE: il cobice, il comune e il ladano sono presenti nel bacino del fiume Po e nei suoi affluenti di sinistra e nei corsi d’acqua che
sfociano nell’Adriatico settentrinale. Lo s. bianco del Pacifico è originario del Nordamerica essendo una specie alloctona non è presente nei
corsi d’acqua italiani.
ALIMENTAZIONE: il cobice, il comune e il ladano nell’acqua dolce si
nutrono soprattutto di vermi, molluschi, crostacei, insetti e delle loro
larve mentre in mare predano piccoli pesci oltre che invertebrati
bentonici e detriti organici. Lo s.
bianco del Pacifico si nutre di crostacei planctonici e invertebrati
bentonici. Da adulto diventa ittiofago predando pesci.
RIPRODUZIONE: gli storioni risalgono i grandi fiumi per depositare le
uova nel periodo tra marzo e maggio. Le femmine depongono
20.000/55.000 uova per kg di
peso, di colore grigio-nerastro,
in acqua corrente. Lo s. bianco del
Pacifico raggiunge la maturità sessuale ad un’età compresa tra i 12 e
i 20 anni a seconda che sia maschio
o femmina. Con le uova dello storione si produce il prelibato caviale.
31
TR
O
TA
PE
RS
IC
O
32
SR
E
SC
PE
O
TT
GA
SR
STAGNO DEGLI
CARPE KOI
SR
CARPE KOI
ANATIDI E DAINI
SR
LUCCIO
SR Stagno
Riproduzione
TROTE FARIO
PESC
PERS
STORIONI
E LUCCI
SR
ROTE FARIO
TROTE IRIDEE
PESCE
PERSICO
TROTE MARMORATE
IE
ES TE
ON NA
P
O
AP M
GI AL
E ES
OT T
TRTRO
LA
CU
ST
RI
RIONI
CCI
M
IS
TE
E
PE
RS
IC
O
TR
OT
E
33
SR
TEMOLO RUSSO
(Tolstolobik)
FAMIGLIA: Ciprinidi
MORFOLOGIA: il corpo è robusto e leggermente compresso, la bocca
molto ampia, la testa è massiccia e gli occhi sono posizionati al di
sotto del margine della bocca.
TAGLIA: può raggiungere 1,5 metri di lunghezza ed i 35 kg di peso. Si
presume viva circa 15 anni.
DISTRIBUZIONE: specie di origine asiatica.
HABITAT: ama acque a corso lento, calme e stagnanti. E’ un pesce gregario che vive e si sposta in banchi formati da numerosi individui.
ALIMENTAZIONE: si nutre esclusivamente di fito e zooplancton.
RIPRODUZIONE: in Italia non si riproduce al pari della carpa erbivora
di cui condivide provenienza, habitat e condizioni bioclimatiche.
34
TINCA
(Tinca tinca)
FAMIGLIA: Ciprinidi
MORFOLOGIA: forma del corpo tozza,; bocca terminale con labbra carnose e munite di due barbigli, squame molto piccole, corpo ricoperto
da abbondante secrezione mucosa, pinne molto ampie e arrotondate,
colorazione verdastro giallognolo sul dorso e bianco giallastro sul ventre.
TAGLIA: può raggiungere 6 kg di peso e 65 cm di lunghezza.
DISTRIBUZIONE: è presente su tutto il territorio italiano.
HABITAT: acque calme o ferme, preferibilmente melmose con presenza di abbondante vegetazione acquatica. D’inverno si infossa nella
melma, in una sorta di letargo.
ALIMENTAZIONE: larve, molluschi e residui vegetali.
RIPRODUZIONE: avviene dalla primavera all’estate, a seconda delle
condizioni ambientali; la femmina depone le uova in acque basse e ricche di vegetazione ad una temperatura di circa 19-20 °C; il diametro
delle uova è molto piccolo, pertanto il numero delle uova deposte è
molto elevato, circa 5/600.000 per kg. di peso della femmina. La
maturità sessuale è raggiunta dai maschi a due anni, quando misurano 15 cm, e dalle femmine a tre anni, quando misurano 18 cm.
35
TROTA FARIO
(Salmo trutta fario)
FAMIGLIA: Salmonidi
MORFOLOGIA: è la così detta “Trota di torrente”, sottospecie della
Salmo trutta. La forma del corpo è allungata e leggermente compressa ai lati; la testa è robusta e la bocca è grande, provvista di denti; la
colorazione è caratterizzata dalla presenza di macchie rosse e nere sul
dorso che in genere è grigio verdastro tendente al bruno. Le pinne,
molto sviluppate, le permettono di nuotare, agevolmente, in acque
turbinose, la pinna caudale è ampia e rettilinea.
TAGLIA: può raggiungere taglie notevoli, indicativamente, anche,
oltre i 60/70 cm e un peso di 5 kg. Nei torrenti, raggiunge raramente il kg di peso,
DISTRIBUZIONE: nelle acque correnti di molte regioni italiane. È difficile dire quali popolazioni siano indigene e quali derivino da immissioni di materiale d’allevamento il più delle volte di origine transalpina o nord europea. In natura, sono anche presenti ibridi con la trota
marmorata.
HABITAT: acque a corrente molto rapida, fresche, limpide e ben ossigenate con fondale roccioso, sassoso o ghiaioso.
ALIMENTAZIONE: vermi, crostacei, tricoterri, pesci, avannotti e insetti.
RIPRODUZIONE: avviene, di norma, da Ottobre a Gennaio, ma varia in
relazione alle condizioni climatiche dell’habitat.
La femmina dopo aver scelto il
luogo della deposizione scava una
piccola buca dove depone le uova,
subito fecondate dal maschio. Le
uova restano in incubazione per un
periodo da 2 a 4 mesi a seconda
della temperatura dell’acqua.
NOTE: Raggiunge la maturità sessuale intornoal secondo/terzo
anno di vita.
36
TROTA GIALLA
(Oncorhynchus mykiss)
FAMIGLIA: Salmonidi
MORFOLOGIA: è una varietà di
trota, risultato di numerose ibridazioni interspecifiche e intergeneriche, all’interno del genere Salmo
con la trota iridea, Oncorhynchus
mykiss (già Salmo gairdnerii),
selezionata, per incroci successivi
di esemplari sempre più chiari. Il
colore va dal giallo aranciato al
bianco giallognolo; è presente una
banda rosea che segue la linea
laterale. A causa del suo colore ha assunto le denominazioni di trota
giapponese o albina.
TAGLIA: può raggiungere i 50 cm e un peso di 3 kg.
HABITAT: acque fredde, correnti ben ossigenate con fondo ghiaioso o
sabbioso. Mal sopporta le acque inquinate.
ALIMENTAZIONE: pesci, larve, insetti e lombrichi e tutto quello che
cade in acqua, per tale motivo non si deve assolutamente gettare
loro dei sassi in quanto, potrebbero essere ingeriti con conseguenze
spesso mortali.
RIPRODUZIONE: la “frega” avviene nel periodo da Ottobre a Marzo,
anche se da noi non riesce a riprodursi spontaneamente. La riproduzione “artificiale” avviene tramite la “spremitura” del ventre della
femmina che, indotta, rilascia le uova, successivamente raccolte in
appositi recipienti. I maschi, sempre attraverso la “Spremitura”,
espellono il liquido spermatico che viene versato nei medesimi recipienti contenenti le uova, che vengono così fecondate.
NOTE: introdotta a scopo sperimentale nelle nostre acque, non ha
dato i risultati sperati, anche perché a causa della sua colorazione è
facilmente esposta alla “predazione”.
37
TROTA IRIDEA
(Oncorhyncus mykis)
FAMIGLIA: Salmonidi
MORFOLOGIA: pesce molto agile e veloce dal corpo allungato. Il capo
è massiccio ed è munito di una ampia bocca, armata di numerosi
denti. Una larga banda rosa violaceo attraversa tutto il corpo in corrispondenza della linea laterale. Dorso scuro con fianchi argentei e ventre color crema. Mantello disseminato di numerosi punti neri.
TAGLIA: raggiunge i 70 cm e gli 8 kg.
DISTRIBUZIONE: specie introdotta dal Nord America. Le prime introduzioni avvennero nei laghi alpini del Moncenisio e nei laghi della
Venezia Giulia. Viste le sue caratteristiche, è diffusa su gran parte del
territorio italiano.
HABITAT: acque correnti e ben ossigenate.
ALIMENTAZIONE: insetti, molluschi,pesci, crostacei, tricotteri, libellule
e cavallette..
38
TROTA MARMORATA
(Salmo trutta marmoratus)
FAMIGLIA: Salmonidi
MORFOLOGIA: è una sottospecie della Salmo trutta, presente solo nei
corsi d’acqua di origine alpina che sfociano nel Po e nell’Adriatico.
La forma del corpo è slanciata, il colore è grigio argenteo con macchie
verdastre o brune che scendono ad interessare anche i fianchi; in natura sono frequenti incroci con la Fario, trota che ha una biologia molto
simile a quella della marmorata, che può da origine ad ibridi interfertili.
Negli ibridi con la Fario sono presenti punti rossi.
TAGLIA: può raggiungere dimensioni considerevoli con punte massime
ben oltre il metro di lunghezza e i 15 kg di peso.
DISTRIBUZIONE: è endemica degli affluenti di sinistra del Po e dei corsi
d’acqua che sfociano nell’Alto Adriatico.
HABITAT: le acque correnti dei grandi fiumi di pianura, limpide e ben
ossigenate;
ALIMENTAZIONE: è quasi esclusivamente ittiofaga.
RIPRODUZIONE: da novembre a dicembre, quando depone le uova in
una buca “nido”, ricavata nella ghiaia mediante possenti colpi di coda.
NOTE: vista, anche, la sua facilità ad ibridarsi con la Fario, la sua presenza è a rischio, quasi al limite dell’estinzione.
39
GLI UCCELLI
Gli uccelli sono animali della classe dei vertebrati i cui arti anteriori si
sono adattati al volo trasformandosi in ali. Il loro corpo è coperto di
penne e di piume e la loro bocca è priva di denti. La mascella è protetta da un astuccio corneo che forma il becco.
Lo stesso può assumere svariatissime forme e dimensioni a seconda
del regime alimentare adottato dalla singola specie. Lo stesso può
pertanto essere adatto a raccogliere semi, lacerare la carne, trafiggere prede, filtrare il fango, succhiare il polline, catturare insetti ecc…
Anche la forma delle zampe segue la stessa logica e pertanto le stesse sono adattate per supportare l’animale per il raggiungimento del
massimo risultato nella specifica specializzazione alimentare.
La riproduzione è ovipara. Il numero, il colore, la forma e dimensione
delle uova è estremamente variabile in quanto correlata ad ogni singola specie che a sua volta può modificare la normale deposizione in
relazione alla temperatura dell’ambiente, al momento della deposizione, all’abbondanza o meno di prole, alla presenza di altri con specifici con cui competere ecc.
Anche il nido, che a seconda delle varie specie viene realizzato da uno
o entrambi i genitori, viene costruito con i materiali più disparati, con
le forme più varie e nei posti più singolari a seconda delle esigenze
di ogni singola specie nonché dei materiali e degli ambienti disponibili.
Caso limite quello del pinguino imperatore ( Aptenodytes forsteri) che
nidificando nell’Antartico, e quindi in un ambiente freddo ed inospitale nonché privo di qualsiasi riparo e materiale da costruzione, depone
un solo uovo che viene covato dal maschio che, digiunando, lo tiene
al caldo e al riparo sulle proprie zampe palmate sotto una sacca cutanea che scende fino al suolo, per ben 9 settimane.
La cova viene effettuata da uno o da entrambi i genitori a seconda
della specie.
Nel parco quasi tutte le specie presenti covano le uova alternandosi
entrambi i genitori con l’eccezione dei germani reali.
Negli stessi, a causa del loro dimorfismo sessuale, la cova è affidata
alla sola femmina che dispone di un piumaggio mimetico meno visibile ai predatori naturali.
Infine un semplice cenno sulla differenza fra penne e piume.
40
Le penne sono delle strutture
cave, rigide o semirigide coerenti fra di loro che sono preposte al sostenimento dell’uccello in volo e che assumono il nome di remiganti,
per quelle che ricoprono le
ali e di timoniere per quelle
che costituiscono la coda.
Anche il corpo è ricoperto di
penne più piccole al di sotto
delle quali si trovano le
piume che sono un morbido
insieme di filamenti, non
coerenti fra di loro che svolgono la funzione prioritaria
di termoregolazione della
temperatura corporea proteggendo l’animale dal freddo o dal caldo eccessivo.
Nel parco sono presenti
numerose specie di uccelli
alcune facilmente visibili,
come i germani reali, le folaghe, le gallinelle, gli aironi
cenerini, i cigni bianchi e
neri, le cornacchie, ecc.
Altre sono poco visibili ma facilmente individuabili dal loro canto (
cuculi, usignoli di fiume, cannareccioni, upupe, ecc.), dai loro splendidi ed inconsueti nidi (codibugnoli e pendolini), dai fori lasciati sugli
alberi ( picchi).
Altre specie come il martin pescatore ed il falco di palude, pur presenti, sono invece talmente timorose ed elusive da rendere problematico
l’incontro.
I numerosi nidi artificiali collocati nel parco vengono annualmente
occupati da passeri e cincie, cui sono destinati, oltre che da…. ghiri,
calabroni, vespe che li trovano asciutti e sicuri.
41
AIRONE CENERINO
(Ardea cinerea)
L’airone cenerino è un grande uccello che nonostante la sua notevole dimensione, fino a 91 cm di lunghezza e 170 cm di apertura alare,
difficilmente raggiunge i 2 kg di peso.
Questo determina che lo stesso ha un volo rettilineo, spesso planato,
con un battito lento, che potremmo definire “senza alcuna fatica”.
Durante il volo le ali sono ad arco e la testa è retratta fra le spalle
mentre le zampe sono distese.
Il suo colore è grigio picchiettato di macchie nere all’attaccatura delle
ali e sulla coda. Il ventre è biancastro e sulla testa sono presenti due
penne filiformi erigibili.
I due sessi non sono distinguibili.
L’alimentazione è costituita da rane, rettili, piccoli topi, ma soprattutto pesci quando questa fonte di cibo risulta abbondante.
Caccia in acque basse restando immobile o camminando molto lentamente e trafiggendo le prede con il becco aguzzo con uno scatto
veloce del collo.
Il periodo della riproduzione inizia a febbraio e si protrae per tutta la
primavera.
Il nido molto voluminoso viene realizzato su alberi molto alti, in
genere pioppi, querce o salici, da numerose colonie in luoghi detti
garzaie.
Nel nido vengono deposte da 3 a 5 uova azzurrate macchiettate di
bruno, rossiccio e grigio che vengono covate da entrambi i genitori
per un periodo di 25/28 giorni.
Le zampe sono molto sviluppate ed hanno lunghe dita che gli consentono di camminare agevolmente nell’acqua bassa e nel fango.
Non è in alcun modo un nuotatore.
La presenza dell’airone cenerino nel Parco Ittico Paradiso merita un
discorso a parte in quanto lo stesso, oltre ad essere un sicuro punto
di vanto per il parco, con la sua presenza costante e massiccia determina problemi non marginali di gestione e soprattutto danni economici rilevanti.
Infatti l’airone cenerino è divenuto un uccello stanziale della zona con
la presenza a non più di due chilometri del parco, di una garzaia che,
come già detto, identifica il luogo dove le colonie di aironi nidificano.
Poiché nel 1996 sono stati censiti circa 250 nidi si può ragionevolmente assumere che nella zona la popolazione complessiva, compresi i nidiacei che raggiungono l’involo, sia di non meno di 700-800
individui.
42
Il territorio su cui gli aironi
sono stanziati è percorso da
numerosi corsi d’acqua
primo fra tutti il fiume
Adda, da vari canali grandi e
piccoli quali la Muzza, la
Muzzetta, il Ramello di
S.Antonio, la Fasola, la
Fasolina ecc…, da una
importante zona umida
quale il Mortone, da rare
marcite allagate solo saltuariamente.
Lo stesso è pertanto ricco di
cibo ma può fornire solo
una parte dell’alimentazione necessaria ad una così
numerosa colonia, per altro
in via di crescita esponenziale.
Il Parco Ittico Paradiso con i
suoi canali a corso lento, con
le sue sponde dolci e moderatamente inerbate, con i
numerosi stagni di allevamento, con la concentrazione di pesci di tutte le taglie,
con l’assenza di pericoli, costituisce pertanto un luogo sicuro e privilegiato di approvvigionamento per gli aironi, che stazionano in caccia
perenne sia diurna che notturna.
Questo massiccio prelievo che è stato quantizzato, per differenza fra il
pesce immesso ed il pesce residuo a fine anno, in circa 15-20 quintali è particolarmente spiacevole ed oneroso sia perché si concentra
sulle specie più pregiate e rare quali temoli, lucci, persici reali, persici trota e salmerini, che per il fatto che il pubblico in visita al parco
raramente riesce a vedere gli aironi che si involano non appena lo
avvistano.
Di contro in momenti di assenza di pubblico sono stati contati fino a
62 aironi contemporaneamente.
Al danno si aggiunge la beffa.
43
FOLAGA
(Fulica altra)
La folaga è un uccello di dimensioni medie raggiungendo i 40 cm
di lunghezza e i 900 grammi di
peso.
La sua forma è massiccia e tondeggiante ed il suo colore è uniformemente nero brillante.
E’ di facile riconoscimento in
quanto ha il becco a punta ed una
vistosa placca frontale bianca.
I due sessi non sono distinguibili
se non per una leggera differenza nelle dimensioni.
Le sue ali sono corte e si leva in volo dopo una lunga rincorsa sull’acqua, battendo velocemente le ali, fino a raggiungere la velocità sufficiente all’involo per nascondersi subito dopo nel fitto del canneto.
Le zampe sono corte e di colore verdastro con una membrana interdigitale che le rende atte al nuoto. Ottima nuotatrice.
L’alimentazione è costituita da piccoli pesci, insetti acquatici, vermi,
molluschi nonché germogli, foglie, semi e frutta.
Il periodo della riproduzione inizia nel mese di marzo e si protrae
fino ad agosto.
Sono possibili due nidiate.
Entrambi i genitori allestiscono il nido, abilmente nascosto ed a
forma di coppa, al margine delle lanche o ancorato a piante galleggianti, con frammenti di piante acquatiche.
Nello stesso vengono deposte da 6 a 9 uova di colore grigio, covate
da entrambi i genitori, che si schiudono dopo 21-24 giorni.
Animale molto pauroso e riservato. Nel parco comincia ad accettare
la presenza umana arrivando ad avvicinarsi per accettare del cibo.
44
GALLINELLA D’ACQUA
(Gallinula chloropus)
La gallinella d’acqua è un uccello estremamente comune in tutte le zone
umide sia con acqua corrente che con acqua stagnante purchè fittamente vegetate. Il piumaggio del corpo è bruno oliva scuro con bande grigio
ardesia sui fianchi e sul ventre.
Il sottocoda è bianco, quando cammina muove la coda a scatti scoprendolo in modo molto evidente e caratteristico.
Gli adulti hanno uno scudo frontale ed il becco rosso con una macchia
gialla sulla punta.
I due sessi non sono distinguibili.
La dimensione massima raggiunge i 35 centimetri ed i 400 grammi di
peso.
Le zampe non sono palmate bensì fornite di lunghe dita atte a camminare nei terreni melmosi.
Le gallinelle volano raramente preferendo camminare nell’erba dove
cercano il nutrimento.
In caso di pericolo compiono brevi e rapidi voli nascondendosi rapidamente nella vegetazione ripariale.
L’alimentazione è costituita da erbe, germogli, foglie, semi, girini, chiocciole, lombrichi.
Il periodo della riproduzione è marzo aprile e possono essere fatte due
nidiate.
Il nido fatto con materiali galleggianti è realizzato ed accudito da
entrambi i genitori.
Lo stesso viene accuratamente camuffato nella vegetazione, subito
sopra il pelo dell’acqua, ed ancorato abilmente a piante vive in modo che
in caso di aumento del livello dell’acqua non possa essere trasportato via
dalla corrente.
Vengono deposte da 5 a 11 uova
che sono di colore marrone chiaro
punteggiate di scuro.
Nel periodo della riproduzione i
maschi ingaggiano combattimenti
acquatici molto spettacolari.
Animale generalmente molto schivo. Nel parco si sta abituando alla
presenza umana per cui si è constatato che con il passare del tempo le
gallinelle si fanno avvicinare molto
di più che in passato.
45
CIGNI NERI
(Chenopis atrata)
CLASSE: Uccelli
FAMIGLIA: Anatidi
ORIGINE E HABITAT: specie originaria
dell’Australia e della Tasmania.
Popola le zone ricche d’acqua e di
vegetazione acquatica. Oggi è diffuso
anche in alcune zone dell’Europa e
dell’America. Grazie al bell’aspetto è
facile vederlo negli zoo di tutto il
mondo.
MORFOLOGIA: il cigno nero presenta
una testa più piccola e un collo più
lungo rispetto alle altre specie di cigni. Il mantello ha un colore scuro, quasi
nero, su tutto il corpo ad eccezione delle remiganti, che sono bianche.
Maschio e femmina hanno piumaggio e taglia simili. Il becco è rosso e l’occhio arancione. Le zampe sono di colore grigio scuro.
I giovani cigni hanno piumaggio grigio scuro fino ai tre anni (raggiungimento dell’età riproduttiva). Si adatta molto bene alla cattività ed è anche
un buon riproduttore.
TAGLIA: circa 1,5 metri.
ALIMENTAZIONE E COMPORTAMENTO: La dieta (simile a quella del Cigno
Reale) è a base di pesciolini, molluschi, sementi e germogli che trova in
acqua immergendo il suo lungo collo. E’ un ottimo volatore anche se il
decollo è un po’ laborioso.
RIPRODUZIONE: le coppie, una volta formate, rimangono fisse per sempre. Di costumi stanziali fa il nido, nascosto dalla vegetazione in prossimità dell’acqua, solitamente con paglia ed erbe secche, che la femmina riveste internamente con piume che si strappa dal ventre, dove depone 5 - 8
uova (guscio biancastro) che cova per circa 30-34 giorni. I pulcini, con piumino grigiastro e becco scuro, sono autosufficienti al momento della schiusa, ma seguono e sono protetti dai genitori. Nel periodo riproduttivo il
maschio è molto geloso ed aggressivo. Nella restante parte dell’anno il
cigno nero convive tranquillamente con altre specie di anatidi, anche di
taglia inferiore alla sua. Nel periodo della muta, che dura alcuni giorni, non
è in grado di volare.
46
GLI ANFIBI
Gli anfibi sono animali vertebrati che conducono la loro esistenza sia in
ambiente acquatico che in ambiente subaereo.
Contrariamente a quanto si potrebbe immaginare è abbastanza difficile incontrare anfibi sia negli specchi d’acqua che lungo i canali.
Il fenomeno è dovuto ai numerosi e molteplici predatori di questi animali che popolano il parco che ne decimano la popolazione.
gli anfibi più frequenti sono:
la raganella arborea
la rana verde
la rana di Lataste
il rospo comune
il rospo smeraldino
la salamandra
il tritone punteggiato
il tritone crestato
Hyla arborea
Rana esculenta
Rana latastei
Bufo bufo
Bufo viridis
Salamandra salamandra rara
Triturus vulgaris meridionalis raro
Triturus carnifex raro
Tutti gli anfibi suddetti sono costantemente predati sia dai pesci quali
siluri, lucci, persici trota, che dai rettili quali natrici, colubri e biacchi
nonché dagli uccelli quali aironi, gallinelle, folaghe e nitticore.
47
I RETTILI
I rettili, che appartengono alla classe dei vertebrati, si dividono in vari
ordini e sotto ordini. Fra questi sono presenti nel Parco Ittico Paradiso i
testudinati o cheloni a cui appartengono le tartarughe e gli squamati
che a loro volta si dividono in sauri e serpenti.
Stante la sua configurazione e la ricchezza di acqua sono presenti le
seguenti specie di rettili, che essendo tutti animali molto timorosi e
schivi non è sempre facile incontrare.
In particolare vi sono numerosissime:
lucertole
Podarcis muralis
ramarri
Lacerta viridis
Sono altresì presenti diverse testuggini palustri.
Per questa specie mentre risulta rara la testuggine palustre europea
(Emys orbicularis) è abbastanza frequente la testuggine palustre americana ( Chrysemy scripta). Quest’ultima è la comunissima tartarughina dagli occhi rossi di pochi centimetri in vendita in tutti i negozi di animali che, non appena raggiunge dimensioni considerevoli, fino a 2830 cm, per cui risultando problematico il suo mantenimento in un
appartamento, viene abbandonata, e pertanto immessa arbitrariamente e senza alcun controllo, nei corsi d’acqua e negli stagni.
La sua immissione nei nostri ambienti può creare grossi danni ai nostri
ecosistemi d’acqua dolce in quanto entra in competizione vincente con
le tartarughe acquatiche europee, meno veloci nel nuoto e più esigenti per quanto concerne l’alimentazione, portandole talvolta fino
all’estinzione.
Altri rettili presenti anche se difficilmente osservabili sono:
natrice d’acqua
Natrix natrix
biscia tessellata
Natrix tessellata
biacco
Coluber viridiflavus
colubro di Esculapio
Elaphe longissima
48
RECINTO DAINI E ANATIDI VARI
Questo recinto è stato creato per
riprodurre il paesaggio spondale
naturale tipico di uno stagno.
Al suo interno vivono diverse specie di anatidi: germano reale,
fischione, marzaiola, moretta
tabaccata, alzavola, moriglione e
mestolone.
Attorno allo stagno vive, in simbiosi con l'ambiente, un branco di circa
15 daini, di cui due neri.
Tutti questi animali vivono allo
stato di semilibertà e, per non
essere distrurbati, possono essere
osservati da apposite finestrine.
49
LA MINIFATTORIA
Nel parco è presente una organizzata minifattoria dove nei
vari recinti si possono vedere
maialini, conigli, vitellini, asinelli, caprette e anatre di varie specie.
Questa idea ci è venuta per permettere ai bambini di vedere
oltre ai pesci anche i più comuni
animali da cortile che altrimenti
non potrebbero conoscere.
50
GLI ALBERI E GLI ARBUSTI
La modifica della struttura tecnica del Parco Ittico Paradiso, da allevamento ittico a parco naturale, ha comportato la modifica dei percorsi
dei canali ma soprattutto la realizzazione di un vero e proprio progetto di recupero e riqualificazione ambientale dell’intera superficie occupata dall’allevamento ittico con la scelta, selezione, messa a dimora,
protezione e coltura di ben 6800 alberi ed arbusti autoctoni per rendere il territorio il più simile possibile ad una asta di fiume sviluppatasi
nel tempo in condizioni naturali e pertanto senza l’intervento umano.
Poiché il territorio è costituito interamente da ghiaie fluviali più o
meno grossolane frammiste a lenti di sabbia, costituendo un terreno
molto difficile da piantumare, è stato necessario asportare una consistente quantità di ghiaia da sostituire con terra di coltura, per ogni
pianta messa a dimora.
Stante la presenza di una nutrita colonia di conigli selvatici che si cibano, fra l’altro della tenera corteccia dei giovani alberi, si è dovuto proteggere ogni singola pianta con apposite retine metalliche che in alcuni casi è ancora possibile osservare.
La piantumazione è stata curata distribuendo gli alberi e gli arbusti a
somiglianza dei popolamenti naturali a seconda della maggiore o
minore umidità del terreno, costituendo un concreto e riuscito esempio sperimentale di riqualificazione di un ambiente difficile e completamente spoglio il cui metodo può essere utilmente utilizzato altrove.
La vegetazione arborea ed arbustiva dell’area era infatti limitata ad
alcuni esemplari isolati lungo i canali o presso gli stagni di riproduzione, ad un piccolo tratto di bosco a quercie ed olmi nella parte ad est
dei canali, con alcune infiltrazioni di robinia ed una forte mortalità di
olmi a casusa di una malattia detta grafiosi, ed una piccola area a saliceto, per lo più arbustivo, nel tratto compreso fra il canale di scarico ed
il fosso detto Ramello di S.Antonio.
Una piantumazione così massiva e naturale ha comportato che il territorio è stato progressivamente occupato da numerosi uccelli, prima
presenti in forma sporadica, quali cuculi, gazze, upupe, tortore, picchi
ecc…, poi in forma stabile avendo trovato nel parco un habitat ideale
sia per vivere che per riprodursi.
Le specie botaniche arboree più significative presenti nel parco sono le
seguenti:
Acero campestre Acer campestris
Acero di monte
Acer pseudoplatanus
51
Acero negundo
Acero riccio
Amareno
Bagolaro
Betulla bianca
Carpino bianco
Fico
Frassino
Gelso nero
Gelso bianco
Melo selvatico
Noce
Olmo
Ontano nero
Orniello
Pesco
Pioppo bianco
Pioppo nero
Platano
Quercia farnia
Robinia
Salice bianco
Salice cinereo
Salice di ripa
Salice fragile
Salicone
Serenella
Susino
Acer negundo
Acer platanoides
Prunus cerasus
Celtis australis
Betulus pendulus
Carpinus betulus
Ficus carica
Fraxinus excelsior
Morus nigra
Morus alba
Malus sylvestris
Juglans regia
Ulmus minor
Alnus glutinosa
Fraxinus ornus
Prunus persica
Populus alba
Populus nigra
Platanus hybrida
Quercus robur
Robinia pseudacacia
Salix alba
Salix cinerea
Salix eleagnos
Salix fragilis
Salix caprea
Syringa vulgaris
Prunus domestica
Le specie suddette sono tutte autoctone o naturalizzate da tempo.
Unica eccezione di alberi non autoctoni è la
recente messa a dimora, per ragioni didattiche,
di tre giovani piante di ginko ( Ginko biloba),
pianta originaria della Cina, nel tratto di canale
dove sono presenti gli storioni.
Ciò è stato fatto in quanto è un interessante elemento di stimolo per le scolaresche l’osservazione diretta di animali e
piante “fossili”, coeve fra di loro, facendo riscontrare gli elementi che
contraddistinguono le caratteristiche che dimostrano l’antichità delle
52
specie suddette e di conseguenza i sentieri evolutivi seguiti da altri
pesci e da altre piante.
Per un ulteriore sviluppo di questo percorso culturale in un’area limitrofa trovano posto equiseti e felci.
Le specie botaniche arbustive più significative
presenti nel parco sono le seguenti:
Biancospino
Crataegus monogyna
Buddleia
Buddleia davidii
Corniolo
Cornus mas
Edera
Hedera helix
Fusaggine
Euonymus europeus
Indaco bastardo Amorpha fruticosa
Lantana
Viburnum lantana
Ligustro
Ligustrum ovalifolim
Nocciolo
Corylus avellana
Palla di neve Viburnum opulus
Prugnolo
Prunus avium
Rosa canina
Rosa canina
Rovo comune Rubus ulmifolius
Sambuco nero Sambucus nigra
Sanguinello
Cornus sanguinea
Vitalba
Clematis vitalba
53
LA VEGETAZIONE ACQUATICA
La riconversione dei canali di tipo industriale in naturali ha permesso
lo sviluppo di una ricca vegetazione acquatica che è nata e si rinnova
annualmente in modo naturale e spontaneo.
La facilità con cui si sono riprodotte alcune specie botaniche trova una
spiegazione nell’acqua purissima.
Oggi nel parco si possono ammirare e studiare le seguenti piante
acquatiche e di ripa:
54
Alisma
Cannuccia
Ceratofillo comune
Carice di ripa
Crescione
Equiseto
Enagra comune
Giglio d’acqua
Giunco comune
Iris
Lima
Alisma plantago-acquatica
Phragmites communis
Ceratophyllum demersum
Carex riparia
Nasturtium officinale
Equisetum palustre
Oenothera biennis
Lilium bulbiferum
Juncus effusus
Iris pseudacorus
Vallisneria spiralis
Lente d’acqua maggiore
Litrum
Menta acquaiola
Morso di rana
Millefoglie d’acqua
Ninfea bianca
Ninfea gialla
Peste d’acqua
Sedano d’acqua
Sparganio
Tifa maggiore
Tifa minore
Verbasco
Spirodela polyrhiza
Lythrum salicaria
Menta aquatica
Hydrocharis morsus ranae
Myriophyllum spicatum
Nynphaea alba
Nuphar lutea
Elodea canadensis
Apium nodiflorum
Sparganium erectum
Typha latifolia
Typha angustifolia
Verbascum thapsus
In tempi recenti si è insediata nella zona una nutrita colonia di nutrie
(Myocastor corpus), animale da pelliccia appartenente alla famiglia dei
Miocastoridi originario del Sudamerica, importato per il pregio della
sua pelliccia e noto con il nome di castorino, che in alcuni stagni ha
danneggiato gravemente, fino al limite della scomparsa, gli insediamenti di tifa maggiore e minore, in quanto lo stesso si nutre dei tuberi di dette piante facendole morire.
55
LA CATENA ALIMENTARE
La vita di ogni ecosistema dipende dai delicati equilibri che si instaurano fra i suoi diversi componenti. La vita dei singoli individui all’interno di un ecosistema è possibile grazie all’acquisizione di materia
dall’ambiente tramite l’alimentazione. La materia acquisita viene utilizzata dagli organismi per costruire i propri organi e tessuti e per produrre l’energia necessaria per mantenerli.
La catena alimentare è quindi l’insieme di tutti i passaggi di materia
e di energia da un organismo all’altro all’interno di un ecosistema.
Acquisire materia non significa, tuttavia, che ciascun organismo possa
assumere qualunque tipo di sostanza. Al contrario gli esseri viventi
sono altamente specializzati e presentano spiccate preferenze alimentari.
Facendo una prima importante distinzione possiamo affermare che
tutti gli animali possono utilizzare solo materia organica, devono cioè
nutrirsi di altri organismi viventi, animali o vegetali, mentre le piante
sono in grado di formare materia organica a partire da sostanze minerali, acqua e anidride carbonica.
Ciò avviene per mezzo del processo della fotosintesi, che unicamente
le piante possono attuare grazie alla loro capacità di sfruttare l’energia del sole.
Proprio per la prerogativa esclusiva di produrre materia organica, le
piante sono dette “produttori primari”, mentre gli animali, che non
sono in grado di fare tutto ciò e che per questo dipendono totalmente dalle piante, sono detti “consumatori”.
Tra i consumatori distinguiamo gli
erbivori che, mangiando direttamente le piante sono detti “consumatori primari” ed i carnivori, che
si nutrono di altri animali e per ciò
sono detti “consumatori secondari”.
Giacchè il sole sorge quotidianamente, l’energia solare è una risorsa praticamente inesauribile a
56
disposizione delle piante, mentre non è così per la materia, che è invece presente nell’ambiente in quantità limitata.
Se dunque non ci fosse un processo che riscompone la materia organica nei suoi componenti inorganici (acqua, anidride carbonica, fosfati,
nitrati, metalli ecc.), la vita di un ecosistema si concluderebbe con il
loro esaurimento, mentre ci sarebbe una grande quantità di materia
imprigionata in forma organica nei corpi delle piante e degli animali
morti.
Questo non avviene grazie alla presenza dei cosiddetti “detritivori”,
batteri, funghi e piccoli animali che consumano le grandi masse di
sostanza organica morta restituendo all’ambiente le sostanze minerali
che così diventano nuovamente disponibili per le piante e per un
nuovo ciclo della materia.
Nella “catena alimentare acquatica” sono proprio i piccoli detritivori ad
assumere importanza vitale per l’economia di un corso d’acqua dolce.
Questo ecosistema è infatti assai particolare, proprio perché la base
della catena alimentare non è costituita dai produttori primari.
Ciò è dovuto a due caratteristiche che rendono atipico l’ecostistema
fiume per la presenza della corrente e della profondità dell’acqua che
condizionano la presenza delle alghe e delle piante acquatiche.
La corrente tende infatti a strappare le piante acquatiche dal fondo ed
a trasportare lontano le alghe sospese.
Inoltre la popolazione vegetale può crescere esclusivamente dove le
acque sono poco profonde, poiché la luce del sole ha una limitata possibilità di penetrazione nell’acqua.
Quindi i produttori primari non sono una base sufficiente per un sistema così complesso e ricco di diversità come quello acquatico.
Da dove provengono allora le materie necessarie?
Le materie sono importate dall’esterno.
Al fiume arriva infatti una grande quantità di sostanza organica morta,
sia perché semplicemente cade nell’acqua ( foglie, tronchi, animali…)
sia perché vi è trasportata dalle precipitazioni ( fango, terriccio, foglie
morte, semi…).
Per la sua posizione il fiume è, quindi, un grande collettore di materia
organica su cui agiscono i sopraccitati detritivori che se ne nutrono, e
che sono pertanto alla base della piramide della nostra “catena alimentare acquatica”.
57
Una vastissima varietà di invertebrati acquatici si nutre dei batteri e
dei protozoi che, sospesi nell’acqua o attaccati al fondale, sono intenti a divorare la sostanza organica morta.
Tra questi ricordiamo i numerosi crostacei ( Gammaridi, Anfipodi,
Cladoceri, nonché il famoso Gambero di fiume), i molluschi
Gasteropodi, i vermi piatti quali le Planarie, gli anellidi quali le sanguisughe, Celenterati quali le Idre, ed infine una incredibile varietà di
larve di insetti quali le zanzare, i Chironomidi, i Tricotteri, i Plecotteri
ecc…
Sempre in questo livello trofico dobbiamo inserire le uova dei
Vertebrati e degli Invertebrati e gli avanotti dei pesci nonché i girini
degli anfibi.
A carico di questa multiforme popolazione, la cui porzione sospesa
prende il nome di “plancton” mentre quella di fondo è denominata
“bentos”, vi è l’alimentazione di una buona porzione della fauna ittica del fiume dai piccoli ghiozzi, ai triotti, ai carassi, ai barbi, fino agli
enormi storioni.
Quest’ultima fonte di cibo è gradita anche alle trote ed ai persici che
normalmente predano altri pesci, e non è disdegnata da pesci prevalentemente erbivori quali carpe, alborelle, scardole ecc.
Anche molti insetti acquatici e le loro larve trovano nel plancton e nel
bentos la loro fonte di energia principale.
Infine al vertice della piramide alimentare abbiamo i veri e propri pre-
58
datori, da quelli che si accontentano di piccoli pesci come le anguille, i
persici e le trote, ai super predatori quali il formidabile luccio ed il
gigantesco siluro.
Nel Parco Ittico Paradiso è presente
anche un pesce, e precisamente la
carpa dalla testa grossa, (
Hypophthalmichtys nobilis) detto
anche Tostolovih o Temolo russo,
che a dispetto della sua considerevole mole, fino a 35 kg. ed a 150
cm, ha specializzato la sua alimentazione cibandosi quasi esclusivamente di zooplancton (plancton di
origine animale) e fitoplancton
(plancton di origine vegetale) risultando l’unico pesce del parco che non viene alimentato.
Per concludere è bene ricordare che anche una grande quantità di animali terrestri si nutre predando la fauna ittica, rettili quali la biscia d’acqua e tanti uccelli quali il martin pescatore, gli svassi e tutti gli aironi
traggono il loro sostentamento dalla vita del fiume o dello stagno per
cui risulta evidente l’importanza che assume la protezione degli
ambienti umidi oramai in via di prosciugamento e di progressiva scomparsa.
La vita dei corsi d’acqua dipende, come precedentemente detto, dall’apporto di materia esterna, ma fornisce cibo ad una moltitudine di
organismi ivi compresi quelli terrestri.
Ancora una volta il ciclo della materia si è chiuso.
L’apporto di materia verso i corsi d’acqua e quindi lo scambio terra
fiume, può anche essere mortale per quest’ultimo.
I pesticidi, i fertilizzanti chimici, gli scarichi industriali, gli scarichi urbani, che prima o poi finiscono nel grande collettore fiume, se non appositamente trattati e rigidamente regolamentati, a causa del loro carico
tossico, finiscono con l’uccidere la grande varietà di forme di vita del
fiume spezzando irrimediabilmente la catena alimentare che da essi si
diparte.
59
STRUTTURE E PARCO GIOCHI
Nel parco sono presenti strutture coperte dove poter consumare una
colazione al sacco, servizi igienici, un bar ed un piccolo negozietto di
souvenir. La struttura comprende altresì un parco giochi, inusuale ed
avventuroso con scivoli, ponti tibetani sospesi, piani inclinati, reti di
arrembaggio, funi di arrampicata, scivoli, altalene, ecc.
Abbiamo inoltre creato una vasca sopraelevata dove i visitatori hanno
la possibilità di toccare i pesci con le mani.
60
I NOSTRI PRODOTTI
Questi formaggi sono prodotti in modo artigianale esclusivamente con
latte biologico proveniente dai nostri allevamenti di razza jersey.
in vendita anche al Parco Ittico Paradiso
61
SPONSOR
62
Finito di stampare: Marzo 2010
Ponzio-Olona
Strada Vicinale della Pieve, 10
27010 Copiano (PV)
64







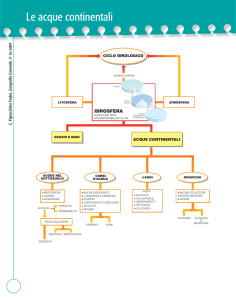
![Lord Byron, 1812-1818, poeta […] Rimbombo di acque! Dalla](http://s1.studylibit.com/store/data/004489654_1-4bb17c51794561741fad69d9434b633b-300x300.png)
