Farmaci antibatterici:
classificazione, meccanismo di azione, meccanismi di resistenza
Valutazione in vitro dell’attività
antibatterica:
saggio di microdiluizione in brodo
Giovanni Di Bonaventura, Ph.D.
Università “G. D’Annunzio”, Chieti-Pescara
Chemioterapia - cenni storici
Chemioterapia “empirica”
Corteccia di cinchona vs malaria (indiani
peruviani)
Muffe vs ferite
Mercurio vs sifilide (XVI secolo)
Chemioterapia “moderna” (scientifica)
Paul Ehrlich (1854-1915)
Domagk (1935)
Concetto di “tossicità selettiva”
Arsfenamina (Salvarsan) vs sifilide (solo in vivo)
Colorante rosso (Prontosil) vs infezioni batteriche
Fleming (1929)
Penicillium notatum vs stafilococchi (penicillina)
Cos’è un farmaco antibatterico ?
Agente antibatterico:
Composto in grado di interferire con la crescita e la
moltiplicazione batterica
Contrariamente al disinfettante, è attivo solo verso
batteri metabolicamente attivi (tranne polimixine)
Antibiotico:
Sostanza a basso PM prodotta dal metabolismo di un
microrganismo: Actinomiceti (Streptomyces), Miceti
(Penicillium, Cephalosporium)
Chemioterapico:
Prodotto di sintesi (analogo strutturale di un antibiotico)
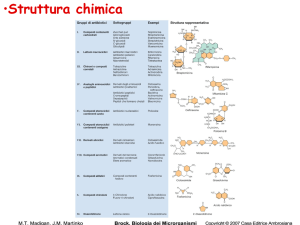
Classificazione degli agenti
antimicrobici
Natura dell’inibizione:
Battericida:
Batteriostatica:
inibisce la crescita del microrganismo, consentendo lo
sviluppo della risposta immunitaria anticorpale
Tipologia di microrganismo:
provoca la morte dell’agente infettivo (infezioni gravi)
Ampio spettro (tetracicline)
Spettro ristretto (penicillina)
Meccanismo di azione:
Inibitori
Inibitori
Inibitori
Inibitori
Inibitori
della parete cellulare
della membrana cellulare
della sintesi proteica (30S, 50S, tRNA)
della sintesi di acidi nucleici
di enzimi metabolici
Caratteristiche desiderabili di
un agente antimicrobico
Adeguata attività antimicrobica
Non interagisce con i meccanismi di difesa dell’ospite
e con la flora commensale
Tossicità selettiva:
Attività rivolta verso il batterio ma non verso la cellula ospite
Indice terapeutico:
Target “caratteristico” (per struttura od affinità)
Concentrazione terapeutica max / concentrazione tox min
Attivo a basse concentrazioni
Stabile, economico, facilmente somministrabile
Previene l’insorgenza di varianti resistenti
Raggiunge adeguate concentrazioni tissutali
Non associato ad effetti collaterali (ipersensibilità)
Inibitori della parete cellulare
(β-lattamici, glicopeptidi, bacitracina)
Gli antimicrobici più comuni sono i β-lattamici:
Penicilline
Cefalosporine
Altri β-lattamici:
Acido clavulanico, tienamicina, sulbactam
Moxalactam
Monobattamici (aztreonam)
Inibitori della parete cellulare
Penicilline
Prodotte da Penicillium chrysogenum
Nucleo fondamentale: acido 6-amino-penicillinanico
Naturali:
Benzil-penicillina (penicillina G)
attiva verso cocchi Gram+ e Gram-
Semi-sintetiche:
Meticillina + Isossazolilpenicilline (oxa-)
Resistenti a β-lattamasi
Aminopenicilline (ampi-, amoxi-)
Carbossipenicilline (carbeni-, ticar-)
Ureidopenicilline (pipera-, azlo-)
Sulfossipenicilline (sulbeni-, sun-)
notevole penetrazione della membrana esterna dei Gram-;
sensibili a β-lattamasi
Inibitori della parete cellulare
Cefalosporine
Presenza del nucleo acido 7-amino-cefalosporanico
Spettro di azione esteso ai Gram-negativi
Naturali:
Cefalosporina C (Cephalosporium achremonium)
Semi-sintetiche:
resistenti a β-lattamasi; penetrazione della membrana esterna
I generazione (cefazolina)
II generazione (cefuroxime)
III generazione (cefotaxime)
IV generazione (cefepime)
Cefamicine:
Naturali (streptomiceti)
Struttura cefalosporina-simile (gruppo metossilico in C7)
Esteso spettro di azione (soprattutto verso i batteri anaerobi)
β-lattamici
Meccanismo di azione
Target principale = parete cellulare batterica
Bersaglio caratteristico della cellula microbica (tox selettiva)
Attività battericida su cellule in attiva divisione
Inibiscono la fase finale di polimerizzazione
(reazione di transpeptidazione) della sintesi del
peptidoglicano, legandosi “selettivamente” agli enzimi
coinvolti nella reazione (Penicillin Binding Proteins – PBPs):
Arresto crescita batterica
Accrescimento oltre i limiti fisiologici
Formazione dello sferoplasto e lisi cellulare:
Produzione di peptidoglicano “lasso”
Induzione di enzimi endogeni batterici (mureina-idrolasi)
Peptidoglicano
struttura
Sintesi del peptdoglicano
transpeptidazione
Beta-lattamici
Spettro (uso terapeutico)
Penicilline:
Generalmente attive su gram-positivi aerobi ed anaerobi:
Alcuni Gram-negativi:
Batteriemia, setticemia, faringite, otite media (S. aureus, S.
epidermidis)
Meningite, polmonite (S. pneumoniae)
UTI (Proteus, E. coli)
Gastroenteriti (Salmonella , Shigella)
Cefalosporine:
Spettro esteso anche ai Gram-negativi
Meningiti (Haemophilus influenzae tipo b, Streptococcus
pneumoniae, Neisseria meningitidis)
Resistenza a beta-lattamasi attive su penicilline
Maggiore penetrazione attraverso la membrana esterna
Beta-lattamici
Tossicità
Penicilline:
Sebbene non associate ad effetti collaterali,
possono indurre ipersensibilità (10% dei casi) o
neurotossicità (dosaggio> 40-50 milioni di unità)
Inibitori della parete cellulare
altri β-lattamici
Acido clavulanico, sulbactam
Moxalactam
Derivato strutturale dell’acido 6-amino-penicillanico
Azione protettiva nei confronti delle β-lattamasi (in
combinazione con penicilline)
Derivato strutturale dell’acido 7-amino-cefalosporanico
Esteso spettro di azione, spiccata resistenza alle β-lattamasi
Monobattamici (aztreonam)
Chromobacterium violaceum
Nucleo fondamentale β-lattamico monociclico
Rilevante attività vs Gram-negativi (anaerobi esclusi),
spiccata resistenza alle β-lattamasi
Inibitori della funzionalità della
membrana citoplasmatica
(Polieni, Azoli, Polimixine)
Polieni (anfotericina B, nistatina)
Azoli (itraconazolo, fluconazolo, chetoconazolo):
Legame irreversibile con lipidi di membrana (ergosterolo) e
conseguente distruzione di membrana.
Fungistatici, infezioni sistemiche (Candida spp)
Nefrotossicità
Bloccano la sintesi di ergosterolo
Fungicidi, infezioni superficiali e sistemiche
Disfunzioni epatiche, nausea, vomito
Polimixine (polimixina B, colistina):
Polipeptidi ciclici prodotti dal genere Bacillus
Interagiscono specificatamente con i lipidi di membrana esterna
(Gram-negativi) distruggendone il doppio strato fosfolipidico ed
alterandone la permeabilità
Meccanismo di azione simile ai disinfettanti (elevata nefrotox)
Spettro esteso, uso topico (associata a bacitracina)
Inibitori della sintesi proteica
(Aminoglicosidi, Tetracicline, Cloramfenicolo,
Macrolidi, Lincosamidi)
La selettività dell’azione di questi antibiotici risiede nelle
sostanziali differenze esistenti tra i ribosomi procariotici
ed eucariotici e nel processo di sintesi proteica
Inibitori della subunità 30 S
Aminoglicosidi
Naturali (Streptomyces, Micromonospora):
Streptomicina
Neomicina
Kanamicina
Gentamicina
Tobramicina
Sisomicina
Semi-sintetici:
Amikacina
Netilmicina
Inibitori della subunità 30 S
Aminoglicosidi
Meccanismi di azione (attività rapida battericida)
1.
2.
3.
Penetrazione dell’antibiotico nella cellula dove si lega
irreversibilmente alla subunità 30S ribosomiale, con
formazione di un prodotto proteico “anomalo” (non
funzionale)
Parte della proteina “anomala” viene inserita a
membrana generando dei pori che favoriscono
l’ingresso di ulteriori quantità di antibiotico
Concentrazioni elevate dell’antibiotico impediscono il
legame all’m-RNA di tutti i ribosomi, causando il
blocco di sintesi proteica
Induzione di errori nella lettura dei codoni di RNA-m
(streptomicina-dipendenza)
Inibitori della subunità 30 S
Aminoglicosidi
Esteso spettro di azione:
Inattivi nei confronti degli anerobi
Gram-positivi e Gram-negativi (infezioni gravi da
P. aeruginosa, Enterobacter spp)
Tossicità:
Nefrotossicità
Ototossicità (perdita cellule ciliate e danno
permanente all’organo del Corti)
Blocco neuromuscolare
Inibitori della subunità 30 S
Tetracicline
Streptomyces spp.
struttura tetraciclica
Inibitori della subunità 30 S
Tetracicline
Meccanismo di azione:
Attività batteriostatica
Legano reversibilmente la sub-unità 30S
ribosomiale batterica, inibendo l’attacco
dell’aminoacil-RNA-tmet e bloccando la
formazione del complesso attivo traslazionale
(polisoma). Possono inoltre inibire la sintesi
proteica eucariotica, ma raramente raggiungono
concentrazioni tossiche
Inibitori della subunità 30 S
Tetracicline
Esteso spettro di azione:
Gram-positivi (acne), Gram-negativi (infezioni
vie aeree)
Ricketsie (trattamento di elezione)
Clamidie (trattamento di elezione)
Spirochete
Alcuni protozoi
Tossicità:
Superinfezioni (eliminazione flora commensale)
Colorazione dei denti in via di sviluppo
Inibitori della subunità 50 S
Macrolidi, cloramfenicolo, lincosamidi
Macrolidi
Streptomyces
Nucleo lattonico macrociclico con funzione chetonica
Cloramfenicolo
Eritromicina
Roxitromicina
Azitromicina
Claritromicina
Streptomyces venezuelae
Lincosamidi (lincomicina, clindamicina)
Inibitori della subunità 50 S
Macrolidi, cloramfenicolo, lincosamidi
Meccanismo di azione:
Attività batteriostatica
Legano, competendo per lo stesso sito, i ribosomi
liberi a livello della sub-unità 50S disaccoppiando
il processo di formazione del legame peptidico
con l’attacco di nuovi ribosomi all’RNAmessaggero. Conseguentemente, si assiste al
blocco della sintesi proteica.
Inibitori della subunità 50 S
Macrolidi, Cloramfenicolo, Lincosamidi
Spettro di azione:
Macrolidi
Infezioni da patogeni intracellulari:
Chlamydia
Campylobacter
Mycobacterium spp.
Polmonite da Mycoplasma pneumoniae
Legionellosi
Cloramfenicolo
Gram+, Gram-
Lincosamidi
Anaerobi obbligati (clindamicina)
Rifampina, Rifamicina,
Rifampicina, Rifabutina
(battericidi)
Antibiotici (Nocardia mediterranea)
Meccanismo di azione – legano la subunità β della RNApolimerasi DNA-dipendente, bloccando l’inizio della sintesi di
mRNA.
Tossicità selettiva – differenze nella struttura della RNApolimerasi batterica rispetto a quella eucariotica
Spettro di azione – esteso, ma impiegati soprattutto nel
trattamento della tubercolosi
Chinoloni
(battericidi)
acido nalidixico, ciprofloxacina, ofloxacina,
norfloxacina, levofloxacina, lomefloxacina, sparfloxacina
Chemioterapici
Meccanismo di azione – legano la subunità GyrA della DNA
girasi e la subunità ParC della topoisomerasi IV, prevenendo la
despiralizzazione del DNA e, quindi, la sua sintesi.
Tossicità selettiva – differente struttura enzimatica tra
procarioti ed eucarioti
Spettro di azione – Cocchi Gram-positivi ed infezioni delle vie
urinarie
Novobiocina
(battericida)
Antibiotico (Streptomyces spheroides, S. niveus)
Meccanismo di azione – lega la subunità GyrB della DNA
girasi (topoisomerasi II), prevenendo la despiralizzazione del
DNA e, quindi, la sua sintesi.
Tossicità selettiva – differente struttura enzimatica tra
procarioti ed eucarioti
Spettro di azione – azione sinergica con quella dei chinoloni
Chemioterapici “antimetaboliti”
acido p-aminobenzoico +
idrossimetil-diidropteridina
Sulfamidici
Via biosintetica
dei folati
Diidropteroatosintetasi
acido diidropteroico
Diidrofolatosintetasi
acido diidrofolico
Trimethoprim
Diidrofolatoreduttasi
acido tetraidrofolico
Metionina
Timidina
Purine
Serina
Sulfamidici
(batteriostatici)
Meccanismo di azione – agiscono come analoghi strutturali
dell’acido p-aminobenzoico inibendo, in maniera competitiva, la
formazione di acido diidropteroico.
Tossicità selettiva – via biosintetica dei folati presente nei soli
batteri
Spettro di azione – Esteso spettro di azione verso Grampositivi e Gram-negativi; usati primariamente nel tratto urinario
e nelle infezioni da Nocardia.
Terapia combinatoria – usati in combinazione con il
trimethoprim inibiscono la via dei folati a due differenti livelli,
prevenendo l’emergenza di ceppi resistenti.
Trimethoprim, Metotrexato,
Pirimetamina (batteriostatici)
Meccanismo di azione – legano la diidrofolato-reduttasi,
inibendo la formazione di acido tetraidrofolico.
Tossicità selettiva – sebbene la via metabolica sia comune ai
procarioti ed eucarioti, l’enzima batterico mostra maggiore
affinità per il trimethoprim.
Spettro di azione – Estesa attività verso batteri Gram-positivi
e Gram-negativi; usati primariamente nel tratto urinario e nelle
infezioni da Nocardia.
Terapia combinatoria - usati in combinazione con i
sulfamidici inibiscono la via dei folati a due differenti livelli,
prevenendo l’emergenza di ceppi resistenti.
Resistenza ai farmaci antibatterici
Tipologie di resistenza:
Resistenza “innata”
Resistenza “acquisita”
Gram-negativi vs penicilline (membrana esterna)
Clamidie e Micoplasmi vs β-lattamici (assenza di parete)
Mutazione spontanea (resistenza cromosomica)
Acquisizione (coniugazione, trasduzione) di determinanti genetici
a localizzazione plasmidica o transposonica (Gram-negativi)
Significato “clinico” della resistenza
I ceppi resistenti sopravvivono in presenza di
concentrazioni raggiunte in vivo a livello sierico
dall’antibiotico in seguito a somministrazione di normali
dosi terapeutiche.
La resistenza predice il possibile fallimento della terapia
antibiotica.
Antibiotico-resistenza
Meccanismi
Modificazione del “bersaglio” del farmaco
Inattivazione enzima attivante il “profarmaco”
Mutazione katG (isoniazide)
Alterate nitroreduttasi (composti nitroeterociclici)
Alterata permeabilità
Penicillin-binding proteins (penicilline, cefalosporine)
DPS (sulfamidici), DHFR (trimethoprim)
Subunità DNA-girasi (chinoloni, novobiocina)
Subunità-β della RNA-polimerasi (rifamicine)
Subunità 50S (macrolidi, lincosamidi)
Minore influsso (Pseudomonas vs aminoglicosidi)
Maggiore efflusso (tetracicline)
Inattivazione enzimatica del farmaco
Produzione di trasferasi (aminoglicosidi)
Produzione di β-lattamasi (β-lattamine)
β-lattamasi
Enzimi in grado di idrolizzare, inattivandole, le βlattamine per apertura del nucleo lattamico:
Localizzazione:
Penicillinasi (
ac. penicilloico)
Cefalosporinasi (
ac.cefalosporoico)
Gram-positivi: inducibili, esocellulari
Gram-negativi: costitutivi, intracellulari (spazio peripl.)
Controllo:
plasmidico (S. aureus, P. aeruginosa, H. influenzae)
trasposonico (Tn2-Tn3, Enterobacteria/ Pseudomonas)
Cromosomico (cefalosporinasi nei Gram-negativi)
Resistenza ai β-lattamici
Antibiotico-resistenza:
il “problema” medico
Meticillino-resistenza negli stafilococchi
100.000 decessi/anno negli USA
Circa il 50% delle infezioni nosocomiali è
resistente ad almeno 1 antibiotico
Esito infausto per il 90% dei pazienti affetti
da tubercolosi multi-resistente
“abuso”/”uso non corretto”
degli antibiotici
Lo sviluppo della resistenza è correlato al livello di
impiego degli antibiotici
L’abuso (uso non corretto) ha aumentato l’incidenza
e la selezione delle mutazioni inducenti resistenza:
Profilassi in chirurgia
Uso empirico (agente eziologico ignoto)
Aumentato uso di antibiotici a spettro esteso
Antibiotici (probiotici) nei mangimi animali
Uso pediatrico per infezioni virali
Scarsa compliance del paziente
Come “controllare” il problema
Evitare l’impiego ripetuto della stessa molecola
Modificare l’antibiotico per eludere il meccanismo di
resistenza
Usare combinazioni antibiotiche
Ridurre il consumo di antibiotici
Aumentare la compliance del paziente
educazione sanitaria
Sviluppo di nuove molecole
educazione sanitaria, limitare l’uso di mangimi animali
Peptidi naturali: magainine (da rane e squali)
Ottimizzazione delle tecniche per la determinazione
dell’antibiotico-sensibilità
Tests di antibiotico-sensibilità
Obiettivo dei tests per la determinazione della
antibiotico-S è di predire il successo od il
fallimento in vivo della terapia antibiotica.
I tests vengono effettuati in vitro, e misurano la
risposta (crescita) di un microrganismo isolato
verso un particolare antibiotico/antibiotici.
I tests sono eseguiti in condizioni standardizzate
per garantire la riproducibilità dei risultati.
I risultati di questi tests debbono essere usati per
guidare la scelta dell’antibiotico da adottare,
alla quale contribuiscono anche le informazioni
cliniche e l’esperienza professionale.
Tests di antibiotico-sensibilità
Definizioni
MIC (Concentrazione Minima Inibente) è una
misura quantitativa dell’attività di un antibiotico
verso un determinato batterio. Definita come la
più bassa concentrazione di antibiotico in grado
di inibire la crescita batterica visibile.
NCCLS (National Committee for Clinical
Laboratory Standards) pubblica i criteri per la
interpretazione dei risultati dei tests di sensibilità
(categorie interpretative).
Categorie Interpretative (Sensibilità, S
Intermedia, Resistenza) individuate da valori di
MIC detti breakpoints (soglia, limite)
Interpretazione dei risultati
BREAKPOINTS
I breakpoints vengono individuati dalla
NCCLS in base a:
– Livelli raggiunti in vivo (sangue, tessuti)
dall’antibiotico
– Correlazione tra risultati in vitro (MIC) ed in
vivo (risoluzione del caso clinico)
Sensibilità
Una infezione sostenuta dal ceppo batterico isolato può essere
trattata appropriatamente con il dosaggio usuale dell’antibiotico
testato e raccomandato per il tipo di infezione clinica.
Sensibilità Intermedia
Gli isolati batterici mostrano MIC corrispondenti a livelli sierici e
tessutali di antibiotico per i quali l’efficacia potrebbe essere più
bassa di quella registrata per gli isolati sensibili. Questa
categoria suggerisce l’efficacia clinica nei siti corporei dove gli
antibiotici sono fisiologicamente concentrati (chinoloni nelle
urine) o quando l’antibiotico può essere utilizzato a
concentrazioni più alte di quelle normali (β-lattamici).
Resistenza
Questa categoria predice il possibile fallimento dell’antibiotico
testato. I ceppi resistenti non sono inibiti dalle normali
concentrazioni sistemiche raggiunte in vivo dall’antibiotico in
seguito a somministrazione di dosi normali.
Tecniche per la determinazione
in vitro dell’antibiotico-sensibilita’
Brodo diluizione (micro- e macrometodo)
Diffusione in agar (Kirby-Bauer)
Agar diluizione
Sistemi Automatizzati
Brodo diluizione
Semina inoculo batterico (5 x 105 cfu/ml)
Incubazione a 37°C per 18 h
Brodo diluizione
NCCLS-breakpoints
ANTIBIOTICO
Piperacillina
Cefazolina
Cefotaxime
Cefpodoxime
Imipenem
Vancomicina
Gentamicina
S
≤16
≤8
≤8
≤2
≤4
≤4
≤4
I
32-64
16
16-32
4
8
8-16
8
R
≥128
≥32
≥64
≥8
≥16
≥32
≥16
S = Sensibilità, I = Sensibilità Intermedia, R = Resistenza
Brodo diluizione
VANTAGGI:
Automatizzata
Riproducibile (standardizzata)
Quantitativa
SVANTAGGI:
Laboriosa (allestimento pannelli antibiotizzati)
Costi
Tecniche per la determinazione
in vitro dell’antibiotico-sensibilita’
Brodo diluizione (micro- e macrometodo)
Diffusione in agar (Kirby-Bauer)
Agar diluizione
Sistemi Automatizzati
1
2
Diffusione in agar
(Kirby-Bauer)
1. Allestimento brodocoltura
da coltura pura
2. Semina brodocoltura
3
3. Apposizione dischetti
antibiotizzati
4
4. Incubazione (37°C, 18-24h)
5
5. Misurazione diametro alone
di inibizione
Diffusione in agar
Risultati
Diffusione in agar
(Kirby-Bauer)
VANTAGGI:
Tecnica standardizzata (NCCLS)
Flessibilità nella scelta degli antibiotici
Facilità di esecuzione
Economicità
Correlazione tra risultati in vitro (antibiogramma) e
risoluzione clinica (risultato in vivo)
SVANTAGGI:
Impossibilità di totale automatizzazione
Produce risultati qualitativi (categorie di sensibilità)
Attività battericida di un antibiotico
• Infezioni gravi: osteomieliti, endocarditi
• Focolaio di infezione situato in distretti anatomici
difficilmente accessibili all’antibiotico
• Concentrazione Minima Battericida (MBC):
La più bassa concentrazione di antibiotico in grado
di inibire la crescita batterica di almeno il 99.9%
(1 germe su 1.000 elude l’azione antibiotica)
della popolazione iniziale.
MIC/MBC test
(Brodo diluizione)
MBC/MIC – killing quotient
Tasso di uccisione = MBC / MIC
1-4 per antibiotici battericidi
(beta-lattamici, chinoloni)
>4 per antibiotici batteriostatici
(sulfamidici, tetracicline)