Prof. L. Manasseri
Lezione VIII – 19-03-2013
Ormoni correlati col ciclo
alimentazione-digiuno
Di seguito vengono analizzati due ormoni: il primo ha funzioni
tipicamente anaboliche, l'insulina; il secondo invece ha funzioni
essenzialmente cataboliche, il glucagone.
Infatti, l'insulina secreta soprattutto in seguito ad una condizione di
iperglicemia, quindi di alimentazione, ha lo scopo di agevolare le
riserve di combustibile energetico, vedi trigliceridi, glicogeno ed anche
proteine. L'insulina ha effetti lipogenetici, sia a livello epatico sia a
livello del tessuto adiposo, sebbene faciliti le riserve esclusivamente a
livello del tessuto adiposo, non nel fegato; favorisce la sintesi di
glicogeno; è protidoanabolico. Funzioni queste tipicamente anaboliche.
Il glucagone invece viene prodotto soprattutto in condizioni di
ipoglicemia, quindi digiuno, e di conseguenza facilita la utilizzazione
delle riserve energetiche glucidiche-lipidiche, non proteiche
(l'organismo non cerca di utilizzare le proteine come riserva, non ci
sono riserve proteiche; né le proteine vengono utilizzate quale fonte
energetica - soltanto il 5% delle proteine introdotte con la dieta
vengono utilizzate come fonte di energia - per quale motivo? Perché
l'organismo cerca di risparmiarle per formare i tessuti). Quindi il
glucagone ha funzioni cataboliche: utilizza i lipidi di deposito, i
carboidrati di deposito - vedi il glicogeno. Per il metabolismo proteico,
invece, non ha effetti particolari.
Claudio Zaccone
1
Insulina
Il seguente è un argomento molto complesso.
Si fa cenno ad alcuni concetti di Biochimica.
Viene seguito il seguente schema:
• la cellula di origine;
• la natura chimica;
• la biosintesi;
• il trasporto;
• i fattori che influenzano la secrezione
dell'ormone;
• le cellule ed i tessuti bersaglio;
• i recettori presenti a livello delle
cellule bersaglio;
• effetti metabolici ed i meccanismi di
controllo.
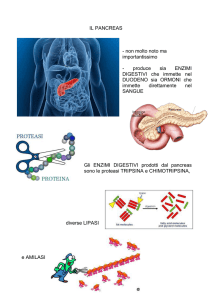
Struttura del pancreas endocrino
Il pancreas endocrino è costituito da isole di
Langerhans, egualmente distribuite nel
parenchima ghiandolare. Nella coda del
pancreas il numero degli isolotti del
Langerhans è superiore rispetto al corpo ed
alla testa.
L'isola di Langerhans produce quattro
ormoni. Di seguito viene analizzata
soprattutto l'insulina, che viene prodotta dalle
cellule β, che costituiscono il 65% delle
cellule endocrine di un isolotto e ne
occupano soprattutto la parte centrale.
Nell'isolotto è possibile distinguere altri tre
citotipi: le cellule α, che sono situate
soprattutto alla periferia e produco
glucagone (15%); le cellule δ che producono
somatostatina; le cellule PP che secerno il
polipeptide pancreatico.
Schema di un isolotto del Langerhans
V'è un'altra forma di glucagone, non quello
prodotto dalle cellule endocrine del pancreas,
ma un fattore simile al glucagone prodotto
dalle cellule L dell'intestino tenue. Fa parte
di un gruppo di sostanze chiamate incretine,
che hanno lo scopo di regolare la secrezione
di insulina.
Natura chimica
Dal punto di vista chimico, l'insulina è un
polipeptide costituito da 51 aminoacidi,
distribuiti in due catene, una catena A o α
(costituita da 21 aminoacidi) ed una catena B
o β (30 aminoacidi).
Le due catene sono legate tra di loro da due
ponti disolfuro intercatena. È inoltre presente
un altro ponte disolfuro intracatena
instaurato tra due residui cisteinici: uno in
posizione 6 e l'altro in posizione 11.
Esistono diversi tipi d'insulina, l'isoforma
suina,
l'isoforma
bovina,
l'isoforma
conigliesca, ect... Quella bovina, ad esempio,
ha
una
differenza
nella
sequenza
aminoacidica in posizione 8, 9 e 10 della
catena A e in posizione 30 della catena B
(alanina invece di treonina).
Ai fini terapeutici il discorso relativo alle
isoforme animali era importante. Al
momento, tuttavia, si impiegano diversi tipi
di insulina per la cura del diabete. L'ormone
di origine suina era la più usata. Qual era lo
svantaggio? La possibilità di avere una
reazione avversa dell'organismo poiché era
una molecola estranea, sebbene vi fosse una
differenza di soli quattro aminoacidi.
Proinsulina – in nero, in peptide C
2
Biosintesi
L'insulina viene prodotta ed accumulata nei
granuli presenti nel citoplasma di una cellula
β, sotto forma di proinsulina. La proinsulina
è costituita dalle due catene che sono tra di
loro collegate da un frammento chiamato
peptide C. Nel granulo sono presenti e
insulina libera e proinsulina. Ci sono degli
enzimi di clivaggio, delle peptidasi (uno ad
attività
tripsino-simile,
l'altro
carbossipeptidasica), che distaccano il
peptide C dall'insulina vera e propria.
I punti di attacco degli enzimi di clivaggio
sono tra due residui di arginina e tra arginina
e treonina. Non è ancora chiaro cosa stimoli
gli enzimi di clivaggio a permettere la
produzione di insulina e di peptide C, secreti
in quantità equimolari, dal momento che sia
l'uno sia l'altro vengono liberati nel momento
dell'esocitosi.
Il gene che codifica l'insulina codifica per un
mRNA che a livello ribosomiale determina la
sintesi di un polipeptide lineare, non
ripiegato. Nella sequenza aminoacidica v'è il
frammento segnale, il quale permette
l'ingresso della preproinsulina all'interno del
reticolo endoplasmatico. A questo livello
avviene la ripiegatura e la formazione della
proinsulina. A livello del Golgi si formano i
granuli secretori. Nei granuli sono presenti le
molecola di proinsulina e i due enzimi di
clivaggio. Si pensa sia l'ambiente acido che si
crea a livello del granulo, permetta agli
enzimi di agire sulla molecola proinsulina
per separare il peptide C dalla molecola vera
e propria.
Trasporto e cellule bersaglio
Il trasporto in circolo avviene in forma
libera, in quanto l'insulina si discioglie nel
plasma e non è legata a proteine (a differenza
del GH, il quale per il 50% è libero, per il
restante legato ad una specifica proteina).
Quali sono le cellule bersaglio dell'insulina?
Mentre il GH ha un'azione quasi
generalizzata (tranne nel cervello, negli occhi
e nelle ghiandole endocrine), l'insulina ha
un'azione diversa relativa ai citotipi con i
quali interagisce. In particolare, si
distinguono due categorie di tessuti:
• insulino-dipendenti, la cui attività
metabolica dipende dall'insulina;
• insulino-indipendenti.
I tessuti insulino-dipendenti maggiormente
rappresentano la superficie corporea: sono il
fegato, il tessuto adiposo ed il tessuto
muscolare. Invece il rene, l'intestino,
l'encefalo sono insulino-indipendenti. Si
pensa ci sia una zona dell'ipotalamo, in
nucleo ventromediale, che s'identifica con il
centro della sazietà ed è insulinodipendente. Ciò spiega perché un soggetto
diabetico è iperfagico. (il discorso viene
analizzato nell'ambito dell'argomento “fame
e sazietà”).
La conseguenza di una carenza di insulina è
causa del diabete di primo tipo. Nel diabete
di secondo tipo, invece, l'insulina viene
prodotta. Anzi, il soggetto inizialmente
presenta una condizione di iperinsulinismo
ma l'insulina non è capace di agire a livello
degli effettori per carenza del recettore (si
richiama ai testi di fisiopatologia per ulteriori
approfondimenti).
Effetti metabolici
Quando si parla di insulina, siccome il segno
tipico del diabete è l'iperglicemia, si pensa
che il metabolismo influenzato dall'insulina
sia quello glicidico ma l'insulina è un
ormone panmetabolico. Interviene sia sul
metabolismo proteico sia sul metabolismo
lipidico sia sul metabolismo glicidico. Lo
stimolo più importante è l'iperglicemia, la
quale stimola la cellula β a produrre insulina.
Questa avrà un effetto protido-anabolico (con
il conseguente incremento della sintesi
proteica e decremento di protido-lisi); un
effetto sul metabolismo lipidico (aumenta la
liposintesi, diminuisce la lipolisi1).
1La lipogenesi avviene sia a livello epatico sia a
livello del tessuto adiposo. Il fegato non accumula i
trigliceridi che sintetizza; si creerebbe una condizione
gravissima, individuata come fegato grasso o
3
Gli effetti sul metabolismo glicidico sono
l'aumento della glicolisi (via metabolica più
importante),
dello
shunt
dell'esoso
monofosfato (significativo per la sintesi dei
lipidi a livello del tessuto adiposo);
l'agevolazione della glicogeno sintesi; la
riduzione della glicogenolisi e della
neoglucogenesi. La conseguenza sarà
l'ipoglicemia2.
Affinché si verifichino i vari eventi, è
necessario che l'insulina agisca a livello di
membrana comportando una risposta a livello
citoplasmatico. Tra i risultati delle risposte,
l'insulina
favorisce
il
trasporto
transmembrana di glucosio, il trasporto di
transmembrana di aminoacidi, il trasporto
transmembrana di acidi grassi ed il
trasporto transmembrana di ioni potassio.
L'ultimo risultato elencato è molto
importante. Quando il soggetto va incontro
ad iperpotassemia, viene prodotta insulina, la
quale permette lo spostamento del potassio
dall'ambiente extracellulare all'ambiente
intracellulare. Tra le conseguenze, si evitano
i danni da iperpotassemia, danni che sono
rilevanti soprattutto a livello cardiaco per i
fenomeni bioelettrici (analizzati il semestre
precedente).
Il trasporto transmembrana di glucosio
avviene ad opera di un meccanismo di
diffusione facilitata, semplice, attraverso un
carrier di nome GLUT. Esistono diversi
GLUT (vengono elencate solo alcune
isoforme):
• GLUT1, nel tessuto encefalico [non
sono d'accordo. GLUT1 è un
trasportare ubiquitario! CZ];
• GLUT2, nel pancreas, a livello della
cellula β, molto importante nella
steatosi, con sofferenza epatocitaria. Anche il tessuto
adiposo sintetizza lipidi ma, a differenza del fegato, li
accumula.
2Il soggetto non va incontro ad ipoglicemia grave. La
concentrazione ematica di glucosio diminuisce a
livelli fisiologici, quindi tendenzialmente ipoglicemia.
In ogni caso, la risposta del pancreas all'insulina
provoca una lieve ipoglicemia, anche qualora lo
stimolo iperglicemico sia una concentrazione di
glucosio superiore a 100mg/ml a livello ematico. La
glicemia non raggiunge quindi valori molto bassi.
Viene invece riportata a valori ottimali.
•
secrezione di insulina a seguito ad
una iperglicemia;
GLUT4, nel muscolo, nell'adipocita e
nel fegato, insulino-dipendente.
Oltre ai carrier, a livello di membrana sono
presenti dei cotrasportatori di glucosio Na+,
SGLT. Sono tipici delle membrane di cellule
enteriche e nefrotubulari.
SGLT – meccanismo
transmembrana Na+-Glu.
del
simporto
Quali sono le modalità e i meccanismi con i
quali l'ormone determina gli effetti
metabolici?
La secrezione d'insulina viene stimolata non
soltanto dalla iperglicemia, che è lo stimolo
più eclatante, ma anche da una
iperamminoacidemia
(aumento
degli
aminoacidi circolanti) e da un aumento dei
lipidi liberi, dei NEFA liberi, ed anche dei
corpo chetonici.
Quali sono gli effetti?
• Una riduzione della glicemia;
• Un aumento della glicogenosintesi;
• Un aumento della glicolisi;
• Una ridotta produzione di glucosio
dal
fegato
ad
opera
della
glicogenolisi;
• Una riduzione della neoglucogenesi;
• Un aumento sintesi proteica (in
sinergia col GH; si ricordi a tal
proposito che alla fase seconda in cui
si creava l'iperglicemia, seguiva poi la
fase in cui la glicemia veniva
normalizzata dalla secrezione di
4
•
•
•
•
•
•
insulina; per cui, la sintesi proteica
iniziata dal GH, viene completata
dall'insulina);
Catabolismo proteico ridotto;
Ridotta ureogenesi (conseguente
all'effetto precedente);
Bilancio azotato positivo (la sintesi è
maggiore rispetto al catabolismo);
Riduzione della lipolisi a livello del
tessuto adiposo (viene inibita la lipasi
ormon-sensibile; c'è un'altra lipasi di
membrana
endoteliale,
la
lipoproteinlipasi, che viene attiva,
perché agisce sui chilomicroni e sulle
VLDL di origine epatica; la
lipoproteinlipasi
permetterà
la
scissione degli acidi grassi che poi
potranno, per diffusione semplice,
attraverso la matrice lipidica, e quindi
liposolubile, penetrare all'interno
della cellula);
Ridotta la chetogenesi;
Aumenta l'attività per il trasporto del
potassio.
Nel caso del glucagone cosa si verifica?
Tutto
l'opposto.
L'unico
ormone
ipoglicemizzante è l'insulina. Tutti gli altri
sono iperglicemizzanti3.
Uno dei problemi del paziente diabetico è un
aumento dal catabolismo proteico ed un
aumento dell'ureogenesi, i quali col tempo
possono
comportare
determinate
conseguenze.
L'insulina, determinando un abbassamento
della glicemia, agisce a livello del nucleo
arcuato ed inibisce la fame. L'effetto
centrale è diverso dall'effetto periferico.
La glicolisi e la glicogenosintesi vengono
attivate in quanto vengono stimolati i sistemi
enzimatici. La gluconeogenesi è inibita
perché vengono inibiti altri sistemi
3Il soggetto non va incontro ad ipoglicemia grave. La
concentrazione ematica di glucosio diminuisce a
livelli fisiologici, quindi tendenzialmente ipoglicemia.
In ogni caso, la risposta del pancreas all'insulina
provoca una lieve ipoglicemia, anche qualora lo
stimolo iperglicemico sia una concentrazione di
glucosio superiore a 100mg/ml a livello ematico. La
glicemia non raggiunge quindi valori molto bassi.
Viene invece riportata a valori ottimali.
enzimatici. La lipogenesi è stimolata così
come gli enzimi che la determinano. La lipasi
ormon-sensibile è inibita, mentre a livello
proteico, aumenta la sintesi, diminuisce il
catabolismo.
L'attività fosforilasica che porta alla
glicogenolisi è ridotta, inibita. L'attività
glicogenosintasica è aumentata in tutti i
distretti (soprattutto nel fegato, nel muscolo
scheletrico e nel miocardio). Anche nel
tessuto adiposo una piccola quota di glucosio
viene
convertita
in
glicogeno.
La
gluconeogenesi, invece, a livello del fegato
viene inibita. Quali sono gli organi
neoglucogenetici? Fegato e rene come azione
vicariante. Il muscolo dà i substrati per la
neoglucogenesi ma non è neoglucogenetico.
L'ingresso di glucosio viene favorito, è vero,
però gli epatociti, per gli effetti a livello di
membrana,
sono
insulino-indipendenti
(infatti non si ha alcun effetto provato). Tutti
gli altri effetti sono positivi. Perché non è
necessaria l'insulina per il trasporto
transmembrana di glucosio a livello della
membrana epatocitica? L'insulina interviene
in una fase postprandiale, dopo i pasti, quindi
il glucosio che verrà assorbito a livello
intestinale viene portato immancabilmente
attraverso la via porta a livello epatico. C'è
quindi un'abbondanza di glucosio a livello
dell'epatocita e non è necessaria l'attivazione
di un meccanismo di trasporto.
Si assiste ad un'entrata di potassio in tutti i
distretti. L'urogenesi è ridotta a livello
epatico (il ciclo dell'urea è tipicamente
epatico). La sintesi proteica è presente in tutti
i distretti (per sintesi proteica non s'intendono
soltanto proteine strutturali ma anche
proteine funzionali, cioè di proteine
enzimatiche
correlate
coi
diversi
metabolismi).
Non vi sono riserve proteiche. Le proteine
del muscolo sono una riserva di proteine ma
non hanno lo scopo di riserva! I trigliceridi
del tessuto adiposo hanno un ruolo di
deposito per l'utilizzazione nei momenti di
digiuno. Le proteine muscolari non hanno
funzione di riserva per le fasi successive, ma
permettono le contrazioni muscolari! Perché?
Si preferisce risparmiare le proteine, non le si
5
usa a fini energetici. Ci sono delle
condizioni, però, in cui le proteine muscolari
possono essere dirottate verso la proteolisi: in
un digiuno proteico di lunghissima durata o
in una epatopatia grave che impedisce
l'utilizzo delle proteine, condizioni non
fisiologiche.
L'insulina facilita l'ingresso di acidi grassi a
livello del tessuto adiposo (lipoproteinlipasi)
e l'entrata degli aminoacidi in tutti i distretti.
Solo nel tessuto adiposo viene inibita la
liberazione di acidi grassi.
L'ormone ha quindi effetti anticatabolici ed
effetti anabolici. Vengono ovviamente
favoriti dei fenomeni, vengono inibiti altri
fenomeni. S'insiste che l'unico ormone
ipoglicemizzante è l'insulina: Tutti gli altri
ormoni vengono chiamati ormoni della
controregolazione, sebbene operino con
meccanismi diversi.
Qual è il meccanismo tipico dei
glucocorticoidi? Sono diversi i meccanismi,
ma il principale è la neoglucogenesi. E per
l'adrenalina? È la glicogenolisi ed anche una
ridotta captazione di glucosio a livello
tissutale. Perché, si ricordi, un ormone
ipoglicemizzante è anche lipolitico (di
norma). Perché? Quando viene prodotto un
ormone iperglicemizzante? Quando c'è un
digiuno, ad esempio. E perché tra i
meccanismi possono essere la glicogenolisi,
la gluconeogenesi o la ridotta captazione di
glucosio a livello muscolare? Perché il
glucosio a cosa serve? Tutto ha un fine.
L'adrenalina è iperglicemica, perché? È
l'ormone dello stress, viene prodotto nelle
emergenze, attiva l'apparato cardiovascolare,
i vasi, etc... Però perché questa iperglicemia?
A chi serve tutto il glucosio? Al sistema
nervoso. Il sistema nervoso quali altri
metaboliti può usare? I corpi chetonoci, il
lattato... anche se il glucosio è il substrato
energetico per eccellenza. Il lattato che viene
prodotto dall'astrocita viene utilizzato dal
neurone.
Tutti i tessuti hanno una riserva di
glicogeno. Modesta o eccessiva, l'unica
cellula che non ha riserve proprie di
glicogeno è il neurone. La dimostrazione è
che se un soggetto che va incontro ad
ipoglicemia, va incontro ad ictus. Le riserve
di glicogeno sono presenti nell'astrocita.
Perché se da un lato diminuisce la glicemia,
d'altro aumentano i NEFA circolanti per i
fenomeni di lipolisi? Perché è chiaro che i
muscoli debbano lavorare! Siccome il
glucosio deve essere utilizzato soprattutto dal
sistema nervoso, gli acidi grassi verranno
utilizzati nel muscolo. Esiste il ciclo acidi
grassi-glucosio, secondo il quale l'acido
grasso viene utilizzato invece del glucosio e
l'esochinasi viene inibita.
La riserva di glicogeno a livello muscolare
per 100g è modesta! È un grammo! Nel
fegato è 5g. Però è chiaro che la massa
muscolare è importante, quindi la quantità è
enorme! C'è una differenza: mentre il
glicogeno epatico serve a tutte le cellule, il
glicogeno muscolare serve solo alla cellula
muscolare.
È chiaro che quando aumentano i NEFA, le
esochinasi vengano inibite e ci sia una
minore captazione di glucosio a livello
muscolare. Di conseguenza si ha un aumento
della glicemia.
Gli eventi su descritti avvengono in tempi
diversi. Le risposte rapide si manifestano in
pochi secondi e prevedono trasporto
transmembrana di glucosio, di amminoacidi,
di potassio nelle cellule sensibili all'insulina.
Le risposte intermedie durano qualche
minuto e sono eventi intracellulari, vedi
sintesi proteica, inibizione della lisi proteica,
aumento dalla sintesi di glicogeno e della
glicolisi, inibizione della fosforilasi, etc... La
risposta a lungo termine è determinata
prima dall'attivazione degli enzimi, poi dalla
sintesi ex novo di enzimi ad opera di fattori
di trascrizione che agiscono a livello genico.
Risulta evidente che la risposta a lungo
termine duri anche ore, considerato che la
sintesi di RNA messaggero necessario agli
enzimi per i vari eventi metabolici sia un
processo di lunga durata.
6
ADIPOSO
aumentata entrata di glucosio
aumentata sintesi di acidi grassi*
utilizzati come fonte di energia.
Nel fegato il trasporto del glucosio non
viene modificato e c'è una minore
chetogenesi. Per il resto, come sopra.
aumentata sintesi di trigliceridi
attivazione della lipoproteinlipasi che agisce
sui chilomicroni e sulle VLDL
Recettore per l'insulina
inibizione della lipasi ormon-sensibile
Come il recettore visto precedentemente per
la leptina e per la prolattina, il recettore per
l'insulina è un recettore ad attività
enzimatica.
Possiede
un
domino
extracellulare che funge da recettore
dell'insulina (quindi presenta un domino di
legame con l'ormone), un dominio
transmembrana ed un dominio intracellulare
che ha attività enzimatica.
aumento della captazione di potassio
*anche a partire da glucosio, quindi liponeogenesi c'è infatti un aumento della sintesi di glicerolo-3fosfato, indispensabile per la sintesi di trigliceridi
MUSCOLO
aumentata entrata di glucosio
aumentate glicogenosintesi e glicolisi
aumentata captazione di aminoacidi
aumentata sintesi proteica
diminuito
rilascio
di
aminoacidi
gluconeogenetici (che poi non potrebbero
essere usati per la gluconeogenesi)
aumentata captazione di corpi chetonici
aumentata captazione di potassio
I corpi chetonici non sono prodotti da
rifiutare! L'acido lattico non è negativo per
l'organismo. Questo, se viene ossidato con
metabolismo aerobico, dà un rendimento di
16 molecole di ATP per una mole di lattato,
una quantità elevata! Da chi viene utilizzato
il lattato? Dal miocardio e dai muscoli che
non sono impegnati nell'attività fisica. Perché
il lattato dà fatica? Perché determina un
ambiente acido. È l'acidosi che causa fatica.
Lo stesso, i corpi chetonici non sono da
buttar via (a parte l'acetone), e sono l'acido
acetoacetico e l'acido β-idrossibutirrico.
Sono una buona fonte di ATP, anche per il
tessuto nervoso. Fin quando non danno una
condizione di acidosi scompensata. I corpi
chetonici vengono utilizzati anche dal
muscolo. In ogni caso, aumentata captazione
di corpi chetonici che pertanto vengono
Recettore per l'insulia – struttura del
recettore, meccanismo di attivazione e di
catalisi, con gli effetti correlati.
Nel caso del GH e della prolattina, la
struttura è molto simile però il sito
intracellulare non ha attività enzimatica ma,
se attivato, attiva una tirosino-chinasi
citoplasmatica della famiglia JANUS [Janus
chinasi (JAK) è una famiglia di tirosina
chinasi non-recettore che trasducono segnali
mediati da citochine attraverso la via
metabolica JAK-STAT. Questa famiglia di
chinasi è stata chiamata "just another kinase
- JAK" 1 & 2 ("solo un'altra chinasi" in
inglese, dato che le JAKs sono solo alcune
fra un grande numero di chinasi scoperte in
un esperimento basato sulla PCR).
Successivamente
hanno
ricevuto
la
denominazione
"Janus
chinasi",
in
riferimento al dio romano Giano, dio delle
porte, che aveva due facce – wikipedia:
http://it.wikipedia.org/wiki/Janus_chinasi].
Nel caso del recettore per l'insulina, il
7
dominio
intracellulare
ha
un'attività
enzimatica tirosino-chinasica. Per cui,
quando l'ormone si lega al sito recettoriale,
l'enzima tirosino-chinasico viene attivato con
meccanismo di autofosforilazione del
dominio intracellulare. Questo comporta
l'attivazione di altre chinasi con i relativi
effetti metabolici.
Quando il dominio si autofosforila, il
recettore si attiva cosicché possa agire sui
substrati del recettore insulinico. Il risultato è
la fosforilazione di proteine enzimatiche, con
conseguenti lipogenesi, glicogenosintesi,
sintesi proteica, espressione genica (effetto
tardivo - sintesi ex novo di proteine
enzimatiche), trasporto della vescicola che
contiene i trasportatori a livello di membrana.
Il discorso è più complesso. Una volta che la
tirosina-chinasi agisce sui substrati, ci sono
fenomeno o di fosforilazione di proteine già
presenti o di defosforilazione. Per cui ci sono
fenomeni di attivazione enzimatica o
disattivazione enzimatica. Ci sono enzimi
bersaglio per la sintesi di glicogeno, per la
sintesi di lipidi, per la glicolisi... tutti eventi
insulino-dipendenti.
Viene attivata una chinasi dell'inositolo
trifosfato (IP3), quindi permette la
traslocazione del trasportatore GLUT a
livello di superficie di membrana; vengono
sintetizzate strutture mitogene, segnali
mitogeni per la sintesi di mRNA per la sintesi
di proteine enzimatiche. L'agente mitogene è
MAP-chinasi che, a livello del nucleo, attiva
i geni per la sintesi di mRNA, il quale verrà
tradotto da ribosomi per la sintesi proteica.
Per quanto riguarda la traslocazione, è
dovuta al fatto che le molecole di inositolo
trifosfato attivano la molecola AKT
[conosciuta anche come protein-chinasi B o
PKB, è una proteina citosolica che svolge un
ruolo chiave nel pathway PI3K/Akt. La sua
attività consiste nella fosforilazione di vari
substrati proteici nei residui serina e treonina,
portando spesso alla inattivazione della loro
attività. Ciononostante, l'attivazione di Akt
provoca come risultato effettivo l'attivazione
di vie biochimiche che portano alla crescita
cellulare ed alla resistenza all'apoptosi –
wikipedia:
http://it.wikipedia.org/wiki/AKT_(proteina)],
la quale che permette la traslocazione.
L'attivazione di AKT dipende dalla chinasi
dell'inositolo trifosfato.
Fattori che influenzano la secrezione
Non soltanto il glucosio stimola la
produzione e la secrezione di insulina, ma
anche il mannosio, il galattosio, proteine,
aminoacidi (soprattutto l'arginina e la
leucina, potenti stimolatori della secrezione
di insulina), chetoacidi, acidi grassi liberi,
ormoni. Tra gli ormoni, in particolare, il
glucagone stimola per via e diretta ed
indiretta. Diretta perché agisce sulla cellula
β; indiretta perché causa iperglicemia. Anche
alcuni ormoni gastrointestinali permettono la
produzione e/o secrezione di insulina, il cui
significato è poco chiaro, si vedano la
secretina, colecistochinina e la gastrina.
L'incretina è il glucagone intestinale che,
una volta prodotto a livello intestinale, agisce
a livello pancreatico, sulla cellula β. Il
peptide simile al glucagone viene prodotto in
seguito ad un pasto glicidico. La cellula L
dell'intestino produce quindi il peptide che
per via portale raggiunge prima il fegato, poi
il pancreas, con la conseguente secrezione
d'insulina. Si tratta dell'asse enteropancreatico (dall'intestino, origine, alla
cellula β, bersaglio). Perché è importante?
Perché arriva il glicide, si libera l'incretina e
si ha la produzione di insulina. Nel frattempo
si ha la digestione del glicide, il glucosio
viene assorbito, quindi c'è lo stimolo da
glucosio. Qual è il significato? Che si ha una
produzione di insulina prima ancora che il
glucosio venga assorbito. Quindi il pancreas
è già pronto a ridurre la glicemia. L'incretina
è bersaglio di farmaci per gli individui affetti
da diabete di secondo tipo.
Il vago è stimolante. Il simpatico, con il βrecettore, è anch'esso stimolante. I fattori
inibenti sono il digiuno, l'esercizio fisico di
lunga durata (maratona), la somatostatina
pancreatica, la leptina, l'attività αadrenergica. Quindi il simpatico, con i β
stimola, con gli α inibisce. L'effetto più
8
comune è l'aumento della glicemia, della
concentrazione plasmatica di aminoacidi, le
incretine (tra cui il peptide intestinale simile
al glucagone), l'assunzione di cibo. Il
parasimpatico stimola, l'ortosimpatico con gli
α inibisce. Viene stimolata la cellula β, viene
secreta l'insulina con i relativi effetti
metabolici.
È chiaro che lo stimolo più efficace è
rappresentato dalla glicemia.
Quando si ha il passaggio del bolo
alimentare, aumenta il glucosio plasmatico e
c'è la risposta insulinica - quindi
monofasica! Se il pasto invece è prolungato,
non unica somministrazione, ci sono due tipi:
un picco rapido, l'insulinemia aumenta, poi
tende a diminuire, poi un più lento ulteriore
aumento. Quindi una fase iniziale rapida cui
segue una fase più lenta tardiva. A cos'è
dovuta? Perché la fase iniziale rapida è
dovuta al fatto che le vescicole che
contengono
l'insulina
sono
pronte
all'esocitosi. Quindi si ha l'immediata
esocitosi. Nel secondo caso c'è bisogno
dell'attivazione della vescicola e dello
spostamento verso la membrana plasmatica.
Quindi ci vuole più tempo.
Il meccanismo dell'esocitosi è Ca2+dipendente. Quindi c'è bisogno dell'ingresso
di calcio nella cellula. Se la cellula è a riposo
- condizione di ipoglicemia -, il trasportatore
GLUT2 trasporta poco glucosio, quindi
l'attività metabolica è modesta, si formano
meno molecole di NADPH, meno molecole
di ATP. Queste condizioni mantengono aperti
i canali del potassio, il quale fuoriesce. Il
canale del calcio è chiuso. Non può così
entrare lo ione Ca2+ e non può avvenire
l'esocitosi. Se però il soggetto va incontro ad
una condizione di iperglicemia, alla quale è
necessaria una risposta insulinica, c'è un
maggiore ingresso di glucosio nella cellula,
quindi aumentano le vie di utilizzazione del
glucosio, un aumento di ATP e di NAPDH. Il
canale del potassio viene così chiuso e lo
ione in esame non può uscire dalla cellula,
che si depolarizza. Alla depolarizzazione
segue l'apertura del canale del calcio, il quale
ione penetra nel citoplasma e si lega alle
proteine che lo trasportano verso altri
polipeptidi che permettono lo spostamento
delle vescicole verso la membrana. La
membrana vescicolare si può così fondere
con la membrana citoplasmatica e si ha
quindi l'esocitosi della vescicola.
Altri fattori che determinano quest'effetto
sono l'aumento del calcio dalle riserve di
calcio intracellulare, quindi non calcio
“esterno” ma “interno”. Qual è il secondo
messaggero che permette uno spostamento di
calcio dalle riserve intracellulari verso il
citoplasma? L'inositolo trifosfato. Viene
infatti attivata la fosfolipasi C con tutte le
conseguenze che ne derivano.
Dopo un pasto aumentano la glicemia e
l'insulina; la cellula α del pancreas viene
invece inibita, sicché la produzione di
glucagone, invece, diminuisca. Se ci fosse
stata l'ipoglicemia, ci sarebbe stata una
situazione diversa.
Dopo un pasto proteico, la glicemia non si
modifica. Aumenta invece il tasso ematico di
aminoacidi, con conseguente aumento sia di
insulina sia di glucagone.
9
Glucagone
Il glucagone è l'altro ormone pancreatico
che però ha azione di tipo catabolico. Mentre
l'insulina permette di accumulare riserve
energetiche, il glucagone fa utilizzare le
riserve energetiche, mobilizzando glucosio
ed acidi grassi dalle riserve di glicogeno e di
trigliceridi.
Origine e biosintesi
La cellula di origine è la cellula α del
pancreas. È un peptide costituito da 29
aminoacidi disposti soltanto in una catena. La
biosintesi è identica a quella di tutti i peptidi:
da preproglucagone si forma il proglucagone
ed infine il glucagone.
Struttura tridimensionale della
molecola di glucagone.
Come detto precedentemente, vi sono due
famiglie di glucagone: una di origine
pancreatica (famiglia in esame), ed una di
origine intestinale, prodotta dalle cellule L.
Nei granuli delle cellule α del pancreas, dal
proglucagone si formano il glucagone ed un
fattore
grande
(o
maggiore)
del
proglucagone, che non viene analizzato di
seguito.
A livello invece delle cellule L dell'intestino,
dallo stesso preproglucagone, si forma un
proglucagone, da cui originano alcune
sostanze, tra cui il glucagone-simile (GLP, di
due tipi, I e II, di cui s'è discusso sopra) e
l'oxintomodulina, avente azione opposta sul
comportamento della fame e sazietà della
grelina. A stomaco vuoto viene prodotta
grelina, che stimola la fame. Il soggetto
introduce cibo, il quale raggiunge l'intestino
sotto forma di chimo. In queste condizioni,
viene prodotta oxintomodulina, la quale ha
un effetto opposto alla grelina, cioè stimola
il centro della sazietà, per cui il soggetto
riduce l'introduzione di cibo. Quindi si
ricordi che dal proglucagone intestinale si
ricavano i peptidi simili al glucagone
pancreatico e l'oxintomodulina, che è un
fattore anoressizzante. La grelina è invece
un fattore oressizzante.
Fattori
che
interessano
la
secrezione, trasporto ematico,
cellule bersaglio, recettore ed
effetti metabolici
Anche il glucagone è trasportato in forma
libera, non legata a proteine plasmatiche.
Quali sono i fattori in grado di stimolare la
produzione di glucagone? Una ipoglicemia,
una
iperaminoacidemia
oppure
una
iponefemia.
Quali sono le cellule bersaglio? Soprattutto
il fegato (principalmente) ed il tessuto
adiposo bianco. Il tessuto adiposo bruno ha
un'altra funzione.
Il recettore è un recettore correlato alla
proteina G, la quale determina la produzione
di cAMP, per cui alla fine gli effetti del
glucagone sono AMP-ciclici.
Gli effetti sull'organismo? Sono prettamente
catabolici. Lo stimolo è l'ipoglicemia. Gli
effetti si rilevano sul metabolismo proteico
(aumento protidolisi, diminuzione di
protidosintesi), sul metabolismo lipidico
(ridotta lipogenesi, aumento lipolisi, perché
viene attivata la lipasi ormon-sensibile), sul
metabolismo glicidico (inibizione di glicolisi
e della glicogenosintesi, aumento di
glicogenolisi
e
neoglucogenesi).
Di
conseguenza, si ha un aumento della
glicemia.
Quando si verificano queste circostanze?
Nel digiuno. Infatti il glucagone viene
chiamato ormone del digiuno.
Nelle 24 ore, quando si va incontro ad una
10
condizione di digiuno che provoca un
incremento
ematico
di
glucagone?
Principalmente durante la notte. È chiaro che
il discorso varia dagli orari dei pasti. Se il
periodo di digiuno è lungo, si ha produzione
di glucagone. A meno che il soggetto non sia
affetto da una forma di disturbo del
comportamento alimentare, classicamente
l'anoressia mentale e la bulimia mentale. C'è
una forma polifagia notturna: il soggetto si
alza di notte e si abbuffa, con assenza di
risposta alla fame. I soggetti affetti da una
forma di sindrome compulsiva da
introduzione di cibo, si abbuffano di notte
sebbene abbiano consumato vari pasti
durante il giorno. Una delle conseguenze di
tale sindrome può essere l'obesità.
Il glucagone ha come tessuti bersaglio il
fegato ed il tessuto adiposo. A livello del
tessuto adiposo avviene la lipolisi. Nel
fegato, invece, aumentano la glicogenolisi e
la gluconeogenesi, quindi una maggiore
messa in libertà di glucosio in circolo;
aumentano la lipolisi, la chetogenesi ed il
catabolismo proteico; diminuiscono la
glicogenosintesi, la glicolisi, la sintesi di
colesterolo; e così via...
Ha sempre un effetto muscolare. Siccome il
muscolo utilizza acidi grassi come fonte
energetica, viene ridotta la captazione di
glucosio a livello circolare. Quindi
l'iperglicemia non è solo legata alla
gluconeogenesi e alla glicogenolisi, ma
anche ad una ridotta captazione periferica di
glucosio correlata con l'utilizzazione di lipidi,
acidi grassi dai muscoli in queste condizioni.
Stimolo secrezione di glucagone
ipoglicemia
iperaminoacidemia
ipolipidemia
L'unico ormone ipoglicemizzante è l'insulina.
Tutti gli altri ormoni sono iperglicemizzanti.
L'unico ormone lipogenetico è l'insulina. In
genere, tutti gli altri ormoni sono da un lato
iperglicemizzanti, da un lato lipolitici.
Infatti l'insulina aumenta la glicolisi, la
glicogenesi e diminuisce la glicogenolisi e la
gluconeogenesi. Il glucagone ha effetti
totalmente opposti.
Le catecolamine hanno effetto modesto sulla
glicolisi, aumentano la glicogenolisi e la
gluconeogenesi, soprattutto da glicerolo e
lattato. La somatotropina ha effetti
iperglicemizzanti,
glicogenolisi
e
neoglucogenesi. I glucocorticoidi anche
aumenta la gluconeogenesi.
Gli effetti glucosio, inibisce la cellula α, gli
aminoacidi la stimolano.
Altri effetti del glucagone
Il glucagone ha effetti non metabolici a dosi
farmacologiche, quindi quando è presente a
concentrazioni elevate. Quando si parla di
dosi fisiologiche, il dosaggio è di bassa
entità. Il dosaggio farmacologico è di elevatà
entità. Se il glucagone viene prodotto in
elevata quantità, ha un effetto a livello
cardiaco:
infatti
ha
un
effetto
tachicardizzante, perché agisce sulla cellula
nodale; sul miocita cardiaco, aumentando la
contrattilità, perché favorisce la sintesi di
cAMP, l'ingresso di Ca2+ dall'esterno, e
quindi una maggiore quantità di Ca2+ per
l'effetto contrattile. Si ripete che l'effetto
cardiaco si ha ad alto dosaggio.
Effetti del glucagone*
aumento glicemia
ridotta la glicogenosintesi
aumenta la produzione nel fegato di
glucosio da parte della glicogenolisi e
gluneogenesi
*Vi sono anche altri effetti
11
Somatostatina ed
equilibrio insulina
glucagone
Gli altri due ormoni prodotti dalle cellule
dell'isola
di
Langerhans
sono
la
somatostatina e il polipeptide pancreatico
(PP). Si fa riferimento solo alla
somatostatina.
Come in tutti i distretti, la somatostatina è
sempre inibitoria. L'isoforma pancreatica
viene prodotta a partire da una molecola di
preprosomatostatina. Ha un ruolo inibitorio
sia sulla produzione di insulina sia sulla
produzione di glucagone.
Equilibrio insulina glucagone
durante l'esercizio fisico
Ormone del digiuno: durante il digiuno, la
glicemia diminuisce, l'insulina diminuisce,
aumenta il glucagone. Conseguenze:
aumentano
i
corpi
chetonici
(βidrossibutirrato e acetoacetato), gli acidi
grassi liberi ed il glicerolo (quindi
neoglucogenesi). L'alalina tende a diminuire,
gli aminoacidi a differente attività tendono ad
aumentare [?].
Quali condizioni sono simili al digiuno?
L'attività fisica nel soggetto allenato. Ma in
quale attività fisica? Se il soggetto ha
un'attività di potenza, di breve durata, di alto
impegno, il substrato di eccellenza per il
muscolo è il glucosio. Se il soggetto svolge
un'attività di durata, aerobica, sottomassimale,
c'è
un
comportamento
particolare: se la durata non è molto lunga,
non supera l'ora e mezza, due ore, il muscolo
utilizza sia glucosio sia acidi grassi (50%
dell'uno, 50% dell'altro4); se la durata è più
4Una piccola quota viene fornita anche dalla
componente proteica: un soggetto che non svolge
lunga, diminuisce la quota di energia che
deriva dal glucosio ed aumenta la quota di
energia che deriva dai lipidi.
Durante
l'attività
fisica
prolungata,
inizialmente si ha un lieve aumento del
glucagone ed una lieve diminuzione
dell'insulina. Quando si superano le due ore,
il
metabolismo
diventa
di
natura
prevalentemente lipidica, l'insulina continua
a diminuire ed il glucagone tende
notevolmente ad aumentare. L'attività fisica
ha un andamento ormonale come il digiuno.
Nel caso in cui il soggetto è a riposo, il
muscolo utilizza per i 2/3 acidi grassi e per
un 1/3 i glicidi, e non è necessaria la
presenza d'insulina. Se il soggetto assume un
pasto, il discorso cambia e c'è bisogno di
insulina perché possa essere immagazzinato
il glucosio.
Quando il muscolo utilizza acidi grassi,
viene impedita l'esochinasi e quindi c'è una
minore utilizzazione del glucosio: è il ciclo
glucosio-acidi grassi. S'immagini che il
soggetto sia a digiuno. Vengono scissi gli
acidi grassi dai depositi e raggiungono il
muscolo. L'acidi grasso viene metabolizzato
ad acetil-CoA, viene aumentata la sintesi
della citrato-sintetasi, quindi si ha un
aumento del citrato, il quale inibisce l'enzima
fruttosio-6-fosfato-chinasi.
Si
ha
un
accumulo del prodotto a monte, con minore
formazione di fruttosio-1,6-bifosfato. Il
fruttosio-6-fosfato inibisce l'esochinasi.
Viene meno quindi la fosforilazione del
glucosio, per cui c'è un minor ingresso di
glucosio con un aumento della glicemia per il
ciclo glucosio-acidi grassi.
attività fisica, solo il 5% dell'energia deriva dalle
proteine; in un soggetto che pratica attività fisica, la
quota raggiunge il 10-15%. Quindi 50% glucosio,
40% acidi grassi, 10% aminoacidi. Infatti, ad un atleta
che svolge un'attività fisica di resistenza, si consiglia
l'introduzione di una quota proteica maggiore rispetto
alla norma, non 1g/1kg ma 1,2g/kg.
12
Catecolamine
Tra i derivati aminici del catecolo, si
analizzano l'adrenalina, la noradrenalina e
dopamina. Ci si riferisce all'adrenalina ed
alla noradrenalina.
Nella midollare del surrene, viene prodotta
per il 90% adrenalina e soltanto per il 10%
noradrenalina. Nelle sinapsi noradrenergiche,
la situazione è opposta: maggiore produzione
di noradrenalina rispetto all'adrenalina. Per
conseguenza di norma si dice che
l'adrenalina è di origine periferica, a livello
del surrene, e la noradrenalina a livello delle
sinapsi centrali, soprattutto le sinapsi
noradrenergiche del simpatico postgangliare.
Nel SNC ci sono dei circuiti in cui il
mediatore chimico non è la noradrenalina ma
è l'adrenalina, ci sono cioè dei distretti molto
limitati che si comportano come la midollare
del surrene.
Natura chimica, stimolo per la
secrezione e trasporto
Le catecolamine derivano dalla tirosina o
dalla fenilalanina. L'enzima che limita la
sintesi delle catecolamine è la tirosina
idrossilasi.
Se si ricorda, quando s'è parlato del ruolo
della dopamina come fattore inibitorio della
prolattina, la prolattina ha un feedback
negativo sulla propria produzione. Come
agisce a livello dell'ipofisi o dell'ipotalamo?
Stimola la tirosina idrossilasi quando la PRL
aumenta. E l'effetto? Si ha un aumento della
sintesi di dopamina che inibisce la sintesi di
prolattina.
Ghiandola surrenalica.
La sintesi è in parte citoplasmatica, in parte
nei
granuli
secretori:
dopamina,
norepinefrina ed epinefrina passano poi in
circolo per effettuare la risposta ormonale.
Il trasporto delle catecolamine è in parte
libero.
Qual è lo stimolo per la secrezione di
adrenalina? È lo stress: l'adrenalina è
l'ormone per eccellenza (non è l'unico) dello
stress acuto. Come lo stress determina la
produzione di adrenalina a livello della
midollare del surrene? Attraverso il sistema
nervoso simpatico. Sono neuroni pregangliari
del simpatico che innervano la midollare del
surrene. Quindi, in fin dei conti, cos'è la
midollare del surrene? Può essere paragonata
ad un ganglio del sistema nervoso simpatico.
Il sistema simpatico è costituito da un
neurone pregangliare che fa sinapsi con un
neurone postgangliare ed il mediatore
chimico è l'acetilcolina. Il neurone
postgangliare fa sinapsi con l'effettore e
agisce attraverso la noradrenalina o
l'adrenalina.
Recettori
I recettori sono o α o β. Il neurone
pregangliare
simpatico,
stimolato
dall'ipotalamo e dal sistema limbico, agisce a
livello della midollare del surrene, quindi
come se fosse un ganglio, e permette la
liberazione
di
adrenalina
attraverso
l'acetilcolina. Quindi tipica reazione di
"attacco o fuga" tramite il SNC ed il SNA
simpatico.
Anche l'ipoglicemia è una condizione
stressante che, agendo a livello centrale,
determina una secrezione di adrenalina.
α-recettore – meccanismo d'azione
13
La midollare del surrene produce anche
endorfine, o meglio, encefaline. Queste
vengono immesse in circolo ed hanno lo
scopo di prevenire una eccessiva risposta
adrenergica.
Quindi
si
cerca
di
controbilanciare l'effetto delle catecolamine
(nel caso, dell'adrenalina).
L'adrenalina agisce su tutti i distretti, non c'è
un citotipo che non risenta dell'effetto
dell'adrenalina o della noradrenalina.
Se l'adrenalina agisce con i β-recettori (β1 e
β2), l'azione avviene attraverso l'attivazione
di una proteina G che attiva l'adenilato
ciclasi. Quindi l'effetto sui β-recettori è
mediato dal cAMP. Invece gli effetti sugli αrecettori sono mediati dal diacilglcerolo
(DAG). Il recettore α attiva una una proteina
Gq, che attiva a sua volta attiva la fosfolipasi
C, il quale permette la formazione di IP3 ed il
DAG. Quindi l'attività degli α-recettori non è
mediato dal cAMP ma dal DAG e,
soprattutto, dall'IP3 .
Struttura tridimensionale
di un β-recettore
Effetti
Per quanto riguarda gli effetti delle
catecolamine, sono di diverso tipo. Effetti
metabolici, ampia attività metabolica, ampio
spettro, che si oppongono all'attività
colinergica (considerando la noradrenalina
delle sinapsi adrenergiche). A livello
dell'occhio, per esempio, causano midriasi,
perché attraverso l'α-recettore provocano la
contrazione del muscolo radiale dell'iride,
che causa una midriasi. Invece l'acetilcolina,
attraverso il sistema parasimpatico, causa
miosi. Muscolo ciliare, attraverso i βrecettori, si ha un rilasciamento ai fini della
visione da lontano. Cuore: effetto sul nodo
senoatriale, aumento della frequenza
cardiaca, aumento della contrattilità del
miocardio, aumento della velocità di
conduzione
dell'impulso
del
nodo
atrioventricolare del sistema di conduzione, e
così via... Nelle arteriole, l'effetto è duplice in
base ai diversi distretti: mediante gli αrecettori, c'è una contrazione; attraverso i β2recettori, c'è una dilatazione. Per esempio, a
livello dei muscoli scheletrici, prevalgono i
β2-recettori (quindi vasodilatazione). A
livello della cute, del rene, a livello
splancnico, predominano gli α-recettori, con
vasocostrizione. È chiaro che nei polmoni
agisce sulla muscolatura liscia bronchiale,
con
i
β2-recettori,
provocando
un
rilasciamento.
Gli effetti
a
livello
gastrointestinale sono modesti, perché
ovviamente predominano gli effetti del
parasimpatico, ma di norma si ha una
diminuzione della motilità e del tono della
muscolatura liscia dell'apparato digerente,
invece c'è una contrazione degli sfinteri
attraverso gli α-recettori.
Quali sono gli effetti metabolici? Ha un
effetto simile al glucagone, iperglicemizzante
e lipolitico. Quindi aumenta la lipolisi del
tessuto adiposo perché viene attivata la lipasi
ormon-sensibile. Aumentano quindi i NEFA
circolanti che possono raggiungere i muscoli
per essere utilizzati al posto del glucosio. Di
conseguenza viene inibita la captazione di
glucosio. Risultato? Iperglicemia.
L'altro meccanismo è la glicogenolisi.
Quindi attiva la fosforilasi, con conseguente
aumento in circolo di glucosio dal glicogeno
epatico. Aumento anche la gluconeogenesi a
partire dal glicerolo, e non da aminoacidi,
perché l'effetto sul metabolismo proteico da
parte delle catecolamine è decisamente
modesto.
In sintesi, gli effetti metabolici:
• aumenta la glicogenolisi mediata dai
β-recettori;
• aumenta la neoglucogenesi mediata
dagli α-recettori;
• aumento della lipolisi a livello del
tessuto adiposo bianco;
• aumento della produzione di calore
(soprattutto a livello del tessuto
adiposo bruno) con gli β3-recettori;
14
•
•
•
•
•
aumento secrezione di insulina;
diminuita utilizzazione di glucosio;
aumenta la secrezione di glucagone;
aumenta la captazione muscolare di
potassio;
dilatazione delle arteriole.
Come determinano l'effetto calorigeno i β 3recettori? Perché hanno un effetto
disaccoppiante: stimolano la sintesi di una
proteina disaccoppiate sicché l'ossidazione
non comporti la fosforilazione. Quindi viene
prodotto calore e non energia sotto forma di
ATP.
Gli ormoni tiroidei hanno un'azione
permissiva sugli effetti delle catecolamine.
Gli ormoni tiroidei nei soggetti ipertiroidei
causano tachicardia. Come? Una volta si
pensava che la tachicardia legata agli ormoni
tiroidei, potesse essere collegata con
l'aumentata produzione di calore. Perché si sa
che l'aumento di calore, agendo a livello del
nodo senoatriale, aumenta la frequenza di
scarica. Quindi gli effetti degli ormoni
tiroidei erano correlati all'ipertermia. È in
parte vero ma l'effetto tachicardizzante degli
ormoni tiroidei è perché hanno un'azione
permissiva dell'ormone sulle catecolamine.
In che modo? Aumentano i recettori β sulla
superficie di membrana. Aumenta anche
l'affinità dei recettori β alle catecolamine.
Questa è una tipica azione permissiva di un
ormone su un altro.
Aumenta anche la secrezione degli ormoni
tiroidei.
Un discorso importante è la secrezione di
renina. Qual è lo stimolo per la secrezione di
renina? L'ipovolemia, l'iposodiemia ed anche
l'attività del simpatico, perché anche qui ci
sono i β3-recettori. Il simpatico, agendo sulle
cellule che producono renina (nelle cellule
dei tubuli renali), aumenta la produzione di
renina, ed è la causa della cosiddetta
ipertensione essenziale. Il soggetto diventa
iperteso perché aumenta la produzione di
renina. Si chiama essenziale perché non si
capisce il motivo attraverso il quale aumenta
la renina. Di conseguenza, si ha una
maggiore produzione di angiotensina,
vasocostrizione, ipertensione.
Molti farmaci che vengono utilizzati per la
terapia all'ipertensione, sono i β-bloccanti, i
quali agiscono perché hanno un effetto
d'inibizione sulla secrezione di renina.
Oppure bloccando i β-recettori, la gittata
cardiaca cosa fa? Se i β-recettori causano una
vasodilatazione, bloccando un β-recettore, si
determina una vasocostrizione. Quindi non si
avrebbe un effetto terapeutico! Il β-bloccante
(sui β2-recettori vasali) non agisce causando
ipotensione.
Altrimenti
si
avrebbe
un'accentuazione dell'ipertensione. Quindi
l'effetto è duplice. A cosa è dovuta la
pressione arteriosa? Alla gittata cardiaca che
condiziona la massima e alle resistenze
periferiche che condizionano la minima. Uno
dei fattori che condiziona le resistenze
periferiche è la vasocostrizione, dovuto, ad
esempio, alla angiotensina. Quindi, se il
soggetto è iperteso perché aumenta la
produzione di angiotensina, dovuta ad un
aumento della produzione di renina, se si
bloccano i β-recettori a livello delle cellule
che producono renina, si ha una minore
produzione di renina ad opera delle
catecolamine. Quale è l'effetto? Una minore
produzione di angiotensina, quindi una
minore vasocostrizione, una vasodilatazione.
Con tale meccanismo diminuisce la minima,
perché questa dipende dalle resistenze
periferiche. Ma cosa fa il simpatico sul
cuore? Aumenta la gittata cardiaca. Ma si
bloccano i β1-recettori cardiaci, si ha una
minore forza di contrazione, una minore
gittata cardiaca, quindi una minore pressione
arteriosa, in modo particolare la massima.
α-recettori
vasocostrizione arteriolare
contrazione dell'utero
contrazione degli ureteri
contrazione dei m. erettori dei peli
rilasciamento intestinale
contrazione m. dilatatore della pupilla
15