CHIMICA
Gli elementi
l
ti chimici
hi i i
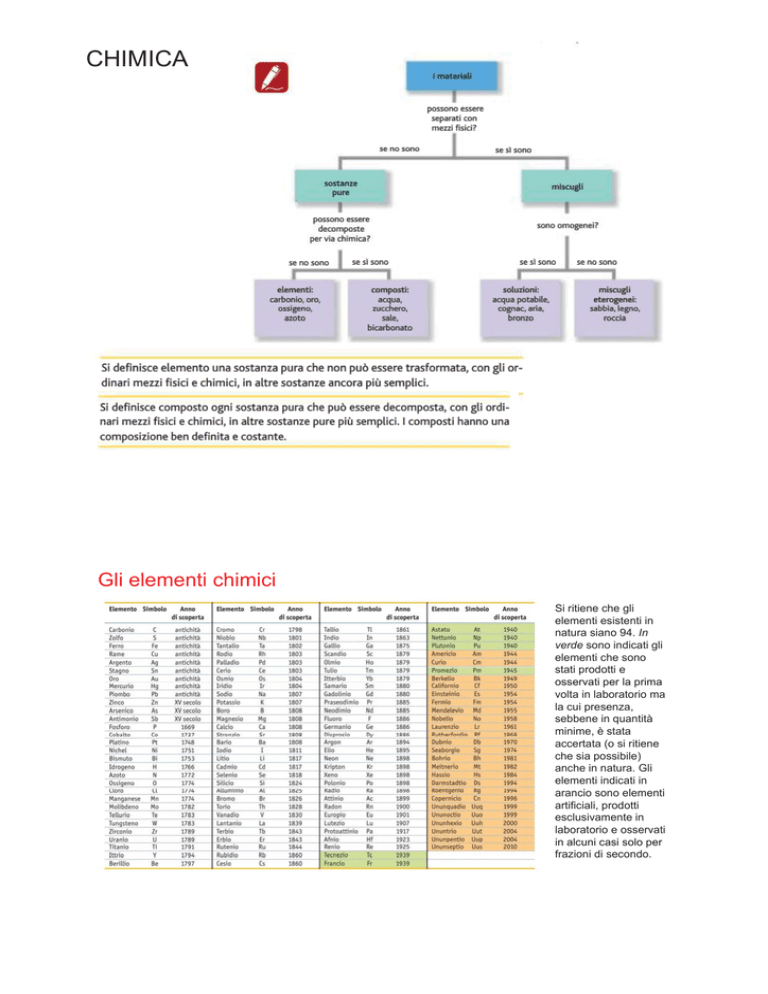
Si ritiene che gli
elementi esistenti in
natura
t
siano
i
94
94. In
I
verde sono indicati gli
elementi che sono
stati prodotti e
osservati per la prima
volta in laboratorio ma
la cui presenza,
sebbene in quantità
minime,, è stata
accertata (o si ritiene
che sia possibile)
anche in natura. Gli
elementi indicati in
arancio
i sono elementi
l
i
artificiali, prodotti
esclusivamente in
laboratorio e osservati
in alcuni casi solo per
frazioni di secondo.
Gli elementi chimici
Il diamante è formato da
carbonio nativo ed è un
minerale estremamente duro
e resistente.
La grafite è costituita anch’essa
da carbonio nativo ma presenta
proprietà
p
p
diverse dal diamante.
Lo zolfo è un non metallo che forma
cristalli giallo opachi e si presenta solido
a temperat
temperatura
ra ambiente
ambiente.
Il silicio è un semimetallo largamente usato nell’industria
elettronica. Esso si comporta come un semiconduttore, ovvero
conduce l’elettricità ad alta temperatura mentre si comporta
come un isolante a bassa temperatura.
La tavola periodica degli elementi
Tavola dei Raggi Atomici:
in giallo = i metalli
in grigio = i semimetalli
e de = i non
o metalli
eta
in verde
le misure sono in picometri (1pm=1x10-12m)
LEGAMI CHIMICI =
si formano per stabilizzare gli atomi (ottetto)
Quandodueopiùatomi sileganotralorosiformaunamolecola:
•
segliatomisonougualisiformaunamolecoladiunelemento
g
g
•
segliatomisonodiversisiformaunamolecoladiuncomposto
es.H2,O2
es.H2O
Elettronegatività:numeroche
esprime la tendenza di un atomo a
esprimelatendenzadiunatomoa
perdereoacquistareelettronidi
legame
Il legame ionico
Dalla posizione sulla tavola periodica si può dedurre
che:
•
gli elementi metallici (a sinistra nella tavola
periodica) tendono a cedere elettroni diventando
ioni positivi;
•
i non metalli (a destra nella tavola periodica)
tendono ad acquistare elettroni trasformandosi in
ioni negativi.
g
Esercizio: ricavare la formula di un composto ionico binario, costituito da magnesio e cloro.
Innanzitutto scriviamo i simboli di Lewis di questi due elementi.
In base alla regola dell’ottetto ogni atomo di magnesio cede due elettroni, mentre ogni atomo di cloro ne può
acquistare soltanto uno: pertanto per ogni atomo di magnesio devono esserci due atomi di cloro.
Si può quindi concludere che nel composto per ogni ione Mg2+ devono essere presenti due ioni Cl–. Con
questo rapporto 1:2 tra ioni positivi e ioni negativi si garantisce la neutralità elettrica del composto e pertanto la
formula risulta essere la seguente:
Scrivi la formula del composto ionico formato dagli elementi potassio e zolfo.
I legami chimici: COVALENTE
La differenza di elettronegatività dev’essere < 1,9
si forma un legame cov. apolare o puro
•Se De =0
•Se 0 < De < 1,9
si forma un legame cov. polare
Il legame covalente apolare o puro: si forma quando i 2 o più atomi che
sii llegano h
hanno stessa
t
eletronegatività
l t
ti ità
E’ tipico delle molecole degli elementi
Il legame covalente semplice
Cl2
Il legame covalente doppio
O2
Il legame covalente triplo
N2
CH4
Il legame covalente semplice.
Il legame covalente
polare
HCl
H2O
CO2
Il legame dativo
Consideriamo la formula di Lewis della molecola dell’acido nitroso (HNO2), in cui oltre ai legami sono
rappresentati anche gli altri elettroni del guscio di valenza
In questo modo è possibile verificare rapidamente che ogni atomo raggiunge una configurazione elettronica
stabile,
t bil rispettando
i
tt d lla regola
l d
dell’ottetto.
ll’ tt tt
Esiste tuttavia un altro acido dell’azoto, l’acido nitrico, in cui è presente un atomo di ossigeno in più e quindi la
p g
q
questo fatto e sapendo
p
che anche il terzo atomo di ossigeno
g
si lega
g aq
quello
sua formula è HNO3. Per spiegare
di azoto, dobbiamo ammettere che l’atomo di azoto metta in comune con il terzo atomo di ossigeno la sua
coppia di elettroni del guscio di valenza non condivisa. La configurazione elettronica dell’atomo di azoto non
cambia, ma in questo modo anche il terzo atomo di ossigeno raggiunge una configurazione elettronica stabile. Il
g
che si forma è ancora un legame
g
covalente, con la differenza che i due elettroni condivisi p
provengono
g
legame
entrambi da uno solo dei due atomi, quello di azoto.
Questa tipologia di legame covalente viene di solito rappresentata con una freccia che va dall’atomo che
fornisce i due elettroni di legame (atomo datore) a quello che li riceve (atomo accettore).
Elementi che
formano dativi:
S N Cl P
Elettronegatività
g
= indica la forza con cui un atomo riesce ad attrarre g
gli elettroni
di legame.
Classificazione (nomenclatura) dei Composti Chimici
Glielementi chimici (sono118), combinandositraloro,costituisconounnumeropraticamenteinfinitodicomposti,unveroe
proprio “mare”
proprio
mare dimolecolediverse.
di molecole diverse.
Esistonoprincipalmenteduemetodidiclassificazionedeicompostichimici:
•Nomenclaturatradizionale,cheutilizzasuffissieprefissiperdescriverelecaratteristichechimichedellediversemolecole.
•NomenclaturaIUPAC(InternationalUnion of PureandAppliedChemistry),chedescrivelamolecolasullabasedellasua
composizioneinatomi,ovverorispecchialaformulabruta,evidenziandoglielementicontenutinellasostanza(es.H2Oper
l’acqua).
I composti si dicono
• binari se formati da due elementi;
• ternari se costituiti da tre elementi
• quaternari …
CompostiBINARI
Gli OSSIDI
L’ossigeno forma composti praticamente con tutti gli elementi della tavola periodica formando
OSSIDI.
• con i metalli forma ossidi basici (ossidi): (metallo + ossigeno)
M+O ÆMO
es. K2O
• con i non metalli
t lli forma
f
ossidi
idi acidi
idi (anidridi
id idi):) (non
(
metallo
t ll + ossigeno)
i
)
X O ÆXO
X+O
es. CO2
Negli
g ossidi l’ossigeno
g
ha valenza 2
Per nominare un ossido, la parola ossido è seguita dalla preposizione di e dal nome dell’altro elemento: Ossido
(che contiene ossigeno) + di + elemento ossidato
Esempi: MgO = Ossido di magnesio; CaO = Ossido di
calcio
CompostibinarinoncontenentiOSSIGENO
Idruri
MH
=compostiformatidaIdrogeno+Metalloealcunisemimetalli
H+MÆ MH
Sonocompostiincuil’idrogenoèlegatoaunelementomenoelettronegativo,comeimetallie
alcunisemimetallie, fattoeccezionale,conl’azoto.
Esempi:KH= Idruro dipotassio; NH3 =Idruro diazoto(ammoniaca)
Idracidi
HX
= sonocompostiformatidall’idrogenoedaunnonͲmetallo
H+XÆ HX
Prendonoilnomediacido seguitodalnomedell’altroelementoconilsuffisso Ͳidrico.
Esempi: HF =Acidofluoridrico; HCl =Acidocloridrico; H2S =Acidosolfidrico
CompostiTERNARI:Lemolecolecontengonotrediversielementiesi
suddividonoinidrossidi,ossiacidiesaliternari.
•Idrossidi
M(OH)
( )
SonocostituitidaunmetallolegatoaungruppoͲOH,ilquale
conferiscecaratteristichebasiche.
Illoronometradizionalesiottienemettendoilnomedel
metallodopoiltermine
t ll d
il t
i idrossido
id
id
NaOH
Al(OH)3
Fe(OH)2
IUPAC
Idrossidodisodio
Triidrossido dialluminio
Diidrossido diferro
di ferro
Tradizionale
Idrossidodisodio
Idrossidodialluminio
Idrossido ferroso
Idrossidoferroso
•Ossiacidi(oACIDI) HXO
Sonocompostivengonoformatidall’aggiuntadiacquaad
anidridi.
Illoronome,nellaclassificazionetradizionale,derivaproprioda
quellodell’anidride.
SO2(Anidridesolforosa)+H2OїH2SO3=Acidosolforoso
SO3(Anidridesolforica)+H2OїH2SO4=Acidosolforico
P2O5 +3H2O ї 2H3PO4 = Acido(orto)fosforico
Salibinari MX= IDRACIDO
+ METALLO (al posto di H)
lemolecolesonocompostedaunmetalloedaunnonmetalloM+XÆ MX
PrendonoilnomedelnonMetalloalqualesiattribuisceilsuffisso
Prendono
il nome del non Metallo al quale si attribuisce il suffisso Ͳuro.
uro.
Esempi: NaCl =Clorurodisodio; CuI =Iodurorameoso
SaliternariMXO
= ACIDO + METALLO (al posto di H)
Sostituendogliatomidiidrogenodegliossiacidiconmetalli,siformanoisaliternari.Sonoutilizzati
nuovisuffissiinsostituzioneedincorrispondenzaconquelliprecedenti.InparentesiilnomeIUPAC,in
questocasoassaipocousati.
HNO2 =Acidonitroso
A id it
+Sodioї
S di
ї NaNO
N NO2 = Nitrito
Nit it disodio(nitritodisodio)
di di ( it it di di )
HNO3 =Acidonitrico +Sodioї NaNO3 = Nitrato disodio(nitratodisodio)
H3PO4 =Acidofosforico +Potassioї K3PO4 = Fosfato dipotassio(fosfatodipotassio)












