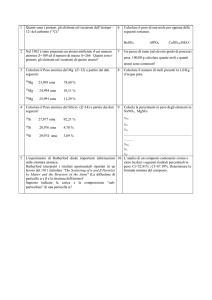
Atomi e proprietà periodiche - Tavola periodica
si consiglia di provare a risolvere i problemi indicati con * SENZA GUARDARE LA TAVOLA PERIODICA, che
può invece essere poi usata per controllare le risposte
1. Chiarire la differenza tra carica nucleare efficace (Zeff) ed elettronegatività di un
elemento.
2. * Scrivere la configurazione elettronica esterna dell’elemento a numero atomico 13.
Prevedere, in base al numero di elettroni di valenza, il gruppo di appartenenza
dell’elemento. Scrivere la formula di struttura del composto che questo elemento può
formare con Cl.
3. Fra le proprietà periodiche seguenti: volume atomico, potenziale di ionizzazione, affinità
elettronica, dire quale o quali sono inversamente proporzionali a Zeff.
4. * Indicare il numero di orbitali, che possono esserci in un atomo, di tipo:
a) n = 4
b) 3p
c) 3px
d) 4f
e) 4s
5. Spiegare perché, mentre il potenziale di ionizzazione è sempre una grandezza
positiva, l’affinità elettronica può assumere valori sia positivi che negativi.
6. * E’ più grande uno ione Cl- o uno ione K* ? un atomo di Br o un atomo di Cl ? un
atomo di Cl o uno ione Cl- ? un atomo di Na o un atomo di Cl ? Giustificare le risposte.
7. * Quanti elettroni possono essere contenuti, al massimo, negli orbitali 3d?
8. Quanti neutroni contiene l'
isotopo 40K? Quanti elettroni contiene uno ione K+ ?
9. Quale isotopo di K avrebbe lo stesso numero di neutroni di 40Ca ?
10. * A quale gruppo appartiene l’elemento [Ar] 3d10 4s2 4p1 ? Scrivere la configurazione
elettronica dello stato eccitato nel quale questo elemento si porta per formare il massimo
numero possibile di legami covalenti.
Mole e agente limitante
1. Se 1 kg di zolfo (S, massa atomica 32.064 g/mol) viene ossidato completamente con
O2 (massa atomica O = 16.000 g/mol) a dare il composto SO2, quanti g di quest’ultimo
si formeranno?
2. Quant’è la massa in g di un miliardo di atomi di oro?
3. Si calcoli quanti g di CO2 si ottengono facendo reagire 4,000 g di CH4 con 4,000 g di
O2 secondo la reazione
CH4 + 2 O2
→
CO2 + 2 H2O.
4. Data la reazione:
Na2CO3 + HCl →
NaCl + CO2 + H2O
Calcolare la quantità massima di NaCl che si può formare quando 100 g di Na2CO3
reagiscono in soluzione con 50 g di HCl.
5. E'più conveniente estrarre il Fe da FeS oppure da Fe3O4 ? Si suppongano uguali i
costi dei minerali e quelli di produzione.
6. Facendo reagire 5 kg di Fe2O3 con 1 kg di C secondo la reazione seguente
Fe2O3 + 3 C →
3 CO + 2 Fe
quanti kg di ferro metallico si ottengono?
7. Nel corso delle missioni spaziali, la CO2 prodotta con la respirazione dall'
equipaggio
viene eliminata mediante la reazione
Li2O (s) + CO2 (g)
↔
Li2CO3 (s)
calcolare la massa di CO2 che può essere eliminata da 42,7 g di Li2O. Perchè, per
questa specifica applicazione, si usa Li2O e non i più economici Na2O e CaO, che
potrebbero dare una reazione analoga?
Concentrazione di soluzioni
1. A 1.50 L di una soluzione acquosa 0.167 M di HCl vengono aggiunti 15.0 mL di
soluzione acquosa di HCl 1.67 M. Determinare la molarità della soluzione finale
risultante.
2. Un dato processo richiede 100 mL di H2SO4 al 20% in massa (d = 1.14 g/mL). Da
quanti mL di H2SO4 al 98% in massa (d = 1.84 g/mL) è necessario partire ?
3. A 300 mL di una soluzione di HCl viene aggiunto un eccesso di AgNO3; il precipitato di
AgCl pesa 77.39 g. Supponendo che la resa sia pari al 45%, qual è la molarità della
soluzione di HCl utilizzata ?
4. Calcolare la molarità di una soluzione di HCl al 38% in massa, di densità di 1.19 g/cm3.
5. Quanti L di soluzione acquosa di H2SO4 al 90 % in massa (densità 1.81 g /mL) si possono
ottenere usando, come unica fonte di S, 1 t di CuS ?
6. Calcolare la densità di una soluzione acquosa al 96,4% in massa di H2SO4, sapendo
che la sua molarità è 18,04 M.
Gas e miscele gassose
1. La composizione % in massa di un gas naturale è CH4 68.2%, C2H6 14.6% e N2
17.2%. Calcolare la quantità di CO2 formata per combustione di 0.531 m3 di questo
gas a c.n. (NB: l’azoto non brucia; gli idrocarburi bruciano con ossigeno, O2,
trasformandosi in CO2 e acqua; scrivere le reazioni bilanciate di combustione).
2. Si mescolano 0.400 moli di He con una certa quantità di Ne in un recipiente da 5.00 L
sino ad ottenere una pressione di 2.50 atm a 27°C. Calcolare le pressioni parziali
dell'
He e del Ne e quante moli di Ne devono essere mescolate con l'
He per ottenere la
pressione indicata.
3. Un volume di 64 L di NO viene mescolato con un volume di 40 L di O2. Avviene la
seguente reazione:
2 NO(g) + O2(g) → 2 NO2(g)
Calcolare le frazioni
molari e le pressioni parziali alla fine della reazione a 0°C e 1 atm.
4. Calcolare quanti m3 di aria (N2 = 80%, O2 = 20% in volume) misurati a 0°C e 1 atm
occorrono per ossidare completamente 18 moli di H2S secondo la reazione:
2 H2S + 3 O2
→
2 SO2 + 2 H2O
5. Calcolare il rapporto stechiometrico aria / benzina (kg aria : kg benzina) nei motori a
scoppio, considerando la benzina come ottano (C8H18, densità 0,70 g/mL) e l'
aria
come una miscela N2 / O2 in rapporto volumetrico 79:21. Calcolare anche i kg di CO2
prodotti per L di benzina bruciato.