EPATITE B
DIAGNOSTICA DI LABORATORIO
HBV-HCV-HIV
Epatite B
L’interesse scientifico per il virus dell’epatite B (HBV) e le sue
manifestazioni cliniche negli ultimi anni è stato notevolmente alimentato dai
significativi progressi intervenuti nella diagnosi e nella terapia.
VIRUS DELL’EPATITE B
Il virus dell’epatite B è l’unico Hepdnavirus di intesse medico, ed è
specifico per la specie umana.
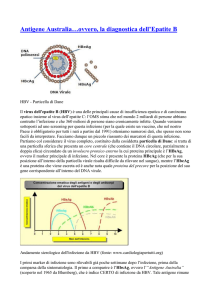
La particella virale completa o particella di Dane è una particella sferica del
diametro di 42 nm, composta da un involucro esterno Lipoproteico
(envelope) che circonda un nucleocapside di 18nm di diametro.
HBV
Il genoma di HBV contiene 4 sequenze codificatrici denominate
C,P,S,X
I primi tre geni C,P,S codificano, rispettivamente, la proteina capsidica
del “core” virale, l’enzima polimerasi e le glicoproteine di superfice
“virus specifiche” (inserite nell’involucro pericapsidico del virione
maturo)
-Il gene P codifica una proteina di (90 Kd) alla quale sono associate le
attività enzimatiche virus specifiche, più un peptide che serve da
segnale di inizio dell’attività polimerasica.
-Il gene C può codificare due proteine : C e C+preC.
La proteina C forma il capside virale (core) e l’antigene c virus specifico
(HBcAg Hepatitis B core antigen)
La proteina C+preC, invece viene avviata verso l’apparato secretorio
cellulare e, dopo alcuni tagli proteolitici, viene eliminata all’esterno della
cellula, in forma di una proteina di 16 Kd che espone epitopi antigenici
peculiari e viene indicata come antigene “e” HBeAg.
-Il gene S
codifica le proteine di superficie (peplos del virione) di cui esse
rappresentano l’antigene specifico HBsAg. Il gene S presenta tre segnali di
inizio della trascrizione e può codificare tre proteine di diverso peso
molecolare: S di 24000 dalton o p24, S+preS1
(33Kd o p33) e
S+preS1+preS2 di (39Kd o p39). Le tre proteine dopo glicosilazione sono
indicate come gp27, gp36 e gp42.
-Gene x
codifica una proteina che attiva la trascrizione del genoma virale.
Come si vede dalla rappresentazione genomica schematizzata dell’HBV
DNA il genoma è rappresentato da una molecola di DNA circolare
parzialmente bicatenario con una catena più lunga L(-) della lunghezza di
3200 nucleotidi e una più corta S(+) di lunghezza variabile da 1700 a 2800
nt.
I quattro geni codificanti organizzati in ORF(open reading frame) si trovano
nella catena L-
Mutazioni a livello
del gene “s”
Mutazioni a livello
del gene “pol”
Mutazioni a livello
della regione precore
Replicazione virus HBV
HBV è assolutamente specifico per la specie umana , ai cui epatociti si
lega attraverso i recettori, il DNA virale viene trasferito nel nucleo della
cellula ospite dove, dopo il completamento della struttura bicatenaria del
genoma , ad opera degli enzimi cellulari preposti alla “sintesi di riparo”,
viene trascritto dalla polimerasi cellulare dando inizio al ciclo di
replicazione virale.
I virioni una volta completati sono eliminati dalle cellule attraverso un
processo di “esocitosi”, insieme ad una notevole quota di HBsAg, che
viene prodotta in eccesso e si presenta in circolo assemblato sia in forma
di particelle rotondeggianti sia in forma filamentosa.
Il virione completo presenta tre glicoproteine di superficie denominate
LHBs, MHBs e SHBs. Negli aggregati filamentosi sono presenti tutte e
tre le diverse glicoproteine, mentre negli aggregati rotondeggianti sono
presenti le SHBs e una parte variabiledi MHBs.
HBV: marcatori sierologici
HBsAg
Definisce l’infezione in atto: la persistenza per più di 6 mesi
consente di stabilire la presenza di una infezione cronica
HBeAg
Indica invariabilmente la presenza di replica / infettività
Anti-HBe
La sieroconversione da HBeAg a anti-HBe indica classicamente
la risoluzione, ma la positività non esclude replica/infettività
Anti-HBs
Indica immunità (naturale o in seguito a immunoprofilassi)
Anti-HBc
Presente in tutte le fasi dell’infezione: può essere l’unico
marcatore nelle infezioni croniche
Anti-HBc IgM
• Differenzia l’infezione acuta/recente
dall’infezione non recente
Significato dei marcatori sierologici di HBV
Infezione
HBsAg, anti-HBc, anti-HBe
Replica virale
HBV-DNA, HBeAg
Danno virusindotto
IgM Anti-HBc
Immunità
Anti-HBs
Infezione acuta da virus dell’epatite B con guarigione
Andamento sierologico tipico
Sintomi
HBeAg
anti-HBe
HBV DNA
anti-HBc totale
HBsAg
0
4
8
anti-HBs
IgM anti-HBc
12 16 20 24 28 32 36
52
Settimane dopo l’esposizione
100
Variazioni dei livelli di anti-HBs nel tempo
0,4
Femmine
Maschi
Variazione (log10 mUI/mL)
0,2
0
-0,2
-0,4
-0,6
-0,8
-1
-1,2
-1,4
-1,6
1992
1999
2003
Livelli “non protettivi” di
anti-HBs dopo 11 anni in
rapporto con i livelli iniziali
Percentuale con <10 mUI/mL
100
75
80
60
35,4
40
20
0
2,6
<100 mUI/mL
<1000 mUI/mL
>10000 mUI/mL
Livelli di anti-HBs nel 1992
Gabbuti et al, AMCLI 2004
L’epatite B è un’affezione a lunga incubazione (fino a sei mesi) che si
trasmette per via interumana (PERCUTANEA) attraverso l’inoculazione di
sangue infetto (trasmissione per via parenterale INAPPARENTE o come
infezione perinatale.
Nel periodo iniziale dell’infezione i virioni sono presenti in apprezzabile
quantità, insieme ad un eccesso di particelle di HBsAg e di HBeAg.
In seguito alla risposta immune-umorale e cellulo mediata il virus viene
bloccato nell’ambiente extracellulare e le cellule infette vengono eliminate
e si ha la guarigione della malattia.
Circa il 90% dei soggetti infettati va incontro a un’infezione primaria
asintomatica, mentre nel rimanente 10% dei casi, l’infezione primaria
risulta sintomatica.
Circa 1% dei casi può sviluppare la forma fulminante, fatale nell’80% dei
casi.
Circa il 90%dei casi di epatite acuta volge a guarigione, mentre il 10%
delle infezioni primarie evolve verso la cronicizzazione.
Circa il 30% delle epatite croniche evolve verso la cirrosi .
Storia naturale dell’infezione da HBV
Fase 1
Fase 2
Fase 3
Immunotolleranza
Immunotolleranza (periodo
(periodo di
di incubazione)
incubazione)
HBV
HBV DNA+++,
DNA+++, HBsAg+++,
HBsAg+++, HBeAg+++,
HBeAg+++, ALTALT-
Attività
Attività immunologica
immunologica (fase
(fase acuta)
acuta)
HBV
HBV DNA+,
DNA+, HBsAg+++,
HBsAg+++, HBeAg+++,
HBeAg+++, ALT+++
ALT+++
Infezione
Infezione cronica
cronica
HBsAg+
HBsAg+ >> 66 mesi
mesi
6
HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Infezione
Infezione risolta
risolta
HBsAgHBsAganti-HBs+,
anti-HBs+, anti-HBc+
anti-HBc+
Mutazioni PreC/C
Epatite
Epatite cronica
cronica HBeAg+
HBeAg+
HBeAg+,
HBeAg+, anti-HBe-,
anti-HBe-,
6
HBsAg+,
HBsAg+, HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Fase 4
Fattovich et.al (2003). Journal of Hepatology 39: S50-S58
Mutazioni
PreC/C
Epatite
Epatite cronica
cronica HBeAgHBeAgHBeAg-,
HBeAg-, anti-HBe+,
anti-HBe+,
6
HBsAg+,
HBsAg+, HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Mutazioni PreC/C
Portatore
Portatore inattivo
inattivo di
di HBsAg
HBsAg
5
5
HBV
HBV DNA<10
DNA<10 /ml,
/ml, ALTALTHBsAg+,
HBsAg+, HBeAg-,
HBeAg-, anti-HBe+,
anti-HBe+,
Storia naturale dell’infezione da HBV
Fase 1
Immunotolleranza
Immunotolleranza (periodo
(periodo di
di incubazione)
incubazione)
HBV
HBV DNA+++,
DNA+++, HBsAg+++,
HBsAg+++, HBeAg+++,
HBeAg+++, ALTALT-
Fase 2
Attività
Attività immunologica
immunologica (fase
(fase acuta)
acuta)
HBV
HBV DNA+,
DNA+, HBsAg+++,
HBsAg+++, HBeAg+++,
HBeAg+++, ALT+++
ALT+++
Infezione
Infezione cronica
cronica
HBsAg+
HBsAg+ >> 66 mesi
mesi
6
HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Infezione
Infezione risolta
risolta
HBsAgHBsAganti-HBs+,
anti-HBs+, anti-HBc+
anti-HBc+
Mutazioni PreC/C
Fase 3
Epatite
Epatite cronica
cronica HBeAg+
HBeAg+
HBeAg+,
HBeAg+, anti-HBe-,
anti-HBe-,
6
HBsAg+,
HBsAg+, HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Mutazioni
PreC/C
Epatite
Epatite cronica
cronica HBeAgHBeAgHBeAg-,
HBeAg-, anti-HBe+,
anti-HBe+,
6
HBsAg+,
HBsAg+, HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Mutazioni PreC/C
Fase 4
Fattovich et.al (2003). Journal of Hepatology 39: S50-S58
Portatore
Portatore inattivo
inattivo di
di HBsAg
HBsAg
5
HBV
HBV DNA<10
DNA<105/ml,
/ml, ALTALTHBsAg+,
HBsAg+, HBeAg-,
HBeAg-, anti-HBe+,
anti-HBe+,
Storia naturale dell’infezione da HBV
Fase 1
Immunotolleranza
Immunotolleranza (periodo
(periodo di
di incubazione)
incubazione)
HBV
HBV DNA+++,
DNA+++, HBsAg+++,
HBsAg+++, HBeAg+++,
HBeAg+++, ALTALT-
Fase 2
Attività
Attività immunologica
immunologica (fase
(fase acuta)
acuta)
HBV
HBV DNA+,
DNA+, HBsAg+++,
HBsAg+++, HBeAg+++,
HBeAg+++, ALT+++
ALT+++
Infezione
Infezione cronica
cronica
HBsAg+
HBsAg+ >> 66 mesi
mesi
6
HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Infezione
Infezione risolta
risolta
HBsAgHBsAganti-HBs+,
anti-HBs+, anti-HBc+
anti-HBc+
Mutazioni PreC/C
Fase 3
Epatite
Epatite cronica
cronica HBeAg+
HBeAg+
HBeAg+,
HBeAg+, anti-HBe-,
anti-HBe-,
6
HBsAg+,
HBsAg+, HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Mutazioni
PreC/C
Epatite
Epatite cronica
cronica HBeAgHBeAgHBeAg-,
HBeAg-, anti-HBe+,
anti-HBe+,
6
HBsAg+,
HBsAg+, HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Mutazioni PreC/C
Fase 4
Fattovich et.al (2003). Journal of Hepatology 39: S50-S58
Portatore
Portatore inattivo
inattivo di
di HBsAg
HBsAg
5
HBV
HBV DNA<10
DNA<105/ml,
/ml, ALTALTHBsAg+,
HBsAg+, HBeAg-,
HBeAg-, anti-HBe+,
anti-HBe+,
Storia naturale dell’infezione da HBV
Fase 1
Immunotolleranza
Immunotolleranza (periodo
(periodo di
di incubazione)
incubazione)
HBV
HBV DNA+++,
DNA+++, HBsAg+++,
HBsAg+++, HBeAg+++,
HBeAg+++, ALTALT-
Fase 2
Attività
Attività immunologica
immunologica (fase
(fase acuta)
acuta)
HBV
HBV DNA+,
DNA+, HBsAg+++,
HBsAg+++, HBeAg+++,
HBeAg+++, ALT+++
ALT+++
Infezione
Infezione cronica
cronica
HBsAg+
HBsAg+ >> 66 mesi
mesi
6
HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Infezione
Infezione risolta
risolta
HBsAgHBsAganti-HBs+,
anti-HBs+, anti-HBc+
anti-HBc+
Mutazioni PreC/C
Fase 3
Epatite
Epatite cronica
cronica HBeAg+
HBeAg+
HBeAg+,
HBeAg+, anti-HBe-,
anti-HBe-,
6
HBsAg+,
HBsAg+, HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Mutazioni
PreC/C
Epatite
Epatite cronica
cronica HBeAgHBeAgHBeAg-,
HBeAg-, anti-HBe+,
anti-HBe+,
6
HBsAg+,
HBsAg+, HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Mutazioni PreC/C
Fase 4
Fattovich et.al (2003). Journal of Hepatology 39: S50-S58
Portatore
Portatore inattivo
inattivo di
di HBsAg
HBsAg
5
HBV
HBV DNA<10
DNA<105/ml,
/ml, ALTALTHBsAg+,
HBsAg+, HBeAg-,
HBeAg-, anti-HBe+,
anti-HBe+,
Storia naturale dell’infezione da HBV
Fase 1
Immunotolleranza
Immunotolleranza (periodo
(periodo di
di incubazione)
incubazione)
HBV
HBV DNA+++,
DNA+++, HBsAg+++,
HBsAg+++, HBeAg+++,
HBeAg+++, ALTALT-
Fase 2
Attività
Attività immunologica
immunologica (fase
(fase acuta)
acuta)
HBV
HBV DNA+,
DNA+, HBsAg+++,
HBsAg+++, HBeAg+++,
HBeAg+++, ALT+++
ALT+++
Infezione
Infezione cronica
cronica
HBsAg+
HBsAg+ >> 66 mesi
mesi
6
HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Infezione
Infezione risolta
risolta
HBsAgHBsAganti-HBs+,
anti-HBs+, anti-HBc+
anti-HBc+
Mutazioni PreC/C
Fase 3
Epatite
Epatite cronica
cronica HBeAg+
HBeAg+
HBeAg+,
HBeAg+, anti-HBe-,
anti-HBe-,
6
HBsAg+,
HBsAg+, HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Mutazioni
PreC/C
Epatite
Epatite cronica
cronica HBeAgHBeAgHBeAg-,
HBeAg-, anti-HBe+,
anti-HBe+,
6
HBsAg+,
HBsAg+, HBV
HBV DNA>10
DNA>106/ml,
/ml, ALT+
ALT+
Mutazioni PreC/C
Fase 4
Fattovich et.al (2003). Journal of Hepatology 39: S50-S58
Portatore
Portatore inattivo
inattivo di
di HBsAg
HBsAg
5
HBV
HBV DNA<10
DNA<105/ml,
/ml, ALTALTHBsAg+,
HBsAg+, HBeAg-,
HBeAg-, anti-HBe+,
anti-HBe+,
Infezione occulta da HBV
200 pazienti HBsAg- / HCV+
147 ECA, 48 cirrosi, 5 "minimal changes"
102 anti-HBc+
50 epatopatie croniche HBsAg- / HCV-
PCR per HBV DNA
66 / 200 HBV DNA+ (33%)
7 / 50
HBV DNA+ (14%)
nessuna mutazione nel genoma HBV
Cacciola et al, NEJM 1999
EPATITE B OCCULTA
L’infezione occulta del virus epatico B è definita come la persistenza del
genoma virale nel tessuto epatico, e in alcuni casi anche nel siero spesso
in quantità non rilevabili, in individui HBsAg negativi.
Le basi molecolari dell’infezione occulta sono strettamente correlate al
caratteristico ciclo vitale del virus HBV . La stabilità e la lunga
permanenza delle molecole di cccDNA virale, associate alla lunga emivita
degli epatociti fanno si che,una volta instauratisi, l’infezione continui per
tutta la vita in maniera subclinica.
La ragione per cui i portatori dell’ infezione occulta sono HBsAg – è
oggetto di studio. Alcuni riportano che alcuni casi sono infettati da varianti
S che producono un HBsAg modificato non rilevabile alle normali
tecniche di determinazione HBsAg
La più alta prevalenza di infezione occulta da HBV è stata riscontrata in
pazienti con infezione da HCV, e recenti studi hanno dimostrato una
potenziale inibizione della replicazione HBV da parte della proteina “core”
dell’ HCV .
L’infezione occulta HBV è nell’80% dei casi accompagnata alla presenza
di anticorpi anti-HBc+ e anti-HBs+ , mentre il rimanente 20% presenta
negatività per tutti i markers sierici dell’infezione HBV.
INFEZIONE OCCULTA DA HBV
Anti-HBc isolato: frequenza
Nelle aree a endemia media o bassa il quadro di
“anti-core isolato” è presente nel:
10-20% degli infetti
1-4% di tutta la popolazione
HBV-DNA positivo in circa il 10% dei casi
Viremia presente soprattutto in:
HCV+ (35%)
HIV+ (80%)
Grob et al, JMV 2000; 62:450-455
HBsAg e anti-HBc isolato - italiani
Frequency %
30
HBsAg+
Anti-HBc only+
20
10
6,1
3,1
2,6
4
0,3
1,7
0
<29 years
29-59 years
>60 years
Infezione da HBV in nuovi donatori
46.147 nuovi donatori
31.190 (67,6%) ≥26 anni
28.495 (91,4%)
HBV negativi
102 (0,33%)
HBsAg+/anti-HBc+
C. Velati et al, ISBT 2005
2.695 (8,6%)
HBV positivi
2.593 (8,3%)
HBsAg-/anti-HBc+
Risultati–Patterns sierologici in soggetti
HBsAg-/anti-HBc+
86,7%anti-HBs+
anti-HBs+
86,7%
50
45
47,3%
40
35
39,4%
30
25
20
13,3%anti-HBsanti-HBs13,3%
15
10
5
2,9%
10,4%
0
anti-s+
anti-e+
Velati C. et al, ISBT 2005
anti-s+
anti-e-
anti-s- anti-santi-e+ anti-e-
Anti-HBc isolato
HBV-DNA in donatori HBsAg negativi
Romanò L. et al, ISBT 2006
Mutanti dell’HBsAg
I mutanti più comuni dell’HBsAg si
concentrano intorno agli aa. 141 - 145.
Il mutante riportato con maggior
frequenza è la sostituzione Gly-Arg in
posizione 145.
Le immagini seguenti mostrano le
variazioni di conformazione nell’epitopo
141-145 in seguito a questa mutazione
(modello di HBsAg secondo Chen et al.,
Proc. Natl. Acad. Sci. 1996; 93: 19972001).
HBsAg: “escape mutant”
principale
Wild-type gly in pos.145
Mutante arg in pos.145
In quali circostanze sono stati trovati i mutanti
dell’HBsAg?
Sono stati trovati in almeno tre situazioni:
1) insuccesso della vaccinazione in neonati da madri
HBsAg-positive
2) fallimento della immunoprofilassi in pazienti
sottoposti a trapianto di fegato
3) diagnosi di infezione da HBV in soggetti negativi
per HBsAg
Riferimento: Locarnini, S. A. 1998. Hepatitis B Virus Surface Antigen and Polymerase Gene Variants: Potential
Virological and Clinical Significance. Hepatology 27: 294 - 297.
MUTAZIONI
Mutazioni a livello del gene “S”
L’HBsAg è costituito da 226 aa; può essere presente sia in forma glicosilata
(gp27) che in forma non glicosilata (p24).
La proteina contiene tre domini idrofobici transmembrana e due idrofilici. Si
è osservata sperimentalmente che la maggior parte delle mutazioni
avvengono nei due domini idrofilici poichè le due regioni sono esposte
all’attacco degli anticorpi dell’ospite e di conseguenza le mutazioni
rappresentano un escape alla pressione immunitaria
Mutazioni a livello della regione “pre-core”
La regione pre-c contiene una struttura secondaria detta epsilon necessaria
per la sintesi del DNA virale all’interno dei capsidi immaturi. Mutazioni in
questo dominio potrebbero influenzare il meccanismo di replicazione e la
persistenza virale.
Mutazioni a livello del gene “p”
IL gene è costituito da almeno 4 domini; il dominio della polimerasi codifica
per la DNA-polimerasi DNA e RNA dipendente, che determina la
retrotrascrizione dell’RNA-pregenomico in DNA.
La presenza di mutazioni in questa sequenza è responsabile della
comparsa di mutanti HBV resistenti al trattamento anti virale con analoghi
nucleosidici inibitori della trascrittasi inversa.
121
s-s-124
Loop 1 of ‘a’ determinant
Vaccine Escape Mutants:
126
T126S
M133L
D144E
T131N
K141E
G145R
158 Y
F
131
133
137
107 -s-s- 138
141
--s--s- 149
139
164
E
D
s-s-147
144 G
D
145
Loop 2 of ‘a’ determinant
195
R
I
W
E
210
Carman, W. J Viral Hepatitis 1997 4: 11-20
M
198
I
M
S
196
TEST DI SCREENING: caratteristiche HBsAg
La pronta identificazione dei soggetti affetti da epatite B è essenziale per
assicurare loro le cure necessarie per prevenire o ritardare l’evoluzione
della malattia e prevenire la trasmissione del virus.
Pertanto il test di screening deve essere:
SENSIBILITA’ ECCELLENTE. Per evitare falsi negativi
Per una diagnosi precoce
SPECIFICITA’ ELEVATA.
Per evitare falsi positivi
CAPACITA’ DI RILEVARE MUTANTI HBsAg.
QUANTITATIVO. Curva di calibrazione compresa tra 0.05- 250 mUI/m
Livelli di HBsAg nell’epatite B acuta e cronica
HBsAg IU/mL
100000
1000
10
0,1
Acute
A. Rodella et al, J Clin Virol 2006; 37: 206-212
Convalescent
Chronic
HBeAg+
Chronic
HBeAg-
Interpretazione dei markers sierologici
HBsAg HBsAb
HBeAg
HBeAb
HBcAb
IgM
HBcAb
IgG
HBV
DNA
ALT
Interpretazione
Pos
Neg
Pos
Neg
Pos
Neg
+++
+++
Infezione acuta
Neg
Pos
Neg
Pos
Neg
Pos
Neg
Norm.
Inf. in risoluzione
Immunità
Neg
Pos
Neg
Neg
Neg
Neg
Neg
Norm.
Vaccinato
Responder
Pos
Neg
Neg
Pos
Neg
Pos
Neg
+/-
+/-
Inf. cronica
senza replicaz.
Pos
Neg
Pos
Neg
Neg
Pos
+++
+++/-
Inf. cronica con
replicaz.
Pos
Neg
Neg
Pos
Neg
Pos
+++
+++
Inf. cronica
mutante Pre C
con replicaz.
Neg
Neg
Neg
Neg
Neg
Pos
Neg
Norm.
Vecchia inf.
risolta
Falso positivo
Neg
Neg
Neg
Neg
Neg
Pos
+/-
+/-
Inf. cronica
Low level
PROFILO 1
HBsAg Anti-HBs
P
<10mU
AntiHBc
AntiHBc
IgM
HBeAg
AntiHBe
HBVDNA
P
P
P
N
P
INFEZIONE ACUTA O CRONICA CON REPLICA VIRALE
PROFILO 2
HBsAg
AntiHBs
AntiHBc
AntiHBc
IgM
HBeAg
AntiHBe
HBVDNA
N
<10mU
P
P
N
N
N/P
“CORE WINDOW”
PROFILO 3
HBsAg
Anti-HBs
AntiHBc
AntiHBc
IgM
HBeAg
AntiHBe
HBVDNA
N
<10mU
P
N
N
N
N
CORE ISOLATO
PROFILO 4
HBsAg
AntiHBs
AntiHBc
AntiHBc
IgM
HBeAg
AntiHBe
HBVDNA
P
<10mU
P
N
N
P
<104
PORTATORE INATTIVO
PROFILO 5
HBSAg
AntiHBs
AntiHBc
AntiHBc
IgM
HBeAg
AntiHBe
HBVDNA
P
<10mU
P
P
N
P
>104
EPATITE CRONICA CON REPLICA VIRALE (“e minus” variant)
PROFILO 6
HBsAg
Anti-HBs
AntiHBc
AntiHBc
IgM
HBeAg
AntiHBe
HBVDNA
N
>10mU
P
N
N
N/P
N
IMMUNIZZAZIONE POST-INFEZIONE
PROFILO 7
HBsAg
Anti-HBs
AntiHBc
AntiHBc
IgM
HBeAg
AntiHBe
HBVDNA
N
>10mU
N
N
N
N
N
IMMUNIZZAZIONE POST-VACCINALE
EPATITE D HDV
Il virus dell’epatite Delta è il più piccolo virus ad RNA che infetta l’uomo.
E’ un virus difettivo.
Necessita della presenza del virus dell’epatite B nella cellula per infettarla.
L’infezione può avvenire contemporaneamente
(coinfezione) o successivamente (sovrainfezione)
a
quella
dell’HBV
Una storia lunga quindici
anni
Prince A.M., Brotman B., Grady G.F. et
al: “Long-incubation post-transfusion
hepatitis without serological evidence of
exposure to hepatitis B virus”. Lancet II,
241-244, 1974
Choo, Q.L. , Kuo G., Weiner A.J. et al.
“Isolation of a DNA clone derived from
blood-borne non-A/non-B viral hepatitis
genome”. Science 224: 359-362, 1989
VIRUS DELL’EPATITE C (HCV)
La scoperta del virus dell’epatite C, nel 1989 è stata possibile grazie a
tecniche di biologia molecolare che hanno consentito di dimostrare, nel
sangue di uno scimpanzé infettato con materiale di provenienza umana un
antigene virus specifico, e di produrlo come proteina ricombinante, con la
conseguente ed immediata introduzione in commercio di un test per la ricerca
degli anticorpi specifici,prima ancora che il virus stesso fosse stato
identificato.
CARATTERI GENERALI:
-Identificato nel 1989
-Responsabile di una forma di epatite che era stata definita “non-a, non-B”
-Famiglia FLAVIVIRIDAE
-Genere HEPACIVIRUS
-Virus a RNA lineare ad elica singola a polarità positiva
.Presenza di mantello
-Diametro di 30-60nm
-Genoma (9.100) nucleotidi
Codifica per la sintesi di 10 proteine suddivise in
PROTEINE STRUTTURALI
una proteina del nucleocapside (gene C)
due proteine del rivestimento esterno (E1 e E2)
PROTEINE NON STRUTTURALI (importanti per la replicazione virale)
una proteasi
una elicasi
una RNA polimerasi RNA dipendente
NS1,NS2,NS3,NS4A,NS4B,NS5A,NS5B
GENOMA DI HCV e poliproteina prodotta dalla sua traduzione.
La poliproteina tradotta viene successivamente maturata da proteasi virali
e cellulari in un minimo di 10 prodotti.
La caratteristica più importante dell’HCV è l’ipervariabilità genomica.
Proprio sulla base di questa eterogeneità genetica, gli isolati virali che
maggiormente differiscono nella sequenza genomica sono stati suddivisi
in “tipi”, o “GENOTIPI”.
All’interno di ogni genotipo sono stati successivamente raggruppati i virus
isolati che, pur tra loro differenti nella sequenza genomica, non lo erano in
grado tale da suggerire l’opportunità di una classificazione in un genotipo
ulteriore; essi sono stati raggruppati in numerosi “sottotipi”.
La distribuzione geografica dei diversi genotipi dell’HCV è ampiamente
variabile. In Italia e in Europa vi è una netta prevalenza del genotipo 1b.
I genotipi hanno un diverso significato clinico;per es i genotipi 1a, 1b, e 4
sono meno responsivi alla terapia.
La conseguenza dell’eterogeneità genica dell’HCV e della sua
capacità di mutazione genetica sono alla base:
a) Della frequente cronicizzazione dell’infezione
( il virus sfugge al sistema immunitario dell’ospite)
b) Della possibile reinfezione anche con ceppi virali di diverso genotipo
c) Della non soddisfacente efficacia della terapia con IFN
d) Della difficoltà di allestire un vaccino
Infezione da HCV: esiti
Esposizione 1
1
1–
–2
2 sett.
sett.
Infezione
da HCV
~16%
~16%
Nessuna
infezione
~84%
~84%
Infezione
acuta
sintomatica
Infezione
acuta
asintomatica
15% – 20%
Risoluzione
spontanea
<20%
?
?
Infezione
persistente
>80%
Riferimenti: 1. Orland, et al., Hepatology, 2001
2. www.medscape.com/viewarticle/416562_3
Cirrosi
epatica
Sieroreversione anti-HCV
Kondili et al, GUT 2002
studio di popolazione in Italia centrale
prevalenza: 2,5%
incidenza: 28/100.000/anno
negativizzazione: 19,4% in 5-12 anni
Mazzeo et al, GUT 2003
studio di popolazione in Italia settentrionale
prevalenza: 3,5%
incidenza: 50/100.000/anno
negativizzazione: 17% in 10 anni
DIAGNOSI DI LABORATORIO PER INFEZIONE DA HCV
Test di screening:
Il test di screening prevede la rivelazione degli anticorpi specifici del virus
dell’epatite C (anti HCV)
I metodi attualmente in commercio utilizzano sia antigeni ricombinanti
delle zone non strutturali (NS3 e NS4) che antigeni strutturali della
regione core di HCV.
Successivamente ,sono stati introdotti i test cosiddetti di “terza
generazione”, nei quali è presente un antigene della regione NS5 ? Vedi
studio della Regione toscana.
TEST DI CONFERMA
La sensibilità e la specificità di questi test è molto elevata, ma la probabilità
di ottenere falsi positivi è elevata ; pertanto è opportuno verificare i test
positivi con un metodo di conferma.
Virus dell’epatite C (HCV): organizzazione
funzionale del genoma e antigeni ricombinanti
% di omologia nucleotidica tra genotipi diversi
92
81
55
65
57
70
Regione strutturale
5’
UTR
C
66
NS3
NS4
Proteasi/
elicasi
1a gen.
NS5
C22-3
3a gen.?
C22-3
C200
C33-C
3’
UTR
RNA polimerasi RNAdipendente
C100-3
2a gen.
26
Regione non strutturale
E2/
E1
NS2
NS1
Capside/core Glicoproteine
envelope
65
C100-3
NS5
RIBA HCV (test di conferma)
E’ un immunoblot su strisce di nitrocellulosa, che utilizza sia antigeni
ricombinanti sia peptidi sintetici da proteine strutturali e non strutturali
del virus.
La presenza di anticorpi di tipo IgG contro antigeni virali si evidenzia in
forma di bande distinte che consentono di identificarli in base alla loro
reattività antigenica.
RISULTATI
a) Positivo: almeno 2 bande
b) Negativo: nessuna banda
c) Indeterminato: 1 sola banda
Secondo le linee guida di (CDC- Atlanta USA 2003)
Un test sierologico anti HCV è ritenuto :
1) POSITIVO se:
Screening + e RIBA o NAAT sono positivi
oppure screening + NAAT – e RIBA +
2) NEGATIVO se:
Screening –
Screening + e RIBA –
Screening + , RIBA – e NAAT –
3) Indeterminato se:
screening + e RIBA indeterminato (status immunologico nei confronti di
HCV non definito)
LIMITAZIONI della metodica immunoassay di screening
Il test immunoassay anti HCV diventa positivo dopo 6-8 settimane dal
contagio; indica una infezione attiva o pregressa , ma non è in grado di
distinguere tra forma ACUTA, CRONICA o RISOLTA. Di solito segue un test
di conferma.
HCV Ag: importanza dell’infezione attiva
Anti-HCV (+)
Infezione pregressa da HCV
Portatore di HCV
(Persistenza dopo
epatite acuta C)
(guarigione dopo
epatite acuta C o eliminazione
dopo infezione persistente)
Falsi positivi
HCV-RNA (+) o
HCV Core Ag (+)
Da: S. Iino, Kiyokawa Hospital, & H.Yoshizawa, Hiroshima University, Japan
Quadri sierologici nell‘infezione da
HCV
Anti-HCV
HCV RNA/
HCV Ag
Interpretazione
Negativo
Negativo
Assenza di infezione
Positivo
Positivo
Infezione attiva (acuta o cronica)
Positivo
Infezione recente
Infezione cronica in pazienti
immunocompromessi
Negativo
Infezione risolta (guarigione)
Infezione cronica con viremia bassa o
intermittente
Falsa positività per anti-HCV
Anticorpi „passivi“
Negativo
Positivo
Infezione acuta da HCV
HCV-RNA IU/mL
HCV Ag fmol/L
100000000
Anti-HCV+
10.000
10000
HCV-RNA
HCVAg
100
Start of
treatment
1
1
30-mar-09
15-mag-09
M.C. Medici et al, J Clin Virol 2011; 51: 260-265
3-giu-09
30-giu-09
12-ott-09
Utilità clinica di un test sensibile per HCV Core Ag
1.
Diagnosi: utilizzo combinato dei test per anti-HCV e
del test hs-HCV Core Ag per identificare le fasi
precoci di infezione acuta
2.
Discrimine: il test per HCV Ag può distinguere i
portatori di HCV (con possibile evoluzione in cirrosi
epatica o carcinoma epatocellulare) dalle infezioni
pregresse e dai pazienti guariti
3.
Popolazioni ad alto rischio: identificazione delle
infezioni in soggetti (ancora o persistentemente)
negativi per anti-HCV
Algoritmo suggerito per la diagnosi di infezione da
HCV in asintomatici
Negativo
STOP
Test di screening per anti-HCV
Positivo
O
RIBA per Anti-HCV
Negativo
STOP
Negativo
Indeterminato
Ulteriori test di laboratorio
(es.
es. PCR, ALT)
PCR negativo
ALT normali
NAT per HCV RNA
Positivo
Positivo
Valutazione
clinica
PCR positivo,
ALT elevate
Da: MMWR 1998;47 (No. RR 19)
HCV: algoritmo potenziale (Prof. Roggendorf)
anti-HCV (Immunoassay)
Non reattivo (negativo)
Reattivo
NO infezione da HCV?
HCV Core Ag
Positivo
Negativo
Infezione
da HCV
HCV RNA
Alternativa: 2°test
EIA o Immunoblot
Positivo
Negative
Infezione
da HCV
Infezione pregressa o
falso positivo anti-HCV
Sierologia HCV - considerazioni
La positività anticorpale non persiste indefinitamente
dopo guarigione
La frequenza di cronicizzazione è probabilmente
inferiore a quanto attualmente considerato (80%)
Gli studi trasversali sottostimano la diffusione
dell’infezione
I risultati “borderline” o negativi alti con i test di
screening, spesso discordanti e/o indeterminati ai test
supplementari, indicano prevalentemente delle “code”
di reattività in via di risoluzione
HCV in Italia (popolazione aperta): alcuni studi
100
Anti-HCV+
90
80
HCV-RNA+
75,9
75,7
70
66,7
60
64,7
64,4
63,2
% positività
84,1
54,4
53,5
50
40
30
16,7
20
10,4
12,6
10
2,7
2,4
3,5
6,5
2,6
3,2
0
Guadagnino
(1997)
Maio (2000)
Coppola
(2000)
Di Stefano
(2002)
Kondili
(2002)
Mazzeo
(2003)
Pendino
(2005)
Cozzolongo
(2009)
Zani (2011)