In espansione gravi malattie da virus su piante ortensi e ornamentali
Avvizzimento maculato del pomodoro
(Tornato Spotted Wilt Virus)
di V. Lisa – Istituto di Virologia Applicata del CNR – TORINO
Un virus è responsabile di una nuova grave malattia che si sta diffondendo eiiilo nelle colture
ornamentali ed ortensi liguri: si tratta di
“tomato spotted wilt virus» (TSWV, virus
dell’avvizzimento del pomodoro, detto anche virus della bronzatura del pomodoro)
Inoltre, numerose altre virosi stanno rendendo poco remunerativa la coltura dello zucchino perché
ne abbassano il rendimento sia qualitativo che quantitativo.
Per tentare di lottare contro tutti questi togeni la Regione Liguria ha stipulato un contratto di ricerca
con l’Istituto di Fitovirologia applicata (IFA) del Consiglio Nazionale delle Ricerche di Torino
nell’ambito del Progetto regionale di Lotta biologica ed integrata. Il contratto è in vigore dall’agosto
1990. Riportiamo di seguito, e per esteso, il programma di ricerca concordato tra IFA e
l’Assessorato all’Agricoltura della Regione Liguria, aggiornato in base ai dati nel frattempo emersi.
Programma di ricerche Virologiche concordato tra IFA e la Regione Liguria
Tomato Spotted Wilt Virus
Il TSWV (virus dell’avvizzimento maculato del pomodoro,
indicato anche come virus della bronzatura del pomodoro) è un
virus noto da decenni, a distribuzione mondiale, ma sino a
pochi anni addietro segnalato solo sporadicamente in Europa.
Di recente si è manifestato m modo preoccupante in Francia,
Inghilterra, Olanda, Spaglia, oltre che in Italia (Liguria, EmiliaRomagna e Sicilia). TSWV è agente di malattia grave, spesso
necrotica, in moltissime specie coltivate e spontanee,
soprattutto erbacee. E’. trasmesso unicamente da tripidi: tra
questi, alcune specie del genere Frankliniella sono vettori
particolarmente attivi. Negli ultimi anni in F.uropa si e
rapidamente diffuso il tripide Frankliniella ocidentalis , cui e
altrettanto rapidamente seguita la diffusione del virus.
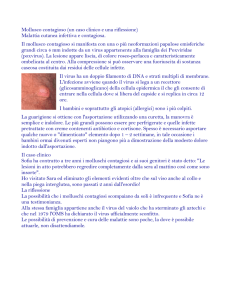
1. Maculatura necrotica su foglia di pomodoro (da Informatore
Fitopatologico n. 12, 1990 Edagricole Bologna
La prima segnalazione di TSWV in Liguria risale al dicembre 1989, su anemone coltivato nel
Sanremese: al momento le specie su cui e stato identificato il virus sono: anemone, antirrino,
Bouvardia sp., calendula, ciclamino, cineraria, crisantemo, Fatsia japonica, lattuga, ligularia,
lisianthus, moluccella, peperone, pomodoro, ranuncolo, statice, Trevesia Palmata, valerianella.
In base a studi svolti in questo Istituto si sa elle nella zona sono
presenti due ceppi del virus: il ceppo L (letture), il più diffuso e
studiato, ed un ceppo simile al ceppo “Impatiens”, recentemente
individuato e descritto negli U.S.A.
I due ceppi sono
differenziabili sierologicamente ed in base a sintomi causati su
piante indicatrici sperimentali.
La diagnosi sierologia è rapida e sicura grazie alla disponibilità
commerciale di corredi ELISA specifici contro i due ceppi del
virus.
2. Necrosi estese su foglie di anemone
(da Informatore Fitopatologico, n. 2,
1992, Ed agricole Bologna.
3. Cineraria con maculatura e
raggrinzimento delle foglie
Per
quanto
a
nostra
conoscenza, nella Regione
Liguria la malattia è presente
nelle province di Imperia e
Savona. La lotta contro questa
virosi è difficile ed incerta:
l'elevato numero di piante
ospiti e la difficoltà di
eliminare il vettore ne rendono
problematica l'eradicazione.
Proposta di attività dell'Istituto di fitovirologia applicata (1FA):
1.
preparare un fascicolo illustrativo sul virus, in cui verrà evidenziata particolarmente la
sintomatologia sulle piante più comunemente infette, da distribuire a tecnici e coltivatori onde
permettere la segnalazione dei casi sospetti il più precocemente possibile.
2.
eseguire diagnosi sierologiche di entrambi i ceppi del virus, onde seguire l'andamento delle
infezioni e, in particolare, individuarne tempestivamente nuovi eventuali focolai anche in base a
segnalazioni da parte di coltivatori, tecnici ed Enti.
3.
procedere allo studio dettagliato di eventuali isolati del virus diversi da quelli già noti, onde
caratterizzarli sufficientemente ai fini diagnostici, qualora risultassero dal materiale del punto
precedente.
4.
collaborare alla ricerca di colture alternative, di interesse per i coltivatori liguri, in
particolare studiandone bibliograficamente e sperimentalmente il comportamento rispetto al virus.
Dette specie o cultivar verranno proposte e coltivate m loco e, se del caso, in ambiente protetto, a
cura degli l'Enti locali. L’infezione sperimentale o naturale avverrà con la collaborazione
dell'Istituto di Fitovirologia applicata, ili particolare per quanto riguarda la diagnosi della malattia
nelle nuove colture.
5.
seguire bibliograficamente e a livello internazionale ogni nuovo tentativo per facilitare lotta
ed radicazione della malattia.
6.
collaborare coli gli Enti preposti per il contenimento del(i) vettore(i) e l'eliminazione di
focolai isolali.
Virosi dello zucchino
I a coltura dello zucchino in Italia, soprattutto la coltura estiva in pien’aria, risulta seriamente
limitata da numerosi virus, quasi tutti capaci di uidui're malattia grave su questa pianta. I sintomi
variano da mosaico, deformazioni regolari, ingiallimenti, sviluppo stentato ad arresto di crescita e
talvolta morte della pianta. Molti virus causano sintomi sui frutti (bollosità, malformazioni,
butterature) che deprecano fortemente il prodotto e sono causa di considerevole danno economico. I
virus finora segnalati in Italia su zucchino sono:
—
—
—
—
—
—
—
—
broad bean wilt virus (BBWV, virus dell'avviyzime'nto della fava)
dover vellow vein virus (CIYVV, virus dell'ingiallimento nervale del trifoglio)
cucumber mosaic virus (CMV, virus del mosaico del cetriolo)
squash mosaic virus (SqMV, virus del mosaico della zucca)
watermelon mosaie virus (WMV-1, virus 1 del mosaico del cocomero)
watermelon mosaic virus-2 (WMV-2, virus 2 del mosaico del cocomero)
zucchmi vellow fleck virus (ZY1-V, virus della picchiettatura gialla dello zucchino)
zucchini vellow mosaic virus (ZYMV, virus del mosaico giallo dello zucchino).
Di questi virus i primi due, BBWV e CIYVV, sembrano finora di scarsa importanza in quanto sono
stati isolati solo sporadicamente e non inducono malattie gravi.
CMV, WMV-2 e ZYMV sono invece molto frequenti, sono stati identificati in tutte le Regioni
italiane in cui sono state svolte indagini virologiche su questa coltura e sono agenti di malattia
grave, in particolare CMV e ZYMV che causano alterazioni sui frutti. Questi 3 virus sono stati
identificati ripetutamente in zucchini con sintomi di virosi provenienti dalla laguna.WMV-1 e
SqMV7 sono anch'essi causa di grave malattia e di bollosità sui frutti ma sono presenti soprattutto
nelle Regioni centromeridionali. WMV-1 è stato tuttavia isolato anche ad Albenga.
ZYLV finora è stato trovato unicamente nel Meridione. Con l'eccezione di SqMV, che è trasmesso attraverso
il seme di qualche cucurbitacea ed ha come vettori alcuni coleotteri, tutti questi virus sono trasmessi da afidi
in modo non-persistente ma apparentemente attraverso il seme di zucchino. I,e specie di afidi capaci di
trasmetterli sono numerose. Le fonti di infezione sono presumibilmente le coltivazioni di cucurbitacee
infette, almeno nelle zone climatiche che consentono la coltura di cucurbicacee durante tutto l'anno, ed altre
piante infette coltivate o spontanee.
Al momento non sono disponibili cultivar o linee di zucchino resistenti ai sei virus più importanti (CMV,
SqMV, WMV-1, WMV-2, ZYFV, ZYMN). La lotta a questi virus non è facile, soprattutto quando — ed è il
caso più frequente — si verificano infezioni da più virus nella stessa coltura; essa consiste essenzialmente in
tecniche di prevenz.ione. Occorre innanzitutto identificare quali virus infettano la coltura ed in quale ordine
cronologico si manifestano, poi verificare la possibilità di applicare forme di protezione delle coltivazioni dai
vettori di virus.
Proposte di attività dell'IFA:
1) I.a Regione provvedera a individuare due aree di coltivazione di interesse economico e analiz.zerà le
modalità colturali ivi adottate. L'IFA procederà alla diagnosi virologica (mediante analisi sierologica
o con altri metodi atti allo scopo) di campioni prelevati in campo e nelle serre delle z.one prescelte, da
piante in diverso studio vegetativo. L.'analisi sarà ripetuta sui diversi cicli colturali die susseguono
durante l'anno. Il prelievo dei campioni avverrà a cura dell'll'A, coli la collahorazione della Regione.
2) Identificare le specie di afidi infestanti le colture in esame, accertandone la capacita vetcricc per via
sperimentale e bibliografica.
3) Impostare prove di lotta mediante protozione delle colture con reti o altri mezzi atti ad isolare le piante dai
vettori. Se dalle indagini di cui al punto 2) ZYMV risulterà presente a livelli economicamente importanti,
potranno essere saggiati metodi di protezione incrociata, utilizzando ceppi attenuati del virus, che
dovrebbero impedire l'infez.ione da normali ceppi virulenti. Questo metodo, clic e stato recentemente
messo a punto in Francia quale difesa dalle infezioni da ZYMV, deve essere sperimentato sotto attento
controllo per verificarne le validità ed i rischi nelle nostre condizioni ambientali. Le prove di lotta
dovranno essere concordate tra I FA e Regione ed eseguite a cura di quest'ultima.
4) Analisi della bibliografia internazionale sul settore, per seguire ogni nuovo tentativo di lotta a queste
virosi. L'attività proposta per entrambi i programmi dovrebbe essere svolta in non meno di 3 anni.
Un foglio illustrativo su TSWV, come proposto al punto 1 ) del programma relativo a TSWV, è stato
preparato a cura dell'IFA ed e allegato a questo numero di Agricoltura Liguria. Ci auguriamo che
questa iniziativa serva ad aumentare l'informa/ione tra i coltivatori ed i tecnici agricoli e possa
aiutare a contenere i danni causati da questo nuovo nemico della nostra agricoltura.
SCHEDA PER IL PREMEVO DI CAMPIONI DI PIANTE O PARTI
DI PIANTE DA SOTTOPORRE AD ESAME DIAGNOSTICO
Consiglio Nazionale delle Ricerce
ISTITUTO DI FITO VIROLOGIA APPLICATA
Strada delle Cacce, 73 - 10135 TORINO - Tei. (Oli) 3977-273/
274/275/2SI-Fax(011)343809
Dati utili per la identifica/ione di un campione (rispondere per quanto possibile)
Darà prelievo del campione …………………………………..…………………
Specie ....................................................................................................................
Cultivar...................................................................................................................
Azienda ..................................................................................................................
(corredare di indirizzo e n. telefonico)
Mittente ................................................................................................................
(corredare di indirizzo e n. telefonico)
Provenienza e ambiente della coltivazione .............................................................
(es.: da seme, da talea eco.; in serra, in pie’ aria ecc.)
Trattamenti effettuati di recente ………………………………………………….
Data di comparsa e tipo di sintomi ………………………………………………
Tipo di distribuzione delle piante malate ..............................................................
(es.: poche piante distribuite a caso, metà delle piante, a gruppi ecc..)
Precauzioni da osservare:
I ) Ogni pianta (o materiale prelevato da ogni singola pianta) in un sacchetto di plastica chiuso.
2) Se possibile evitare di toccare le piante: utilizzare il sacchetto come un guanto.
3) Quantità: qualche grammo è sufficiente per le prove, e però opportuno che vi sia sufficiente
materiale (cs. getto apicale, pianta intera se molto piccola; piante radicate con terra non sono
necessario) da poter valutare i sintomi.
4) Tenere i campioni in frigorifero (senza congelare) fino al momento della spedizione.
5) Per i saggi sierologici è necessario il testimone sano della stessa specie. Inserire un campione
analogo a quello infetto, prelevato da piante sane o almeno senza sintomi, possibilmente coltivate
in una zona distante da quella dove c'è la malattia.
6) Inviare i campioni con un mezzo rapido.
4. Arabescature necrotiche su Kitsia japonica.
.