Chimica Inorganica Biologica
I composti di coordinazione
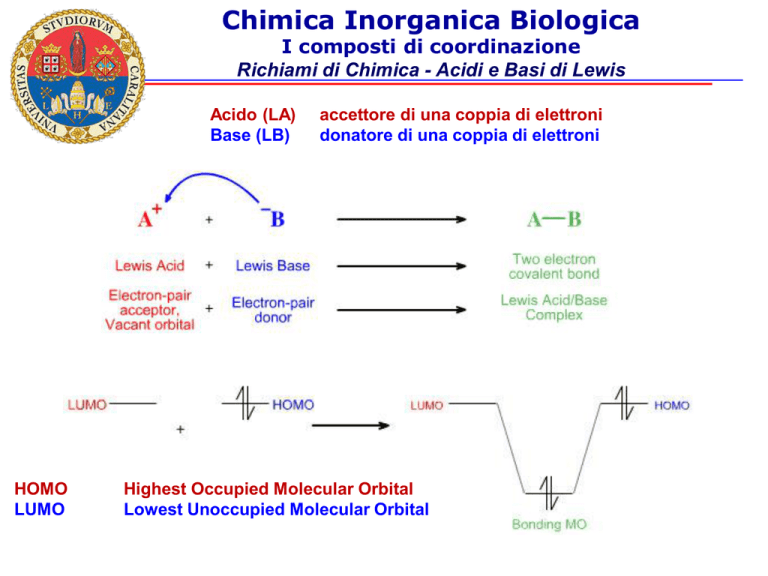
Richiami di Chimica - Acidi e Basi di Lewis
Acido (LA)
Base (LB)
HOMO
LUMO
accettore di una coppia di elettroni
donatore di una coppia di elettroni
Highest Occupied Molecular Orbital
Lowest Unoccupied Molecular Orbital
Chimica Inorganica Biologica
I composti di coordinazione
Richiami di Chimica - Acidi e Basi di Lewis
+
Chimica Inorganica Biologica
I composti di coordinazione
Richiami di Chimica - Acidi e Basi di Lewis
Chimica Inorganica Biologica
I composti di coordinazione
Richiami di Chimica - Acidi e Basi di Lewis
Chimica Inorganica Biologica
I composti di coordinazione
Richiami di Chimica - Acidi e Basi di Lewis
Metalli
Leganti
acidi di Lewis
basi di Lewis
Un legame N-Co come quello in [Co(NH3)6]3+ è un
legame “coordinato” o “dativo”. Nella letteratura
meno recente veniva indicato con una freccia.
Non vi sono differenze
significative fra legame di
coordinazione e legame
covalente polare.
Tuttavia un legame covalente subisce
generalmente rottura omolitica mentre un
legame dativo subisce rottura eterolitica
Chimica Inorganica Biologica
I composti di coordinazione
Metalli di Transizione
Configurazione elettronica del MT
Stato di ossidazione del MT
Numero di Coordinazione del MT
Carica del complesso
Leganti
Geometria di coordinazione
Chimica Inorganica Biologica
Gli elementi di transizione
Serie 1
Sc [Ar]4s2 3d1,
Ti [Ar]4s2 3d2,
V [Ar]4s2 3d3,
Cr [Ar]4s1 3d5,
Mn [Ar]4s2 3d5,
Fe [Ar]4s2 3d6,
Co [Ar]4s2 3d7,
Ni [Ar]4s2 3d8,
Cu [Ar]4s1 3d10,
Zn [Ar]4s2 3d10,
Serie 2
Y [Kr]5s2 4d1,
Zr [Kr]5s2 4d2,
Nb [Kr]5s2 4d3,
Mo [Kr]5s1 4d5,
Tc [Kr]5s2 4d5,
Ru [Kr]5s1 4d7,
Rh [Kr]5s1 4d8,
Pd [Kr]5s0 4d10,
Ag [Kr]5s1 4d10,
Serie 3(4f pieni)
Cd [Kr]5s2 4d10,
Hg [Xe]6s2 5d10
Hf [Xe]6s2 5d2,
Ta [Xe]6s2 5d3,
W [Xe]6s2 5d4,
Re [Xe]6s2 5d5,
Os [Xe]6s2 5d6,
Ir [Xe]6s2 5d7,
Pt [Xe]6s1 5d9,
Au [Xe]6s1 5d10,
Chimica Inorganica Biologica
Gli elementi di transizione
Zeff aumenta lungo il periodo
Perché?
Zeff ha un effetto maggiore sugli orbitali nd
rispetto a (n+1) s e p.
Gli elettroni d hanno una maggiore
probabilità di trovarsi vicino al nucleo
Chimica Inorganica Biologica
Gli elementi di transizione
(n+1)p
(n+1)s
Energia
Orbitali di core
nd
Z
Lungo il periodo l’energia degli orbitali nd diminuisce più velocemente di quella
degli orbitali (n+1)s, che a sua volta diminuisce più di quella degli orbitali (n+1)p.
Ad esempio nel Ga [Ar 3d10]4s24p1, i 3d10 sono elettroni interni (di core). La
configurazione del Gallio è di fatto analoga a quella di B e Al, “s2p1”
Chimica Inorganica Biologica
Gli elementi di transizione
Stati di ossidazione e stabilità relativa:
Sc
Una ragione per la varietà degli stox
assunti dai metalli di transizione è la
vicinanza in energia degli orbitali
atomici 3d e 4s.
Gli stox più comuni sono evidenziati in
verde.
Ti
+1 +2
+3
+4
V
+1 +2
+3
+4
+5
Cr
+1 +2
+3
+4
+5
+6
Mn
+1 +2
+3
+4
+5
+6
Fe
+1 +2
+3
+4
+5
+6
Co
+1 +2
+3
+4
+5
Ni
+1 +2
+3
+4
Cu
+1 +2
+3
Zn
+2
Sc [Ar]4s2 3d1,
Ti [Ar]4s2 3d2,
V [Ar]4s2 3d3,
Cr [Ar]4s1 3d5,
Mn [Ar]4s2 3d5,
Fe [Ar]4s2 3d6,
Co [Ar]4s2 3d7,
Ni [Ar]4s2 3d8,
Cu [Ar]4s1 3d10,
Zn [Ar]4s2 3d10,
+3
+7
Chimica Inorganica Biologica
Gli elementi di transizione
Il numero degli stox aumenta da Sc a Mn.
Sc
Il Mn presenta sette possibili stati di
ossidazione.
Ti
+1 +2
+3
+4
V
+1 +2
+3
+4
+5
Il numero degli stox decresce da Mn a Zn.
Cr
+1 +2
+3
+4
+5
+6
Mn
+1 +2
+3
+4
+5
+6
Fe
+1 +2
+3
+4
+5
+6
Co
+1 +2
+3
+4
+5
Ni
+1 +2
+3
+4
Cu
+1 +2
+3
Zn
+2
Dopo il Mn alcuni elettroni sono
necessariamente appaiati (regola di
Hund); questo diminuisce il numero degli
elettroni spaiati e pertanto degli stox
possibili.
La stabilità degli stati di ossidazione più
alti decresce da Sc a Zn. MnVII e FeVI sono
forti ossidanti.
+3
+7
Chimica Inorganica Biologica
Gli elementi di transizione
Numero di coordinazione
Il numero di coordinazione definisce il
numero di atomi gruppi che circondano
il metallo in un composto di
coordinazione
che
possono
appartenere ad un numero di leganti
pari o inferiore al numero di
coordinazione Varia da 2 a 9 anche se le
più comuni per la prima serie di
transizione sono 2, 4 e 6.
Chimica Inorganica Biologica
Complessi di coordinazione
Carica formale MT
I metalli di transizione possono dare composti in cui il metallo si
trova in stato di ossidazione formale variabile
[RuO4] (+8) [Cr(CO)4]4-
Formale significa che il metallo non ha in realtà su di sé 8 cariche positive
oppure 4 cariche negative, poichè la carica reale sul metallo raramente è più
grande di ± 2 come indicato dal “Principio di elettroneutralità di Pauling”
La carica formale sul metallo deriva dal fatto che gli elettroni del legame
covalente tra metallo e legante sono attribuiti al legante.
lo stato di ossidazione
formale del metallo si
ricava dal bilancio delle
cariche, dopo aver
assegnato le cariche
formali ai leganti
Carica = 1Carica = 1-
Carica = 0
Carica totale sul complesso
Stox = x
[CoCl(NO2)(NH3)4]+
Numero di coordinazione = 6
x –1 –1 = +1
x = +3
Chimica Inorganica Biologica
Complessi di coordinazione
Carica formale MT
Carica = 1Carica = 1-
Carica = 0
Carica totale sul complesso
Stox = x
[CoCl(NO2)(NH3)4]+
Numero di coordinazione = 6
x –1 –1 = +1
x = +3
Qual’è la carica formale sullo ione
metallico?
Chimica Inorganica Biologica
Complessi di coordinazione
Configurazione elettronica del MT
Regola generale:
La configurazione dn per uno ione MX+ è:
dn = dNEV – stox
CrCl2: Cr2+ dn = dNEV - stox = d6-2 = d4
NEV = Numero Elettroni Valenza
(n° del gruppo)
NB: NON 3d34s1
CrCl3: Cr3+ dn = dNEV - stox = d6-3 = d3
Cr(CO)6: Cr0 dn = dNEV - stox = d6-0 = d6
Il Cr è “zero valente” come il Cr metallico! Ma possiede una
configurazione 3d6 e non 3d5 4s1.
[CoCl4]-: Co3+ dn = dNEV - stox = d9-3 = d6
[Re2Br8]2-: Re3+ dn= dNEV - stox = d7-3 = d4
Chimica Inorganica Biologica
Complessi di coordinazione
Esempi
[Cr(ox)3]3- (ox = C2O42-)
[Cr(NH3)2(SCN)4]2-
[Co(mnt)2]2- (mnt = (NC)2C2S22-)
Chimica Inorganica Biologica
Complessi di coordinazione
Esempi
[Cr(C6H6)2]
[Fe(C5H5)2] ferrocene
[Cr(C6H6)(C5H5)]
[Mn(CO)3(C5H5)] cimantrene
Chimica Inorganica Biologica
Complessi di coordinazione
Esempi
Chimica Inorganica Biologica
Complessi di coordinazione
Esempi
[CuCl4](MFEA)2
[PtCl2(NH3)2]
MFEA
[PdCl4]2-
Chimica Inorganica Biologica
Complessi di coordinazione
Leganti
• Numero di atomi donatori
• Monodentati
• Bidentati (chelanti)
• Multidentati
• Natura atomo donatore
• S-donatori
• N-donatori
• O-donatori
• Alogenuri
• …
• Proprietà elettroniche
• Donatori sigma
• Donatori pi-greco
• Accettori pi-greco
Chimica Inorganica Biologica
Complessi di coordinazione
Leganti
Monodentati
Acqua
Monossido di carbonio
Chimica Inorganica Biologica
Complessi di coordinazione
Leganti
Monodentati
Piridina (py)
Chimica Inorganica Biologica
Complessi di coordinazione
Leganti Chelanti
M
M
2
Chimica Inorganica Biologica
Complessi di coordinazione
Leganti Chelanti
Chimica Inorganica Biologica
Complessi di coordinazione
Leganti Chelanti
Chimica Inorganica Biologica
Complessi di coordinazione
Leganti chelanti
tetradentati
Pirrolo
Chimica Inorganica Biologica
Complessi di coordinazione
Leganti chelanti
tetradentati
Ione metallico
Raggio ionico (pm)
Compatibilità con macrocicli tetrapirrolici
Be2+
Mg2+
Ca2+
Al3+
Ga3+
In3+
(V=O)2+
Mn2+ (AS)
Mn3+
Fe2+ (AS)
Fe2+ (BS)
Fe3+ (AS)
Fe3+ (BS)
Media Fe2+/3+
Co2+ (BS)
Ni2+
Cu2+
Zn2+
45
72
100
53
62
80
60
83
60
78
61
65
55
65
65
69
73
74
Troppo piccolo
Clorofilla
Troppo grande
Piuttosto piccolo
Trovato in olii minerali (raro)
Piuttosto grande (raro)
Abbondanti in olii minerali
Troppo grande
Usato in catalisi
Troppo grande
Adatto
Adatto
Piuttosto piccolo
Sistemi eme
Cobalammine (vitamina B12)
Tuniclorina
Piuttosto grande
Piuttosto grande
Chimica Inorganica Biologica
Complessi di coordinazione
Esempi
R=
OHCNCH3
5-deossiadenosile
Dimetilbenzoimidazolo
Ribosio-3-fosfato
Vitamina B12 (cobalamina)
Chimica Inorganica Biologica
Complessi di coordinazione
Esempi
Tridemnum solidum
Tunichlorin
K. C. Bible et al., Proc. Natl. Acad. Sci. USA, 85, 4592 (1988)
Chimica Inorganica Biologica
Complessi di coordinazione
Esempi
Lo ione Mg2+ ha le dimensioni perfette
per la cavità e mantiene la struttura
perfettamente planare e rigida evitando
dispersioni dell’ energia solare sotto
forma di calore e ottimizzandone
l’utilizzo per il processo fotosintetico.
Clorofilla a
Chimica Inorganica Biologica
Complessi di coordinazione
Esempi
Fe2+ eme
Fe3+ emina
Eme
Presente in
a
Citocromo a
b
Emoglobina, mioglobina, perossidasi e
citocromo b
c
Citocromo c
Cloroeme
Clorocruorina
Pigmento presente in invertebrati
terrestri e marini. Funge da
trasportatore d'ossigeno ai tessuti
permettendo
la
respirazione
cellulare.
Chimica Inorganica Biologica
Complessi di coordinazione
Esempi