a cura di Lucio Buratto
Buratto
Caretti
e Luigi Caretti
Mi
Mi opero
opero di
GLAUCOMA
GlAuCOmA
CAMO
CENTRO AMBROSIANO OFTALMICO
Al mio amico Sandro Galan
Lucio
Al mio Maestro Dottor Alessandro Galan,
con eterna gratitudine
Gigi
© Copyright gennaio 2014 Camo S.p.A.
Piazza Repubblica, 21 - 20124 Milano
http://www.camospa.it - e-mail: [email protected]
Tutti i diritti sono riservati
È vietata ogni riproduzione totale e parziale.
I
N
T
R
O
D
U
Z
I
O
Il glaucoma è una malattia degli occhi molto complessa, di solito ad andamento cronico e progressivo.
E’ una patologia molto diffusa: rappresenta infatti la
seconda causa di cecità nel mondo.
Si può presentare in modi diversi e, se non diagnosticato in tempo, può determinare in maniera silenziosa
e subdola danni gravi e irreversibili alla vista fino alla
cecità.
Il compito del medico oculista che si rapporti ad
un paziente con sospetto o diagnosi confermata di
glaucoma è molto delicato e preciso: oggi è infatti
possibile con una diagnosi precoce e con una valida
terapia controllare con grande efficacia il decorso di
questa grave malattia. Il medico oculista oggi ha a
disposizione strumentazioni moderne che permettono una precoce diagnosi e il dettagliato monitoraggio della malattia nel tempo; inoltre ha, dal punto
di vista terapeutico, nuovi farmaci, laser, strumentazioni e tecniche chirurgiche di recente introduzione
che consentono di evitare l’insorgenza e la progressione di gravi menomazioni visive. Le nuove terapie
infatti hanno permesso di raggiungere e conservare
risultati progressivamente più stabili e duraturi nel
tempo.
Ma questo compito è arduo in quanto, oltre al contributo del medico, è fondamentale la collaborazione
del paziente che deve sottoporsi a frequenti e periodici controlli nel tempo, sopportare lunghe terapie
con colliri da utilizzare quotidianamente e affrontare
eventualmente trattamenti parachirurgici (laser) o chirurgici.
Fondamentale infine è il rapporto di fiducia medico-paziente in cui il primo, oltre che a trattare con
competenza e conoscenza la patologia, deve essere
N
E
anche in grado di far capire al secondo che la sua
completa comprensione del tipo di patologia di cui è
affetto e la sua tenacia sono importanti per il raggiungimento del risultato desiderato da entrambi, cioè la
salvaguardia della vista.
Lucio Buratto
Luigi Caretti
Per consultare gratuitamente altre pubblicazioni
sui problemi dell’occhio
andare sul sito
www.camospa.it
Il presente libretto viene stampato ad uso
esclusivo dei pazienti in cura presso
il Centro Ambrosiano Oftalmico
5
ANATOMIA DELL’OCCHIO
Per una più agevole comprensione del glaucoma, è opportuno richiamare alcuni concetti di anatomia e fisiologia dell’occhio
(Fig. 1).
Fig. 1. Anatomia del bulbo dove si evidenziano le varie strutture
che compongono l’occhio. Focalizziamo l’attenzione sulla retina,
la membrana arancione che riveste la parete interna dell’occhio
ed il vitreo, il gel che riempie l’occhio.
6
L’occhio o bulbo oculare si compone di diverse strutture interne.
Se procediamo dall’esterno all’interno troviamo un guscio fibroso
biancastro denominato sclera, che nella sua porzione anteriore diviene perfettamente trasparente, assume la forma di calotta sferica e prende il nome di cornea. Dietro la cornea c’è uno
spazio denominato camera anteriore, delimitato posteriormente
dall’iride, cioè la parte colorata dell’occhio, che si presenta forata
nel centro. Il foro centrale dell’iride si chiama pupilla e funge da
diaframma di diametro variabile per regolare la quantità di luce
che penetra nel bulbo oculare. Infatti la pupilla varia di diametro a
seconda dell’intensità della luce ambientale, permettendo all’occhio di mantenere le migliori condizioni di illuminazione al suo interno: in questo modo in presenza di molta luce (per esempio
all’aperto durante una bella giornata) la pupilla si restringe, riducendo la quantità di luce che entra nel bulbo e evitando così di essere abbagliati; viceversa, in presenza di scarsa illuminazione (per
esempio di notte), la pupilla si allarga leggermente, consentendo
l’ingresso nell’occhio di maggiore quantità di luce che ci permette
di vedere ciò che ci circonda senza difficoltà.
Volendo esemplificare l’anatomia, si possono paragonare le parti
dell’occhio appena descritte ad un orologio: il vetro trasparente è
la cornea, il quadrante è l’iride, lo spazio compreso tra i due è la
camera anteriore.
Dietro l’iride e il suo foro centrale pupilla c’è il cristallino, cioè la
lente trasparente di forma biconvessa che converge i raggi luminosi sulla retina. Tutte le strutture descritte finora compongono la
parte anteriore dell’occhio o segmento anteriore.
Nella cavità interna dell’occhio, dietro il cristallino, troviamo il segmento posteriore, in cui è presente una sostanza gelatinosa e
trasparente detta vitreo che occupa la maggior parte del volume
dell’occhio.
In questo settore la superficie interna dell’occhio è tappezzata
dalla retina, una pellicola sottile e trasparente composta da milioni di cellule nervose dette cellule ganglionari, la cui funzione è
quella di trasformare in impulso elettrico lo stimolo luminoso delle
immagini provenienti dall’esterno. Tra retina e sclera c’è un tessuto ricco di vasi che provvede a fornire gran parte del nutrimento
necessario per il funzionamento dell’occhio: questo strato, detto
coroide, fornisce il colorito arancione che l’oculista percepisce
quando valuta il fundus del paziente (vedi dopo).
I sottilissimi prolungamenti delle cellule nervose della retina si
7
raggruppano in fasci di dimensioni sempre maggiori a formare il
nervo ottico: esso, che nel bulbo appare rilevato e denominato
papilla ottica (o testa del nervo ottico), costituisce un cordoncino formato da circa un milione di fibre nervose.
Il nervo ottico può essere paragonato ad un cavo della corrente
elettrica: infatti esso, uscendo dalla parte posteriore dell’occhio,
veicola gli impulsi nervosi fino alla parte posteriore del cervello
(corteccia cerebrale occipitale) e permette con un processo
psicofisico la reale interpretazione delle immagini visive (Fig. 2).
Fig. 2. Vie ottiche: il nervo ottico uscendo dalla parte posteriore
dell’occhio, veicola gli impulsi nervosi fino alla parte posteriore del
cervello (corteccia cerebrale occipitale).
Il funzionamento dell’occhio, che dipende dall’integrità delle strutture descritte, può essere ben esemplificato dal paragone con
quello di una macchina fotografica (Fig. 3).
L’immagine infatti entra nell’occhio per essere impressa sulla retina così come in una macchina fotografica penetra attraverso
l’obiettivo per arrivare ad impressionare la pellicola.
La parte anteriore dell’occhio (cornea, iride e cristallino) rappresenta quindi l’obiettivo dell’occhio e, come tale, è responsabile
della messa a fuoco delle immagini sulla retina, cioè la pellicola
fotografica del nostro esempio.
L’iride funziona invece come un diaframma, determinando grazie
ad un meccanismo di dilatazione e restringimento della pupilla, la
8
Fig. 3. Meccanismo della visione: paragone dell’occhio con la
macchina fotografica.
quantità di luce che penetra nell’occhio (come detto in precedenza).
Il cristallino, essendo una vera e propria lente con un potere determinato, agisce come tale e focalizza l’immagine sulla parte posteriore dell’occhio e cioè sulla retina.
E’ necessaria quindi di una perfetta trasparenza di cornea, cristallino e vitreo perchè le immagini possano giungere nitide alla retina.
Dietro l’iride, in uno spazio chiamato camera posteriore, ci sono
organelli a disposizione radiale detti processi ciliari, che producono continuamente un liquido ricco di sostanze nutritive, liquido
chiamato umor acqueo. Questo liquido, una volta prodotto, circola nella parte anteriore dell’occhio, cioè lambisce la superficie
del cristallino, poi passa attraverso la pupilla in camera anteriore e
scorre lungo la superficie interna della cornea (Fig. 4).
Successivamente esce dell’interno dell’occhio tramite una zona
compresa tra l’iride e la cornea chiamata angolo irido-corneale
(o camerulare), attraversando una struttura detta trabecolato.
9
Fig. 4. Circolazione dell’umor
acqueo.
Fig. 5. Circolazione dell’umor
acqueo: l’eliminazione di parte
dell’umor acqueo dall’interno
del bulbo avviene attraverso il
trabecolato, successivamente
attraverso il canale di Schlemm
e poi attraverso le vene esterne
dell’occhio.
Il trabecolato è una specie di griglia formata da strati di lamelle a
maglie fitte che permettono l’eliminazione di parte dell’umor acqueo. L’eliminazione avviene attraverso il canale di Schlemm e poi
attraverso le vene esterne dell’occhio (Fig. 5).
Normalmente questo angolo irido-corneale resta aperto permettendo il deflusso dell’umor acqueo nel trabecolato in quantità
adeguata: in queste condizioni di equilibrio in cui una parte di
umor acqueo è prodotta e una parte è eliminata, la pressione
interna dell’occhio si mantiene ad un valore costante. Se invece
l’angolo si chiude o si riduce di ampiezza, il liquido non riesce
ad uscire dal bulbo oculare in quantità idonea e si determina
pertanto l’aumento della pressione dell’occhio. In altri casi ancora l’aumento della pressione interna dell’occhio è causato da
un ostacolo al deflusso a livello del trabecolato, dove le maglie
sono più strette della norma, mentre l’angolo irido-corneale resta aperto (vedi dopo).
10
LA PRESSIONE INTRAOCULARE
Sia la produzione dell’umor acqueo all’interno del bulbo che la
sua eliminazione da esso devono essere in costante equilibrio per
conservare una corretta pressione intraoculare, come accennato
in precedenza.
Se, come vedremo più avanti, questo equilibrio si perde (per vari
motivi), si verifica l’innalzamento della pressione interna dell’occhio e inizierà a svilupparsi la malattia glaucomatosa: questa si
può verificare perché le vie di scarico sono intasate o bloccate.
La pressione intraoculare, che per semplicità abbrevieremo con
la sigla “PIO” (Pressione Intra Oculare), si misura in millimetri di
mercurio, cioè mm Hg, come si usa per tutti i tipi di pressione.
La PIO normale di solito varia tra i 10 e i 21 mm Hg con una media
di 16 mm Hg, anche se a dire il vero un parametro ben definito
non esiste in assoluto perché è individuale; infatti il livello pressorio a cui si possono manifestare i danni è variabile a seconda dei
singoli individui.
La PIO presenta un ritmo circadiano, cioè una tendenza a valori
più elevati di mattina e più bassi di sera e di notte. Variazioni della
PIO > 5 mmHg sono più frequenti in occhi glaucomatosi e dovrebbero pertanto portare a consigliare adeguati controlli diagnostici.
Il 5-10% della popolazione ultraquarantenne ha una PIO maggiore di 22 mmHg (ipertesi oculari): in un significativo numero di
questi pazienti non sono riscontrabili alterazioni di tipo glaucomatoso né della papilla ottica, né del campo visivo. Questi pazienti
necessitano di controlli nel tempo, in quanto ogni anno circa il 2%
di essi sviluppa alterazioni del campo visivo di tipo glaucomatoso.
E’ utile ricordare che diversi fattori possono influenzare transitoriamente il livello pressorio, come la già citata deviazione diurna,
la frequenza cardiaca, il consumo di alcol e caffeina, l’esercizio
fisico, l’assunzione di liquidi o farmaci sistemici o per uso oculare
(vedi dopo il paragrafo sui fattori di rischio).
11
MECCANISMI DI DANNO DETERMINATO
DALL’IPERTENSIONE OCULARE
Gli esperti ritengono che i complessi meccanismi attraverso i quali
si sviluppa il glaucoma sono ancora oggi in parte sconosciuti.
Il primo meccanismo viene definito “meccanismo di danno meccanico”: in caso di aumento della PIO, non essendo l’occhio
estensibile, si verifica una compressione delle delicate fibre nervose della retina, in particolare sulla papilla ottica dove le esili fibre
nervose si raccolgono a formare il nervo ottico.
Questa compressione determina un danno sulla papilla ottica logorando le fibre nervose nel suo centro e dando luogo alla caratteristica “escavazione glaucomatosa”, che l’oculista riesce ad
individuare durante la visita (Fig. 6).
Inoltre negli ultimi anni è stato scoperto che l’aumento della PIO
è capace di danneggiare le fibre nervose anche attraverso la cronica riduzione dell’apporto vascolare che l’aumento della PIO determina (“meccanismo di danno ischemico”). Il nervo ottico costituisce infatti la zona più delicata e sensibile del fondo oculare (o
fundus). La cronica riduzione dell’apporto di sangue (e quindi di
nutrimento) nella parte più superficiale della testa del nervo ottico
può determinare danni anche se intermittente e transitoria. In
questo ambito sono da considerare diverse patologie vascolari
sistemiche, quali il diabete, l’arteriosclerosi, l’ipertensione arteriosa, vasospasmi, malattie cardiache, emicrania, apnea notturna,
ma anche l’ipotensione arteriosa, malattie tutte da individuare e
eventualmente curare per ridurre il rischio di sviluppare glaucoma.
Inoltre molto recentemente si è compreso che un’alterazione
dell’immunità del soggetto può contribuire nello sviluppo dell’otticopatia (danno della papilla ottica) da glaucoma. Si può quindi
oggi considerare in parte il glaucoma come una malattia autoimmunitaria del sistema nervoso, cioè condotta dal sistema di difesa del soggetto contro se stesso e innescata per ragioni ancora
non ben chiarite (“meccanismo di danno immunitario”). Questo
complesso meccanismo patogenetico sembra particolarmente
rilevante in quel gruppo di pazienti glaucomatosi che, presenta-
12
no danni del campo visivo associato a valori normali di PIO (vedi
dopo il paragrafo sul glaucoma a pressione normale).”
A
B
C
D
Fig. 6. Progressione dell’escavazione della papilla ottica, che viene valutata
dall’Oculista durante l’esplorazione del fundus.
In A, B, C l’escavazione aumenta di profondità ed estensione, cioè il nervo
ottico subisce una perdita di fibre nervose. I meccanismi attraverso cui si determina il danno del nervo ottico (otticopatia) possono essere di tipo compressivo (effetto meccanico dell’aumento della PIO), di tipo ischemico (riduzione
dell’apporto di sangue al nervo ottico) o di tipo autoimmunitario (danno su
base autoimmune, scoperto recentemente).
In D la papilla presenta una profonda e larga escavazione, il colorito è pallido
(papilla pallida e atrofica della fase terminale di malattia).
13
IL CAMPO VISIVO
Se fissiamo un oggetto noi percepiamo l’oggetto fissato insieme
a tutto ciò che lo circonda: l’area di spazio che viene percepita
costituisce il campo visivo.
Se un soggetto sano guarda una barca in mezzo al mare al tramonto, percepisce con lo sguardo oltre la barca tutto ciò che c’è
intorno, cioè il mare, l’orizzonte, il sole che tramonta.
A
B
C
D
Fig. 7. Nell’evoluzione del glaucoma l’atrofia delle fibre visive si
manifesta con la perdita di porzioni del campo visivo che diventano cieche, finchè rimane solo una zona centrale di visione.
14
Si deve fare una distinzione tra campo visivo binoculare, che rappresenta tutto ciò che è visibile con i due occhi contemporaneamente, e campo visivo monoculare, che si riferisce ad un solo
occhio. I campi visivi monoculari dei due occhi si sovrappongono
parzialmente nella visione binoculare, che è quella che noi utilizziamo costantemente.
In presenza di glaucoma in stadio avanzato, invece, il paziente
vede la barca come attraverso un tubo o un buco di una serratura, non distingue cioè tutto ciò che c’è intorno. L’aumento della
PIO è in grado di provocare questi gravi danni, che si instaurano
tipicamente in tempi molto lunghi.
Inizialmente di solito il danno interessa le fibre nervose che portano le immagini relative a porzioni periferiche del campo visivo:
il paziente continua a vedere l’oggetto che fissa e non si accorge
che l’area di spazio che globalmente percepisce si sta riducendo.
Altre volte, invece, i primi difetti sono centrali.
Da ultimo invece vengono lesi anche i fasci nervosi che provengono da quell’area della retina centrale con cui si fissano gli oggetti e si ha quindi la riduzione della acuita’ visiva fino alla cecita’
completa.
La particolarità della malattia è che i danni evolvono in maniera
lenta ma costante verso la progressiva e definitiva riduzione del
campo visivo, molto spesso senza dare particolari disturbi al paziente.
15
DESCRIZIONE DEL GLAUCOMA
Con tale termine non si fa riferimento ad un tumore come in genere accade con i termini medici con desinenza “-oma”.
Il glaucoma è una malattia progressiva, in quanto causa danni che
tendono a peggiorare nel tempo gradualmente e inesorabilmente
fino a compromettere la vista in maniera definitiva. E’ una malattia
cronica, cioè dura molti anni (e quando comincia non si ferma o
meglio perdura per tutta la vita).
Il danno che causa è determinato dall’aumento della PIO e consiste in una sofferenza del nervo ottico, che gradualmente perde
la sua funzione determinando quindi la progressiva riduzione del
campo visivo.
Nella maggior parte dei casi il glaucoma è una malattia bilaterale,
vale a dire che coinvolge entrambi gli occhi.
Bisogna specificare però che l’aumento della PIO non è sufficiente
per porre la diagnosi di glaucoma. Vi sono infatti, come accennato
in precedenza, casi di ipertensione oculare senza danni al campo
visivo e viceversa casi con alterazione del campo visivo associati
a PIO normale (glaucomi a pressione normale). Da ciò si capisce
come la prevenzione costituisca un punto imprescindibile e come
sia fondamentale diagnosticare precocemente questa malattia.
Una volta effettuata la diagnosi corretta ed instaurata una valida
terapia, l’oculista sottopone il paziente a periodiche visite comprensive della misurazione della PIO ed a esami strumentali (tra
cui l’esame del campo visivo) per verificare che la malattia non
progredisca. Se dovesse verificarsi peggioramento clinico, il medico può modificare in modo appropriato la terapia o potenziarla
per riportare la PIO a valori normali. Ricordiamo però ancora una
volta che non esistono valori normali in assoluto, cioè che valgono
per tutte le persone, ma esiste una pressione individuale giusta
che impedisce alle fibre del nervo ottico di danneggiarsi.
Dal punto di vista terapeutico va evidenziato che la cura efficace
e tempestiva, cioè durante la prime fasi della malattia, fornisce
migliori risultati rispetto ad una cura avviata quando i danni sono
già avanzati e gravi (irreversibili).
16
FATTORI DI RISCHIO
Anche se i complessi meccanismi attraverso i quali si sviluppa il
glaucoma sono ancora in parte sconosciuti, sono stati individuati
numerosi fattori di rischio che si associano alla malattia.
Il glaucoma rappresenta infatti una malattia multifattoriale, cioè
diverse cause contribuiscono alla sua genesi.
L’incidenza della malattia glaucomatosa nella popolazione aumenta progressivamente con l’età, soprattutto dopo i 40 anni.
L’incidenza dei difetti glaucomatosi del campo visivo in soggetti al
di sotto dei 40 anni è dello 0.7%, mentre sale al 4.8% al di sopra
dei 60 anni. Pertanto è fortemente consigliato effettuare una visita
oculistica dopo i 40 anni, ma prima per i soggetti con familiarità o
altri fattori di rischio. Si pensa che il 50% dei malati di glaucoma
non sia al corrente di avere la malattia.
Non esistono differenze statisticamente significative tra maschi e
femmine.
Molto importante è la familiarità, cioè la presenza di familiari del
paziente affetti da glaucoma costituisce un fattore che predispone
a sviluppare la malattia. Chi ha un parente di primo grado affetto
da glaucoma, corre un rischio da 4 a 8 volte maggiore di manifestarla rispetto ad un soggetto senza familiarità. Sono stati già
individuati sei geni nel DNA sicuramente legati alla comparsa del
glaucoma. Il meccanismo della familiarità è di per se ancora poco
chiaro.
In futuro, test diagnostici sul DNA saranno verosimilmente utilizzabili non solo per valutare il rischio glaucomatoso ma anche per
scegliere tra diverse opzioni terapeutiche nei singoli pazienti.
Le persone di razza nera e i caraibici presentano una maggiore
incidenza di glaucoma, mentre quelle di razza asiatica sono più
frequentemente affette da un tipo particolare di glaucoma detto
glaucoma ad angolo chiuso, a causa della particolare conformazione del bulbo oculare.
Alcune malattie generali che comportano alterazione o compromissione della circolazione sanguigna come diabete soprattutto,
17
ma anche arteriosclerosi, ipertensione arteriosa, ipotensione arteriosa, vasospasmi, malattie cardiache, emicrania, apnea notturna,
riducendo l’apporto di sangue al nervo ottico possono generare o
favorire l’insorgenza del glaucoma.
Diverse sono le cause oculari: difetti elevati della vista come soprattutto miopia elevata ma anche ipermetropia elevata, cataratta, trombosi delle vene retiniche, infiammazioni oculari, tumori
oculari, complicanze avvenute durante l’intervento di cataratta o
dopo di esso e traumi pregressi.
Un cenno maggiore merita la cataratta come causa di glaucoma.
La cataratta è l’opacizzazione del cristallino, cioè la lente presente
all’interno dell’occhio. Quando essa diventa molto evoluta può
subire modifiche della sua struttura responsabili degli innalzamenti della PIO. Inoltre, come il paziente affetto da cataratta vede
annebbiato, così l’oculista che lo visita ha difficoltà nella visualizzazione del fondo oculare e soprattutto della papilla ottica: quest’ultima deve essere valutata per eseguire la corretta valutazione clinica o il monitoraggio del glaucoma. Pertanto l’appropriata
valutazione iniziale della malattia glaucomatosa o il suo monitoraggio accurato nel tempo sono difficoltosi nei pazienti affetti da
cataratta molto densa.
Il glaucoma può anche essere provocato da farmaci: il più comunemente in causa è il cortisone. Questo farmaco, sia per via
generale (orale, intramuscolare, endovenosa), sia soprattutto se
utilizzato localmente (colliri, pomate) quando assunto in maniera
continuativa può causare glaucoma. Il cortisone, per motivi genetici e per modifiche del trabecolato, determina aumento della PIO
che scompare alla sospensione del farmaco solo se il cortisone è
stato utilizzato per brevi periodi (inferiore ai due mesi). Nel tempo
può indurre un glaucoma del tipo cronico con caratteri molto simili
a quelli del glaucoma primario ad angolo aperto, ma con andamento più grave.
Pertanto è fondamentale che chiunque faccia uso prolungato di
questo farmaco si rivolga all’oculista per la valutazione degli eventuali effetti collaterali, quali la cataratta e soprattutto il glaucoma.
18
PREVENZIONE
La prevenzione costituisce un punto fondamentale in quanto consente di individuare precocemente il glaucoma, che come detto
si presenta molto spesso come una patologia priva di disturbi,
tanto da essere definita “il ladro silente della vista”. Infatti il glaucoma non determina disturbi chiari ed eclatanti per i quali il paziente ravveda la necessità di rivolgersi allo Specialista. Il glaucoma
costituisce l’unica malattia oculare per la quale è oggi possibile
effettuare un’efficace prevenzione.
La prevenzione, che si basa sull’identificazione dell’aumento della
PIO o delle cause oculari e non oculari che il paziente può presentare (vedi paragrafo precedente sui fattori di rischio), costituisce
quindi il solo modo per individuare precocemente i primi segni di
malattia (prevenzione di malattia). L’unico sanitario che può effettuare una diagnosi precoce del glaucoma e’ il medico Oculista.
Una volta formulata la diagnosi corretta, il medico prescrive l’adeguata terapia per evitare la progressione della malattia.
La terapia precocemente instaurata è fondamentale per prevenire
l’avanzamento del deficit visivo indotto dalla malattia (prevenzione
del peggioramento clinico): una volta che si è determinato il danno delle fibre nervose, esso è irreversibile, quindi la terapia serve
per prevenire il peggioramento della malattia e non per far tornare
a funzionare le fibre nervose danneggiate.
Sicuramente l’età critica è rappresentata dai 40 anni, momento in
cui è imperativo effettuare una visita oculistica.
Il paziente che presenta una o più cause di glaucoma descritte nel
precedente paragrafo (in particolare la familiarità) deve sottoporsi
a visita oculistica prima di questa età.
Riassumendo, ai fini della massima della prevenzione, devono essere sottoposti a screening per il glaucoma i soggetti con i fattori
di rischio più importanti e quindi:
• Tutti i soggetti di età superiore ai 40 anni.
• Tutti i consanguinei dei pazienti glaucomatosi indipendentemente
dall’età.
• Tutti i miopi medio elevati (miopia di grado superiore alle 6 diottrie).
19
CLASSIFICAZIONE
Esistono moltissimi tipi diversi di glaucoma, cioè di quella malattia
caratterizzata dall’aumento della PIO, e la loro classificazione si
basa sull’apertura dell’angolo irido-corneale e su altre caratteristiche (Fig. 8A-B):
• ad angolo aperto (il più frequente rappresentando oltre il 50%
della totalità dei casi)
• ad angolo chiuso (10% dei casi).
Inoltre i glaucomi possono essere divisi in:
• primari, cioè non associati a patologie oculari o sistemiche (oltre
il 65% dei casi)
• secondari, cioè dovuti a malattie oculari o generali (oltre il 30%
dei casi)
• congeniti, ovvero già presenti al momento della nascita (1% dei
casi).
Fig. 8A. nella parte sinistra
si vede il normale deflusso
dell’umor acqueo, mentre
nella parte destra il deflusso
è bloccato al livello del trabecolato (glaucoma ad angolo
aperto)
Fig. 8B. nella parte sinistra il
deflusso dell’umor acqueo è
normale, mentre nella parte
destra l’iride si addossa alla
cornea ostruendo il passaggio dell’umor acqueo (glaucoma ad angolo chiuso).
20
Glaucoma primario ad angolo aperto
Costituisce la forma di glaucoma più frequente nella popolazione,
rappresentando oltre il 60% della totalità dei casi, ed è riscontrabile soprattutto negli anziani. È responsabile del 13% delle cause
di cecità, senza differenza tra maschi e femmine.
Le prime alterazioni possono svilupparsi già intorno ai 40 anni.
E’ presente mediamente nello 0.43% della popolazione sopra i 45
anni di età; la sua frequenza aumenta con l’età fino ad arrivare a
circa il 2% intorno ai 70 anni.
Come detto, recentemente diversi studi clinici hanno dimostrato che questa frequente forma di glaucoma presenta una componente genetica molto spiccata, ovvero nel DNA ci sono delle
particolari zone che rendono alcuni soggetti particolarmente predisposti a contrarre la malattia.
L’aumento della PIO è causato da un ostacolo al deflusso a livello del trabecolato, dove la maglie sono più strette della norma,
mentre l’angolo irido-corneale resta aperto. L’umore acqueo raggiunge normalmente il trabecolato, ma non viene sufficientemente
filtrato in quanto quest’ultimo è strutturalmente alterato (ostruzione dei canali di scarico) (Fig.9). La pressione oculare aumenta
causando un danno progressivo al nervo ottico.
La patologia è bilaterale, cioè interessa entrambi gli occhi, anche
se le prime alterazioni si sviluppano spesso in uno solo.
Fig. 9. Meccanismo di formazione del
glaucoma primario ad angolo aperto: ostacolo al deflusso a livello del
trabecolato. Il trabecolato presenta
un’ostruzione dei canali di scarico
che non permette un sufficiente passaggio dell’umor acqueo. La pressione oculare aumenta causando un
danno progressivo al nervo ottico.
21
Riguardo la sintomatologia, va ricordato con enfasi che i sintomi
di avvertimento di questa affezione sono praticamente assenti,
per cui la prevenzione rappresenta il punto veramente cruciale. Il
paziente affetto da glaucoma gode di un apparente benessere e
non é spinto a rivolgersi all’Oculista. Questo stato di cose comporta il pericolo che una diagnosi precoce non venga fatta e che
ci si accorga della presenza della malattia soltanto nelle fasi molto
avanzate quando i danni irreversibili hanno già raggiunto una notevole gravità.
Per evitare questa drammatica evenienza é necessario che la malattia venga ricercata sistematicamente fra le persone che hanno
maggiore probabilità di soffrirne.
La diagnosi viene posta dall’Oculista che riscontra 3 aspetti:
• l’alterazione del campo visivo
• l’aumento dell’escavazione della papilla del nervo ottico
• l’aumento della PIO, sopra i 21 mmHg.
Va però precisato che il glaucoma primario ad angolo aperto rappresenta una condizione cronica in cui l’aumento della PIO può
esserci, come non esserci; quindi l’aumento della PIO non è una
caratteristica costante in tutti i pazienti. Di conseguenza la mera
misurazione della PIO è completamente insufficiente a definire
una diagnosi certa di tale patologia.
Inoltre la PIO elevata non giustifica sempre la diagnosi del glaucoma: esistono infatti molti casi di ipertensione oculare innocua.
L’insorgere del danno è molto condizionato dal grado di vulnerabilità individuale del nervo ottico. In altre parole vi sono individui
che possono tollerare indefinitamente senza danni pressioni piuttosto elevate, e viceversa altri sviluppano una lesione glaucomatosa anche a livelli di ipertensione molto modesti.
Lo stato della papilla ottica e lo studio del campo visivo potrebbero evidenziare o meno danni al nervo ottico e sciogliere ogni
eventuale dubbio.
Esistono inoltre esami specifici (che di seguito tratteremo) che aiutano a diagnosticare la malattia nelle fasi iniziali, quando cioè è
sicuramente più controllabile e gestibile.
Al momento della diagnosi, la capacità visiva può essere molto
buona (anche se vi sono alterazioni periferiche del campo visivo)
e può rimanere tale per molto tempo.
Dal punto di vista terapeutico, va detto che generalmente la malattia
risponde bene alla terapia ipotonizzante topica, vale a dire ai colliri
che vanno instillati ogni giorno e che sono in grado di ridurre la PIO.
22
In alcuni soggetti che non rispondono in maniera adeguata alla terapia medica può essere necessario per arrestare il decorso della
patologia eseguire trattamenti laser specifici o interventi chirurgici.
Glaucoma primario ad angolo chiuso
E’una forma relativamente rara: 10% di tutti i casi di glaucoma,
circa lo 0.1% delle persone sopra i 40 anni, con una forte prevalenza nella donna di 4:1. E’ prevalente nei cinesi, negli indiani
asiatici e negli eschimesi.
Si differenzia enormemente da tutti gli altri tipi di glaucomi perché
insorge in maniera estremamente repentina: viene infatti denominato anche glaucoma acuto.
Esso si genera perché l’angolo camerulare viene rapidamente
bloccato dall’apposizione della parte più periferica dell’iride e ciò
comporta un drammatico aumento della PIO, che può raggiungere anche i valori di 70 mmHg (Fig.10).
L’aumento così drastico ed improvviso della PIO è accompagnato
da un insieme di sintomi che sono tipici di questa forma di glaucoma. Insorge un dolore molto violento localizzato all’occhio, con
irraggiamento alla fronte e alla testa. La capacità visiva diminuisce velocemente ed compaiono nausea e vomito. Il paziente che
giunge all’osservazione del medico con attacco acuto di glaucoma è infatti un paziente molto sofferente e provato.
Certamente il glaucoma ad angolo chiuso insorge in occhi anatomicamente predisposti, cioè con un angolo camerulare molto
stretto a causa di una camera anteriore ridotta di profondità o di
un’inserzione anteriore dell’iride. In occhi come questi si può ve-
Fig. 10. Meccanismo di chiusura dell’angolo irido-corneale
nel glaucoma primario ad angolo chiuso. L’umore acqueo
non riesce a raggiungere il sistema trabecolare di deflusso
perchè l’angolo formato da iride e cornea è troppo stretto:
l’iride si addossa progressivamente alla cornea ostruendo
completamente il passaggio.
23
rificare la chiusura improvvisa dell’angolo a causa delle seguenti
condizioni favorenti:
• midriasi, cioè la dilatazione della pupilla (durante il sonno o nel
guardare la televisione al buio o guidare di notte);
• sforzi di accomodazione (durante una prolungata lettura o lavori di
precisione su oggetti molto piccoli).
Molto recentemente è stata suggerita, come per il glaucoma primario ad angolo aperto, una predisposizione genetica anche se
ancora in corso di studio e quindi non ancora completamente
definita.
Glaucomi secondari
Rappresentano un gruppo molto eterogeneo di glaucomi che costituiscono la conseguenza di altre malattie oculari, di traumi o
degli effetti indesiderati di alcuni farmaci e che arrivano nel complesso a circa il 30% di tutte le forme.
Possono essere ad angolo chiuso o aperto, legati a cause oculari
o extraoculari. Spesso l’angolo della camera anteriore e più in
generale le vie di deflusso dell’umore acqueo vengono alterate da
malattie infiammatorie, emorragie, tumori, spostamenti del cristallino, proliferazione di tessuti anomali ed altro.
L’evoluzione di questi glaucomi è talvolta di tipo cronico, ma in
certi casi assume un andamento più violento, con dolore, arrossamento ed intorbidamento della visione.
La terapia dei glaucomi secondari varia a seconda delle malattie
di base che li determinano. I risultati non sono sempre soddisfacenti.
I glaucomi secondari costituiscono un capitolo molto ampio e di
non immediata comprensione, motivo per cui descriveremo brevemente solo le due forme più frequenti: il glaucoma neovascolare e quello secondario ad infiammazioni intraoculari.
Il glaucoma neovascolare può essere una conseguenza di diverse malattie oculari: trombosi delle vene retiniche, retinopatia
diabetica, tumori intraoculari, infiammazioni oculari croniche.
Esso viene innescato da una condizione di ampia e persistente
ischemia retinica, cioè riduzione dell’apporto di sangue alla retina.
In seguito all’ischemia retinica, l’iride e l’angolo camerulare vengono invasi di vasi sanguini anomali detti “neovasi”. Ciò comporta
nel tempo un aumento vertiginoso della PIO, che negli stadi terminali può raggiungere anche valori di 70 mmHg.
La terapia di questa gravissima forma di glaucoma è soprattutto
sintomatica, cioè è rivolta prevalentemente al tentativo di control-
24
lo del dolore ricorrente che si determina, in quanto i tentativi di
ridurre la PIO con colliri sono molto spesso inefficaci. Anche gli
altri possibili approcci terapeutici (chirurgia, criotrattamento, trattamento laser ab esterno) consentono di ottenere risultati pressori
spesso poco soddisfacenti.
Nel glaucoma secondario ad infiammazioni intraoculari
(uveiti) l’aumento della PIO è dovuto alla formazione di aderenze
tra il bordo della pupilla e il cristallino che impediscono il passaggio dell’umor acqueo dalla camera posteriore a quella anteriore
dell’occhio (blocco pupillare).
La terapia in questi casi è parachirurgica (laser) o chirurgica.
Altre due forme di glaucoma secondario relativamente frequenti
sono quelle associate a diabete e a cataratta in fase molto avanzata.
Glaucoma congenito
E’ quella forma di glaucoma già presente al momento della nascita o che si sviluppa nei primissimi anni di vita. Prende anche il
nome di glaucoma malformativo.
Costituisce un’affezione rara: prevalenza nella popolazione di
1:10.000 nati.
E’ bilaterale nell’70-80% dei casi.
Si sviluppa per la presenza di alterazioni congenite dell’angolo
irido-corneale (trabecolato) che rendono difficoltoso il deflusso
dell’umore acqueo della camera anteriore dell’occhio. Ne risulta
un aumento della PIO il cui grado dipende dalla gravità della malformazione (Fig.11).
L’aumento della PIO che si verifica entro i 3 anni di età è responsabile della del tipico aspetto del buftalmo, cioè gli “occhi grandi”, do-
Fig. 11. Nel glaucoma congenito
l’angolo irido-corneale risulta alterato e consente un parziale deflusso dell’umor acqeuo dal bulbo
oculare con conseguente aumento della PIO.
25
vuto all’abnorme ingrandimento della sclera e della cornea (Fig. 12).
Questi tessuti oculari si ingrandiscono in seguito all’aumento della
PIO perché nel bambino essi sono molto elastici. La cornea quindi si presenta ingrandita e opaca, motivo per cui la visione risulta
compromessa. Il nervo ottico presenta l’aumento dell’escavazione.
Oltre l’aumento del volume degli occhi, i genitori notano che il
bambino lacrima spesso, presenta fastidio alla luce e fenomeni di
blefarospasmo, cioè chiude frequentemente e fortemente le palpebre. Ognuno di questi sintomi sospetti deve spingere i genitori
dall’oculista per effettuare una visita di controllo.
La terapia di questa malattia é esclusivamente chirurgica.
Il bambino necessita di un precoce intervento chirurgico volto
ad eliminare le malformazioni dell’angolo irido-corneale: si tratta
di interventi chirurgici particolari che sono diversi da quelli usati
nei glaucomi dell’adulto. L’effetto del trattamento chirurgico nella
gran parte dei casi dura per tutta la vita del piccolo paziente, nel
senso che la PIO si mantiene nel range di normalità anche se
spesso la capacità visiva risulta inferiore alla norma.
Se, invece, non interviene precocemente l’adatta terapia, con
l’andare del tempo la malattia porta fatalmente alla cecità. Infatti
questa grave forma di glaucoma, se non adeguatamente trattata
nei modi e nei tempi, favorisce anche l’insorgenza dell’ambliopia
da deprivazione visiva, vale a dire che il sistema visivo in formazione del bambino, non ricevendo lo stimolo visivo necessario, non si
sviluppa adeguatamente risultandone occhi con una irreversibile
ridotta capacità visiva (ambliopia).
In ogni caso questi piccoli pazienti necessitano di controlli specialistici per tutta la vita.
Fig. 12. Nel paziente affetto da
buftalmo, gli occhi si ingrandiscono e la cornea diventa opaca.
26
VISITA OCULISTICA NEL PAZIENTE
GLAUCOMATOSO
La prima cosa è l’accurata anamnesi, cioè la raccolta della storia
clinica del paziente e dei suoi familiari.
Poi l’oculista valuta l’acuità visiva del paziente, cioè la lettura di
lettere poste su uno schermo (ottotipo), di grandezza decrescente, situato ad una distanza predeterminata (3 o 5 metri), naturale
ovvero senza lenti correttive ed eventualmente corretta cioè con
l’interposizione di lenti correttive volte a correggere il difetto di vista (Fig.13).
Successivamente si passa alla biomiscroscopia o esame alla
lampada a fessura: il medico con l’ausilio di questo microscopio
ingrandente esamina l’occhio nel suo complesso e poi misura la
tensione oculare (Fig.14).
Classicamente la misura del tono oculare è una manovra rapida chiamata tonometria
ad applanazione secondo Goldmann: viene
effettuata, previa instillazione nel sacco congiuntivale di una goccia
di anestetico in collirio e
di un colorante arancione (fluoresceina), grazie
ad uno strumento chiamato tonometro ad applanazione dotato di un
piccolo cono di plastica.
Il paziente viene invitato
Fig. 13. Tavola ottotipica per la misurazione della a tenere gli occhi fermi e
capacità visiva. Ad ogni dimensione, in relazione bene aperti in modo che
alla distanza a cui il paziente è posto, corrisponde il cono, delicatamente
una valore espresso in decimi, in cui 10/10 rap- appoggiato alla cornea
e illuminato con una
presentano la “buona” visione.
27
Fig. 14. Visita oculistica con lampada a fessura.
luce blu, possa rilevare il valore della PIO espressa in mmHg su
un’apposita scala (Fig.15).
Dato che, come detto in precedenza, i valori della PIO variano nel
corso della giornata, l’esame della curva tonometrica è importante e consiste nella registrazioni della misurazioni tonometriche
eseguite durante il giorno, ogni 4-5 ore. Le fluttuazione considerate normali non devono superare i 5 mmHg tra valore massimo e
minimo, mentre nel glaucoma superano spesso i 5 mmHg.
La tonometria costituisce una metodica valida sia per la diagnosi
di glaucoma che per il controllo dell’efficacia della terapia.
Oggi esiste un sistema ancora più rapido e pratico, che non richiede l’anestesia, chiamato tonometria Icare. La misurazione
viene effettuata con una sonda molto leggera che entra momentaneamente a contatto con la cornea (Fig.16).
La tonometria Icare ha assunto oggi un ruolo importante nei programmi di screening di massa poiché è rapida, indolore e come
detto non richiede l’uso di colliri, né competenze specialistiche, in
quanto può essere effettuata anche dal personale di supporto al
medico. La misurazione non viene quasi percepita dal paziente;
per tale motivo è eseguibile persino per i soggetti particolarmente
28
poco collaboranti, come i bambini
e i pazienti affetti da demenza.
Il tonometro a soffio d’aria è un altro strumento a “non-contatto”: da
un pistoncino, posto di fronte alla
cornea, viene emesso un soffio
d’aria che va ad applanare la superficie corneale analizzata; poi, attraverso un sistema di rilevazione,
lo strumento deduce la resistenza
Fig. 15. Tonometro ad applanaziocon cui l’occhio contrasta la forza
ne, che serve per la misurazione della
esterna del soffio d’aria e quindi
pressione oculare.
deduce la IOP. Come l’Icare, il tonometro a soffio è utile nei bambini
o comunque per lo screening nei
pazienti poco collaboranti.
Per una corretta misurazione della
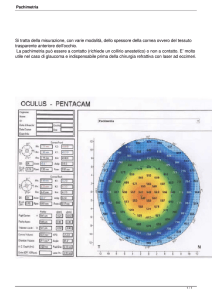
PIO bisogna considerare lo spessore centrale della cornea, che si
rileva con uno strumento di nome
pachimetro. Infatti è stato dimostrato che la misurazione della PIO
con il tonometro ad applanazione
viene sovrastimata o sottostimata
se lo spessore corneale è rispettivamente al di sopra o al di sotto di
Fig. 16. Tonometria Icare.
un valore considerato “medio” per
la popolazione. Pertanto i soggetti con spessore corneale ridotto
sono più a rischio di essere sottostimati e, quindi, di sfuggire alla
diagnosi di glaucoma.
Nel completo inquadramento di questo tipo di pazienti risulta di
fondamentale importanza l’esame del fundus, cioè la parte interna e posteriore dell’occhio ed in particolare della papilla ottica
(Fig.17).
Una variazione nell’aspetto della papilla può essere la prima tappa
nella diagnosi di un glaucoma. Se necessario l’esame del fundus
si esegue instillando della gocce che dilatano la pupilla, ma molto
spesso è possibile valutare la testa del nervo ottico anche a pupilla non dilatata. La sofferenza del nervo ottico nel paziente affetto
da glaucoma si manifesta tipicamente con la perdita del normale
colorito roseo della papilla ottica che diventa più biancastra cioè
29
Fig. 17. Esame del fundus oculare.
Fig. 18. Gonioscopia o esame dell’angolo irido-corneale.
pallida e con l’aumento della sua
escavazione (papilla glaucomatosa).
Altro esame fondamentale che
l’Oculista conduce alla lampada
a fessura è la gonioscopia, cioè
la visualizzazione dei particolari
dell’angolo irido-corneale, punto
attraverso il quale l’umor acqueo
fuoriesce dall’occhio. Previo l’utilizzo di un gel che fa da menisco,
viene posta a contatto dell’occhio
una particolare lente dotata di uno
specchio che consente di apprezzare i particolari strutturali dell’angolo camerulare (Fig.18).
L’angolo così può essere definito
da aperto a chiuso, secondo una
convenzionale scala di valori da 0
a 4 (sistema di valutazione secondo Shaffer) (Fig.19).
30
Fig. 19. Sistema di valutazione dell’apertura dell’angolo irido-corneale secondo Shaffer (4 gradi).
- Grado 4: angolo aperto (compreso tra 35 e 45 gradi)
- Grado 3: angolo aperto (compreso tra 20 e 35 gradi)
- Grado 2: angolo stretto (20 gradi)
- Grado 1: angolo molto stretto (10 gradi)
- Grado 0: angolo chiuso (0 gradi).
Di seguito spiegheremo brevemente alcune indagini strumentali
utili per formulare la diagnosi.
Misurazione della pressione intraoculare con
tonometro non a contatto ad aria
31
INDAGINI DIAGNOSTICHE NEL PAZIENTE
GLAUCOMATOSO
Per un corretto e moderno inquadramento diagnostico lo Specialista ha a sua disposizione diverse indagini cliniche a cui sottoporre il paziente con sospetto di patologia glaucomatosa. Alcune di
esse sono semplici e rapide, altre complesse e lunghe.
Lo studio del campo visivo: detto anche campimetria o perimetria, è importante sia per porre diagnosi di malattia che per
monitorarne l’andamento nel tempo. Oggi gli strumenti per l’esecuzione di questo tipi di esame (perimetri) sono sofisticati e assistiti da computer: è riconosciuto che la perimetria automatizzata
individua deficit campimetrici di tipo glaucomatoso ad uno stadio
più precoce di quella manuale.
Mentre valutare una papilla resta tuttora
molto soggettivo, l’automazione della perimetria ha reso disponibili diversi
procedimenti standardizzati d’interpretazione computerizzata.
Il computer di un perimetro automatizzato permette diverse elaborazioni e può
conservare in memoria i valori normali
per ogni punto testato nel campo visivo,
ponendoli anche in relazione all’età del
paziente. I programmi utilizzati consentono di misurare esattamente il grado di
sensibilità di ciascuno dei punti retinici
indagati. Ne risultano mappe numeriche
che permettono di confrontare esami
eseguiti in tempi diversi al fine di sorvegliare l’andamento della malattia.
La sua forma più utilizzata si chiama
perimetria statica, che consiste nella
presentazione al paziente di vari stimoli
Fig. 20. Perimetro statico compuluminosi, dotati di diversa grandezza e
terizzato.
32
intensità luminosa, posti su uno schermo omogeneamente illuminato; il paziente, dopo averli percepiti, deve segnalarli premendo
un pulsante (Fig. 20).
Tutte le risposte vengono traslate su un grafico come aree di differente intensità di grigio. Esse rappresentano così la mappa della corrispondente zona di retina stimolata dall’impulso luminoso.
Vale la pena sottolineare che questo esame richiede una buona
concentrazione e la collaborazione del paziente, che deve cercare di rispondere agli stimoli luminosi con grande attenzione. Una
certa quota di pazienti, modesta ma non trascurabile, necessita
di un adeguato addestramento, prima di essere in grado di praticare correttamente esami del campo visivo: proprio per questo
motivo molto spesso il primo esame eseguito non è considerato
estremamente attendibile.
Nel campo visivo normale di ciascun occhio esiste una sola zona
di non visione, zona detta macchia cieca, che corrisponde
alla papilla ottica, dove sono
presenti le fibre nervose e non
cellule sensibili alla luce. Normalmente questa piccola zona
cieca non viene percepita dal
soggetto (Fig.21).
Le alterazioni del campo visivo presenti nel glaucoma sono
dette scotomi. Per scotoma si
intende una zona del campo visivo, a limiti più o meno sfumati
e di forma varia, di non visione.
Rappresenta il danno funzionale delle fibre nervose retiniche.
Per capire cosa sia uno scotoma basta pensare a quando
guardiamo per alcuni secondi
una lampadina elettrica: per
qualche minuto percepiamo
una fastidiosa macchia scura centrale che ci ostacola la
visione. Questa è lo scotoma,
che però in questi casi è di duFig. 21. Campo visivo computerizzato norrata molto breve.
male.
33
Nel glaucoma gli scotomi si formano lentamente, nell’arco di diversi anni e soprattutto sono irreversibili. Nascono come piccole
aree periferiche intorno alla zona centrale di visione, successivamente e progressivamente si ingrandiscono e confluiscono fino
ad interessare nello stadio terminale di malattia anche la parte
centrale della vista e quindi tutto il campo visivo (Fig. 22A-B).
I difetti iniziali sono tipicamente di due tipi: difetti fascicolari e depressioni generalizzate del campo visivo (Fig. 23A-B-C-D).
Va precisato che possono essere già perse oltre il 40% del totale
delle fibre nervose, prima di evidenziare un’alterazione mediante
la perimetria di Goldmann. Quindi nel momento in cui noi possiamo porre con certezza la diagnosi di glaucoma in base ad un
esame del campo visivo convenzionale, un certo numero di fibre
nervose è già andato irreversibilmente perduto Pertanto negli ultimi anni sono emerse nuove e sofisticate indagini strumentali più
Fig. 22. A e B. Campo visivo computerizzato con alterazioni glaucomatose.
Nelle fasi iniziali della malattia gli scotomi si presentano nella parte centrale del
campo visivo; nel tempo essi, ingrandendosi e confluendo, interessano quasi
tutto il campo visivo del paziente.
34
A
B
C
D
Fig. 23. Difetti iniziali fascicolari del campo visivo nel paziente glaucomatoso:
a) “Salto” nasale; b) Deformazione della macchia cieca o scotoma di Seidel; c)
Scotoma paracentrale; d) Difetti arciformi: o scotoma di Bjerrum.
o meno recenti (che descriveremo più avanti) per consentire una
diagnosi più precoce in modo da poter iniziare il trattamento sin
dalle prime fasi della malattia.
Comunque per controllare l’andamento nel tempo della malattia
glaucomatosa la ripetizione periodica del campo visivo rappresenta ancora oggi il mezzo più efficace, pratico e sicuro. La cadenza della ripetizione di tale esame sarà scandita dal medico,
che prenderà in considerazione il caso dal singolo paziente (nei
casi di glaucoma conclamato e può essere necessario ripeterlo
anche ogni 3-4 mesi).
Dato che, come detto, un aspetto normale della papilla e un cam-
35
po visivo normale non devono necessariamente far escludere un
glaucoma, oggi esistono alcune altre indagini volte ad individuare
i primi danni da glaucoma.
Esame elettrofunzionali quali PEV (potenziali visivi evocati) e
PERG (elettroretinogramma a stimolazione pattern): lo studio
bioelettrico di PEV e del PERG è una metodica di relativamente recente introduzione, sofisticata, ancora in via di evoluzione e
soprattutto di codificazione. Non è ancora entrata ad oggi nella
routine degli esami necessari nel paziente affetto da glaucoma.
Entrambi questi esami si basano sul fatto che il danno alle fibre
nervose causa un rallentamento della trasmissione degli impulsi.
Misurano la risposta del nervo ottico a uno stimolo sensoriale a
differenti frequenze d’onda.
Senso cromatico: l’alterazione della visione dei colori è una conseguenza della riduzione dell’efficienza e del numero di fibre nervose funzionanti. Di solito si analizza con tavole dove numerosi pallini
di diverso colore formano figure o numeri. Si altera nelle fasi iniziali
del glaucoma. Il più frequente difetto indotto dal glaucoma riguarda la percezione dei colore blu e giallo. La perimetria blu-giallo ha
mostrato notevoli capacità nel rilevare alterazioni glaucomatose del
nervo ottico in soggetti ipertesi oculari, che avevano dato risposte
normali alla perimetria convenzionale “bianco su bianco”.
Sensibilità al contrasto: essa corrisponde alla differenza di luminosità tra toni chiari e scuri. Per la sua valutazione si usano
tavole o schermi a barre bianche e nere di differente contrasto o
più modernamente con gli ottotipi di Pelli-Robson. Questi ultimi
sono ottotipi a contrasto variabile, costituiti da triplette di lettere
che hanno tutte la stessa dimensione; ogni tripletta ha un contrasto costante e 16 livelli di contrasto decrescenti. Si altera nelle fasi
iniziali del glaucoma.
Misurazione dello spessore delle fibre: può essere eseguita con due metodiche:
Tomografia a coerenza ottica (OCT): dato che oltre alla papilla ottica, il glaucoma precocemente determina un’atrofia degli
assoni delle cellule ganglionari anche nello strato di fibre nervose
retiniche, l’esame OCT sta diventando sempre più diffuso per la
diagnosi di glaucoma grazie alla sua efficacia e precisione nella
misurazione dello spessore delle fibre nervose retiniche.
La polarimetria a scansione laser (GDX): metodica alternativa all’OCT per la misurazione dello spessore delle fibre nervose
retiniche.
36
TERAPIA
La terapia medica del glaucoma ha lo scopo di arrestare o di prevenire la sofferenza e il danno del nervo ottico ed il parallelo deterioramento del campo visivo. Al momento attuale ciò può essere
ottenuto, anche se non sempre, riducendo il valore della PIO a
valori “non dannosi” per l’occhio da trattare. Questi valori variano
individualmente e sono condizionati da una serie di parametri che
è necessario conoscere prima di iniziare il trattamento. Occorre
quindi stabilire per ogni paziente una ben definita strategia individuale, espressione delle sue condizioni cliniche.
La terapia del glaucoma prevede come primo stadio la terapia medica, vale a dire l’utilizzo di farmaci in grado di ridurre la IOP somministrati per via locale come colliri, gel o più raramente pomate.
Se la terapia medica non funziona o perde la sua efficacia nel
tempo si procede con la terapia parachirurgica che prevede l’utilizzo di laser. I tipi di laser utilizzati sono argon laser, Nd:Yag laser
e laser a diodo.
La terza opzione terapeutica è costituita dalla chirurgia, a cui si
ricorre quando la PIO non si riduce ai valori considerati normali o
il campo visivo peggiora nonostante le altre terapie.
Nel corso degli anni la terapia medica potrà essere eventualmente integrata con i vari trattamenti laser o anche con l’intervento
chirurgico.
In ogni caso le aree del campo visivo perse a causa dei danni
provocati al nervo ottico non possono essere recuperate con nessuna delle terapie: la terapia ha funzione esclusivamente conservativa o preventiva nei confronti di un ulteriore danno della visione
ed permette di evitare la progressione della malattia, che in casi
estremi può condurre alla cecità.
Richiamando alla nostra attenzione le 2 forme principali di glaucoma possiamo proporre questo semplice ed efficace schema:
• glaucoma cronico ad angolo aperto:
1. terapia medica
2. laser
3. chirurgia
37
• glaucoma ad angolo chiuso:
terapia laser o chirurgia + terapia medica.
Nella parte finale di questa pubblicazione verrà trattata un particolare tipo di glaucoma quello a pressione normale.
Terapia medica
Attualmente il medico oculista dispone di numerosi farmaci ipotensivi oculari per cui la scelta dovrà cadere su quella sostanza
che più si addice al caso in esame. Occorre iniziare il trattamento
con un solo farmaco, quello che consenta di raggiungere e mantenere il valore pressorio target per quel paziente e che nel contempo risulti ben tollerato dal paziente (età, lavoro del paziente,
altre patologie oculari o sistemiche, numero di somministrazioni
necessarie). Se un solo farmaco non è sufficiente, si possono associare tra loro diversi prodotti.
Il loro possibile meccanismo di azione può essere di:
• ridurre la produzione di umor acqueo
• facilitare il suo deflusso (trabecolare o uveo-sclerale)
• migliorare l’irrorazione del nervo ottico.
I farmaci utilizzabili sono diversi e vengono divisi per classe in
base al loro meccanismo di azione (Fig. 24):
• Beta-bloccanti: betaxololo, timololo, levobunololo (betaclar, betoptic, timoptol, timod, vistagan…). I beta-bloccanti, che riducono la produzione di umor acqueo, rappresentano da molti anni i
farmaci di prima scelta nel trattamento di varie forme di glaucoma,
in quanto efficaci e ben tollerati.
• Miotici: pilocarpina, pilotonina, aceclidina, dapiprazolo (pilogel,
dropil, glaunorm, glamidolo, pilodren). Aumentono il deflusso trabecolare. Farmaci molto efficaci, ma poco tollerati dal paziente,
specie se giovane, miope o affetto da cataratta incipiente. La loro
somministrazione è tuttavia opportuna quando altri farmaci non
sono sufficientemente efficaci e necessaria quando è presente o
temibile una chiusura d’angolo (blocco pupillare, iride a plateau).
• Inibitori topici dell’anidrasi carbonica: dorzolamide, brinzolamide
(trusopt, azopt). Riducono la produzione di umor acqueo.
• Simpaticomimetici: dipivefrina, apraclonidina, brimonidina (alphagan). Aumentano il deflusso trabecolare. Ben tollerati dal paziente, possono essere usati per integrare la terapia già in uso.
• Prostaglandinici: latanoprost, bimatoprost, xalatan, lumigan, travatan, saflutan, ocusynt, etc. Facilitano il deflusso uveo-sclera-
38
Fig. 24. Meccanismo di azione dei farmaci antiglaucomatosi.
le. Oggi per l’indubbia azione ipotensiva, la necessità di una sola
somministrazione quotidiana e la buona tollerabilità, possono essere considerati come farmaci di prima scelta specie quando i
beta-bloccanti trovano controindicazioni di carattere generale.
I farmaci antiglaucomatosi sono sotto forma di colliri o gel: i primi
sono di consistenza fluida, mentre i secondi sono più densi.
La corretta modalità per instillare i colliri nel sacco congiuntivale è
la seguente: dopo aver abbassato leggermente la palpebra inferiore ed aver reclinato il capo si mette una goccia di collirio o un
centimetro di gel (Fig. 25).
La frequenza di somministrazione varia a seconda del prodotto:
una (solo per le prostaglandine), due o tre volte al giorno, tutti i
giorni senza esclusione (sabato, domenica, festivi, viaggi, etc) per
tutta la vita. La terapia per il paziente glaucomatoso deve essere
assimilata ad una della sue abitudini quotidiane e diventare quindi
una cosa da non dimenticare mai. Pertanto il medico deve prendere la decisione di instaurare la terapia medica con molta pon-
39
derazione, perché ciò comporta
un impegno non indifferente per
il paziente.
Nel caso la terapia sia composta da più colliri, è buona norma
attendere 5 minuti tra le varie
somministrazioni al fine di favorire il corretto assorbimento
oculare di ciascun farmaco.
Anche i possibili effetti collaterali
variano da farmaco a farmaco.
Relativamente frequenti sono
Fig. 25. Instillazione di colliri per il glaucogli effetti temporanei legati alle
ma.
prime somministrazioni, come
bruciori e arrossamenti, attribuibili all’adattamento dell’occhio alle nuove sostanze: tali effetti
sono non preoccupanti e pertanto bisogna tollerarli. Rare sono
invece le allergie, che si risolvono alla sospensione del farmaco.
La categoria dei farmaci beta-bloccanti va evitata nei soggetti cardiopatici, asmatici e bronchitici perché il loro utilizzo può causare
un peggioramento di queste malattie.
I miotici, come la pilocarpina, restringendo la pupilla possono
determinare disturbi della visione, quali riduzione della luminosità
percepita e annebbiamento con riduzione della messa a fuoco
della durata di qualche ora. Talvolta si può verificare cefalea, men-
Terapia medica - farmaci ipotonizzanti
Farmaci che agiscono:
• aumentando il deflusso trabecolare
• aumentando il deflusso uveo-sclerale
• riducendo la produzione di umor acqueo
Farmaci che modificano il diametro della pupilla:
• midriatici (dilatano la pupilla), con possibile senso di abbagliamento come effetto collaterale
• miotici (restringono la pupilla), con possibili effetti collaterali
quali riduzione della luminosità e riduzione della messa a fuoco.
40
tre la cataratta può essere favorita nel suo sviluppo solo con l’uso
protratto per anni.
Oltre i farmaci per uso locale, esistono anche sostanze impegnate
per via generale, cioè orale e endovenosa.
Essi sono:
• Inibitori dell’anidrasi carbonica (via orale): acetazolamide, fenamide, glicofenamide (diamox, glaumid).
• Agenti iperosmolari (via endovenosa): glicerolo, mannitolo.
Vengono riservati a casi di glaucoma acuto o improvvisi ed elevati
aumenti della PIO.
Riguardo la capacità ipotensiva della terapia è corretto presumere
una diminuzione della PIO rispetto al valore di partenza di:
• circa il 25-30% in caso di monoterapia
• circa il 35% in caso di terapia associata
• circa il 40% in casi di massima terapia medica (associazioni farmacologiche multiple).
In particolare in caso di monoterapia topica, cioè l’utilizzo di un
solo collirio, l’effetto ipotensivo dei vari farmaci non è uguale per
tutti. Infatti ci possiamo aspettare una riduzione della IOP rispetto
al valore di partenza del:
• 30% per le prostaglandine
• 20-30% per i betaboccanti
• 20-25% per gli alfa-2 agonisti
• 20% per gli inibitori anidrasi carbonica
• 20% per i miotici.
Oggi diversi esperti sono convinti che esistono buoni motivi per
limitare l’utilizzo della massima terapia medica quali:
• aumento del rischio di irritazione oculare e di sensibilizzazione
• peggioramento della prognosi chirurgica, perché l’uso cronico dei
colliri ipotonizzanti può incrementare la cicatrizzazione postoperatoria e quindi provocare la chiusura della fistola creata dal chirurgo generando nuovamente nel periodo postoperatorio l’aumento
della PIO.
Pertanto oggi è opinione condivisa che associare due farmaci
appare ancora convincente; tuttavia, una chirurgia anticipata dovrebbe essere preferita ai concetti di massima terapia medica,
che includono anche fino a quattro farmaci diversi.
Vale la pena ricordare che occhi con ipertensione oculare non
necessariamente sviluppano danni glaucomatosi e talvolta possono essere tenuti sotto controllo per verificare la comparsa dei
41
primi segni di una neuropatia prima di prendere in considerazione
l’opportunità di trattare.
Ovviamente, si devono tenere in considerazione anche altri fattori
e indicatori di rischio. Alcuni di essi, ad esempio l’età o la familiarità possono influenzare la decisione di trattare mentre altri possono perfino determinare la scelta del tipo di trattamento.
Laser terapia
Il laser è una fonte di luce intensa e molto concentrata (Laser, Light Amplification by Stimulated Emission of Radiation).
Oltre a fornire la possibilità di eseguire alcune tecniche che una
volta potevano essere effettuate solo chirurgicamente, il laser permette la realizzazione di nuove e affidabili metodiche terapeutiche, non cruente e dotate di discreta efficacia nel controllo dei
glaucomi.
L’intervento laser si esegue ambulatorialmente, quindi senza la
necessità di ricovero.
Dopo aver instillato una goccia di anestetico che rende la procedura priva di dolore, il paziente si posiziona seduto e appoggiato
alla mentoniera (come per l’esame alla lampada a fessura). Previa
apposizione di un po’ di gel, si posiziona una lente a contatto
sull’occhio e si esegue il trattamento laser, che dura alcuni secondi o minuti a seconda del tipo di laser e del tipo di trattamento
pianificato (Fig. 26).
Infatti a seconda del tipo di glaucoma si eseguono trattamenti
diversi.
Il laser ad Argon ed altri laser termici vengono impiegati soprattutto per praticare la trabeculoplastica, indicata nelle forme
di glaucoma ad angolo aperto
e la gonioplastica di uso più
raro.
Nel glaucoma ad angolo aperto l’Argon Laser Trabeculoplastica (ALT), migliorando le
aperture sul trabecolato (trabeculoplastica), si propone di aumentare il deflusso dell’umor
acqueo dall’occhio (Fig. 27).
Fig. 26. Paziente glaucomatoso durante la Il raggio laser viene focalizlaserterapia.
zato sul tessuto da trattare
42
Fig. 27. Argon Laser Trabeculoplastica (ALT) e suoi effetti
sul trabecolato dell’angolo irido-corneale.
Fig. 28. La Trabeculoplastica
Selettiva (SLT) e suoi effetti
sul trabecolato dell’angolo irido-corneale.
Fig. 29. Differenza nell’effetto creato sul trabecolato tra ALT e SLT.
attraverso la lente. Vengono poi erogati
dalla macchina numerosi colpi, chiamati
spots, della durata ciascuno di frazioni di
secondo. Il trattamento nel suo complesso dura alcuni minuti. Raramente questi
brevi impulsi possono causare leggeri fastidi. Gli effetti collaterali e le complicanze
della procedura sono rari. Spesso si verificano un transitorio aumento della PIO
e una modesta infiammazione del bulbo,
che vengono curati con una terapia integrativa della PIO e con un collirio a base di
cortisone. Purtroppo spesso questo tipo
di trattamento ha una durata transitoria
(anche se può essere ripetuto) o non è in
grado di ridurre al PIO ad un valore tale
da consentire al paziente di sospendere
la terapia medica, motivi per cui è usata
poco frequentemente.
La Trabeculoplastica Selettiva (SLT, Selective Laser Trabeculoplasty), introdotta più
recentemente, viene utilizzata in pazienti
affetti da glaucoma cronico scompensato
con la terapia medica, anche se già sottoposti ad ALT o a chirurgia filtrante, nei pazienti intolleranti ai colliri, e presenta molti
vantaggi. Infatti, utilizzando un laser freddo
tipo Yag che emette energia a bassa lunghezza d’onda con impulsi a breve durata,
consente di trattare selettivamente solo la
zona di trabecolato non funzionante, può
essere ripetuto nel tempo ed è scevro delle complicanze tipiche (anche se rare) dei
trattamenti laser convenzionali come l’ALT
(Fig. 28-29). Il trattamento dura circa 10
minuti.
Nel glaucoma ad angolo chiuso il trattamento consiste in un’iridotomia periferica Yag laser, cioè si determina una nuova
via (piccolo foro) di passaggio costante
dell’umor acqueo attraverso l’iride perife-
43
rica per impedire il suo avanzamento e la conseguente chiusura
dell’angolo.
Generalmente si esegue un solo piccolo foro, talvolta due e raramente più di due fori sempre di piccole dimensioni nello spessore
dell’iride (Fig. 30).
Come si fa l’iridectomia
Al paziente vengono somministrati due diversi colliri, uno che
si propone di restringere la pupilla e un altro che anestetizza la
superficie anteriore dell’occhio.
Il paziente viene fatto sedere davanti al laser.
Il medico oculista applica sull’occhio una lente a contatto che
consente di meglio focalizzare il raggio laser sulla parte di iride
in cui eseguirà poi il foro.
A questo punto, il medico sceglie una sede iridea idonea, preferibilmente un punto periferico ove il tessuto irideo è sottile.
Esegue poi uno o due emissioni laser (spot).
Verifica che l’iride sia stata effettivamente perforata, poi, se necessario, esegue un altro foro in sede diversa, poi rimuove la
lente a contatto e prescrive al paziente una terapia medica che
dovrà essere somministrata per alcuni giorni.
Nel glaucoma acuto lo si esegue nell’occhio malato per evitare
che il rialzo pressorio si ripeta e anche nell’occhio controlaterale per prevenire l’insorgenza dell’attacco
acuto. Il trattamento dura poche decine di
secondi.
Nei glaucomi terminali (es. glaucoma neovascolare) si utilizza la ciclofotocoagulazione a diodi per distruggere i corpi ciliari
che producono umor acqueo (Fig. 31).
E’ una procedura che generalmente si esegue, in sala operatoria, anche se sempre in
regime ambulatoriale. Il chirurgo appoggia al
bulbo oculare una sonda collegata ad un laser a diodi ad onda continua che emette spot
che riducono la funzionalita dei corpi ciliari.
Fig. 30. Iridotomia periferica
Lo scopo del trattamento è di ridurre la
Yag laser con descrizione del
pressione per diminuire i ricorrenti e intennuovo passaggio dell’umor
sissimi dolori causati dall’elevatissima PIO.
acqueo attraverso il foro irideo.
44
Il problema di questa forma di trattamento è che risulta difficile calibrare
l’estensione del trattamento, cioè la
quantità di corpi ciliari da distruggere:
se poco esteso, la riduzione pressoria
risulta insufficiente, mentre se troppo
estesa, l’occhio va incontro a riduzione
pressoria eccessiva.
In conclusione va ricordato che spesso, anche dopo trattamento laser, la
terapia
farmacologica con colliri va
Fig. 31. Ciclofotocoagulazione a
proseguita: ciò non significa che il tratdiodi.
tamento è stato inutile perchè il laser
consente frequentemente di raggiungere valori pressori inferiori a
quelli presenti prima del trattamento laser. Questo aspetto contribuisce ad un migliore controllo della malattia nel tempo.
Chirurgia
La chirurgia del glaucoma comprende una serie di interventi di microchirurgia, ossia interventi che non si eseguono ad occhio nudo
ma con l’ausilio di un microscopio operatorio per avere notevoli
ingrandimenti delle finissime strutture oculari.
L’intervento si esegue generalmente in anestesia locale, tranne
nei bambini per i quali si pratica l’anestesia generale. L’anestesia,
qualunque sia, permette di portare a termine l’intervento senza
alcun dolore per il paziente.
Anestesia per l’intervento chirurgico
Per effettuare l’anestesia locale, il paziente viene steso su un
lettino operatorio e il medico inietta il farmaco anestetico intorno
all’occhio per ottenere l’analgesia (assenza di dolore) e l’acinesia dell’occhio (assenza di movimento). Di solito l’iniezione viene
preceduta dalla somministrazione di un tranquillante per via generale al fine di ridurre l’eventuale stato di tensione del paziente
(Fig. 32). Un sottile ago viene fatto penetrare attraverso la palpebra inferiore e/o superiore. Quindi viene iniettato l’anestetico
nello spazio che si trova intorno (anestesia peribulbare) o dietro il
bulbo oculare (anestesia retrobulbare): nell’anestesia retrobulbare si inietta solitamente un volume da 3 a 10 millilitri di anestetico
locale a contatto del ganglio ciliare.
45
Subito dopo l’iniezione, il chirurgo esercita un delicato massaggio sul globo oculare, manovra che favorisce la diffusione
dell’anestetico. La PIO aumenta immediatamente dopo l’iniezione per tornare a normalizzarsi in qualche minuto. L’occhio
viene posto sotto una pressione di 30 mmHg per alcuni minuti
utilizzando un pallone precalibrato o un semplice peso compressivo. L’occhio a questo punto risulta privo di sensibilità dolorosa e di capacità di movimento, pertanto è idoneo all’esecuzione dell’intervento chirurgico.
Negli ultimi anni questo tipo di interventi viene sempre più frequentemente eseguito in regime di Day-hospital, ovvero il paziente torna a casa lo stesso giorno dell’intervento.
La microchirurgia e il laser si “aiutano” a vicenda, nel senso che
alcuni insuccessi dell’intervento possono essere risolti con il laser
e, viceversa, alcuni insuccessi della laserterapia possono essere
risolti con la chirurgia. Entrambe possono essere ripetute, se necessario.
Dopo entrambi questi trattamenti spesso la terapia medica va
proseguita.
Oggi l’esperienza dei chirurghi in questo specifico settore è notevolmente aumentata, così come sono migliorate la qualità dei
microscopi operatori e le tecniche chirurgiche; pertanto i risultati
sono eccellenti con minime complicanze post-operatorie.
Come detto in precedenza, l’intervento chirurgico viene eseguito
quando la PIO non si riduce ai valori
considerati normali o il campo visivo
peggiora nonostante le altre terapie
oppure in situazioni in cui sarebbe
necessario ottenere un risultato duraturo e stabile.
Il paziente deve rendersi conto prima di sottoporsi all’intervento chirurgico (così come alla laserterapia), che lo scopo non è purtroppo
quello di aumentare la vista, a differenza di altri interventi come quello
Fig. 32. Anestesia locale in un paziente di cataratta, bensì quello di non far
peggiorare la malattia.
operando di trabeulectomia.
46
Lo scopo viene raggiunto quando si riduce la PIO, cosa che si ottiene aumentando il deflusso di liquido dall’interno
all’esterno dell’occhio.
Gli interventi sono diversi a seconda del
tipo di glaucoma.
Nel glaucoma acuto si può eseguire
chirurgicamente la rimozione di un pezzetto di iride periferica (iridectomia) (Fig.
33).
In realtà questa procedura viene effettuata più frequentemente con il laser (iridotomia).
Fig. 33. Iridectomia basale chirurPiù spesso la chirurgia si pratica nel
gica nel glaucoma acuto.
glaucoma cronico ad angolo aperto, in
cui l’ostacolo al deflusso dell’umor acqueo sta nei canali del trabecolato. L’intervento più comune si
chiama trabeculectomia o intervento fistolizzante che consente il diretto passaggio dell’umor acqueo all’esterno, sotto la
congiuntiva al di sotto della palpebra superiore, dove viene facilmente riassorbito. In particolare il chirurgo rimuove un piccolo
tassello di trabecolato, creando cioè una fistola (vale a dire un
forame), attraverso cui il liquido intraoculare passa al di sotto della
congiuntiva dove si forma una “bozza” leggermene rilevata, che
garantirà costante drenaggio (Fig. 34,35).
Questa piccola bozza non è visibile se non alzando con un dito la
palpebra superiore e talvolta può essere responsabile di qualche
disturbo, quali la sensazione di corpo estraneo nell’occhio e lacrimazione (Fig. 36).
Per aumentare le probabilità di successo negli ultimi anni si è diffuso l’utilizzo durante l’intervento di trabeculectomia di sostanze
antimitotiche (mitomicina C o 5-fluorouracile) che hanno lo scopo
di ridurre nel periodo postoperatorio la probabilità di chiusura della fistola praticata dal chirurgo.
Questo tipo di interventi può comportare delle complicanze, che
in realtà sono relativamente rare (insuccesso, appiattimento della
bozza, ipotonia, infezioni, infiammazioni, cataratta).
Esistono molti altri tipi di intervento che vengono definiti non-fistolizzanti, il più recente ed efficace dei quali si chiama canaloplastica, che però al momento attuale non garantiscono le stesse
probabilità di successo.
47
A
B
C
Fig. 34. A,B,C. Intervento di trabeculectomia nel glaucoma cronico: il chirurgo
rimuove un piccolo tassello di trabecolato creando un forame attraverso cui il
liquido intraoculare passa al di sotto della congiuntiva.
Questo tipo di interventi (detti anche non-perforanti) si propone di
ottenere una riduzione della pressione interna del bulbo attraverso una parete che viene chirurgicamente assottigliata a tal punto
da permettere una vera e propria filtrazione del liquido interno:
l’umore acqueo drena dalla camera anteriore attraverso uno strato della cornea (la membrana di Descemet) e gli strati interni del
trabecolato. Gli interventi che si basano su questi principi sono
la sclerectomia profonda, la viscocanalostomia e la più recente
canaloplatica.
La Canaloplastica rappresenta inoltre la tecnica più interessante.
Si esegue un piccola incisione per avere accesso al che si trova
intorno all’iride (canale di Schelmn). Un microcatetere circumnaviga il canale di Schlemm, allargando il canale principale di drenaggio e i suoi canali piu’ piccoli di raccolta, mediante l’iniezione
di un materiale sterile, simile ad un gel, chiamato viscoelastico. Il
catetere viene quindi rimosso e viene applicata una sutura all’interno del canale, che viene così tensionato. Aprendo il canale, si
riduce la pressione all’interno dell’occhio.
Tutte la tecniche non-perforanti, seppur gravate da un minor numero di complicanze, risultano però meno efficaci nel ridurre la
pressione oculare rispetto alla trabeculectomia classica. A loro
favore c’è sicuramente il fatto che, in caso di PIO postoperatoria
non sufficientemente ben controllata, non precludono la possibilità di eseguire successivamente una trabeculectomia.
Va ricordato inoltre che esistono anche gli impianti drenanti antiglaucomatosi (per es. Molteno, Baelverdt, Krupin, Ahmed) che
sono tradizionalmente indicati nei glaucomi refrattari in cui le pro-
48
Fig. 35. Meccanismo di filtrazione del
liquido intraoculare nell’intervento di
trabeculaectomia: il liquido passa al
di sotto della congiuntiva dove si forma una “bozza”.
Fig. 36. La piccola bozza della trabeculectomia è visibile solo se si alza
con un dito la palpebra superiore.
cedure filtranti spesso non funzionano o non hanno funzionato.
Esistono inoltre altri tipi di intervento, come il criotrattamento
per distruggere dei corpi ciliari che producono umor acqueo. Il
razionale del trattamento è lo stesso della ciclofotocoagulazione
a diodi, a differenza della quale è molto meno dosabile: infatti il
problema di questa forma di trattamento è che risulta difficile calibrare l’estensione del trattamento, cioè la quantità di corpi ciliari
da distruggere: se poco esteso, la riduzione pressoria risulta insufficiente, mentre se troppo esteso, l’occhio può andare incontro a riduzione pressoria eccessiva ed irreversibile (tisi del bulbo).
Pertanto oggi viene eseguito raramente.
Nel prossimo futuro si prospettano nuovi interventi chirurgici o
chirurgie combinate a trattamenti laser nuovi o già esistenti che
probabilmente aumenteranno le possibilità di controllo della malattia
Sia gli interventi filtranti (trabeculectomia) che i non filtranti possono essere associati a quello di cataratta (chirurgia combinata), che
consiste nell’opacizzazione del cristallino.
La chirurgia combinata di glaucoma e cataratta sta diventando
49
sempre più frequente perché quest’ultima è spesso già presente
se il paziente è anziano, ma anche perché i farmaci miotici antiglaucomatosi (come la pilocarpina) o precedenti interventi antiglaucomatosi possono accelerare lo sviluppo della cataratta.
L’indicazione all’intervento non viene posta sempre in un paziente
affetto da cataratta e glaucoma, ma solo in particolari condizioni. Infatti possiamo proporre un semplice schema per la gestione
della terapia del paziente affetto da cataratta e glaucoma.
1. Se il glaucoma è ben controllato dalla terapia medica con cataratta che riduce la capacità visiva, è necessario eseguire solo
l’intervento di cataratta (che consiste nella rimozione del cristallino
opaco con un tecnica detta facoemulsificazione e nella sua sostituzione con un cristallino artificiale).
2. Se il glaucoma non è ben compensato dalla terapia medica con
cataratta che ostacola poco la visione, si esegue prima l’intervento per il glaucoma e dopo qualche mese l’intervento di cataratta.
3. Se il glaucoma non è ben compensato e la cataratta condiziona la visione, è opportuno l’intervento combinato di cataratta e
glaucoma.
50
DECORSO POSTOPERATORIO DEL PAZIENTE
CHIRURGICO E ISTRUZIONI PRATICHE
Come detto la maggior parte degli interventi per il glaucoma si
esegue in anestesia locale e in regime di Day-hospital, cioè il paziente viene dimesso in giornata, anche se per la guarigione completa dall’intervento di solito occorre almeno un mese - un mese
e mezzo, periodo in cui vanno eseguite alcune cure e rispettate
alcune attenzioni.
Spesso l’occhio viene bendato fino al primo controllo postoperatorio che si effettua il giorno successivo, momento in cui viene
sbendato e visitato dal medico, che successivamente prescrive la
terapia postoperatoria che il paziente deve effettuare.
Sono normali alcuni sintomi nei giorni immediatamente successivi
all’intervento, quali rossore oculare, modesta dolenzia, sensazione di corpo estraneo (dovuta al taglio eseguito e ai punti applicati),
prurito e un po’ di fotofobia (fastidio alla luce), motivo per cui è
buona norma usare occhiali scuri. Pertanto il paziente che avverte
questi fastidi non deve preoccuparsi.
Inoltre la visione dell’occhio operato non è limpida durante i primi
giorni dopo l’intervento; è necessario far trascorrere alcuni giorni
perché la situazione migliori. Lo smaltimento completo (guarigione) del trauma chirurgico avviene in 1-2 mesi e dipende dal tipo
di intervento.
Il medico prescrive una ricetta con le indicazioni per le medicine da utilizzare. La somministrazione del collirio o della pomata
oftalmica va iniziata nell’occhio operato subito dopo la dimissione
e deve protrarsi per tutto il periodo suggerito dal chirurgo. Talvolta vengono prescritte anche pastiglie o iniezioni, che egualmente
devono essere iniziate subito dopo la dimissione, in associazione
all’eventuale terapia che il paziente sta già assumendo e che non
deve mai sospendere di propria iniziativa.
Il paziente deve comprendere che la corretta assunzione delle
medicine prescritte è fondamentale per la completa guarigione e
per evitare complicazioni.
51
Le raccomandazioni per i primi
giorni successivi l’operazione riguardano principalmente il modo
di somministrare il collirio o la pomata e spesso conviene dare una
dimostrazione diretta al paziente:
lavarsi prima le mani, non toccare
le ciglia, non premere sull’occhio,
agitare prima il flaconcino, applicare il collirio o la pomata solo
nell’occhio operato.
Per applicare la terapia (colliri o pomate) nell’occhio operato è
bene che il paziente stia seduto (o anche sdraiato a letto), aprire
entrambi gli occhi e guardare verso l’alto. Un familiare con una
mano abbassa leggermente la palpebra inferiore del paziente
in modo da esporre il fornice congiuntivale, di colorito roseo,
senza esercitare pressioni sull’occhio: in tal modo si crea una
coppa in grado di accogliere il farmaco. Si somministra qualche
goccia di collirio o un centimetro di pomata oftalmica.
In caso siano prescritti più colliri, è buona norma attendere
qualche minuto tra le varie somministrazioni al fine di favorire il
corretto assorbimento oculare di ciascun farmaco.
Se il paziente lo desidera, può effettuare una delicata quotidiana
pulizia delle palpebre dell’occhio operato una o due volte al giorno
con una salviettina sterile umida o bollita. Non c’è alcun problema
nel lavarsi il viso, prestando sempre attenzione a non esercitare
pressioni o a far entrare del sapone nell’occhio.
Non sempre è necessario bendare l’occhio dopo la dimissione,
anche se per i primi 2-3 giorni la benda può essere utile in caso
i punti applicati sull’occhio determinassero un fastidio eccessivo:
infatti i punti di sutura possono determinare talvolta delle piccole
lesioni da strofinamento che si formano durante i continui fisiologici movimenti di apertura e chiusura delle palpebre (ammiccamento). I punti di sutura applicati durante l’intervento vanno quasi
sempre rimossi; il paziente deve stare tranquillo perché la manovra è ambulatoriale e indolore.
Utile è l’eventuale assunzione di comuni farmaci antidolorifici se
dovesse insorgere dolore all’occhio o alla testa.
52
Sono da evitare gli sforzi fisici intensi, come prendere in braccio
un bambino, sollevare pesi superiore a 10 chili, etc, per evitare
il rischio di emorragie legato ad un eccessivo afflusso di sangue
nella regione oculare. Per lo stesso motivo deve evitare di piegarsi
per raccogliere oggetti a terra e calzare le scarpe solo aver appoggiato il piede su una sedia.
Altre attività possono invece essere intraprese da subito con l’occhio non operato, come leggere, guardare la televisione, passeggiare, radersi, farsi il bagno (proteggendo l’occhio operato con
una garza); mentre per la doccia e i lavaggio dei capelli è opportuno attendere 2-3 giorni, prestando attenzione ad evitare il contatto del sapone o lo shampoo con l’occhio da poco operato. Il phon
per asciugare i capelli non va diretto verso l’occhio.
Le raccomandazioni riguardano anche la posizione durante il sonno. Per i primi giorni il paziente deve dormire semiduto o almeno
con tre cuscini per impedire un eccessivo afflusso di sangue nella
regione oculare con rischio di emorragie.
Sempre per i primi giorni durante la notte è opportuno proteggere
l’occhio con una conchiglia copriocchio di plastica trasparente,
che in genere viene fornita alla dimissione: la sua utilità consiste
nel proteggere l’occhio da poco operato da inavvertiti traumi o
strofinamenti possibili durante il sonno. Comunque non deve dormire mai dalla parte dell’occhio operato senza protezione o con il
viso rivolto verso il cuscino per almeno un mese.
Nei primi giorni successivi all’intervento, l’utilizzo di un paio di occhiali scuri è utile per riparare l’occhio dalla luce, dall’aria, dalla
polvere e soprattutto da eventuali traumi: vanno tenuti durante
tutta la giornata; nei giorni successivi, gli occhiali possono anche
essere chiari, in totale vanno portati per due settimane circa.
E’ consigliato aspettare un paio di settimane prima di riprendere
le attività che maggiormente possono creare problemi all’occhio
operato (nuoto, sforzi fisici eccessivi, palestra, lavarsi in ambienti
polverosi e malsani).
Per riprendere un lavoro di ufficio o le normali attività bastano 6-7
giorni.
Il paziente deve essere comunque messo in grado di poter telefonare alla struttura dove ha subito l’intervento, trovando un medico disponibile ad occuparsi di eventuali problemi (persistenza
o accentuazione dei sintomi, etc), risolvere dubbi sulla terapia o
sull’andamento del decorso postoperatorio.
53
In conclusione il paziente, dopo aver eseguito correttamente la
terapia e seguito tutte le raccomandazioni suggerite per il conseguimento della guarigione, viene periodicamente sottoposto a
visite oculistiche di controllo; le visite sono necessarie nei mesi e
negli anni successivi all’intervento, sono ravvicinate subito dopo
l’intervento per poi essere progressivamente diradate nel tempo.
Il verificarsi di problemi è raro e nella maggior parte dei casi sono
facilmente risolvibili se diagnosticati in tempo.
54
IL GLAUCOMA A PRESSIONE NORMALE
Esiste anche questa particolare forma caratterizzata da un glaucoma primario ad angolo aperto, con PIO completamente normale e senza riscontri anamnestici di precedenti malattie oculari.
Questi pazienti quindi presentano alterazioni del campo visivo di
tipo glaucomatoso spesso in presenza però di valori di PIO assolutamente normali.
L’Oculista talvolta si trova in difficoltà quando deve spiegare per
la prima volta al paziente di che malattia si tratti, proprio perchè
descrive una malattia da ipertensione oculare (glaucoma), ma in
assenza di ipertensione oculare.
Riguardo le manifestazioni oculari, va precisato che l’aspetto della
papilla ottica ed i difetti del campo visivo possono essere sovrapponibili a quelli del glaucoma a tensione elevata.
Tuttavia vi sono alcune differenze con il glaucoma a tensione elevata, molte delle quali sono di carattere sistemico:
• i pazienti con glaucoma a pressione normale sono, mediamente,
più anziani di una decina d’anni
• i soggetti di sesso femminile sono affetti in proporzione doppia
rispetto a quelli di sesso maschile
• la papilla ottica ha più probabilità di evidenziare delle intaccature o
depressioni localizzate sul bordo (dette incisure) e delle emorragie
• il campo visivo ha maggiori probabilità di evidenziare difetti in vicinanza del punto centrale di fissazione
• i pazienti affetti possono evidenziare una probabilità superiore alla
media di essere affetti da patologie di carattere sistemico quali
vasospasmi periferici, come fenomeni di Raynaud o emicrania,
ipotensione notturna o insufficienza carotidea.
• non è raro evidenziare patologie autoimmuni.
Benché molti pazienti rimangano con la stessa PIO per molti anni,
circa l’8% mostra una tendenza verso valori più elevati, tramutandosi quindi i un classico glaucoma ad alta pressione e ad angolo
aperto.
Per la patogenesi di questa particolare forma di glaucoma sono
55
state formulate tre principali ipotesi. Alcuni autori pensano che la
componente vascolare sia importante : in particolare si ritiene che
la pressione di perfusione e quindi il nutrimento ematico della testa del nervo ottico sia insufficiente (ipotesi vascolare) e pertanto
essa viene considerata la responsabile del danno al nervo ottico.
Altri autori ritengono che la PIO sia “troppo elevata per questo
tipo di occhi”, in quanto il nervo ottico sarebbe meno capace di
sopportare anche una PIO compresa nei valori normali (ipotesi
meccanica).
Recentemente però è stata proposta anche anche un’altra ipotesi
patogenetica, quella immunitaria, secondo la quale questo tipo di
glaucoma costituisce una malattia autoimmunitaria del sistema
nervoso, cioè condotta dal sistema di difesa del soggetto contro
se stesso e innescata per ragioni ancora non ben chiarite (ipotesi
immunitaria).
Il trattamento farmacologico va prescritto in caso di progressione
della malattia e si basa su 2 aspetti:
1. Riduzione della PIO. Una riduzione del 25-30% dà la maggior
probabilità di rallentare la progressione; questo può essere ottenuto con una terapia medica.
2. Riduzione delle alterazioni circolatorie della testa del nervo ottico attraverso la terapia della malattia sistemica di base, qualora
presenti (vasospasmi, ipotensione notturna, insufficienza carotidea).
Allo stato delle nostre conoscenze, una riduzione della PIO di circa il 25%, l’abolizione di un vasospasmo e la correzione di un calo
pressorio notturno indotto da terapia ipotensiva sistemica, danno
le migliori garanzie per quei pazienti affetti da glaucoma a pressione normale che presentano un deterioramento progressivo delle
funzioni visive.
56
DOMANDE E RISPOSTE
Che cos’è il glaucoma?
Il glaucoma è una malattia cronica grave malattia dell’occhio. E’
così grave da essere la prima causa di cecità assoluta ed irreversibile al mondo. Comporta un danno del nervo ottico (il nervo che
porta la vista dall’occhio al cervello) causato da una pressione
interna dell’occhio troppo alta.
Ma il glaucoma non è un tumore dell’occhio?
No. Il glaucoma non è un tumore dell’occhio, ma è una malattia
che danneggia il nervo ottico causato da una pressione interna
dell’occhio più alta di quello che l’occhio normalmente riesce a
sopportare.
Mio padre è affetto da glaucoma, mi devo preoccupare?
Si. Si deve preoccupare in quanto Lei ha una probabilità maggiore
rispetto alle altre persone di sviluppare il glaucoma nel corso della
sua vita. E’ pertanto necessario che faccia delle visite periodiche
dall’oculista per valutare se ha la malattia e se sono presenti dei
fattori di rischio per poterla sviluppare. Dopo i 45 anni dovrebbe
iniziare a fare una visita all’anno.
Sono affetto da glaucoma. I miei figli devono essere visitati?
Tutti i familiari di persone affette da glaucoma devono fare una
visita oculistica.
Per sapere se ho il glaucoma, cosa devo fare?
L’unico modo è quello di sottoporsi ad una visita oculistica.
La mia vista è ottima e non ho mai avuto dolori agli occhi.
Posso avere il glaucoma?
Si, perché la forma più frequente di glaucoma (ad angolo aperto) non determina alcun disturbo e, soprattutto nelle fasi iniziali e
57
intermedie, non procura una riduzione della vista. Il paziente ha
molto male solo nella forma molto più rara di glaucoma ad angolo
stretto durante l’attacco acuto.
Il glaucoma può causare la cecità?
Si, sfortunatamente il glaucoma è una grave malattia che, se non
trattata adeguatamente, porta ad una progressiva perdita della
vista. Però se la diagnosi è posta tempestivamente e le prescrizioni mediche sono seguite scrupolosamente, non vi è motivo di
temere di perdere la vista.
Il glaucoma viene a tutte le età?
Il glaucoma può venire a tutte le età. E’ tuttavia più frequente nelle
persone anziane.
C’è qualcosa nella dieta o nel mio modo di vivere che può
farmi venire il glaucoma?
No. La dieta ed il modo di vivere non hanno nessuna correlazione
con lo sviluppo di glaucoma.
Ci sono alimenti controindicati con il glaucoma?
Se assunti in quantità moderata, non esistono alimenti dannosi
per il paziente affetto da glaucoma.
L’uso del videoterminale può determinare il glaucoma?
No, non esiste relazione tra l’utilizzo del videoterminale e il rischio
di insorgenza di glaucoma.
Il fumo di sigaretta può far sviluppare o peggiorare il glaucoma?
Il fumo danneggia i vasi sanguigni riducendo la quantità di ossigeno che arriva ai tessuti. Chi presenta già problemi di circolazione,
come diabete o ipertensione arteriosa, fumando accelera l’evoluzione negativa di queste patologie. E anche per il glaucoma vale
lo stesso principio.
Se ho la pressione sanguigna alta, ho anche la pressione
oculare alta?
No, sono due cose totalmente diverse: infatti non esiste una correlazione clinicamente significativa tra pressione sistemica e pressione dell’occhio.
58
Solo in caso di pressione arteriosa molto bassa, questa può peggiorare il glaucoma, perché viene ridotto il flusso di sangue necessario per nutrire il nervo ottico.
Ho la pressione dell’occhio normale, ciò significa che posso stare tranquillo perché non ho il glaucoma?
No, purtroppo la sola misurazione della pressione non è utile per
fare diagnosi di glaucoma. In particolar modo, avere la pressione
oculare «normale» non esclude la possibilità che di essere malati
di glaucoma. Infatti esiste, anche se non è molto frequente, la
possibilità di avere il glaucoma con valori di pressione «normali».
Gli esami da eseguire prima della visita quali sono e a che
servono?
Gli esami necessari per poter correttamente inquadrare la sua malattia sono vari e non invasivi. Sono il campo visivo, la tomografia
a coerenza ottica ed eventualmente altri esami che il suo Oculista
riterrà utili per il suo caso. Tutti questi esami vanno ad affiancare
molti altri aspetti clinici che lo Specialista rileva durante la visita.
Mi hanno fatto la diagnosi di glaucoma, quanto mi devo
preoccupare?
No, perché oggi si sono nuovi farmaci, nuovi interventi e nuovi
trattamenti laser che sono più efficaci rispetto a quelli del passato. Tuttavia è sempre necessario assumere la terapia tutti i giorni
e sottoporsi a controlli periodici, la cui scadenza è in rapporto ai
fattori di rischio soggettivi.
Come si cura il glaucoma?
Il glaucoma è una patologia cronica, che può essere trattata soprattutto con colliri che vanno messi tutti i giorni. Comunque dal
glaucoma non si può guarire. Per cui una volta iniziata la terapia,
questa continua per sempre. È però possibile tenerlo sotto controllo con una terapia adeguata che ha lo scopo di abbassare la
pressione dell’occhio ed arrestare l’evoluzione della malattia.
Quando è necessario l’intervento chirurgico nel glaucoma?
Il paziente con glaucoma va sottoposto ad intervento quando le
normali terapie mediche o il trattamento parachirurgico con il laser
non risultano efficaci nel ridurre efficacemente la pressione oculare o quando il campo visivo peggiora.
59
Dopo aver eseguito un trattamento laser, devo mettere ancora le gocce che metto ora?
Molto spesso si, perché il trattamento laser serve per migliorare
l’efficacia della terapia medica in atto, non per sostituirla.
Ma il glaucoma si cura solo con colliri o ci si può operare?
Si, si può operare. Ci sono diversi tipi di interventi. La necessità
dell’intervento deve essere valutata dal proprio oculista. Lo scopo
dell’intervento tuttavia è solo di ridurre la pressione dell’occhio
(come le gocce ed i laser) senza nessun vantaggio o recupero
visivo.
L’eventuale intervento chirurgico è risolutivo, cioè il suo effetto dura per sempre?
L’intervento è un mezzo per arrestare la progressione della malattia. Ma, a seconda del tipo di glaucoma e della sua tendenza a
progredire, esso può non essere sufficiente, vale a dire che può
essere necessario continuare la terapia medica e talvolta anche
ripetere l’intervento.
Le lenti a contatto sono pericolose per il paziente in terapia
medica per il glaucoma?
Le lenti a contatto, se usate correttamente, non causano peggioramento della malattia.
Dopo l’intervento chirurgico, posso usare nuovamente le
lenti a contatto?
Nel caso di interventi laser o di chirurgia dell’iride non esistono
controindicazioni. Solo dopo l’intervento di trabeculectomia fistolizzante (o interventi simili) può essere difficoltoso usare le lenti a
contatto a causa della “bozza congiuntivale”, che si forma sotto
la palpebra superiore.
Per quanto tempo il paziente con glaucoma deve mettere
le gocce che riducono la pressione oculare?
Le gocce vanno messe per sempre, tutti i giorni e con costanza,
rispettando orari prestabiliti. Questo perché le sostanze contenute nei colliri hanno efficacia solo solo per un determinato numero
di ore. Se non si istillano le gocce, la pressione oculare si alza
determinando danno al nervo ottico.
60
La terapia in collirio per il glaucoma ha efficacia per sempre?
L’azione terapeutica di molti farmaci nel tempo può notevolmente
ridursi per fenomeni di assuefazione, cioè di adattamento dell’organismo al farmaco. In questi casi è indispensabile cambiare sostanza per riottenere il giusto effetto sulla malattia.
Con che frequenza occorre fare visite di controllo?
Le visite di controllo, a seconda dello stadio e della gravità della
malattia, vanno effettuate tra i 4 e i 6 mesi.
Sono affetto da glaucoma, sono in terapia con le gocce e la
pressione oculare è 21. Va bene?
Non è possibile dare una risposta assoluta a questa domanda,
perché ogni occhio ha una sua pressione ideale che dipende da
tanti fattori. Pertanto l’Oculista può dare una risposta adeguata al
singolo caso.
È vero che l’intervento di trabeculectomia è rischioso e che
e’preferibile eseguire altri interventi piu innovativi?
L’intervento di trabeculectomia in mani esperte fornisce ottimi risultati con una bassa percentuale di complicanze. Recentemente
sono stati proposti interventi chiamati “non perforanti” che comportano meno complicanze, ma sembrano essere meno efficaci
nel ridurre la pressione oculare.
Per fare l’intervento per il glaucoma mi devo ricoverare?
No, oggi tutti gli interventi antiaucomatosi possono essere eseguiti in anestesia locale e senza necessità di degenza.
Io ho il glaucoma e la cataratta. Posso operarli insieme?
Si, tecnicamente è possibile operare nello stesso tempo la cataratta e il glaucoma. Sarà compito del chirurgo valutare l’opportunità di eseguire l’intervento combinato nel suo specifico caso.
61
INTERVENTO IN DAY SURGERY
Il Day Surgery del Centro Ambrosiano Oftalmico è nato e quindi organizzato ed attrezzato per eseguire la chirurgia dell’occhio
senza ricovero notturno; il paziente si reca al Centro il mattino
dell’operazione, riceve la necessaria preparazione, viene operato
e poi va a casa a fine mattina o nel pomeriggio.
Quasi tutti gli interventi sull’occhio non richiedono ricovero in
quanto sono interventi che riguardano un piccolo organo quasi indipendente dal resto dell’organismo; inoltre sono interventi
che non alterano le condizioni fisiche generali del paziente anche
perché sono di breve durata e spesso non richiedono anestesie
profonde.
L’intervento avviene con l’assistenza di un anestesista e
l’ambiente è dotato degli strumenti necessari ad assistere il paziente sia durante che dopo l’intervento; inoltre la sala operatoria è attrezzata con le più recenti apparecchiature per la
moderna chirurgia oftalmica.
Premesso che le attuali tecniche chirurgiche sono già per conto
loro più sicure e più precise di quelle utilizzate fino a pochi anni
or sono, la chirurgia oftalmica eseguita in day surgery presenta,
rispetto a quella eseguita in ospedale, parecchi vantaggi:
• la sala chirurgica e le sale complementari (sale d’attesa, sala postoperatoria) sono attrezzate per le specifiche esigenze dell’oculista e del paziente oftalmico;
• il paziente viene assistito da personale specificamente educato e
preparato alla chirurgia oftalmica; esso quindi ha una competenza
specialistica maggiore e si occupa meglio del paziente;
• l’utilizzazione sempre dello stesso personale permette di ottenere
una sua migliore conoscenza e familiarità con le strumentazioni e
quindi un miglior uso delle stesse;
• il paziente evita il ricovero, elemento questo che comporta sempre una certa ansia e preoccupazione (a nessuno piace andare in
ospedale... anche perché spesso proprio in ospedale si prendono
delle malattie...);
62
• il paziente può essere mobilizzato subito, può cioè alzarsi, camminare etc;
• il paziente può avere la compagnia e l’assistenza dei suoi familiari
per cui egli si trova in un’atmosfera rilassante prima e dopo l’intervento; ciò riduce il suo stato di ansia e di tensione per cui egli
affronta con maggior tranquillità l’operazione con indubbi effetti
positivi sul risultato finale; tutto ciò permette anche di utilizzare
una minor quantità di farmaci sedativi ed anestetici. Dopo l’operazione il paziente viene trattenuto al centro per una mezz’ora
circa e poi, dopo un adeguato controllo sanitario, se abita vicino
alla struttura chirurgica, viene inviato a casa (accompagnato da
un familiare); egli quindi può contare sull’assistenza di un parente
o di un amico e sul proprio ambiente domestico evitando così
la fredda ed impersonale struttura ospedaliera. A casa non è richiesta una particolare assistenza generale, solo la compagnia di
qualcuno. Se invece abita lontano (a più di un’ora e mezza dalla
struttura chirurgica) è bene che rimanga a dormire per la prima
notte in un albergo nelle vicinanze dell’ambulatorio chirurgico.
Dopo l’intervento il paziente viene trattenuto per il tempo necessario e dopo un adeguato controllo da parte del chirurgo, viene
dimesso
63
SERVIZIO URGENZE
In orario di ufficio (10.00-12.15/13.15-18.30) chiamare lo studio
di Piazza Repubblica 21 al numero 02-6361191 e comunicare il
motivo dell’urgenza. Solo per i pazienti operati degli ultimi tre
giorni e solo in caso di vera necessità esiste un servizio di
reperibilità; esso è operante negli orari di chiusura dell’ufficio (se possibile, evitare le chiamate notturne).
Chiamare il numero telefonico indicato nel foglio di terapia che
viene dato alla dimissione; è il numero di un telefono cellulare, in
caso di difficoltà ripetere la chiamata o inviare un sms o lasciare il
messaggio in segreteria telefonica dicendo chiaramente e lentamente nome e cognome e numero di telefono (ripetere due volte
il numero telefonico).
Per appuntamenti, informazioni o esigenze di normale amministrazione, chiamare in giorni feriali ed in orario di ufficio lo studio
di Piazza Repubblica 21, preferibilmente al mattino, al seguente
numero: 02-6361191.
64
GLOSSARIO
• Afachia: è l’occhio privo di cristallino
• Anestesia: procedura per cui si rende indolore l’intervento; può essere topica (a base di gocce), locale (con iniezione) o generale.
• Astigmatismo: è un difetto di rifrazione dovuto ad una curvatura ovoidale
della cornea; comporta affaticamento visivo, mal di testa e visione
ridotta.
• Cataratta: opacità del cristallino umano
• Chirurgia rifrattiva: ogni tipo di intervento che si propone di correggere
un difetto di rifrazione (miopia, astigmatismo, ipermetropia, ecc.).
• Cheratocono: malattia della cornea; essa si assottiglia progressivamente,
subisce cambiamenti di forma e ciò induce un calo progressivo
della vista.
• Cornea: struttura trasparente situata nella parte anteriore dell’occhio; serve
a concentrare la luce sulla retina. Sulla cornea vengono eseguiti
la maggior parte dei trattamenti laser per la correzione dei difetti
rifrattivi.
• Cristallino umano: lente situata nella porzione interna dell’occhio, dietro
al foro pupillare; serve a focalizzare la luce sulla retina (se diventa
opaca, si ha la cataratta).
• Cristallino artificiale: è una piccola lente, costituita da materiale sintetico
trasparente; serve a correggere una miopia elevata o a rimpiazzare il cristallino umano quando questo viene rimosso.
• Crosslinking: terapia non chirurgica del cheratocono; se eseguito precocemente è in grado di arrestare la malattia.
• Decimi di vista: unità convenzionale di misura per valutare quantitativamente l’acuità visiva di un soggetto; non ha corrispondenza con
le diottrie che il paziente usa sull’occhiale o sulla lente a contatto.
Una persona ha dieci decimi quando può leggere le lettere più
piccole che vengono mostrate durante la visita oculistica; ha 5/10
o 1/10 solo quando legge i caratteri di media grandezza o solo
quelli più grandi.
• Degenerazione Maculare Legata all’Età (DMLE): alterazione della
macula, la parte centrale e più importante della retina; la maculopatia è tipica dell’anziano e riduce la capacità di vedere bene.
65
• Diottria: è l’unità di potere rifrattivo; tanto più un difetto di rifrazione è forte
tanto più elevato sarà il numero di diottrie; tante più sono le diottrie tanto più spesso è l’occhiale e tanto più esso è necessario.
Tante più sono le diottrie del difetto tanto meno il paziente vede
senza la correzione.
• Emmetropia: condizione per la quale un occhio è privo di difetti di rifrazione.
• Errore o difetto di rifrazione: è una anomalia dell’occhio per cui occorre
una lente affinché l’occhio veda correttamente (miopia, astigmatismo, ipermetropia).
• Facoemulsificazione: tecnica di facoemuslficazione per rimuovere la cataratta: con questa metodica la cataratta viene frammentata dentro
l’occhio attraverso una piccola incisione (2,0-2,5 mm circa) e poi
aspirata con un sistema di lavaggio ed aspirazione.
• Glaucoma: è una malattia caratterizzata dalla progressiva riduzione della vista e del campo visivo causata dall’aumento della pressione
interna dell’occhio che avviene per accumulo di umore acqueo.
• ICL: Intraocular Contact Lens ossia lente a contatto intraoculare; in realtà
è un cristallino artificiale che serve a correggere elevati difetti di
miopia ed ipermetropia.
• Ipermetropia: difetto di rifrazione per cui l’occhio vede male a distanza
ravvicinata e meglio per lontano.
• Iniezioni intravitreali: consistono nella iniezione dentro l’occhio di farmaci
per curare la DMLE (Degenerazione Maculare Legata all’Età) e
altre malattie.
• Laser ad eccimeri: moderni strumenti in grado di emettere precisi fasci di
luce che consentono la correzione di difetti visivi.
• Laser a femtosecondi: è un laser che emette raggi di luce in tempi incredibilmente veloci (miliardesimi di secondo) e dotato di notevole
energia. Utilizzato in modo adeguato si comporta come un bisturi
di luce.
• LASIK: intervento e laser per la correzione della miopia lieve, media ed
elevata; viene utilizzata anche per l’astigmatismo e l’ipermetropia.
• Lente a contatto: sottile disco di materiale plastico che viene applicato
sulla parte anteriore dell’occhio cioè sulla cornea per correggere alcuni difetti di rifrazione (miopia, astigmatismo, ipermetropia,
afachia).
• Lente intraoculare: è stessa cosa di un cristallino artificiale.
• Macula: la parte centrale e più importante della retina; è la parte utilizzata
per leggere, scrivere, lavorare al computer, vedere la televisione,
guidare. Se la macula si ammala (DMLE Degenerazione Maculare
Legata all’Età) la vista ne subisce serie conseguenze.
66
• Miopia: difetto di rifrazione per cui un occhio vede bene per vicino e male
per lontano.
• Oculista: medico specializzato nella cura delle malattie dell’occhio; fra gli
oculisti meno del 10% eseguono chirurgia rifrattiva.
• Ottico: è un artigiano diplomato che ha il compito di eseguire l’occhiale prescritto dal medico oculista e di consigliare lenti che correggono
semplici difetti visivi.
• Optometrista: è un diplomato abilitato a prescrivere lenti per la correzione
dei difetti di vista e ad applicare lenti a contatto; l’optometrista
non può prescrivere medicine, curare malattie, fare operazioni.
• Peeling: intervento chirurgico con vitrectomia che serve per la cura della
DMLE (Degenerazione Maculare Legata all’Età)
• PIO: Pressione Intra Oculare
• Presbiopia: anomalia per cui un occhio non riesce ad “accomodare”, non
riesce cioè a mettere a fuoco a distanza ravvicinata; richiede occhiali per ogni attività svolta nel raggio di 20-50 centimetri o meno.
• PRK: consiste nella disintegrazione mediante laser ad eccimeri di uno strato
sottilissimo di cornea anteriore; si utilizza prevalentemente per la
correzione delle miope lievi e medie, ma anche per l’ipermetropia
e l’astigmatismo lieve
• Retina: membrana che avvolge l’occhio all’interno; la sua integrità e funzionalità è fondamentale per una vista ottimale
• Trapianto di cornea: intervento chirurgico che consiste nella sostituzione
di una porzione di cornea malata con un eguale porzione di cornea sana di donatore proveniente da una Banca della Cornea.
Esistono vari tipi di trapianto: perforante, lamellare, anteriore, posteriore, ecc.
• Visus o acuità visiva: capacità dell’occhio a vedere; un occhio che vede
bene ha 10/10 di visus (cioè il 100 per 100 di vista) un occhio che
vede poco ha 1-2/10 cioè il 10-20% della visione totale; la minore
o maggiore acuità visiva dipende in generale dalle condizioni di
salute dell’occhio.
• Visione da vicino: quando una persona guarda qualcosa situata ad una distanza inferiore ai 50 cm circa dal suo occhio si dice che utilizza la visione
per vicino; è in pratica la visione che serve per leggere, scrivere, ecc.
• Visione da lontano: quando una persona guarda qualcosa situata a 3 metri
od oltre si dice che usa la visione per lontano; è in pratica la visione
che serve per vedere la televisione, per guidare la macchina ecc.
Si usa invece la visione intermedia quando si guarda fra i 50 cm
ed i 3 metri.
67
P R I N C I PA L I AT T I V I T À D E L
C E N T R O A M B R O S I A N O O F TA L M I C O
Chirurgia:
• Cataratta
• Miopia
• Astigmatismo
• Ipermetropia
• Presbiopia
• Glaucoma
• Chirurgia del vitreo e della retina
• Iniezioni intravitreali
• Chirurgia palpebrale
• Trapianti di cornea
Laser:
• Miopia, laser ad eccimeri
• Cataratta: laser a femtosecondi
• Opacità secondaria: laser yag
• Malattie della retina: laser argon
• Glaucoma: laser yag e argon
• Crosslinking per cheratocono
Diagnostica:
• Aberrometria computerizzata
• Autorefrattometria computerizzata
• Biometria
• Ecografia
• Fluorangiografia
• OCT del segmento anteriore e posteriore
• Ortottica
• Perimetria computerizzata
• Pachimetria ultrasonica
• Topografia corneale
• Tonometria ad aria
68
DAY SURGERY
DI MICROCHIRURGIA OCULARE
È un centro attrezzato per eseguire la chirurgia dell’occhio senza
ricovero ed in piena sicurezza.
I pregi in questa modalità chirurgica sono:
• assenza di ricovero
• ambienti specificatamente studiati per la chirurgia oculare
• elevata professionalità
• assistenza personalizzata
• massima sicurezza
Nel Day Surgery di Microchirurgia Oculare sono eseguibili, fra gli
altri, interventi chirurgici per:
• cataratta
• glaucoma
• miopia
• astigmatismo
• ipermetropia
• presbiopia
• chirurgia della retina
• vitrectomia
• iniezioni intravitreali
• trapianti di cornea
• cheratocono
• chirurgia palpebrale
• ed altri
Com’è il Day Surgery della CAMO?
Il Day Surgery è un insieme di ambienti progettati appositamente
per la chirurgia oculare e dotati dei più moderni e sicuri sistemi di
assistenza per il paziente:
69
• ha tre modernissime sale chirurgiche realizzate ed attrezzate appositamente per la chirurgia dell’occhio
• ha una sala laser dotata dei più recenti ritrovati della tecnologia laser
• ha attrezzature per anestesia locale e generale;
• dispone di personale altamente specializzato fra cui un medico
anestesista.
E’ costruito secondo i più avanzati sistemi di sicurezza per il paziente; dispone fra l’altro di:
• impianto elettrico ad alta sicurezza dotato di alimentazione autonoma di emergenza
• aria condizionata sterile
• gas di emergenza
• impianto autonomo di sterilizzazione
• pavimenti e tappezzerie antistatici e antipolvere.
E’ dotato dei più moderni e sofisticati strumenti per chirurgia oculare; dispone fra l’altro di:
• due laser a femtosecondi
• un laser ad eccimeri
• due microscopi operatori
• quattro facoemulsificatori
• un vitrectomo
• due microcheratomi
• tanti altri strumenti necessari per la microchirurgia oculare
L’ambulatorio è stato ispezionato ed approvato dai competenti
Organi Sanitari di Controllo.
70
Biografia di Lucio Buratto
Nella chirurgia oculare il Dr. Buratto si occupa della correzione laser e chirurgica di miopia, astigmatismo e ipermetropia così come
del trattamento chirurgico della cataratta. In ambedue i settori ha
ricevuto numerosi riconoscimenti a livello internazionale.
Il Dr. Buratto ha iniziato la sua professione di chirurgo “rifrattivo”
nel 1989 quando, primo a livello mondiale, ha iniziato a utilizzare
il laser ad eccimeri all’interno della cornea per la correzione della
miopia.
Fino ad oggi ha eseguito parecchie migliaia di interventi di miopia,
astigmatismo ed ipermetropia ed ha acquisito una esperienza ed
una competenza unica in Italia.
Per le sue ricerche e per i suoi risultati nel campo della miopia ha
conseguito numerosi premi e riconoscimenti internazionali:
– Al congresso internazionale di San Diego (California) il primo
premio per la miglior nuova tecnica chirurgica con laser ad eccimeri.
– Al congresso di Barcellona il premio per le sue ricerche ed innovazioni apportate nel campo della chirurgia della miopia.
– Al congresso internazionale dell’American Academy of Opthalmology di New Orleans è stato nominato “Chirurgo Rifrattivo
dell’Anno”
– È stato insignito dalla Società Oftalmologia Italiana del riconoscimento di “Maestro dell’Oftalmologia Italiana”.
– Al congresso Europeo di Nizza della Società Europea di Chirurgia della Cataratta e Rifrattiva ha ricevuto il riconoscimento
“Pioniere in Chirurgia Rifrattiva”.
– Al congresso della Società Inglese UKISCRS per i suoi studi nella Lasik è stato insignito della medaglia d’oro “Peter
Choyce”.
– Al congresso Internazionale di Dallas dell’American Academy
of Ophthalmology ha ricevuto il massimo riconoscimento internazionale per un chirurgo rifrattivo, il premio “Barraquer” per le
71
sue ricerche ed innovazioni sulla chirurgia refrativa con laser.
– Al XXII congresso Europeo dell’ESCRS (European Society of
Cataract and Refractive Surgery) a Parigi, per i suoi studi sulla chirurgia della cataratta e chirurgia rifrattiva, ha ricevuto la
“Binkhorst Medal”.
– Al congresso Annuale dell’HSIOIRS ad Atene per i suoi studi
sulla chirurgia rifrattiva ha ricevuto il premio “Fyodorov”.
Ogni anno organizza a Milano il più importante congresso italiano
della chirurgia refrattiva e della cataratta con la partecipazione dei
più famosi chirurghi internazionali.
È stato fondatore e Presidente della Associazione Italiana di Chirurgia della Cataratta e Rifrattiva.
Ha diretto 55 corsi di aggiornamento sulla chirurgia della cataratta e della miopia ed ha tenuto 70 corsi per l’insegnamento della
chirurgia oculare.
A tutt’oggi ha pubblicato 11 trattati dedicati alla correzione laser
o chirurgica della miopia.
Il trattato di chirurgia “LASIK Principles and Techniques” è stato il
best seller internazionale;
il trattato “Lasik Surgical Techniques and Complications” è stato
tradotto in tre lingue diverse.
Nel 2013 ha pubblicato una serie di 5 trattati sulla moderna chirurgia della cataratta; i 5 trattati sono stati anche pubblicati in lingua inglese dalla principale casa editrice mondiale in oftalmologia.
1) Introduzione alla chirurgia della cataratta
2) Tecniche di faco e femtofacoemulsificazione in chirurgia della
cataratta
3) IOL in chirurgia della cataratta
4) Casi complicati in chirurgia della cataratta
5) Complicanze in chirurgia della cataratta
72
Biografia di Luigi Caretti
Il Dr. Luigi Caretti è un chirurgo del segmento anteriore e del segmento posteriore.
Si è laureato in Medicina e Chirurgia presso la Seconda Università
di Napoli, ha conseguito presso l’Università di Padova il diploma di
specializzazione in Oftalmologia. Dal gennaio 2003 lavora presso
l’UOC di Oculistica (ora Centro Oculistico San Paolo) dell’Ospedale Sant’Antonio dell’ULSS n° 16 di Padova, dove ricopre l’incarico di dirigente medico di 1° livello dall’ottobre 2006. Attualmente
è direttore dell’U.O.S di Chirurgia Vitreo-Retinica dell’Ospedale
Sant’Antonio di Padova.
Ha ampia esperienza in chirurgia segmento anteriore, posteriore
e degli annessi oculari (più di 7000 interventi eseguiti come primo
operatore).
E’membro di diverse società scientifiche nazionali ed internazionali.
Ha pubblicato 12 lavori scientifici inerenti all’oculistica su riviste
nazionali ed estere, di cui 5 su riviste indicizzate.
Nel 2013 ha pubblicato di una monografia in lingua inglese intitolata “Cataract Surgery in Complicated Cases” assieme al Dott.
Buratto e al Dott. Brint e una monografia in lingua italiana intitolata “Chirurgia della cataratta nei casi complicati” insieme al Dott.
Buratto.
73
Note
74
Note
a cura di
Mi opero di
Lucio Buratto
CATARATTA
a cura di
Mi opero di
MIOPIA FORTE
CAMO
CAMO
MI OPERO DI
CENTRO AMBROSIANO OFTALMICO
a cura di
Mi opero di
CENTRO AMBROSIANO OFTALMICO
a cura di Claudio
Macaluso
Lucio Buratto
Lucio Buratto
Miopia
astigMatisMo
iperMetropia
Mi opero di
CORNEA
CAMO
CAMO
CENTRO AMBROSIANO OFTALMICO
CENTRO AMBROSIANO OFTALMICO
a cura di Lucio
Buratto
Luigi Caretti
Mi opero di
GlAuCOmA
a cura di Matteo
Cereda
Lucio Buratto
Mi opero di
RETINA
CAMO
CAMO
CENTRO AMBROSIANO OFTALMICO
a cura di
Mi opero di
Lucio Buratto
PREsbIOPIA
Lucio Buratto
CENTRO AMBROSIANO OFTALMICO
a cura di
Lucio Buratto
OCCHIO
E NUTRIZIONE
Speciale
CAMO
CENTRO AMBROSIANO OFTALMICO
CAMO
CENTRO AMBROSIANO OFTALMICO
76
Indirizzo dello Studio Oculistico
presso cui visita
il Dr. Lucio Buratto:
Centro
Ambrosiano
Oftalmico
Piazza della Repubblica, 21
20124 Milano
Contatti:
Telefono: 02.6361191
Fax: 02.6598875
Sito internet: www.camospa.it
Email: [email protected]
La struttura è specializzata
nella chirurgia dell’occhio;
in particolare nel trattamento
delle seguenti patologie:
• Cataratta • Miopia
• Ipermetropia • Astigmatismo
• Presbiopia • Glaucoma
• Cheratocono
• Retina • Cornea
CAMO
CENTRO AMBROSIANO OFTALMICO