Giuliano Pinna CASO CLINICO SAPORE DI SALE Roberta Buso* Imma Ambrosino** * ULSS2 Marca Trevigiana
Ospedale Cà Foncello di Treviso
Dipartimento di Medicina Interna
[email protected]
**Specialista ambulatoriale branca
Geriatria ASL Lecce - DSS Maglie n.57
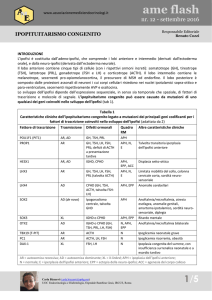
imma-­‐[email protected] PRIMO ACCESSO AL DEA Presentiamo il caso di una donna di 73 anni che si recava in PS perché da circa due settimane era comparsa astenia ingravescente e, nei giorni precedenti l’accesso, aveva presentato plurime scariche diarroiche (circa 3-­‐4 al dì) in assenza di nausea e vomito. Non era presente febbre o sintomatologia dolorosa di accompagnamento. Dal punto di vista anamnestico la paziente era casalinga e conduceva vita attiva. Nel 2001 aveva subito un intervento per cataratta occhio destro; nel gennaio 2012 era stata sottoposta ad intervento di isterectomia per neoplasia endometriale e il successivo follow-­‐up oncologico era risultato negativo per ripresa di malattia. Dalla menopausa aveva sofferto di ripetuti episodi di calore/flushing responsivi alla terapia ormonale sostitutiva che tuttavia aveva sospeso da circa 10 anni. Infine la paziente era in terapia con Rosuvastatina 20 mg per la presenza di ipercolesterolemia nota da circa 5 anni. All’arrivo in PS la paziente si presentava astenica, senza reperti obiettivi patologici ma con il riscontro bioumorale di una iponatriemia ipotonica (Na 127 mEq/l; osmolarità plasmatica calcolata 265,2 mOsm/kg H2O). La paziente veniva trattenuta in osservazione intensiva breve dove con infusione di soluzione fisiologica si otteneva la normalizzazione del sodio (Na 136 mEq/l). Veniva dimessa con diagnosi di “Iposodiemia in corso di gastroenterite”. 1 Dal punto di vista fisiopatologico infatti l’iponatriemia ipotonica poteva essere spiegata dal fatto che le perdite gastrointestinali dovute alla presenza di diarrea avevano provocato una riduzione del sodio totale lasciando invariata l’acqua corporea. SECONDO ACCESSO IN DEA Tuttavia pochi giorni dopo la dimissione la paziente accedeva nuovamente in PS per persistenza di scariche diarroiche associate ad astenia ingravescente, iporessia e conati di vomito. Agli esami bioumorali si riscontrava nuovamente la presenza di iponatriemia severa ipotonica Na 118 mEq/l; osmolarità plasamatica 243 mOsm/kg per cui la paziente veniva ricoverata in Medicina Interna. PRIMO RICOVERO IN MEDICINA INTERNA Durante la degenza il sodio veniva corretto con soluzione fisiologica e la paziente veniva sottoposta ad accertamenti di primo livello (Rx torace, ECG, ecografia addominale e TAC cerebrale senza MdC) che risultavano nei limiti di norma. In considerazione del decorso favorevole la paziente veniva dimessa con diagnosi di “Iponatriemia in corso di gastroenterite a lenta risoluzione”. Si decideva però di proseguire gli accertamenti programmando in regime di post-­‐ricovero TAC torace addome con MdC (per escludere una iponatriemia a genesi paraneoplastica da ripresa della pregressa neoplasia endometriale) e screening endocrinologico. SECONDO RICOVERO IN MEDICINA INTERNA Pochi giorni dopo la dimissione la sintomatologia di malessere generale e astenia si presentava nuovamente. Inoltre comparivano cefalea intensa e vomito per cui la paziente tornava in PS dove veniva riscontrata la presenza di iponatriemia ipotonica (Na 131 mEq/l; osmolarità plasmatica 268 mOsm/Kg). La paziente veniva ricoverata presso la Medicina Interna dove eseguiva degli accertamenti più approfonditi per inquadrare meglio la problematica (Fig 1). Infatti l’ipotesi di una iponatriemia ipotonica da gastroenterite appariva sempre meno probabile visto il decorso clinico poco favorevole. Si decideva quindi di dosare l’osmolarità urinaria che risultava superiore a 100 mOsm/kg (733 mOsm/Kg) indicando quindi la presenza di una ridotta capacità di eliminare H2O libera da parte dell’organismo. Inoltre la sodiuiria spot era > 20 mmol/l (52 mmol/l) per cui ci si orientava verso una ridotta capacità renale di eliminare H2O libera. Tali condizioni sono tipiche di insufficienza renale cronica, inappropriata secrezione di ADH (SIADH da farmaci, traumi, neoplasia) e deficit di glucocorticoidi. La prima ipotesi veniva subito scartata poiché la paziente presentava dei valori normali di creatinina (creatinina 0,87 mg/dL). Per vagliare le altre due ipotesi si inviava lo screening endocrinologico che risultava nei limiti. In particolare: ACTH 14.8 pg/mL (vn 0.0 -­‐ 46.0); Cortisolemia ore 8.00: 10 mcg/dL (v.n. 5-­‐23); Cortisolemia ore 16.00: 7 mcg/dl (v.n. 3-­‐13); Cortisolo 2 libero urinario 52 mcg/24h (vn 40.0 -­‐ 158.0); TSH 0.79 mlU/L (vn 0.35 -­‐ 4.60); Cromogranina 63 ng/mL; Acido 5-­‐idrossi indolacetico/24h 2.7 ng/24h. La paziente veniva inoltre sottoposta a TAC toraco-­‐addominale con MdC senza evidenza di recidiva della malattia neoplastica. Durante la degenza con l’infusione di soluzione fisiologica il quadro clinico migliorava e la natremia si normalizzava per cui la paziente veniva dimessa con diagnosi di “iponatriemia in corso di accertamento”. In regime di post ricovero veniva programmata una rivalutazione endocrincologica per pianificare eventuali ulteriori approfondimenti diagnostici in regime ambulatoriale. TERZO RICOVERO IN MEDICINA INTERNA Pochi giorni dalla dimissione la paziente presentava un episodio presincopale e veniva accompagnata in PS dove agli esami si riscontrava di nuovo la presenza di iponatriemia severa (Na 119 mEq/l). Ricoverata in Medicina Interna si ripeteva lo screening endocrinologico prima di iniziare la correzione del sodio. Durante la prima notte di degenza la paziente accusava comparsa di intenso malessere associato a ipotensione (PA 90/50 mmHg), ipoglicemia (48 mg/dl) e peggioramento della sodiemia (Na 112 mEq/l) suggestivi per crisi addisoniana. Trattata con Idrocortisone e.v. 100 mg, con infusione di soluzione glucosata al 5% e soluzione fisiologica si assisteva alla regressione della sintomatologia. Nei giorni seguenti giungevano gli esiti delle misurazioni di cortisolo a.m e p.m. che risultava < 1.00 microg/dl, l’ACTH a.m. e p.m era < 5.00 pg/ml e le raccolte di CLU 24 h risultavano non calcolabili configurando un quadro di insufficienza cortico-­‐surrenalica secondaria. Il rimanente screening endocrinologico risultava normale: TSH 0.24 nIU/l; FT3 2.42 pg/ml; FT4 1.02 ng/dl; GH 0.8 ng/mL (v.n. 0.0 -­‐ 5.0); IGF-­‐1 57 ng/mL (v.n. 91 – 220); LH 5.6 mU/mL (v.n. 7.7 -­‐ 58.5); FSH 14.4 mU/mL (v.n. 25.8 -­‐ 134.8); Prolattina 55.4 ng/ml; Macroprolattina 45.6%. DIAGNOSI FINALE Nel sospetto di insufficienza cortico-­‐surrenalica secondaria veniva eseguita RMN cerebrale con MdC con studio mirato all’ipofisi con riscontro di macroadenoma ipofisario di circa 2 cm (Fig 2). L’esame campimetrico non mostrava deficit significativi del visus (Fig 3). La paziente veniva quindi avviata a valutazione chirurgica per asportazione del macroadenoma. Dopo l’intervento veniva iniziata terapia sostitutiva inizialmente con Idrocortisone e dopo qualche giorno con Levotiroxina. L’esame istologico è risultato diagnostico per cisti di Ratke. COMMENTO IPOPITUITARISMO L’ipopituitarismo è una sindrome clinica caratterizzata da una totale o parziale perdita della secrezione degli ormoni da parte della ghiandola ipofisaria 1,2, in particolare dell’adenoipofisi con il deficit in primis dell’ormone della crescita (GH), seguito dal deficit delle gonadotropine (ormone luteinizzante -­‐ LH -­‐ e ormone follicolostimolante – FSH), poi dell’ormone tireostimolante (TSH) e 3 adrenocorticotropo (ACTH) o viceversa e infine della prolattina3 e della neuroipofisi con il deficit di ossitocina (o ormone antidiuretico – ADH) che è più frequente nell’ipopituitarismo secondario1 . Il tasso di incidenza (da 12 a 42 nuovi pazienti per milione per anno) e il tasso di prevalenza (da 300 a 455 pazienti per milione) risultano essere sottostimati, infatti l’attuale incidenza di questo disordine è compresa tra il 30 % e il 70% dei pazienti con danno cerebrale che presentano i sintomi clinici di una ridotta o assente secrezione degli ormoni ipofisari4. A seconda delle cause scatenanti possiamo distinguere: un ipopituitarismo primario che è dovuto a un disordine della ghiandola ipofisaria o a un danno o disfunzione delle cellule secernenti dell’ipofisi e un ipopituitarismo secondario che è legato a un danno a carico dell’ipotalamo o delle connessione vascolari e/o nervose dell’asse ipotalamo/ipofisi1. Tra le cause più frequenti dell’ipopituitarismo primario si annoverano i tumori intrasellari e parasellari, in particolare l’adenoma ipofisario e le complicanze di trattamenti chirurgici e/o radioterapici delle neoplasie cerebrali5. Il diametro dell’adenoma ipofisario solitamente è di circa 1 cm o più ampio e i sintomi dell’ipopituitarismo si instaurano nell’arco di alcune ore o pochi giorni quando si verifica l’apoplessia ipofisaria 5. La cisti del Rathke (RCC), che è stata riscontrata all’esame istologico della nostra paziente, è una lesione benigna della regione sellare e parasellare che deriva dall’epitelio rimanente della tasca del Rathke6. Ha un picco di incidenza tra i 30 e i 50 anni, risulta essere molto frequente come mostrato da uno studio autoptico7 che ha evidenziato la presenza di RCC nella regione sellare nel 22% dei campioni, tuttavia tale lesione rimane spesso misconosciuta in quanto asintomatica nella maggior parte dei pazienti6. La maggior parte delle RCC ha un diametro compreso tra 10 e 20 mm e un contenuto prevalentemente mucoide o gelatinoso6 e alla Risonanza magnetica nucleare (RMN) appaiono, nella maggior parte dei casi, come delle lesioni rotondeggianti della regione sellare iperintense nelle sequenze T2 pesate e ipointense nelle immagini T18. L’intervento chirurgico per via transfenoidale è il trattamento di scelta6, anche se un case report relativo all’ insufficienza corticosurrenalica acuta secondaria a RCC ha mostrato che la terapia con Idrocortisone per via ev ad alte dosi non soltanto corregge i sintomi, ma determina anche una riduzione delle dimensioni della RCC9. Per quanto concerne l’ipopituitarismo secondario il danno a livello dell’asse ipotalamo/ipofisi può essere causato da una frattura delle ossa del cranio e/o del naso5 o da tumori parasellari che possono determinare effetti compressivi sull’asse ipotalamo-­‐ipofisi o anche da trattamenti chirurgici e/o radioterapici1. La patologia sottostante, l’età di insorgenza, la velocità e il grado del deficit secretivo hanno un impatto significativo sulle manifestazioni cliniche5. Nell’adulto il deficit del GH, che nella maggior parte dei casi si manifesta precocemente essendo le cellule somatotrope particolarmente sensibili alle pressioni3, si manifesta con: riduzione della massa e della forza muscolare, fatica, astenia generalizzata, obesità, aumento del grasso viscerale, dislipidemia, osteopenia, aterosclerosi precoce e riduzione della contrattilità miocardica10. Il successivo deficit che si instaura è quello delle gonadotropine FSH e LH che negli uomini si manifesta con riduzione della libido, impotenza e riduzione della massa ossea e muscolare e 4 nelle donne con amenorrea, oligomenorrea, infertilità, riduzione della libido, dispareunia a breve termine, osteoporosi e aterosclerosi precoce a lungo termine11,12. Per quanto riguarda il deficit del TSH i sintomi clinici sono simili a quelli associati all’ipotiroidismo primario13, ossia: stanchezza, intolleranza al freddo, stipsi, aumento di peso, perdita dei capelli, bradicardia, raucedine e rallentamento ideativo 5. Il deficit di ACTH ossia l’insufficienza cortico-­‐surrenalica secondaria (SAI) è differente dall’insufficienza cortico-­‐surrenalica primaria (PAI) o Malattia di Addison in quanto nel primo caso una vera e propria crisi addisoniana è molto rara poiché la secrezione di aldosterone dipende solo in minima parte dalla ghiandola ipofisaria14. Sebbene sia possibile che la secrezione di aldosterone possa essere ridotta in caso di deficit di ACTH, tuttavia la restante secrezione di aldosterone che viene regolata dal sistema renina-­‐angiotensina-­‐aldosterone è sufficiente a mantenere un normale volume plasmatico e una normale pressione14; inoltre non si verifica iperpigmentazione e iperkaliemia, mentre si assiste alla comparsa di iponatriemia che è dovuto ad un’aumentata produzione di ormone antidiuretico (ADH) secondario al ridotto volume circolante e ad un aumentato riassorbimento di acqua a livello dei tubuli renali prossimali per effetto della ridotta quota di filtrazione glomerulare; ancora il ridotto feed-­‐back negativo sulla secrezione di CRH da parte dell’ACTH ha come effetto anche un aumentato rilascio di ADH che è co-­‐secreto dagli stessi neuroni del nucleo paraventricolare dell’ipotalamo (Figura 4). L’unico sintomo clinico del deficit di prolattina è l’impossibilità di allattamento, mentre i sintomi principali del deficit di ADH sono poliuria, polidipsia e nicturia12. La diagnosi dell’ipopituitarismo si ottiene dosando i livelli basali degli ormoni secreti dalle ghiandole bersaglio e dall’ipofisi che sono rispettivamente IGF-­‐1e GH; estradiolo, progesterone, testosterone, FSH e LH; cortisolo, aldosterone e ACTH; FT3,FT4 e TSH; prolattina; ADH. La misurazione dei livelli basali degli ormoni è sufficiente per differenziare l’ipopituitarismo dal deficit secretivo primario delle ghiandole target. Si assiste ad un incremento degli ormoni ipofisari quando il deficit è a carico degli organi bersaglio, mentre il mancato incremento dei livelli degli ormoni ipofisari insieme ad una riduzione degli ormoni secreti dalle ghiandole bersaglio si osserva in caso di danno ipofisario o ipotalamico11 (Tabella 1). Talvolta può essere necessario un test di stimolazione per differenziare se il danno è a carico della ghiandola bersaglio, ipofisario o ipotalamico. Nel caso del deficit di ACTH, come nel nostro caso clinico, può essere difficile ottenere una diagnosi definita con il solo dosaggio basale del cortisolo e dell’ACTH. Poiché il cortisolo ha un ritmo circadiano con un picco al mattino, esso viene dosato tra le 8:00 e le 9:00 am11,15. Se il cortisolo è molto basso (< 3 a 4 µg/dL) siamo di fronte ad un’insufficienza cortico-­‐surrenalica (AI), se, al contrario, è molto alto (> 15 a 16 µg/dL) si può escludere un AI; in entrambi i casi non sono necessari test di stimolazione. Nel caso in cui il valore del cortisolo è compreso tra 4 e 10 µg/dL oppure tra 10 e 15 µg/dL, come nella nostra paziente in cui il valore di cortisolo è pari a 10 µg/dL, può essere diagnostico un test di stimolazione (Figura 1). Nella pratica clinica si utilizza il test all’ACTH qualora il rischio di ipoglicemia severa sia elevato11. Diversi studi hanno riportato che il test all’ACTH a basse dosi (1 µg) è più sensibile del test all’ACTH convenzionale alla dose di 250 µg 16, che tuttavia resta il test maggiormente utilizzato nella pratica clinica dal momento che altri studi hanno riportato che il test a basse dosi non è 5 molto preciso17. Dopo 30 minuti dalla somministrazione di ACTH si dosa il cortisolo plasmatico; se quest’ultimo è < 18 µg/dL siamo dinanzi ad un’insufficienza surrenalica; al contrario se il livello del cortisolo è > 23 µg/dL si può escludere un AI15. Nel caso in cui il livello plasmatico del cortisolo sia compreso tra 18 e 23 µg/dL possono essere utili test addizionali quali il test di tolleranza all’insulina che è stato considerato il gold standard per la diagnosi di SAI, ma può causare ipoglicemie severe11 per cui deve essere fatto sotto stretto controllo medico; qualora il test all’insulina fosse controindicato può essere effettuato il test al glucagone15. Inoltre il test al CRH (ormone di rilascio della corticotropina) è un test utile per distinguere l’insufficienza ipofisaria da quella ipotalamica. Nel caso del riscontro mediante Risonanza Magnetica Nucleare (RMN) di incidentaloma non funzionante bisogna distinguere il microincidentaloma di dimensioni inferiori ad 1 cm dal macroincidentaloma di dimensioni superiori ad 1 cm18. Nel caso del microincidentaloma si ripete la RMN ogni anno per i primi tre anni e successivamente i controlli possono essere a distanza di tempo maggiori. Nel macroincedentaloma, invece, la RMN viene effettuata dopo sei mesi e in contemporanea vengono effettuati gli esami di funzionalità ipofisaria e una valutazione del campo visivo; se questi esami risultano alterati allora è indicato l’intervento chirurgico. Nel caso in cui tali esami risultano normali si pratica un follow-­‐up annuale per i primi tre anni e successivamente ad intervalli più lunghi. Qualora si assista ad una crescita tumorale con effetti compressivi e alterazioni del campo visivo allora è indicato l’intervento chirurgico di asportazione della lesione18 (Figura 5). Per quanto concerne la terapia dell’ipopituitarismo, sebbene dal punto di vista teorico la terapia sostitutiva con gli ormoni ipofisari e ipotalamici sarebbe fisiologica, tuttavia nella maggior parte dei casi utilizziamo gli ormoni secreti dalle ghiandole target sia per contenere i costi che per evitare l’inconveniente di somministrazioni ripetute. Per tale motivo nel deficit di ACTH utilizziamo: Idrocortisone (10-­‐20 mg A.M.; 5-­‐10 mg P.M) o Cortone acetato (25 mg A.M.; 12.5 mg P.M.) o Prednisolone (5 mg A.M.)19; nel deficit di TSH: L-­‐tiroxina al dosaggio di 0.6 µg/kg di peso corporeo11; nel deficit delle gonadotropine: nell’uomo si utilizza Testosterone Enantato (200 mg im, ogni 3 – 4 settimane) o Testoterone Undecanoato (80-­‐120 mg due volte al giorno) – nella donna Estrogeni coniugati (0.625 -­‐1,25 mg al giorno per 25 giorni) o Progesterone (5-­‐10 mg al giorno per 16-­‐25 giorni). Grazie allo sviluppo della terapia con GH umano ricombinante è stato possibile trattare gli adulti con ipopituitarismo o ridotta secrezione di GH5 con buoni risultati clinici (normalizzazione del peso corporeo, miglioramento della forza muscolare, aumento della massa ossea, riduzione del rischio cardiovascolare, miglioramento della funzione cardiaca e delle performance cognitive)5 ; si utilizza il GH per via sottocutanea alla dose serale di 0.15-­‐0.30 mg/die. Inoltre il deficit di ADH viene trattato con Desmopressina per via orale alla dose di 0.1-­‐0.2 mg 2 -­‐ 3 volte al giorno e per via nasale alla dose di 10 µg/0.1 mL 2 -­‐ 3 volte al giorno (Tabella 2). Infine nella pratica clinica il deficit di prolattina non viene trattato con terapia ormonale sostitutiva11. 6 Fig 1. management dell’iponatriemia Fig 2. RMN cerebrale con MdC. Studio mirato all’ipofisi. Nella regione ipofisaria è presente formazione ovalare con massimo diametro C-­‐C di circa 20 mm e L-­‐L di 14 mm a sviluppo intra e sovrasellare, Tale formazione sembra inglobare il peduncolo ipofisario che appare nettamente ispessito. Sembra riconoscere piccola porzione di normale parenchima dell' adenoipofisi lungo il pavimento sellare. Scarsamente riconoscibile la neuroipofisi. 7 Fig 3. campimetria ottica: non deficit campimetrici Fig.4: Valutazione schematica dell’AI. Tradotta e modificata da De Miguel Novoa P. et al. 8 Fig.5. Valutazione schematica in presenza di incidentaloma (Freda P.U, 2011). Tab 1: Valutazione diagnostica dell’ipopituitarismo Tradotta e modificata da Kim S.Y 9 Tab. 2: Terapia ormonale sostitutiva. Tradotta e modificata da Kim S.Y. BIBLIOGRAFIA 1.
Melmed S. The pituitary. 3rd ed. London: Academic press; 2011 2.
Kim S.Y. Diagnosis and treatment of hypopituitarism. Endocrinol Metab 2015;30:443-­‐455 3.
Toogood AA, Beardwell CG, Shalet SM. The severity of growth hormone deficiency in adults with pituitary disease is related to the degree of hypopituitarism. Clin Endocrinol (Oxf) 1994;41:511–516. 4.
Ascoli P, Cavagnini F. Hypopituitarism. Pituitary. 2006;9:335–342. 5.
Prabhakar VK, Shalet SM. Aetiology, diagnosis, and management of hypopituitarism in adult life. Postgrad Med J. 2006;82:259–266. 6.
Larkin S, Karavitaki N, Ansorge O. Rathke's cleft cyst. Handb Clin Neurol.2014;124:255-­‐69. 7.
Teramoto A, Hirakawa K, Sanno N, Osamura Y: Incidental pituitary lesions in 1,000 unselected autopsy specimens. Radiology 193:161–164, 1994. 8.
Zada G. Rathke cleft cysts: a review of clinical and surgical management. Neurosurg Focus 31 (1): E1, 2011. 9.
Yoji H et al. Acute Adrenal Insufficiency Associated with Rathke’s Cleft Cyst. Intern Med. 2016; 55: 639-­‐642. 10.
Shalet SM, Toogood A, Rahim A, Brennan BM. The diagnosis of growth hormone deficiency in children and adults. Endocr Rev 1998;19:203-­‐23. 11.
van Aken MO, Lamberts SW. Diagnosis and treatment of hypopituitarism: an update. Pituitary 2005;8:183-­‐91. 10 12.
13.
14.
15.
16.
17.
18.
19.
Vance ML. Hypopituitarism. N Engl J Med 1994;330:1651-­‐62. Alexopoulou O, Beguin C, De Nayer P, Maiter D. Clinical and hormonal characteristics of central hypothyroidism at diagnosis and during follow-­‐up in adult patients. Eur J Endocrinol 2004;150:1-­‐8. Reimondo G, Bovio S, Allasino B, Terzolo M, Angeli A. Secondary hypoadrenalism. Pituitary 2008;11:147-­‐54. De Miguel Novoa P. et al. Guidelines for diagnosis and treatment of adrenal insufficiency in adults. Endocrinol Nutr 2014;61 (1): 1-­‐34 Arlt W, Allolio B. Adrenal insufficiency. Lancet 2003;361: 1881-­‐93. Dorin RI, Qiao Z, Qualls CR, Urban FK 3rd. Estimation of maximal cortisol secretion rate in healthy humans. J Clin Endocrinol Metab 2012;97:1285-­‐93. Freda P.U., Beckers A.M. et al. Pituitary Incidentaloma: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 2011; 96(4):894-­‐904. Smith JC. Hormone replacement therapy in hypopituitarism. Expert Opin Pharmacother 2004;5:1023-­‐31. 11