Scuola di Ingegneria Industriale e dell’Informazione
Course 096125 (095857)
Introduction to Green and Sustainable Chemistry
A.A. 2015/2016
Catalisi nella Chimica
Sostenibile
Prof. Attilio Citterio
Dipartimento CMIC “Giulio Natta”
http://ISCaMaP.chem.polimi.it/citterio/
Uso dei Catalizzatori nelle Reazioni Chimiche
Aumentano la velocità delle reazioni chimiche
Velocizzano selettivamente una delle molte reazioni
termodinamicamente possibili e dare selettivamente specifici
prodotti.
Cioè, l'uso di catalizzatori può controllare la selettività verso
speciali prodotti.
Controllano l'enantio-selettività di una reazione
Il catalizzatore è anche noto col termine macchina molecolare
Sintetizza la speciale conformazione di isomeri chirali
E' compatibile con varie condizioni di reazione e controlla la
selettività delle reazioni chimiche.
E' di particolare importanza nell'alta selettività e economia atomica
nei bio-processi, e tutte le reazioni in biomasse sono catalizzate
da enzimi.
alta specificità, selettività e economia atomica.
Attilio Citterio
Esempio di Catalisi Rilevante:
Reazione di Idroformilazione
catalizzatore
R-CH=CH2 + CO + H2
H3C
100% Economia Atomica
H2
C
O
C
H2
C
H
H
normale
100 - 300 psi CO/H2, 100°C, P:Rh = 1000
Catalizzatore:
HRh(CO)(PPh3)3
Rh(acac)(CO)2
Rh(acac)(CO)(PPh3)
Rh(acac)[P(OPh)3]2
Attilio Citterio
+
C
O
CH
R
C H3
iso
Esempio di Catalisi Rilevante:
Sintesi dell’acido Cinnamico in Acqua
I
COOH
[Pd]
+
COOH
KOH, H2O
Reazione di Heck*
[Pd] = per es. PS-PEG-NH-CO-
92%
(usato in filtri UV, aromi)
PPh2
Cl
Pd
Y. Uozumi, J.Org.Chem., 1999
*Nobel price 2010
Attilio Citterio
Esempio di Catalisi Rilevante:
Processo Lonza – Sintesi della Nicotinammide
[Cat. ossido]
O2/NH3
[Pd]
[Pd]
- NH3
- 3 H2
[rhodococcus rhodocrous]
H2O
Vitamina B3
C6H16N2 + 3/2 O2 → C6H6N2O + 2 H2O + 3 H2
Combinazione di
catalisi e biocatalisi
Attilio Citterio
Cinetica delle Reazioni Chimiche e Catalisi
Endotermica
Descrive quanto velocemente un
sistema si trasforma da uno stato
iniziale allo stato di equilibrio.
Una reazione esotermica presenta
spesso una barriera inferiore alla
propria reazione inversa e perciò
procede più velocemente.
Energia del Sistema
La cinetica si interessa
primariamente del superamento
della barriera energetica. Non si
occupa della termodinamica (cioè
dell’energia di reagenti e prodotti).
Esotermica
Barriera
della
reazione
diretta
Coordinata
di reazione
Stato di
Stato Transizione
Iniziale
Attilio Citterio
Barriera
della
reazione
inversa
Stato
Finale
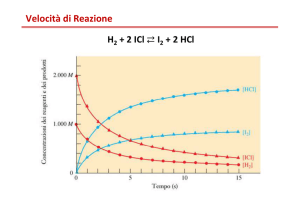
Velocità e Ordine di Reazione
In generale, la velocità di reazione dipende dalla concentrazione dei
reagenti. Il numero di reagenti da cui la velocità dipende determina
l’ordine di reazione:
Probabilmente
(CH3)3CBr + di 1° ordine (CH3)3C+ + Br-
R + R’ P + P’
+ C2H5OH
C2H5OH
• Primo ordine: velocità = k·[R]
E’ tipico di reazioni di dissociazione.
• Secondo ordine:
velocità = k·[R]·[R’]
Questa è tipica di reazioni di interscambio e associative
Probabilmente
di 2° ordine
Cl- + CH3F
Attilio Citterio
CH3Cl + F-
Cinetica: Limitazioni alla Velocità di Reazione
Nelle normali considerazioni sulla cinetica si assume che i prodotti
sono rimossi rapidamente e che i reagenti sono in eccesso.
Ma le velocità di reazione sono limitate anche dal trasporto delle
specie per diffusione
velocità k
d R
o
dx
Spinta dalla
concentrazione
d R
velocità k
dx
Spinta dal
potenziale chimico
Tipicamente, la diffusione di una specie (un reagente o un prodotto)
è più lenta e la velocità complessiva di una reazione limitata dal
trasferimento di massa dipende solo da quella specie.
Attilio Citterio
Cinetica: Limitazioni alla Velocità di Reazione
• L’energetica dei processi ha una diversa dipendenza in funzione
del fatto che sia controllata dal trasferimento di massa o dalla
barriera energetica della reazione.
Limitate dal trasporto di massa -molte piccole barriere-
“cammino di reazione”
Attilio Citterio
energia
energia
• I processi limitati dal trasferimento di massa dipendono da
quanto lontano si deve muovere un reagente (velocità x1/2).
• I processi limitati dalla reazione dipendono da quanta energia
una reazione necessita per potersi effettuare.
Limitate dalla reazione-poche grandi barriere-
“cammino di reazione”
Energie di Attivazione
In alcune reazioni sono possibili cammini di reazione alternativi che
portano a prodotti diversi, per esempio differenti isomeri:
Esempio:
H
R
trans:
AT
AC
C C
Br
Br
C C
Br
BT
BC
BT
Br
H
cis:
IT
IC
H
H
PT
PC
distanza S-X
Attilio Citterio
energia
distanza S-Y
Per una reazione di sostituzione
H2C=CHBr + Br2 H BrCH=CHBr + HBr
IT B
C
AT
R
AC I
C
PT
PC
posizione lungo i due cammini
Cinetica e Catalisi
Accelerazione del superamento della barriera energetica (stato di
transizione):
Aumento della velocità di
campionamento (pre-fattore k0):
k k0 e
Variando la configurazione dei
reagenti per farli interagire più
efficientemente in modo che
reagiscano più velocemente
(tipicamente 100-1000 più veloce).
Attilio Citterio
Diminuzione dell’energia
dello stato di transizione (E).
E
k BT
Formando un complesso con la
configurazione dello stato di
transizione ne riduce l’energia,
tipicamente più di 0.9 eV!
Effetti Spazio / Temporali in Reazioni
[t]
a
s
Dinamica in
stato solido
ms
trasporto
nei pori
Cicli di
reazione
ns
fs
trasporto
nei reattori
trasporto
nei grani
Ristrutturazione
della superficie
Stadi
elementari
pm
nm
µm
mm
Attilio Citterio
m [l]
I catalizzatori sono per lo
più non attivi (bulk)
Anche la maggior parte
della superficie è inattiva
Attivi sono i difetti
Esistono molti tipi di
difetti
I catalizzatori sono matrici
che si comportano
dinamicamente per una
minoranza di elementi
strutturali metastabili che
sono i siti attivi
Livello di Dettaglio nella Catalisi
1000 µm
100 nm
100 µm
10 nm
50 µm
1 nm
10 µm
1000 nm
Attilio Citterio
0,1 nm
Catalisi
Effetto della temperatura sulla velocità complessiva della reazione per
catalisi nello stadio determinante della cinetica:
Velocità di Reazione, k (s-1)
Temperatura, T [K]
10
12
10
11
10
10
10
9
10
8
10
7
10
6
3000 1000
500
300
200
catalizzatore che
aumenta k0
catalizzatore che
diminuisce E
reazione non
catalizzata
0
1
2
1000/T
3
[K-1]
Attilio Citterio
4
5
Catalizzatori
I catalizzatori sono composti o materiali che accelerano una reazione
ma non sono consumati dalla reazione – non sono né reagenti né
prodotti. Tipicamente sono substrati.
In alcuni casi sono intermedi che sono trasformati da una reazione
ma rigenerati da una reazione successiva e quindi rilasciati.
Lenta
H
H
C C
H
+
H2
(decomposizione H2)
H
etilene
Veloce
H H H
C C
H H H
superficie di Pt
Accelera la decomposizione di H2
Attilio Citterio
etano
Nozione di Reazione Catalitica: Ciclo
A
B
P
separazione
1- legame di 2 molecole A e B
con il catalizzatore,
Catalizzatore
P
Catalizzatore
legame
A B
In termini generali :
reazione
Catalizzatore
2- A e B reagiscono e danno P,
legato al catalizzatore,
3- P si stacca dal catalizzatore,
liberandolo per un nuovo ciclo
Br·
Br-C-C-H
C=C
Reazioni a catena radicalica:
ktr≈107
1- Una specie radicalica si addiziona
2- La specie radicalica addotto
ripristina il radicale originario
Attilio Citterio
ka≈108
HBr
Br-C-C·
Visualizzazione dell'Effetto di un Catalizzatore:
Diagramma di Energia Potenziale
energia potenziale
Per la reazione noncatalizzata:
A
A
+
B
la reazione si realizza
quando A e B entrano in
collisione con abbastanza
energia da superare la
barriera di attivazione.
P
B
Catalizzatore
P
A B
P
Catalizzatore
Catalizzatore
Catalizzatore
legame
reazione
separazione
coordinata di reazione
Attilio Citterio
Per la reazione catalizzata:
L’adsorbimento dei reagenti è
spontaneo e la barriera di
attivazione della reazione sul
catalizzatore è sensibilmente
inferiore, il prodotto però
deve deadsorbirsi dal
catalizzatore.
Catalisi Omogenea - Meccanismi
Modifica la distribuzione di carica, orientamento o forma di una
molecola, rendendola più facilmente aggredibile nel corso della
reazione.
Occupando un sito reattivo forza la reazione ad avvenire in un
altro sito.
Tiene assieme due molecole finche reagiscono.
Stabilizza un intermedio instabile finche reagisce.
Decompone una piccola molecola rendendola reattiva.
N.B. Modifica delle costanti di equilibrio (stabilizzando un
reagente o un prodotto varia la resa della reazione – non si tratta di
una vera catalisi perché il catalizzatore è diventato un reagente ed
in effetti è usato stechiometricamente).
Attilio Citterio
Terminologia
Gruppo funzionale: una porzione reattiva di una molecola.
Nucleofilo: una porzione carica negativamente di una
molecola, reagisce con regioni cariche positivamente di un
altra molecola.
Base di Lewis: un donatore di coppie elettroniche. p. es.: NH3
Elettrofilo: una regione carica positivamente, reagisce con
parti cariche negativamente di un altra molecola.
Acido di Lewis: un accettore di coppie elettroniche. p. es: H+
Legante: basi di Lewis legate a un atomo metallico. p.es.: CN⎯
in [Fe(CN)6]4⎯
Radicale: Una molecola incompletamente legata, possiede
elettroni spaiati. p. es: H3C-CH2•
Catione/Anione: ioni carichi positivamente/negativamente.
p. es: H+ / OH⎯
Attilio Citterio
Classi di Catalizzatori
Omogenei -- catalizzatore e
reagenti sono nella stessa
fase.
Enzimi -- molecole proteiche
che accelerano le reazioni
biologiche.
Eterogenei -- catalizzatore e
reagenti sono in fasi
differenti
Attilio Citterio
Catalisi
Meccanismi:
Organizzazione Conformazionale
Modifica cariche/trasferimento di elettroni
-
+
Promozione decomposizione reagenti
Formazione di complessi reattivi
+
Formazione di radicali liberi.
Fe2+ + H2O2 FeOH2+ + •OH
Attilio Citterio
complesso
(più facilmente ionizzato)
Catalisi: Un’altra visione
Meccanismi specifici usati per abbassare le energie di attivazione:
1. Legami e orientazione dei substrati (energia di legame).
2. Catalisi generale Acido-Base.
3. Catalisi covalenti.
4. Catalisi assistita da ioni metallici.
5. Organizzazione dell’ambiente di reazione (allontanare l’acqua).
Attilio Citterio
Catalisi Omogenea
Catalisi nella stessa fase.
Questi catalizzatori formano complessi con molecole in una data fase
(normalmente in soluzione liquida) e modificano il processo di reazione.
+
+
ZnCl2
Complesso
ZnCl2
+
PhCOCl + (C2H5)2O → PhCOOC2H5 + C2H5Cl
Attilio Citterio
+
Catalisi Omogenea
(Catalisi per modifica della distribuzione di carica)
Le reazioni spesso implicano l’attacco di una molecola
da parte di un’altra che possiede sia:
carica positiva e perciò attrae elettroni (elettrofilo)
carica negativa e perciò attrae le cariche positive
(nucleofilo)
N.B. Le cariche possono essere anche parziali
I catalizzatori omogenei spesso modificano l’entità
della carica della molecole interessate rendendo
l’attacco più veloce.
Attilio Citterio
Catalisi Omogenea
(Polarizzazione di reagenti con ioni metallici)
La formazione di un complesso tra una molecola organica
e un alogenuro metallico generalmente comporta il
trasferimento di elettroni al metallo (quando -legato):
+
+
-
C2H5OC2H3 + AlCl3 →
Ulteriori
reazioni
[C2H5OAlCl3]¯ + C2H5+
I complessi formati tramite legami o che incorporano stati d
possono trasferire carica dal metallo piuttosto che accettarla.
Attilio Citterio
Catalisi Omogenea
(Polarizzazione di reagenti con ioni metallici)
Esempio:
+
+
+2
+2
(H2N)2C=N-CN + H2O [+ CuSO4] (H2N)2C=N-CO-NH2
(In questo caso il gruppo SO4-2 non partecipa al processo)
Attilio Citterio
Catalisi Omogenea
(Polarizzazione di reagenti con ioni metallici)
Spostare elettroni da un legante (molecola reagente) a
uno ione metallico può:
Facilitare l’attacco da parte di nucleofili (specie cariche
negativamente).
Ritardare l’attacco da parte di elettrofili (carichi positivamente).
Le specie ossidanti sono generalmente elettrofili per cui
la coordinazione tipicamente rallenta le reazioni di
ossidazione e accelera le reazioni di riduzione!
[Nota: L’efficacia dei vari ioni metallici dipende dal pH.]
Attilio Citterio
Catalisi Omogenea
(Complessi di reagenti con ioni metallici)
Molti effetti importanti si verificano in piccole molecole a
seguito della formazione di complessi:
:
M + :
:
:
M :
+
:
:
-
: :
Cl-
:
Cl+ -
:
Cl2
M
:
polarizzazione (formazione di un dipolo)
Attilio Citterio
:
:
:
-
:
:
:
:
H2O2 2 HO•
:
M+
:
:
:
Produzione di radicali liberi.
+:
:
:
:
:
:
:
:
:
:
NO2Cl + FeCl3 NO2+ + FeCl4⎯
:
:
ionizzazione per trasferimento di carica o decomposizione
+
:
Catalisi Omogenea
(Complessi che variano l’acidità dei reagenti)
Esempio:
+2
+2
+
+
+2
2 Cu+2 + 2H2O Cu2(OH)22+ + 2H+
Gli elettroni si muovono dall’acqua al Cu+2 che riduce la
densità elettronica sugli idrogeni nell’H2O, rendendo più facile
rimuovere uno di essi.
Questo può aumentare l’acidità (donazione H+) di 107 o più!
Attilio Citterio
Catalisi Omogenea
(Complessi che variano l’acidità dei reagenti)
Quando una molecola che porta un atomo di idrogeno (che si possa
rimuovere come ione) forma un complesso con un accettore di coppie
elettroniche (Acido di Lewis), lo ione idrogeno è molto più facilmente
rimosso.
Ciò fa aumentare la reattività. Dopo la reazione l’acido di Lewis viene
ricuperato per decomposizione del complesso.
Example:
+
CH3OH + AlCl3
AlCl3(OCH3)⎯ + H+
Attilio Citterio
Catalisi Omogenea
(Equilibri tautomerici)
Scelta di una specifica struttura di un composto in
equilibrio con altri (comune per migrazione di idrogeno):
Quando due strutture esistono in equilibrio, solo una forma può
produrre un complesso, stabilizzando solo tale forma.
72%
CH3-COH-CH-CO-CH3
28%
CH3-CO-CH2-CO-CH3
Cu2+
+2
100%
Attilio Citterio
Tautomeria
cheto-enolica
Catalisi Omogenea
(Fattori influenzanti il G# di reazione)
G# = H# - TS#
I fattori agiscono sul H#, , o S#!
Variazioni dell’energia di legame (via )
Variazioni in H# dai cambiamenti di stato
Variazioni in S# per cambio nel:
numero di particelle
simmetria
movimenti possibili
stato/fase
carica
Attilio Citterio
Catalisi Omogenea
(variazioni di entropia per interazioni elettrostatiche)
La differenza di entropia dai reagenti isolati allo stato di transizione
elettrostaticamente legato è:
S = FZAZB
dove F è una costante e Z sono le cariche del legante.
La variazione in S# per formazione del complesso con uno
ione carico (normalmente un metallo) è:
(S) = F[ZA + ZM]ZB - FZAZB
= FZBZM
Il segno della variazione di entropia da parte del catalizzatore
determina se la reazione è accelerata o ritardata. Ciò dipende dal
segno di ZB e ZM.
Attilio Citterio
Catalisi Omogenea nella Metatesi per
Rottura di Anello (RCM)
La catalisi omogenea è spesso usata per la
produzione di prodotti farmaceutici e la sintesi di
prodotti naturali e materiali organici.
Un significativo esempio (tra gli altri …) è la reazione
di Metatesi di olefine su catalizzatore di Schrock e
Grubbs (Nobel 2006)
O
H
H
H
H
Cl
Cl
cat [Ru]
O
2
P
O
H
H
H
Ring Closure Metathesis RCM
Ph
P
H
OPMB
Attilio Citterio
Ru
O
OPMB
Pietre Miliari nella Catalisi Asimmetrica
1939 Pt modificato con Cinconina (Lipkin e Stewart)
1956 Pd modificato con fibroina della seta (Akabori, Izumi)
1963 Ni Raney /tartrato (Izumi)
1966 ciclopropanazione asimmetrica catalizzata da un complesso
chirale di una base di Schiff, 10% ee (Nozaki, Noyori)
1968 Idrogenazione asimmetrica con un complesso di rodio-fosfina
chirale, 15% ee (Knowles e Sabacky; Horner)
1970 processo L-Dopa della Monsanto
1971 legante DIOP (Kagan)
1980 Epossidazione asimmetrica, Ti/TBHP/tartrato (Sharpless)
1984 processo a l-mentolo della Takasago, Rh-Binap (Otsuka,
Akutagawa, Noyori)
1988 Diidrossilazione asimmetrica di olefine, OsO4/chinina
(Sharpless)
1991Epossidazione di Jacobsen-Katsuki
2001premio Nobel in Chimica per Knowles,Noyori e Sharpless
Attilio Citterio
Catalisi Omogenea
(catalisi enzimatica - BIOCATALISI)
Gli enzimi sono i catalizzatori essenziali degli esseri
viventi: offrono grande selettività di forma, specificità e
efficacia.
Gli enzimi usano molti maggiori approcci catalitici
simultaneamente:
Polarizzazione tramite la formazione di complessi metallici.
Mantenere i siti di reazione desiderati adiacenti.
Usare l’ingombro sterico per prevenire reazioni indesiderate.
Gli enzimi sono proteine formate da amminoacidi:
H
H2N C C
R
R
Attilio Citterio
O
OH
Biocatalisi: Esempi
L’enzima catalasi accelera la
decomposizione dell’acqua
ossigenata in acqua e ossigeno
2 H2O2 2 H2O + O2
107 molecole convertite / secondo
!!!
Il citocromo P450 =
enzima d’ossidazione
e di detossicazione di
composti tossici
Attilio Citterio
Catalisi Omogenea
(catalisi enzimatica - carbossipeptidasi-A)
La carbossipeptidasi-A è una proteina con 307 amminoacidi.
Spezza altre proteine nel seguente modo:
• Cattura la proteina
• Lo ione Zn2+ polarizza
il legame d’interesse
• Dell'acqua polarizzata
viene fornita per
idrolizzare il legame
Attilio Citterio
Catalisi Omogenea
(catalisi enzimatica - carbossipeptidasi-A)
In maggior dettaglio:
[terminale amminico
(-NH2) dell’Enzima]
• Cattura la proteina
H-C-H
• Lo ione Zn2+
polarizza il legame
d’interesse
H-CH-N
2+
Zn O=C
O
• Acqua polarizzata
viene fornita per
idrolizzare il legame
Attilio Citterio
- +
HO-
H- O
C=O
Attacco nucleofilo
dell’O nell’H2O
[terminale carbossilato
(acido) dell’Enzima]
Azione dell’Enzima (Meccanismi)
Una tipica legge cinetica per reazioni
enzimatiche è:
E
Velocità di formazione dei prodotti = k
[E][S]/([S] + KM) dove [E] è la concentrazione
dell’enzima e [S] è la concentrazione del
substrato. KM è una costante nota come la
costante di Michaelis.
S
Si noti: La reazione è di primo-ordine in E
ma non ha un ordine specifico in S.
Il meccanismo proposto è
(ES)
1. Formazione del complesso ES:
E + S H ES (ka)
2. Decomposizione di ES:
ES H E + S (ka’)
P
3. Formazione dei prodotti e rilascio
dell’enzima:
ES H P + E (kb)
E
Attilio Citterio
1. Lega e Orienta i Substrati
reagenti (da legare)
Vincola i reagenti a stare
vicini legandoli e li orienta
in modo adatto per la
reazione.
Specialmente efficace se
si richiedono 3 o più
reagenti
contemporaneamente
perché la reazione
avvenga.
catalizzatore
La vicinanza e
l’orientamento
favoriscono la
formazione
dello stato di
transizione
(S‡ inferiore)
Il forte legame
nello stato di
transizione
abbassa il ‡
Prodotto (rilasciato)
Attilio Citterio
stato di
transizione
2. Catalisi Acido-Base
Gli amminoacidi nell’enzima
forniscono ioni H+ al reagente
o accettano ioni H+ dal
reagente.
H+ =
Donano
generale,
Es. Rottura da parte del lisozima:
NAG
NAG
E
E
4
4
Glu
35
1
acido
Asp
52
D
Glu
35
1
NAG3
Accettano H+ = base
generale.
Asp
52
D
NAG3
1° stadio: Glu-35 agisce da acido.
Glu
35
1
Asp
52
D
NAG3
Glu
35
1
Asp
52
D
NAG3
2° stadio: Glu-35 agisce da base.
Attilio Citterio
3. Catalisi Covalente
Si forma un legame covalente
(transiente) tra il(i) reagente(i) e
l’enzima.
Esempio: la Serina proteasi
forma un legame covalente
con la parte della proteina
che intende rompere.
Questo è un intermedio
Enzima’
CH2
O
Ser
195-CH2-O
‘Acil-
N
His
57
N
H
CH
C
H
O-
O
H
O
C
Asp 102
COMPLESSO
ACIL-ENZIMA – H2O
Chimotripsina
Attilio Citterio
(N)
4. Catalisi Assistita da Ioni Metallici
La coordinazione ai centri
metallici facilità le reazioni via
legami metallo-substrato
(legante) in grado di attivarlo.
Esempio: Carbossipeptidasi A
che usa uno ione Zn2+
Stato fondamentale
Glu 270
Stato di transizione:
Lo Zn2+ stabilizza la
formazione dell’OH
legato e della carica
negativa del COO-
Attilio Citterio
R H
R'
OH N
C
C
O
O HO
2+
Zn
+
Arg127
5. Organizzazione dell’Ambiente di Reazione
(allontanamento dell’acqua)
Le molecole di acqua si
dispongono in modo da
permettere una favorevole
interazione dei reagenti.
Se l’enzima può legare ai
reagenti senza le molecole
di acqua associate, questi
possono reagire tra loro più
facilmente.
H
O
+
H O
H
H
O
H
H
H
-
O
H
H
Attilio Citterio
H
O
O
H
H
Catalisi Eterogenea
Desorbimento
del Prodotto
Desorbimento
del Reagente
Fase 1
(gas)
Fase 2
(solido)
Adsorbimento
del Reagente
X
Diffusione
Superficiale
formazione dello stato di
transizione & reazione
Catalizzatore
Punti critici:
• Veloce formazione dello stato di transizione o lo
stato ha una bassa energia.
• Rapido adsorbimento dei reagenti, desorbimento
dei prodotti, e lento desorbimento del reagente.
Attilio Citterio
La Catalisi
eterogenea è un
fenomeno di
superficie, non un
processo interno.
Catalisi Eterogenea
Energia, Entropia, ed Effetti Sterici
nella catalisi eterogenea:
L’entropia in genere diminuisce perché i
reagenti sono confinati sulla superficie (un
fatto non buono per reazioni veloci).
Gli effetti sterici sono generalmente ridotti
dall’organizzazione dei reagenti sulla
superficie.
La barriera energetica della reazione
viene generalmente ridotta dalla
superficie catalitica. L’insieme degli stadi
può esser reso essenzialmente
istantaneo.
Attilio Citterio
Catalisi Eterogenea
La velocità di reazione in un processo catalizzato
dipende dalla densità di molecole adsorbite.
v = k·A·B
A copertura
delle specie A
B copertura
delle specie B
v: velocità, k: costante specifica
Più veloce per A = B.
Siti aperti -- necessari per
l’ulteriore adsorbimento
Il miglior catalizzatore
adsorbe i reagenti più
fortemente.
I reagenti non devono
raggrupparsi assieme per
una reattività ottimale ad alte
ricoperture.
Attilio Citterio
mol
min g
catalizzatore
mol
2
m
min
superficie catalizzatore
Frequenza di Ripristino (Turn Over)
Velocità rispetto al numero
di siti attivi
bassa densità
di siti
alta densità
di siti
La frequenza di ripristino (turn over) è il numero di molecole formate
per sito attivo al secondo (in uno stadio di saturazione con il reagente,
cioè reazione di ordine zero rispetto al reagente)
TOF =
molecole
1
s
sito s
Attilio Citterio
TON e Catalisi
TON
Numero totale di molecole di prodotto formate per sito attivo
TON = TOF × vita media del catalizzatore
TON = 1
reazioni stechiometriche
TON 102
reazioni catalitiche
TON = 106-107
applicazioni industriali
Reazione
Cracking
Isomerizzazione
Polimerizzazione
Cracking
Isomeriz. scheletrica
Migrazione doppio
leg.
Substrato
TOF
TOF Relativo
Molecole/sitosec
Esano
0.0469
1
Nonano
0.150
3.2
Dodecano
1.07
23
m-Xilene
10.6
226
Propilene
40.7
868
1-Esene
36.7
782
1-Eptene
56.7
1209
3
5
1-Esene
>5x10
> 1x10
4
6
1-Esene
4.7x10
1x10
Attilio Citterio
Catalizzatori Eterogenei Supportati
Schema di un catalizzatore a
fase liquida supportata.
Il liquido o l’acqua assorbita sul
supporto poroso forma un film
sulla superficie interna del
supporto.
SLPC: la fase A è un solvente
organico non volatile (R = H); la
fase B è una fase gas (olefine o
CO/H2.
SAPC: fase A è acqua (R =
SO3Na); la fase B è un liquido
organico (olefina pesante)
Chemtech, 2 (1992) ACS
Attilio Citterio
Catalisi Eterogenea –
(Assorbimento di gas)
Adsorbimento
fisico
H2 + 2M 2HM
chemiadsorbimento
CO + 2M COM2
chemiadsorbimento
CH4 + 2M CH3 M+ HM
Ri-ibridizzazione di
legame sp sp2
Attilio Citterio
interazione di
superficie
tramite legami
Catalisi Eterogenea –
(Assorbimento di gas)
Chemiadsorbimento dissociativo
Aumenta la reattività e diminuisce l’energia di attivazione della
reazione per violento distacco delle molecole di reagente.
Chemiadsorbimento associativo
Aumenta la reattività e diminuisce l’energia di attivazione della
reazione incoraggiando la reibridizzazione dei legami secondo
quanto richiesto dalla reazione.
Attilio Citterio
Catalisi Eterogenea in Reazioni
Catalizzatori di ossidazione: non devono essere ossidabili. Perciò
molti ossidi e sali di metalli in alto stato di ossidazione catalizzano
bene vari processi di ossidazione.
Catalizzatori di riduzione (idrogenazione): non devono esser ridotti
dall’idrogeno e dagli altri riducenti. I metalli costituiscono dei buoni
catalizzatori per le reazioni con H2.
Catalizzatori di deidrogenazione: validi sono alcuni ossidi isolanti
(p.es.: Al2O3).
Catalizzatori di isomerizzazione: ossidi di natura acida ad alta
area superficiale (pori e canali interni – zeoliti, argille)
Catalizzatori di polimerizzazione: molto buoni sono vari tipi di
acidi.
Attilio Citterio
Catalisi e Natura del Metallo
La capacità di certi metalli di adsorbire i gas determina la loro attività
catalitica per queste specie – maggiore è l’adsorbimento, più efficace è
la catalisi:
Gruppo
Catalizzatore
A
B1
B2
B3
C
D
E
Metalli
Ti, Zr, HF, V, Nb,
Ta, Cr, Mo, W, Fe,
Ru, Os
Ni, Co
Rh, Pd, Pt, Ir
Mn, Cu
Al, Au
Li, Na, K
Mg, Ag, Zn, Cd,
In, Si, Ge, Sn, Pb,
As, Sb, Bi
O2 C2H2 C2H4 CO H2 CO2 N2
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
-
+
+
+
+
+
-
+
+
+
±
-
+
+
-
+
-
+
-
-
-
-
-
-
Attilio Citterio
Strategie nell’uso di Catalizzatori
Autosegregazione dal mezzo di reazione
Eterogenizzazione di catalizzatori omogenei
Materiali catalitici nanostrutturati
Biocatalisi e biotrasformazioni
Tecnologie catalitiche:
Reattori a letto fluido
Reattori a membrana
Reattori rotanti a letto catalitico
Microreattori
Attilio Citterio
Catalisi e Principio di Sabatier
Pt
400
Ir
Ru
Pd
Rh
Ag
500
Il catalizzatore deve
avere affinità per il
reagente
Cu
.... ma non troppa!
Co
Au
600
60
Fe
W
80
100
{A+B}
G°
120
Principio di Sabatier: curve a vulcano Tv/K. La temperatura
a cui la velocità di decomposizione dell’acido formico (asse
verticale) ha un certo valore v, correla con il calore di
formazione del formiato metallico, in kcal per equivalente
(asse orizzontale).
Attilio Citterio
A+B+K
AK + B
AKB
P+K
Coordinata di reazione
Catalisi Omogenea vs. Eterogenea
Catalisi omogenea
Catalisi eterogenea
Alta attività & selettività
Ampia varietà di reazioni
(enantio-selettive)
Siti attivi chiaramente definite e
ben caratterizzati (< numero di
atomi, = molecole o cluster)
Efficiente trasferimento di
calore
Tossico, corrosivo
Contaminazione da parte dei
prodotti di reazione
Separazione complicata
(distillazione, ecc.) <<<
riciclabilità
Soprattutto processi batch
Applicazioni più limitate (in
chimica fine) (< enantioselettività)
Generalmente meno attivo e/o
selettivo
Può contenere un’ampia varietà
di siti attivi (difficile di
caratterizzare/quantificare)
Attilio Citterio
Facile separazione
Riusabile - riciclabili
Uso confinato
Meno tossico, non corrosivo
Meno scarti
Processo in continuo
Molti tipi di reattori
Autoseparazione del Catalizzatore
Una progettazione attenta permette che i prodotti si auto-separino
utilizzando proprietà intrinseche fisico/chimiche quali la solubilità, la
volatilità, ecc.
Il catalizzatore è solubile in uno dei reagenti e rimane solubile quando si aggiunge l’altro reagente. Al procedere della
reazione, ed il prodotto si accumula, il catalizzatore precipita dalla miscela come olio. Questo clatrato olio—liquido—
mantiene l’attività catalitica, in quanto i reagenti possono penetrare al suo interno. Quando tutti i reagenti sono
convertiti in prodotti, l’olio catalitico ritorna ad essere un solido appiccicoso, che si può facilmente separare e riciclare.
Dioumaev, VK, and RM Bullock. July 31, 2003. Nature 424(6948):530-531
Attilio Citterio
Reazioni Acido-Catalizzate
Tipo di catalisi usata molto
ampiamente
Trovano applicazioni in tutti i
settori dell’industria chimica,
farmaceutica e affini
Largamente basate su Acidi di
Bronsted e Lewis economici
- H2SO - HF - AlCl3 - BF3
I processi continui di più grande
scala in fase gas si stanno
spostando verso acidi solidi
Chimica molto varia:
Attilio Citterio
+
CH2CH2R
RCH=CH2
COR
+
RCOCl
OH
HO
O
Me
Me
Me
+
Me
Me
Me
Acilazioni Aromatiche con Vari Catalizzatori
O
CH2COX
MeO
X
Solvente
S/C (g/g)
Produttività
Resa in Volume (g/l)
STY (g/l/giorno)
Fattore E (g/g)
Efficienza Atomica (%)
Sottoprodotti
Catalizzatori
+
HX
MeO
AlCl3
H-beta
Cl
CS2
0.7
0.26
47
560
3
25
OAc
2.9
25
162
648
0.4
71
Cl
2.6
7
51
303
0.24
80
OAc
CH3NO2
8.5
0.4
17
22
0.43
71
AlCl3.nH2O
HCl
HOAc
HCl
HOAc
Attilio Citterio
H3PW6Mo6O
Yb(Otf)3
Vie Sintetiche al Caprolattame
(intermedio del nylon-6)
Processo Du Pont
Tradizionale
O
N OH
O
H2SO4
NH2OH.H2SO4
NH
grossi scarti di (NH4)2SO4
E = 8 (kg rifiuti per kg di prodotto)
H2
5000 kPa
O2
900 kPa
Miglioramento (uso di catalizzatori ambientalmente-compatibili)
N OH
O
NH3 + H2O2
TSI
scarichi minimi (acque)
senza sali
E = 0.32
Attilio Citterio
O
Zeolite
NH
Ni/Al2O3
Co. 160°C
Altra Via al Caprolattame
Nuovo (materia prima alternativa)
O
+
2HCN
NC
H2
CN cataliz.
NC
CH2NH2
alumina
(- NH3)
rifiuti minimi
evita l’uso della materia prima benzene (via
cicloesano/cicloesanone)
senza sali
E = 0.13
Attilio Citterio
H2O
NH
Eterogeneizzazione di Catalizzatori Acidi
Acido di
Lewis
Zinco
Triflato
Supportato
Acido di
Brønsted
BF3/SiO2
Acido
Solfonico
Solido
Preparazione Acido Solfonico
SH
n-C12-ammina
MeO
Si
Si(OEt)4
SH +
MeO Si
MeO
co-condensazione
MercapropropilTetraetossiOO O
trimetossisilano
ortosilicato
SiO2
Titolazione con Piridina di
Silice con Acido Solfonico
OH
OSO
Si
1700
1600 1500 1400
Frequenza cm-1
Attilio Citterio
OO O
SiO2
H2O2 acquosa
Catalizzatori Eterogenei Acidi per la
Preparazione di Polimeri
Cl
OH
Cl
Al
+ AlCl3
Silice
• Uso come catalizzatore
eterogeneo nella
+ HCl
polimerizzazione di resine
Acido Solido Supportato
Cl
Cl
Al
+
RESINA
Filtraz. Cataliz.
Riciclo del Catalizzatore Ricuperato - NO REFLUI
Attilio Citterio
Forze Acide di Tipici Acidi Solidi
AH + B a BH+ + A-
H0 = pKa + log[B]/[BH+]
Costante di acidità di Hammett
Acidi solidi
H0(a)
-Hads (NH3)/kJ ml-1
H3PW12O40
-13.16
195
Cs2.5H0.5PW12O40
-13.16
-
SO42-/ZrO2
-14.52
165150
H-ZMS-5
-12.70
145
SiO2-Al2O3
-12.70
Nafion®
ca. -12
Acidi
omogenei
CF3SO3H
H2SO4 c.
-14.1
-12.0
Attilio Citterio
Applicazioni Industriali di Catalizzatori
Solidi Acido-Base
127 processi industriali usano catalizzatori solidi acido-base
Soprattutto nella produzione di bulk/petrolchimici, quali disidratazioni,
condensazioni, alchilazioni ed eterificazioni
180 differenti catalizzatori usati
74 di questi sono zeoliti, di cui le ZSM-5 costituiscono il gruppo più ampio
il secondo gruppo più ampio è costituito da ossidi di Al / Si / Ti e Zr
Prodotto
Azienda
Catalizzatori
Cumene
Mobil, Enichem
Zeolite
LABs
UOP
Zeolite
Cicloesanolo
Asahi
H-ZMS-5
Vinilbicicloeptene
Sumitomo
Na/allumina
Etileneimmina
Nippon Shokubai
Si/Ba/Cs/P/O
* Review : K Tanabe & W F Holderich, Applied Cat. A 1999, 181, 399
Attilio Citterio
Origine dell’Acidità delle Zeoliti
H
Catalisi acida:
A + H+
O
f AH+
AH+ + B f ABH+
f AB + H+
ABH+
A + B f AB
+
Na
+
O
O - O
Al
Si
Si
O
O
O O
+
NH4 Z-
Z-
Per esempio:
A è
3+
La (H2O)
B è
AB è
C 2 H5
Z-
-(NH3)
+
H Z-
(LaOH)2+ + H+ Z-
Attilio Citterio
Relazioni tra Struttura e Forza Acida
H-ZSM-5
Affinità protonica:
H-Z a H+ + ZH-Z+B a HB+ + ZHB+: ione carbenio, ione
carbonio
+
H
C
H + H
Solvatazione di HB+
Al
Centro acido di Brønsted
Attilio Citterio
Conversione monomolecolare
di Intermedi di alcani
Catalisi nel Processo del Cumene
H3C H CH3
C
+
H3C
Catal.
Importante fino agli anni 1950 per la produzione del fenolo
Il processo iniziali usarono AlCl3 o H2SO4
Grosse quantità di scarichi acidi
La Huls sviluppa il processo ad HF
Più verde ma pericoloso
Processo UOP in fase gas con H3PO4/ SiO2 e BF3
Buono ma corrosivo
Processo Mobil con Zeoliti
Nessun scarico acido, non-corrosivo, resa vicina al 100%.
Attilio Citterio
Sintesi di Alchilbenzeni
Benzene + Olefina
Cat.
Alchilbenzene
Vengono convertiti in solfonati per usi di detergenza
Fino alla fine del 1960 iso-C12H24 veniva usato con H3PO4/ SiO2
Bassa biodegradabilità a seguito delle strutture ramificate, corrosivo
Idrocarburi lineari C10 - C12 usati ma HF o AlCl3
Migliorata la biodegradabilità, peggiorata la situazione dei reflui
La tecnologia UOP con zeolite diventa popolare negli anni 1980-90
Permangono tuttavia problemi in merito alla degradazione
I composti sono poco biodegradabili e ci si sposta sui solfati di
alcoli o sui bio-tensioattivi?
Attilio Citterio
Catalisi con Zeoliti (Selettività di Forma)
Disproporzione del Toluene mediante HZSM-5
xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
+
xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
La selettività di forma permette
al solo p-xilene di attraversare il
canale del materiale
Attilio Citterio
Struttura a
canali della
ZMS-5
Zeoliti - Struttura Terziaria
Attilio Citterio
Materiali Silicei Porosi
- 1756 - scoperta delle zeoliti naturali
Evoluzione storica
- 1938 - zeoliti sintetiche (Prof. R.M. Barrer)
- 1950 - interesse industriale (adsorbimento e catalisi)
- la dimensione dei pori variata mediante sintesi controllate
- 1973 - crisi petrolifera necessità di materiali con porosità maggiore
- 1980 - prime PILCs stabili supermicroporose
- 1992 - MCM mesoporose controllate (Mobil Oil Corporation)
- 1995 - PCH micro/mesoporose controllate (Università del Michigan)
PCH
PCH
MCM
PILC
zeoliti
0
10
microporose
20
100
mesoporose
Attilio Citterio
Diametro
del poro
(Å)
Materiali Mesoporosi
MCM-41
dp = 3 nm
O
Si
metano
etano
Attilio Citterio
Catalisi Eterogenea con Basi Solide
CO2 membrane candidate: Idrotalcite
H2O + CH4
CO32-
CO
Acqua
H2
Ossidi metallici stratificati (LDO)
Attilio Citterio
Separatore
molecolare
Strato
catalitico
Zeoliti come Alternative alle Vie Classiche
Allumino-silicati
Strutture cristalline 3D
Dimensioni uniformi dei pori
Applicazioni verdi in:
> Catalisi
> Trattamento delle acque
> Bonifiche
> Controllo degli odori
Attilio Citterio
Reazioni Redox ed Agenti Ossidanti
Pericolosi…
CrO3 /H2SO4
(py)2 CrO3
(pyH)+ClCrO3(CH3)2S /Cl2
(CH3)2SO / (COCl)
Pb(OAc)4 /piridina
(Jones)
(Collins)
(Corey)
Sporchi…
MnO2
Ag2CO3
Al(OiPr)3 / Me2CO
Puliti…
Pt/O2
Titanio silicaliti / H2O2
Attilio Citterio
Ossidazioni Stechiometriche vs. Catalitiche
Metodo Tradizionale:
p.es. 3PhCH(OH)CH3 + 2CrO3 + 3H2SO4 → 3PhCOCH3 + Cr2(SO4)3 + 6H2O
grandi quantità di reagenti consumati
condizioni pericolose (ossidante tossico, refluo tossico)
meno di metà degli atomi nel processo finisce nel prodotto desiderato
Metodo Verde (catalitico):
PhCH(OH)CH3 + 1/2O2 → PhCOCH3 + H2O
solo ossigeno (aria) consumata
condizioni non-pericolose (?)
reflui ambientalmente benigni
la maggior parte degli atomi nel processo finisce nel prodotto desiderato
Attilio Citterio
Catalisi nella Produzione di Cicloesanolo
O
OH
OOH
O2 Cat
+
H3BO3
Usato nella produzione dell’acido adipico and nylon-6,6
Primo stadio: tipico catalizzatore Co o Mn naftenato
Catalizzatore non recuperato
Secondo stadio realizzato con acido borico
Anch’esso porta a scarichi acidi
Il processo Asahi implica l’idratazione del cicloesene con acqua su
HZSM-5 - selettività: 95%
+
Cataliz.
H2O
Attilio Citterio
OH
Ossido Nitroso ed Acido Adipico
HNO3
L’N2O è un gas serra 200 volte più
potente della CO2
Anche implicato nel danneggiamento
dello strato di ozono
2 N2O
2 H2O
Opzioni di Controllo
• CH4 + 4N2O = 4N2 + CO2 + 2H2O
• N 2O
+ 0.5O2 = N2 + O2
La concentrazione atmosferica di
310 ppb e aumenta del 6% p.a.
• N2O + 0.5O2 = 2NO (Acido nitrico)
Prima del 1998 il 10% dell’N2O
derivava dalla produzione dell’acido
adipico
Opzione a lungo termine
glucosio enzima HO2CCH2CH2CH2CH2CO2H
H2 Pt
Acido adipico
J W Frost & K M Draths, Chem. Br.1995, 31 206
Attilio Citterio
Schema di Ciclo di Vita di un Processo
Tradizionale di Produzione dell’Acido Adipico
Energia
Emissioni
Estrazione
del petrolio
Sottoprodotti
Petrolio
Energia
Derivati del
benzene
Benzene
Sottoprodotti
Attilio Citterio
Acido Adipico
Produzione
dell’acido
adipico
N2O
Altri Prodotti
Processo di Produzione della Cicloesanone
Ossima
Processo Precedente
Processo di Ammossimazione
(NH4)2SO4
Ossimazione
Ossimazione
NH3
(NH3OH)2SO4
H 2O 2
H2
dil. H2SO4
NH3
Aria
NO
O2
H2
NH3
Attilio Citterio
Ossidazioni Catalizzate dalle Titanio Silicaliti
OH
NOH
O
R
OH
R
O
Ar-OH
NH3
TS-1
+ 30% H2O2
R 2S
R2SO
RR1CHOH
RR1C=O
1983 – Scoperta Enichem
(B. Notari, Stud. Surf. Sci. Catal., 1988, 37, 413)
Attilio Citterio
Ossidazione Selettiva dell’Alcol Benzilico in
un Reattore a Membrana
Struttura del reattore a membrana
Acquoso
Organico
Ossidazione catalizzata per trasferimenti di fase (PCT)
CH2OH
+
CHO
OClR4N+X-
COOH
+
• Differente cinetica per l’alcol ad aldeide e per l’aldeide ad acido
• A condizioni di flusso ottimali si può mantenere una selettività del 100%
in aldeide
Attilio Citterio
Catalisi a Trasferimento di Fase – Sistemi a
Nanofiltrazione
FASE ACQUSA
KI
KBr
FASE ORGANICA
RBr
RI
RICICLO DEL CATALIZZATORE
Prodotto
unità NF
Luthra et al, Chem. Commun., 2001, 1468
Attilio Citterio
Isomerizzazione Catalizzata da Base Solida
Na/NaOH - Alumina
ENB
VNB
• I processi industriali catalizzati da basi solide sono relativamente rari
• La Sumitomo ha sviluppato un processo per convertire VNB in ENB
• Questo processo elimina l’uso di Na/K in ammoniaca liquida
• ENB è usato come componente chiave nelle gomme EPDM
Attilio Citterio
Catalisi Acido-Base / Etileneimmina
Usato come intermedio per farmaceutici
La produzione convenzionale forma 4 ton. di solfato di
sodio per 1 ton. di etileneimmina
Il processo Nippon Shokubai combina pulitamente i due
stadi usando un catalizzatore solido di ossido di
Si/Ba/Cs/P.
selettività dell’81% a conversione del 86%
H2N
OH
+ H2SO4
H2N
Attilio Citterio
NaOH
OSO3H
N
H