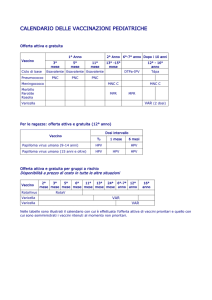
La Vaccinazione HPV:
La Ricerca
Paola Garutti
Clinica Ostetrica e Ginecologica
Ferrara
Stato attuale della ricerca sui vaccini
1. Vaccini profilattici
2°generazione
2. Vaccini terapeutici
3. Vaccini ad effetto combinato
Background
Meccanismo d’azione dei vaccini
VACCINI
PROFILATTICI
VACCINI
TERAPEUTICI
Antigeni :
Oncoproteine
Antigeni:
Capside
VACCINI
PROFILATTICI
Capside
Anticorpi anti HPV
Bloccare l’entrata del
virus nella cellula
VACCINI
TERAPEUTICI
Oncoproteine
T cells citotossiche
specifiche
Eliminare la cellula
infetta/malata
I vaccini profilattici attuali sono basati su antigeni VLP
(Virus Like Protein) -L1 di HPV 16-18
HPV 16-18
Epitelio
VACCINI TERAPEUTICI
Sensibilizzazione specifica delle cellule T
Cellula
dendritica
Linfonodo
Tumore
WU R, Monie NIH 2010
1.Vaccini profilattici
Perchè fare ricerca su vaccini profilattici?
40
44
PCV1
11
13
55
7
39
32
42
70
59
18
27
45
2a
57
61
6
73
3
34
10
28
29
RhPV1
58
33
51
26
52
35
16
56
31
66
30
53
Vaccini attuali molto specifici per 16-18 con alta immunizzazione
prolungata
• Azione debole e forse breve la cross -reattività con tipi affini
(31,33,45)
Adattato da de Villiers E, et al. Virology 2004; 324:17–27.
•
Non proteggono da tutti i carcinomi: circa 1/3 sono
da altri sottotipi virali
– Epidemiologia mondiale degli HPV correlati a carcinomi varia
per aree geografiche:
HPV 16/18 sono causa di carcinoma nel
– >70% Nord America ed Europa
– 65% Africa
– <60% Asia e America Centrale-Sud
• Rischio di rimpiazzo e competizione da parte di altri
HPV nel futuro
• Vaccinazione impraticabile nei paesi in via di sviluppo
(procedure complesse di produzione e purificazione, costi e
organizzazione complessa)
Orientamento attuale della ricerca
• COPERTURA VIRALE
– Vaccino nona-valente (VPL L1)
– Vaccini regione-specifici pluri-valenti (VPL L1)
– Vaccino universale (VLP L2)
• COSTI
– Dosi ridotte
– Tecnica di produzione
– Via di somministrazione
Stato della Ricerca
sull’aumento della
Copertura virale
1 ) Vaccino nona-valente
Studi in fase III
induce anticorpi verso VLP- L1
dei seguenti HPV:
6,11,16,18 +
31, 33, 45, 52 e 58.
Potrebbe coprire il 90%dei tumori
Effetti dei vaccini attuali:
Modello matematico predittivo
Condilomi
CIN2-3
Carcinoma squamoso
J Nat Canc Inst 2012
Bi -Quadrivalemte
vs Nonavalente
Condilomi
protezione + 9 /12%
CIN2-3
Il nonavalente ha un
potenziale teorico di
ridurre nel lungo
termine l’incidenza
delle lesioni
precancerose e il
carcinoma squamoso
della portio
protezione + 4,4 / 6.6%
Carcinoma squamoso
J Nat Canc Ins 2012
Bi -Quadrivalemte
vs Nonavalente
Il nonavalente ha
un potenziale
teorico basso di
ridurre nel lungo
termine
l’incidenza di altri
carcinomi HPV
correlati
J Nat Canc Ins 2012
Nonavalente: quesiti
• Diminuita efficacia per gli HPV principali (1618) ?
• Studi di efficacia sulla popolazione:occorrono
20-30 anni per il carcinoma?
• Reale utilità di passare alla 2° generazione di
vaccini: dimostrare con studi di popolazione
quanto la maggior copertura sia utile?
J Nat Canc Ins 2012
Nonavalente-Clinical trial .gov
Luxembourg A. 9-valent HPV (9vHPV) vaccine program,
key results [Presentation]. Meeting of the Advisory
Committee on Immunization Practices, Atlanta, Georgia,
February 27, 2014.
ACIP Atlanta 27 febbraio 2014
Nonavalente-Clinical trial
Luxembourg A. 9-valent HPV (9vHPV) vaccine program, key results
[Presentation]. Meeting of the Advisory Committee on Immunization
Practices, Atlanta, Georgia, February 27, 2014.
ACIP 27 febbraio 2014
Copertura virale
2) Altre ricerche sui vaccini profilattici VLP-L1
(fase preclinica o su volontari )
Vaccini con valenza specifica di area geografica
Ad esempio :
Associazione di HPV 16-18 e 52,45,31 in Argentina
Associazione HPV 16-18 e 45,33,35 in India
Asia sud – Corea su HPV 58
Cina su HPV 33
Tipi di HPV nelle CIN2+ ed Etnia
Copertura virale
3) Vaccini profilattici VLP-L2
Studi in fase pre-clinica
(in laboratorio)
L1 proteina maggiore del capside
L2 proteina minore
del capside
Solo quando il virus si lega alla membrana basale si
modifica ed espone L2 per interagire con la cellula
Proteina rimasta stabile nel tempo , oggi è ancora
comune a molti sottotipi di HPV
Pan-vaccino VLP- L2
Risultati fino ad oggi
+
+
-
Induce anticorpi meno specifici e quindi attivi
verso molti sottotipi di HPV
Si può produrre con tecniche meno costose
Induce anticorpi meno potenti di L1, a basso titolo
ed è ipotizzabile un numero alto di nonresponders
Stato della Ricerca
sulla riduzione dei
Costi
dei vaccini profilattici
COSTI
Altre ricerche sui vaccini profilattici VLP-L1
(fase preclinica o su volontari)
Produzione
su capsomeri (pentameri)
su batteri ( E.coli, Salmonella enterica,Drosophila.Listeria M.)
meno costosi e stabili a temperatura ambiente
su piante transgeniche (pomodoro, patate, tabacco)
Vie somministrazione
per inalazione nasale o per via vaginale o per via sublinguale
per risolvere il problema della somministrazione con
siringhe,costi,catene del freddo ecc .
Costi
Riduzione del numero di Dosi
Bivalente
Quadrivalente
età
9-14
9-13
dosi
due
due
tempo
0-6
0-6
sesso
Femmine
Femmine-Maschi
EMEA 2013-2014
JAMA 2013 Dobson SR
JAMA 2014 Hervweijer E
Paesi che hanno approvato 2 dosi
BIVALENTE
QUADRIVALENTE
Europa (EMEA)
Europa (EMEA)
Italia
Canada
Lombardia
Brasile
Puglia
Colombia
Toscana
Sardegna
Piemonte
Trentino
Liguria
2.Vaccini terapeutici
Vaccini terapeutici
Perché fare ricerca?
- I vaccini profilattici non sono terapeutici e non
controllano pre-esistenti infezioni
-
Costarica Trial Group-vaccino bivalente a 12 mesi regressione infezione HPV
48.9% vs 49.8% placebo
Future II-vaccino quadrivalente-in 2 aa progressione di HPV 16-18 prevalenti
verso CIN 2+ 11.2% vs 11.9 %placebo
Chi è già infetto non è protetto perché le cellule basali infettate non esprimono
L1-L2 e l’adiuvante sembra inibire una possibile risposta T cells per la induzione
di IL10
- Alta prevalenza di infezioni HPV già in atto nella
popolazione non vaccinata
-
Terapie antivirali :ricerche in corso ,risultati non prima di 10-20 anni
- Necessità di nuove ed efficaci terapie per le
malattie HPV- correlate, soprattutto antitumorali e
verso le infezioni latenti
Background
• I vaccini terapeutici utilizzano come
antigeni le 2 oncoproteine E6-E7
che sono presenti nelle H-GIN
(CIN,VAIN,VIN,AIN) e nei Carcinomi
HPV correlati
E6-E7 sono antigeni ideali
• Espressione continua
– Le proteine restano espresse sulla cellula perché necessarie
per innescare la trasformazione cellulare neoplastica
Indispensabili per la progressione e il
mantenimento dell’espressione morfologica del
fenotipo maligno
• Specifiche delle cellule malate:
-
– espresse sempre e solo nelle cellule malate quindi il
vaccino non danneggia le cellule sane dell’ospite
• Estranee all’ospite
– non inducono tolleranza
Meccanismo d’azione del vaccino
terapeutico
E6-E7 applicati
:
molecole
complesse
su vettori
Cellula
dendritrica
Lin K, Wu T, NIH 2010
VACCINI TERAPEUTICI
STATO DELLA RICERCA
Risultati attuali
Studi in fase pre-clinica e trials clinici Fase I-II
• Fino ad oggi
– Efficaci sugli animali
– Scarsa efficacia dei vaccini E6-E7
sull’uomo
• Ben tollerati-sicuri
• Risposta T Cells specifica che non si
correla necessariamente alla risposta
clinica
Criticità da risolvere
IMMUNOGENICITA’
– E6 E7 scarso potere antigenico
– Trovare adiuvante forte che aumenti potere antigenico e non
sia tossico
VETTORE
– Vettori studiati non sono ancora ideali
– Basati su proteine-peptidi
– Basati su vettori batterici/virali (Adenovirus, Salmonella,
Listeria) : i più potenti. Rischio di infezioni
– Vaccini cell-based (dendriti, cell tumorali)
– DNA vaccini : più studiati perché sicuri, semplici,e di facile
preparazione, rischio di creare carcinomi se E6-7 DNA
– Trovare vettori poco costosi, non dannosi, efficaci nel
trasporto degli antigeni E6/E7
Stanley 2012
Criticità da risolvere
RISPOSTA IMMUNOLOGICA
– Risposta immunosoppressiva con T Cells
regolatorie che contrastano i Linfociti T citotossici
– Microambiente locale spesso ostacolante la
infiltrazione delle cellule T nella lesione:
• i linfociti vengono bloccati perché si legano allo stroma dei
microvasi e non riescono ad infiltrare la lesione
Stanley 2012
•
•
•
•
•
Studi recenti su uomo
(Fase I-II)
Ca collo-testa
Ca invasivo e metastasi
CIN2-3
CIN 1
VIN3
Meyer S. Acta Obstet.Ginecol.Scand 2014
Van Meyr H Anticancer Agents Med Chem 2014
Vici P Biomed Central 2014
VIN 3
Kenter 2009 Fase II
vaccino long-peptide HPV 16 E6/7+ adiuvante
Ipotesi: effetto terapeutico su VIN 3 HPV 16 +
Studio:
20 donne con VIN 3 refrattarie a terapie e longstanding, trattate
con 3-4 dosi del vaccino e controllate a 3 mesi e 12, fino a 24
Risultati:
già a 3 mesi si osserva riduzione dei sintomi e scomparsa di
lesioni
A 12 mesi :
9 regressioni complete istologiche (47%)
10 NR
6 parziale risposta (32%)
4 non risposta (1 diventa Ca dopo 10 anni di persistenza)
Conclusioni: 47% vs 1,5 % di regressione
spontanea, vaccino ben tollerato.
Il Futuro dei vaccini terapeutici
Potrebbero essere una valida terapia per lesioni che
esprimono HPV E6-E7 sia precancerose che tumori
di vari organi
• La combinazione di trattamenti per i carcinomi ha un
potenziale per migliorare la prognosi.
• Chemioterapia e radioterapia potrebbero
essere somministrate in dosi minori meno tossiche
Van Meir Review 2014
Kenter G Review 2014
Conclusioni
Il futuro è avere due armi che agiscono da punti diversi per combattere i danni
prodotti da HPV: la profilassi e la terapia.
A piccoli passi la ricerca sta continuando…..
Grazie !
• FINE
3. Nuovi vaccini con funzione
profilattica e terapeutica
Studi pre-clinici e clinici
•Roden et al
VACCINO TA-CIN HPV 16
L2 + E6-E7
Ipotesi: combinare effetto profilattico ad ampio spettro di vaccino
VLP L2 con effetto terapeutico di vaccino basato su oncoproteine
E6/7
John Hopkins University USA 2012
• Faulstich et al
VACCINO HPV16 L1
–P16INK4A
Ipotesi: sintetizzare un capsomero virale stabile che esprime sia
proteina L1 che p16 iperespressa nei tumori e non nelle cellule
normali.
Valutare se una tale chimera è in grado di indurre anticorpi
neutralizzanti anti L1 e cellule citotossiche specifiche verso p16
German Cancer Research Center Germany 2012
Lesioni intraepiteliali
Studio in Fase III
•
•
•
•
Pazienti: 1176 donne-180 uomini
Vaccino MVA E2 ricombinante
Iniezione intralesionale (Utero,uretra,vulva,ano)
Risultati:dopo un anno
– Donna
• 89.3% regressione completa
• 2.4% regressione a CIN 1
• 8.3% coilociti rari
– 83% negativi per HPV DNA
Rosales R 2014-Hum Gen Ther
Considerazione finale
• Tutti gli studi sono in fase di ricerca iniziale, pre-clinici su
modelli animali o su pochi casi (Fase I-II) e solo per
vaccino 9-valente è in corso Fase III
Ricerca
di base
Casi clinici
Fase I-II
Trials clinici
Fase III
Applicazione
clinica
Disseminazione e
valutazione di
impatto
• La traslazione verso l’applicazione clinica di
nuovi vaccini è per ora solo ipotizzabile ma
non ancora validata
Studi recenti per aumentare
immunogenicità di L2
Modelli sperimentali su animali
Jagu
vaccino L2 polimerico:
polimerico concatenazione di
più L2 provenienti da diversi HPV
•
Risultati:
• Induce risposta anticorpale robusta e
persistente per diversi mesi verso ampio
spettro di HPV oncogeni
• Ancora di più se con adiuvante
• Antisiero copre anche altri sottotipi di HPV
Int J cancer 2009.101: 782-792
Kirnbauer
Chimera: L2 inserito sulla superficie
immunogenica di L1 (RG1- VLP)
- induce risposta di anticorpi neutralizzanti
verso HPV 16,18,31,45, 52, 58, 6-11, 5.
- Antisiero cross-reagisce neutralizzando
anche 26,33,35,39,56,59,68,73 e LRisk 32
e 2, 27,3,76
Cioè copre verso HPV filogeneticamente diversi
ad alto rischio 16, 18, 45,73, 56, 59
Jhons Hopkins University Baltimora (USA)
Altri vaccini
3. Kuburu (NIH Bethesda):
immunizzazione intravaginale nei topi
con pseudo-virioni costituiti da L1 e L2
proteine del capside fanno aumentare le
CD8+ T cells di 10 volte almeno per 100
giorni
• Vaccini Terapeutici
Webb et al (Canada) - CARCINOMA
Vaccino verso E7 di HPV 16,18,31,45,52
(Pentarix) basato su proteine ricombinanti +
adiuvante
Risultati :
-induce una forte risposta immunitaria delle CD8+ T
Cells multi-genotipica specifica sui topi
-provoca la regressione di tumori che esprimono
*
E7
*Regressione dei tumori impiantati sui topi trattati con Vaccino anti E7
potenziato con adiuvante e di HPV 16, 18, 31, 45, 52 (Pentarix)
Non
Non trattati
trattati
Senza adiuvante
Adiuvante 1
Adiuvante 2
Volume del
tumore
Webb J, Vaccine 2011
Studi recenti sperimentali su modelli animali
Sharma R et al (USA) : vaccino HPV16- E7 +
•
•
adiuvante potente (Steptavidina):
Risultati: una singola dose eradica Carcinoma E7 +
impiantato sui topi nel 70% per 90 gg.
Meccanismo azione attribuibile all’adiuvante:
•
•
•
•
Stimolazione della memoria CD4+ e CD8+
Risposta delle citochine
Infiltrazione di cellule nel tumore
Aumento delle cell Killer NK
Sharma R et al ,Vaccine 2010
VIN : Perché non-responders?
CR
Diametro minore
• 1° vaccinazione
– Risposta iniziale di
TCells + forte e rapida
– INFγ/IL5-10 + alta
• 2° vaccinazione
– INFγ/IL5-10 più alta
NR
Diametro maggiore
• 1° vaccinazione
– Risposta iniziale di
TCells + debole
– INFγ/IL5-10 + bassa
• 2° vaccinazione
– INFγ/IL5-10 più bassa
– T cells regolatori alta
Viraggio della risposta immunitaria
sfavorevole nelle lesioni più grandi
Welter-Kenter 2010
Importanza del tipo di risposta immunitaria
indotta dal vaccino
Welter –Kenter 2010: VIN 3
– Successo legato alla stimolazione risposta Th1
Tcells citotossiche >Tcells regolatorie
– Fallimento legato alla stimolazione del
meccanismo regolatorio
– Necessari studi per inibire la risposta
regolatoria
Ipotesi : Modulare l’Ambiente immunitario locale per una
piattaforma locale favorevole al vaccino e indurre forte
risposta sistemica
Daayana 2010 Fase II
vaccino HPV 16-18
E6/7/ L2 + imiquimod come
immunomodulatore-adiuvante in pretrattamento
Studio:
19 VIN 2-3 (18-70 anni) cronici (1-20 anni) resistenti alla terapia
Imiquimod x 8 settimane e 3 dosi vaccino a seguire
Risultati:
63% di regressione a 52 settimane
79% asintomatiche
36% HPV free
Complete Responders : forte risposta sistemica e infiltrazione locale di
TCells citotossici e no risposta di TCells regolatori
Non responders. Scarsa risposta T Cells citotossiche specifiche
Elevata risposta sistemica e locale di Tcells regolatorie
Conclusione : Responders e non responders
hanno una diversa reazione immunitaria locale e
sistemica
Inibizione dell’effetto di attivazione
dei T linfociti regolatori
Studi preclinici (animali)
• CAO 2010
condiloma gigante laser + ciclofosfamide a basse dosi
riduzione delle T Cell regolatorie e assenza di recidive
• CURRAN 2010 e SHARMA altre strategie sui
recettori
• CHUANG 2011
Anticorpi monoclonali per distruggere le T Cells
regolatorie e poi un vaccino E7
Carcinoma
Gillison M. (2011) : Pazienti con Ca collo-testa HPV
16+: aumentata risposta per E7, ben tollerato
Alvarez S. (2011) ( in corso ) Ca stadio 1B1, vaccino
a dosi ripetute ben tollerato
CIN2-3
Solares (2011): Vaccino HPV 16-E7 + adiuvante
7 donne con CIN 2-3
5/7 regredite dopo vaccino entro un anno di follow-up
3/5 HPV clearance.
Tutte le donne hanno risposta immune
Trimble C (2011) : Vaccino HPV 16-E7
9 donne con CIN 2-3 esprimenti E7
3 /9 lesioni regredite
In corso Fase II
CIN2-3
Bagarazzi et al (2012) fase I
Vaccino HPV 16-18 E6/7 + elettroporazione
18 CIN2-3 trattati chirurgicamente /3 dosi crescenti di vaccino
Risultati:
no effetti collaterali- ben tollerato
INF٧ in aumento con le dosi
CD8+ T cells specifiche
Bagarazzi: fase II- dati nel 2013
150 CIN2-3 non trattati
Tecnica : i.m. + elettroporazione
Ipotesi: maggior penetrazione degli antigeni per raggiungere
le cellule dendritiche
Eliminare cell infette e successiva regressione del processo
displastico
Sci.Translation Med.ott 2012
Bivalente
Uguale immunogenicità 2 dosi vs 3 dosi
Romanowsky-Eurogin 2013
www.gsk-clinicalstudyregister.com