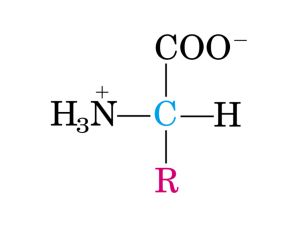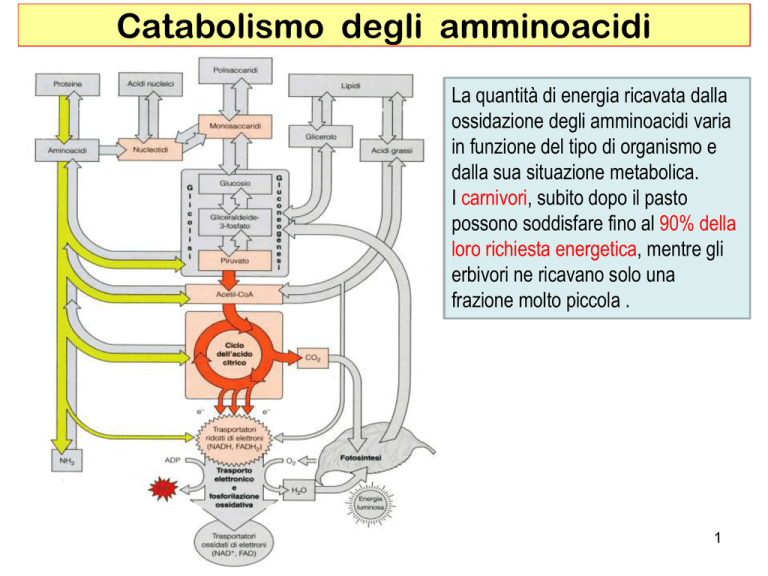
Catabolismo degli amminoacidi
La quantità di energia ricavata dalla
ossidazione degli amminoacidi varia
in funzione del tipo di organismo e
dalla sua situazione metabolica.
I carnivori, subito dopo il pasto
possono soddisfare fino al 90% della
loro richiesta energetica, mentre gli
erbivori ne ricavano solo una
frazione molto piccola .
1
Degradazione delle proteine della dieta
Proteine
▼
H+
Inibitori della tripsina per
evitare la pancreatite acuta
Pepsinogeno
(zimogeno)
pH 1,5÷2,5
(antisettico &
denaturante)
▼
Secretina
▼
Pancreas
▼
Gastrina
▼
HCO3(pH~7,0)
▼
Pepsina
(Phe,Tyr,Trp)
Peptidi
▼
▼
Stomaco
Duodeno
Colecistochinina
Enteropeptidasi Intestino
tenue
▼
TripsinogenoTripsina (Lys, Arg)
(Phe Tyr,Trp) ChimotripsinaChimotripsinogeno
▼
ProcarbossipeptidasiCarbossipeptidasi
▼
Amminopeptidasi
Amminoacidi liberi
2
Metabolismo degli amminoacidi nei mammiferi
(Glutammato)
(a-chetoglutarato)
Gli amminoacidi possono
subire una degradazione
ossidativa in tre diverse
situazioni metaboliche
Durante una dieta ricca
in proteine (Il surplus viene
degradato; non esistono
forme di riserva degli
amminoacidi)
Durante il turnover
proteico (soprattutto gli
amminoacidi non essenziali)
Durante il digiuno o nel
diabete mellito (come fonte
di energia in sostituzione dei
carboidrati)
3
Catabolismo dei gruppi amminici negli animali
girino
Un esempio di
adattamento
metabolico
Amminoacidi
rana
Composto poco
solubile, eliminato
come massa semisolida con le feci
4
Vie di escrezione dell’azoto dei nucleotidi
Nucleotidi
Pirimidinici
Nucleotidi
purinici
NH4+
Immunodeficenza da
carenza di ADA
Urea
inibitori
competitivi
5
Catabolismo della timina
Catabolismo dei gruppi amminici negli animali
Deamminazione
ossidativa
Transamminazione
Glutammato
deidrogenasi
ATP
Mitocondri
Transamminazione +
Deamminazione =
Transdeamminazione
7
Le reazioni di transamminazione (1)
Il fine delle reazioni di transamminazione è
quello di raccogliere i gruppi –NH3 dei 20
L-amminoacidi, provenienti dalla
proteolisi, in un unico amminoacido
“il glutammato”
Reazione catalizzata dalle
amminotransferasi o transamminasi
che richiedono come gruppo prostetico il
piridossal fosfato (PLP) la forma
coenzimatica della piridossina o
vitamina B6
8
Le reazioni di transamminazione (2)
La valutazione dei livelli di alanina amminotransferasi (ALT o glutammato-piruvato
transferasi, GPT) e aspartato amminotransferasi (AST o glutammato-ossalacetato
transferasi , GOT) nel siero, è un test diagnostico per valutare danni cardiaci (infarto) o epatici
(intossicazione da farmaci o da prodotti industriali come solventi organici epatotossici)
Es: nell’infarto il
primo enzima in
eccesso presente
nel sangue è la
piruvato chinasi
(PK), il secondo
è la GOT e per
ultimo il GTP
ALT o GPT
CH3
L-Alanina
AST o GOT
CH3
Piruvato
CH2
CH2
COOH
COOH
L-aspartato
Ossalacetato
9
Trasporto –NH4+ dai tessuti al fegato
Tessuti
(muscolo
compreso)
Negli animali ureotelici, l’ammoniaca, presente in
forma solubile come –NH4+, è estremamente tossica
(turbe mentali, ritardo nello sviluppo, fino al coma e
alla morte ad alte concentrazioni).
Quella prodotta nei tessuti extraepatici (catabolismo
delle proteine e degli acidi nucleici) deve essere
trasportata al fegato dove viene trasformata in urea
e inviata ai reni per essere smaltita con le urine
Principale forma di trasporto non tossico
dell’ammoniaca grazie alla sua carica netta nulla che
gli permette di attraversare la membrana plasmatica
sangue
Reni
Urine
Fegato
10
Ciclo della glucosio-alanina
Un esempio di economia cellulare
NAD+
Glutammato
deidrogenasi
NADH+H+
Nel muscolo in forte attività il
trasporto dell’ammoniaca in eccesso
prodotta dalla degradazione delle
proteine avviene anche attraverso
l’alanina, un altro amminoacido come
la glutammina con carica netta nulla.
Il vantaggio di questa via è che
contemporaneamente vengono
allontanati dal muscolo sia lo ione
ammonio sia il piruvato prodotto dalla
glicolisi anaerobica, molto attiva nel
muscolo in forte attività. In queste
condizioni, insieme al ciclo di Cori, si
trasferisce il dispendio energetico per
la gluconeogenesi al fegato e tutto
l’ATP muscolare può essere utilizzato
per la contrazione.
11
Ciclo dell’urea (1)
Matrice mitocondriale
epatica
ciclo dell’urea
12
Ciclo dell’urea (2)
Carbamil fosfato
Ornitina transcarbammilasi
arginosuccinato
sintetasi
arginasi
arginosuccinasi
13
Meccanismo d’azione della carbamil fosfato sintetasi I
mista
Biciclo di Krebs
ossalacetato
15
Bilancio energetico
I collegamenti tra i due cicli riducono i costi energetici dello smaltimento dello ione
ammonio attraverso l’urea
Nel ciclo dell’urea si consumano 4
legami ad alta energia (4 ATP):
• 2 nella sintesi del carbamil fosfato
• 2 nella sintesi dell’arginino succinato
Il consumo reale si
riduce ad 1,5 ATP
grazie al riciclo del
malato in ossalacetato
nel ciclo di Krebs che
recupera 2,5 ATP dalla
riossidazione del NADH
nella catena respiratoria
16
Adattamento metabolico
Nei ruminanti che vivono
in ambienti siccitosi
l’urea è riciclata in
amminoacidi grazie ai
microorganismi presenti
nel rumine
Il riciclaggio degli
aminoacidi in proteine è
presente anche negli
animali in letargo
(Es: l’orso bruno in
letargo non urina)
In entrambi i casi si tratta
di un adattamento
metabolico per:
• evitare la perdita di
acqua attraverso le
urine (camelidi)
• la formazione di urina
• diminuire il consumo
netto di energia chimica
17
Regolazione del ciclo dell’urea (1)
Regolazione a lungo termine
Iperproteica
Aumenta la sintesi della carbamil fosfato
sintetasi e dei quattro enzimi del ciclo
(più urea)
Digiuno
prolungato
Dieta
Ipoproteica
Diminuisce la sintesi della carbamil fosfato
sintetasi e dei quattro enzimi del ciclo
(meno urea)
18
Regolazione del ciclo dell’urea (2)
Regolazione a corto termine
L’arginina, attiva l’N-acetilglutammato
sintasi che catalizza la formazione dell’Nacetilglutammato il quale, oltre a regolare
allostericamente la carbamil fosfato
sintetasi I (enzima di alimentazione del
ciclo dell’urea) è il precursore della sintesi
dell’arginina nelle piante e microorganismi.
Nei mammiferi sono assenti gli altri enzimi
necessari alla sintesi dell’arginina per cui
questo amminoacido diventa essenziale.
Nei felini, dove i livelli di l’arginosuccinasi
sono bassi, la carenza di arginina nella
dieta comporta un sensibile aumento di
ammoniaca nel sangue, con conseguente
vomito, spasmi muscolari, ipersensibilità
sensitiva, fino al coma e morte
(iperammoniemia felina)
19
Vie di degradazione dello scheletro carbonioso degli amminoacidi nei vertebrati
Alcuni amminoacidi
sono indicati più
volte in quanto parti
del loro scheletro
carbonioso sono
degradate in
prodotti finali
differenti.
20
Catabolismo degli amminoacidi a catena ramificata
Sono gli unici amminoacidi ad essere utilizzati come fonte di energia direttamente
nei tessuti extraepatici (soprattutto nel muscolo)
Complesso
multienzimatico
analogo a quello della
piruvato deidrogenasi
21
Biosintesi amminoacidi
N2
22
Ciclo dell’azoto
1011 Kg di azoto fissata annualmente nella biosfera
L’azoto viene fissato dal complesso
della nitrogenasi, presente solo in
alcuni procarioti che spesso vivono
come simbionti nei noduli delle radici
delle piante leguminose
23
Complesso della nitrogenasi (1)
(+2)
(+4)
CH3-C-COOO
=
CO2
Il triplo legame N≡N è molto stabile e per
ottenere ammoniaca occorrono condizioni
di reazione molto drastiche. Il complesso
della nitrogenasi abbassa notevolmente
l’energia di attivazione rendendo possibile
la reazione nelle condizioni biologiche.
Sintesi chimica (processo Haber)
N2 + 3H2
400-500°C, p~ 700atm
ΔG°’=-33,5 kJ/mole
2NH3
Sintesi biologica (fissazione)
16 ATP
N2 + 10H+ +8e-
10H+
16 ADP + 16 Pi
t.a., p~ 0,8atm
2NH4+ + H2
Funzione ATP più catalitica che termodinamica.
Legame ATP alla reduttasi sposta E’° da
24
-300mV a -420mV
Complesso della nitrogenasi (2)
Il complesso della nitrogenasi si denatura rapidamente in presenza di ossigeno
Sezione di un nodulo di leguminosa
I batteri risolvono questo inconveniente in 4 modi:
Fissazione anerobica
Regolazione del consumo di O2 a livello della
catena respiratoria
Formazione di eterocisti (cianobatteri)
Simbiosi con le radici di piante leguminose
Nucleo
Nodulo
N2
Carboidrati
Leghemoglobina
ATP
Catena respiratoria
Batteroide
Membrana peribatteroide
(in rosso)
(in blu)
O2
Lega tutto l’O2 impedendo
l’inattivazione del
complesso della
nitrogenasi
NH4+
Questo fenomeno è alla base della rotazione delle coltivazioni dei cereali con le leguminose
25
Biosintesi amminoacidi
Le piante e i batteri sintetizzano tutti i 20 amminoacidi
I mammiferi sono in grado di produrne solo metà
Non essenziale
Essenziale
Alanina
Glicina
Prolina
Serina
Cisteina
Asparagina
Glutammina
Aspartato
Glutammato
Tirosina *
Valina
Leucina
Isoleucina
Treonina
Metionina
Fenilalanina
Triptofano
Istidina
Lisina
Arginina
* Essenziale se nella dieta non è presente fenilalanina
26
Molecole derivanti dagli amminoacidi (1)
Oltre a formare proteine, gli amminoacidi sono precursori di molte importanti molecole
biologiche quali: ormoni, coenzimi, nucleotidi, porfirine, antibiotici, pigmenti,
neurotrasmettitori
Es 1: Biosintesi gruppo eme & pigmenti biliari
Glicina
Porfirine
Eme
Emoglobina
Fe3+
Bilirubina
Diglucoronide
(FegatoBile)
Bilirubina
(SangueBile)
Trasporto con
sieroalbumina
Biliverdina
Il funzionamento anormale
del fegato o un blocco della
secrezione della bile portano
all’accumulo di bilirubina
nel sangue con conseguente
colorazione giallastra della
pelle e dei bulbi oculari
(Itterizia)
Stercobilina
(Feci)
Urobilinogeno
(Intestino
tenue)
Urobilina
(ReniUrine)
27
Molecole derivanti dagli amminoacidi (2)
Catecolammine
(da catecolo:1,2
diidrossibenzene)
Oltre ad essere
ormoni secreti
dalle
ghiandole surrenali
per regolare il
metabolismo in
condizioni di stress
o calo glicemico,
sono prodotte dal
cervello e da altri
tessuti nervosi per
accelerare il battito
cardiaco e la
pressione del
sangue. Un
eccesso di
Dopamina è
spesso associato
alla schizofrenia,
mentre un difetto al
morbo di Parkinson
Es 2: Neurotrasmettitori per decarbossilazione di alcuni aa
GABA: Inibitore
dell’attività neuronale; in
carenza si possono
avere attacchi epilettici
(Diidrossifenilalanina)
Serotonina:
importante
nella
regolazione
dell‘umore, del
sonno, della
temperatura
corporea,
dell‘appetito.
Un eccesso
causa
emicrania ,
depressione e
ansia
(Norepinefrina)
(Epinefrina)
Istamina: Rilasciata in grandi quantità
durante la risposta allergica; stimola
la secrezione di HCl nello stomaco.
Potente vasodilatatore
28
Metabolismo degli amminoacidi nel fegato
29
Metabolismo degli amminoacidi nel fegato durante il digiuno o nel diabete tipo 1
30
Metabolismo dei nucleotidi
31
Biosintesi “de novo” dei nucleotidi purinici
La sintesi “de novo” delle purine inizia dal
5-fosforibosil 1-pirofosfato (PRPP)
Via del pentosio fosfato
R-5 P
PRPP
Origine degli atomi delle purine
La biosintesi termina con l’inosinato (IMP)
32
Conversione di IMP in AMP e GMP
Biosintesi “de novo”
33
Regolazione biosintesi nucleotidi purinici
Inibizione retroattiva
(feed-back)
34
Biosintesi “de novo” nucleotidi pirimidinici
*
La biosintesi dei nucleotidi pirimidinici inizia con
l’aspartato, carbamil fosfato e PRPP
* La formazione del carbamil fosfato
è catalizzata dalla
carbamil fosfato sintetasi II
(citoplasmatica) diversa dalla
carbamil fosfato sintetasi I
vista nel ciclo dell’urea.
2 ATP
2 ADP
Gln
Glu
chinasi
citidina sintetasi
Uridina 5’-trifosfato (UTP)
Citidina 5’-trifosfato (CTP) 35
I nucleotidi difosfato sono i precursori dei deossinucleotidi
dADP, dGDP
dCDP, dUDP
ADP, GDP
CDP, UDP
36
Biosintesi del timidilato (dTMP)
FdUMP
Metotrexato
Trimetoprin
37
Meccanismo di azione della timidilato sintasi
“Substrato suicida”
38
Chemioterapia con pro-farmaci analoghi di basi e nucleosidi
Strategia
chemioterapica che
sfrutta le vie di
riutilizzazione delle
basi e nucleosidi
purinici e pirimidinici
Analogo
39
Vie di riutilizzazione delle pirimidine (1)
RNA
DNA
CTP
UTP
dCTP
dUTP
dTTP
CDP
UDP
dCDP
dUDP
dTDP
CMP
UMP
dCMP
dUMP
dTMP
CR
H2 O
NH3
UR
U
Sintesi
“de novo”
CdR
H2 O
NH3
UdR
TdR
T
●
Membrana
cellulare
40
Vie di riutilizzazione delle pirimidine (2)
RNA
DNA
CTP
UTP
dCTP
dUTP
dTTP
CDP
UDP
dCDP
dUDP
dTDP
CMP
UMP
dCMP
dUMP
dTMP
CR
H2 O
NH3
Sintesi
“de novo”
UR
CdR
H2 O
NH3
UdR
U
TdR
T
NH2
N
U
O
N
H
●
H
Es: riutilizzazione dell’uracile
Membrana
cellulare
H
41
Azione farmacologica del 5-fluorouracile
RNA
DNA
CTP
5F-UTP
dCTP
dUTP
dTTP
CDP
5F-UDP
dCDP
5F-dUDP
dTDP
CMP
5F-UMP
dCMP
5F-dUMP
dTMP
CR
H2 O
NH3
Sintesi
“de novo”
CdR
5F-UR
5F-U
H2 O
NH3
UdR
TdR
T
NH2
N
5F-U
O
N
H
F
H
42