Chimica Organica
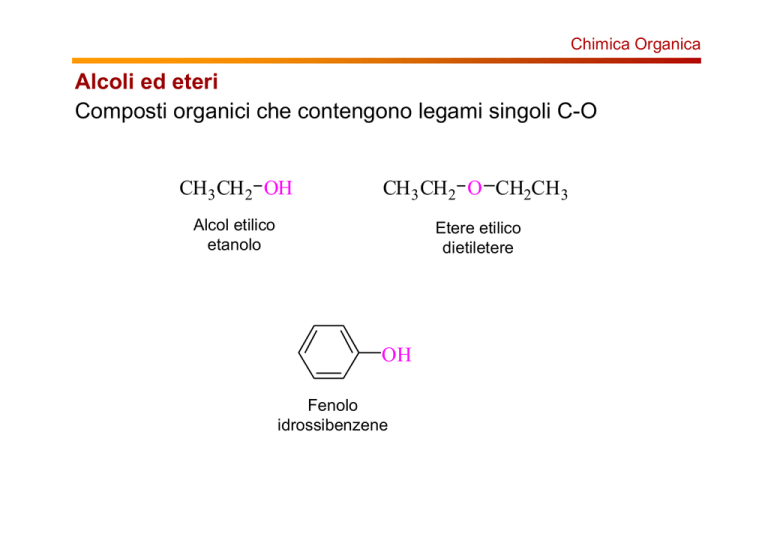
Alcoli ed eteri
Composti organici che contengono legami singoli C-O
CH3 CH2 OH
CH3 CH2 O CH2CH3
Alcol etilico
etanolo
Etere etilico
dietiletere
OH
Fenolo
idrossibenzene
Chimica Organica
Nomenclatura degli alcoli
Si individua la catena di atomi di carbonio più lunga contenente il gruppo
ossidrile e si cambia la desinenza in –olo.
Si numerano i carboni partendo dall’estremità più vicina all’ossidrile
Si assegnano numero e nome a ciascun sostituente che vengano riportati
in ordine alfabetico
Chimica Organica
Nomi comuni
Chimica Organica
Nomenclatura degli eteri
Negli eteri semplici, che non hanno altri gruppi funzionali, si premettono i
nomi dei due sostituenti alla parola etere.
Se ci sono più gruppi eteri o altri gruppi funzionali, allora il gruppo etereo
viene considerato come un sostituente alcossi- del composto.
Chimica Organica
Proprietà degli alcoli
Punti di ebollizione di alcani, cloroalcani ed alcoli
Chimica Organica
Il legame a idrogeno
E’ un legame debole (non covalente) che si instaura tra eteroatomi e atomi di
idrogeno legati a eteroatomi. E’ di natura essenzialmente, ma non solo,
elettrostatica. E’ direzionale.
CH2CH3OH
CH3OCH3
Etanolo (78 ºC)
Dimetil etere (-24ºC)
Chimica Organica
Acidità degli alcoli
Ad eccezione dei fenoli, gli alcoli si comportano come acidi e basi debolissimi
Come base
Come acido
Chimica Organica
Acidità degli alcoli
Ad eccezione dei fenoli, gli alcoli si comportano come acidi e basi debolissimi
Chimica Organica
Acidità degli alcoli
L’anione fenossido è stabilizzato per risonanza.
Chimica Organica
Preparazione degli alcoli
Addizione di H2O ad alcheni (Markovnikov)
CH 3
H 2SO 4
CH 3
OH
H 2O
Sostituzione di alogeni con OHCl
NaOH
OH
Riduzione di aldeidi e chetoni
OH
O
[H]
Riduzione di acidi carbossilici ed esteri
COOH
[H]
CH 2 OH
Chimica Organica
Reazioni degli alcoli
Il gruppo OH è un nucleofilo debole, che può essere convertito in ottimo nucleofilo se
deprotonato. E’ un pessimo gruppo uscente, che può diventare ottimo se protonato.
1. Sintesi degli eteri
2. Sintesi di alogenuri e disidratazione
3. Ossidazione
Chimica Organica
Sintesi degli eteri (Williamson)
La sintesi di Williamson è una reazione di tipo SN2
Chimica Organica
Disidratazione degli alcoli
E’ una reazione di eliminazione E1
Chimica Organica
Disidratazione degli alcoli
Viene seguita la regola di Saitzev
Chimica Organica
Sintesi degli alogenuri
Chimica Organica
Ossidazione degli alcoli
Chimica Organica
Ossidazione degli alcoli
E’ possibile fermare l’ossidazione degli alcol primari al primo stadio (aldeide)
usando un ossidante blando
Un ossidante più forte porta direttamente ad acido carbossilico
Chimica Organica
Reazioni dei fenoli
I fenoli reagiscono come nucleofili all’ossigeno (Williamson) ma non danno eliminazione né
sostituzione nucleofila. Hanno la reattività tipica di un benzene sostituito fortemente attivato
OH
+
+
R
X
Fenolo
OH
OH
NO2
+
SO3
Br
CH3
Alogenazione
Alchilazione
OH
OH
NO2
SO3H
Nitrazione
Solfonazione
Chimica Organica
Ossidazione di fenoli a chinoni
OH
Na2Cr2O7
+
O
O
H3O
Benzochinone
Fenolo
O
O
Benzochinone
NaBH4
Na2Cr2O7
HO
OH
Idrochinone
Chimica Organica
Reazioni degli eteri
Gli eteri sono sostanzialmente poco reattivi, anche se possono esse scissi da
acidi forti. Unica eccezione gli epossidi (o ossirani), eteri ciclici a 3 atomi, che a
causa della grande tensione di anello reagiscono prontamente con nucleofili.
Chimica Organica
Epossidi
La reazione avviene con meccanismo SN2 catalizzato da acidi e porta al diolo
ottenibile dall’alchene originario per addizione anti.
Chimica Organica
Epossidi
OH
OH
OH
OH
OH
O
Benzo[a]pirene
H 2N
HN
Chimica Organica
Tioli e solfuri
Chimica Organica
Disolfuri
La differenza maggiore nelle reazioni di alcoli e tioli sta nelle ossidazioni:
OH
SH
CHO
S S
disolfuro
COOH
SO3H
acido solfonico
Non è l’atomo di carbonio legato all zolfo ad essere interessato dalla reazione ma
l’atomo di zolfo stesso.
L’ossidazione di solfuri a disolfuri avviene in presenza di ossidanti blandi (I2, H2O2) o
addirittura di ossigeno. La reazione può essere invertita con riducenti quali HSO3- o
LiAlH4.
Il legame S-S è molto più stabile (270 KJ/mol) del legame O-O (145 KJ/mol)
Chimica Organica
Ponti disolfuro
I gruppi disofuro formati all’interno di proteine dalle catene laterali dell’amminoacido
cisteina (un tiolo) hanno un ruolo fondamentale nel determinare la conformazione
delle proteine stesse.