caricato da
common.user18060
Formulario di Chimica Analitica: Metodi Volumetrici e Ottici

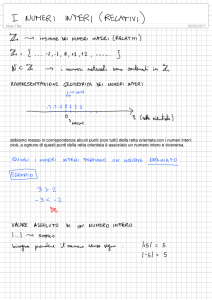
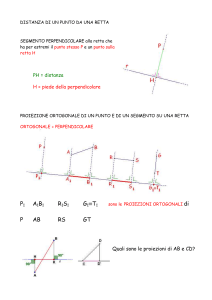
FORMULARIO Cap 1 : Metodi volumetrici di analisi Normalità : La normalità o concentrazione normale (N) di una soluzione è il numero di equivalenti di soluto contenuti in un litro di soluzione. 𝑛𝑒𝑞 𝑁= 𝑉 𝑔𝑟𝑎𝑚𝑚𝑖 𝑛𝑒𝑞 = 𝑝𝑒𝑠𝑜 𝑒𝑞𝑢𝑖𝑣𝑎𝑙𝑒𝑛𝑡𝑒 𝑝𝑒𝑠𝑜𝑒𝑞 = 𝑃.𝑀. 𝑣𝑎𝑙𝑒𝑛𝑧𝑎 𝑜𝑝𝑒𝑟𝑎𝑡𝑖𝑣𝑎 𝑁 = 𝑀 𝑥 𝑣𝑎𝑙𝑒𝑛𝑧𝑎 𝑜𝑝𝑒𝑟𝑎𝑡𝑖𝑣𝑎 Si ricorda che : La valenza operativa di un acido è pari al numero di idrogenioni (H+) che vengono rilasciati durante il processo di dissociazione dell’acido : H2SO4 → 2 H+ + SO42valenza operativa = 2 La valenza operativa di una base è pari al numero di ossidrili (OH ) che vengono rilasciati durante il processo di dissociazione della base Ca(OH)2 → Ca2+ + 2 OHvalenza operativa = 2 La valenza operativa di un sale è pari al numero di ioni carichi positivamente rilasciati durante il processo di dissociazione del sale : K2SO4 → 2 K+ + SO42valenza operativa = 2 Molarità : La molarità o concentrazione molare esprime il numero di moli di soluto contenute in un litro di soluzione. molsoluto M= Vsoluzione M= % p/p x d x 1000 100 PM 𝑀= 𝑀= = 𝑝/𝑝 𝑥𝑑 100 % 𝑃𝑀 p p % x d x 10 PM se d è in g/ml se d è in g/L 𝑁 𝑣𝑎𝑙𝑒𝑛𝑧𝑎 𝑜𝑝𝑒𝑟𝑎𝑡𝑖𝑣𝑎 Molalità : La molalità o concentrazione molale rappresenta il numero di moli di soluto contenuto in 1 Kg di solvente. 𝑚𝑜𝑙𝑠𝑜𝑙𝑢𝑡𝑜 𝑚= 𝐾𝑔𝑠𝑜𝑙𝑣𝑒𝑛𝑡𝑒 Osmolarità : (unità di misura = Osm) Per un elettrolita debole (non si dissocia subito completamente ma ha più equilibri di dissociazione) : 𝑂𝑠𝑚 = 𝑀 Per un elettrolita forte (si dissocia completamente in un unico equilibrio di dissociazione) : 𝑂𝑠𝑚 = 𝑀 𝑥 𝑛° 𝑑𝑖 𝑖𝑜𝑛𝑖 Si ricorda che : Il numero di ioni in questo caso si riferisce a tutti gli ioni che si formano durante la dissociazione, cioè : H2SO4 → 2H+ + SO42- il numero di ioni è pari a 3 FeSO4 → Fe2+ + SO42- il numero di ioni in questo caso è pari a 2. Frazione molare : La frazione molare di un dato componente “a” di una soluzione è il rapporto tra il suo numero di moli e le moli totali di tutti i componenti della soluzione. 𝑋𝐴 = 𝑚𝑜𝑙𝐴 𝑚𝑜𝑙𝑡𝑜𝑡𝑎𝑙𝑖 Densità : è dato dal numero di grammi di solvente sul volume di solvente. d = g/V Concentrazione percentuale in massa : è il numero di grammi di soluto sciolti in 100 g di soluzione : 𝑚𝑎𝑠𝑠𝑎 𝑠𝑜𝑙𝑢𝑡𝑜 (𝑔) % p/p = 𝑚𝑎𝑠𝑠𝑎 𝑠𝑜𝑙𝑢𝑧𝑖𝑜𝑛𝑒 (𝑔) 𝑥 100 % p/p = (% p/V) / d Concentrazione percentuale in volume : è il numero di grammi di soluto sciolti in 100 ml di soluzione : 𝑚𝑎𝑠𝑠𝑎 𝑠𝑜𝑙𝑢𝑡𝑜 (𝑔) % p/V = 𝑉𝑜𝑙𝑢𝑚𝑒 𝑠𝑜𝑙𝑢𝑧𝑖𝑜𝑛𝑒 (𝑚𝐿) 𝑥 100 % p/V = % p/p x d Concentrazione percentuale volume su volume : è il numero di millilitri di soluto disciolti in 100 ml di soluzione : 𝑉𝑜𝑙𝑢𝑚𝑒 𝑠𝑜𝑙𝑢𝑡𝑜 (𝑚𝑙) % V/V = 𝑉𝑜𝑙𝑢𝑚𝑒 𝑠𝑜𝑙𝑢𝑧𝑖𝑜𝑛𝑒 (𝑚𝑙) 𝑥 100 ppm, ppb, ppt : esprimono la concentrazione di soluto quando la soluzione è molto grande. Parti per mille (Parts of thousands): 𝑔𝑟𝑎𝑚𝑚𝑖 𝑑𝑖 𝑠𝑜𝑙𝑢𝑡𝑜 1 ppM = 1 ppt = 𝑔𝑟𝑎𝑚𝑚𝑖 𝑑𝑖 𝑠𝑜𝑙𝑢𝑧𝑖𝑜𝑛𝑒 𝑥 103 Parti per milione (Parts of million): 𝑔𝑟𝑎𝑚𝑚𝑖 𝑑𝑖 𝑠𝑜𝑙𝑢𝑡𝑜 1 ppm = 𝑔𝑟𝑎𝑚𝑚𝑖 𝑑𝑖 𝑠𝑜𝑙𝑢𝑧𝑖𝑜𝑛𝑒 𝑥 106 Parti per billione (Parts of billion): 𝑔𝑟𝑎𝑚𝑚𝑖 𝑑𝑖 𝑠𝑜𝑙𝑢𝑡𝑜 1 ppb = 𝑔𝑟𝑎𝑚𝑚𝑖 𝑑𝑖 𝑠𝑜𝑙𝑢𝑧𝑖𝑜𝑛𝑒 𝑥 109 Parti per trilione (Parts of trillion): 𝑔𝑟𝑎𝑚𝑚𝑖 𝑑𝑖 𝑠𝑜𝑙𝑢𝑡𝑜 1 ppt = 𝑔𝑟𝑎𝑚𝑚𝑖 𝑑𝑖 𝑠𝑜𝑙𝑢𝑧𝑖𝑜𝑛𝑒 𝑥 1012 NB! Notare anche che il simbolo "ppt" è a volte usato per indicare "parti per mille" (parts per thousands) e a volte per indicare "parti per trilione". Miscele : I volumi nelle miscele non sono mai additivi tranne nei casi in cui si ha una miscela dello stesso componente o se viene specificatamente indicato nell’esercizio. Nel caso in cui i volumi non sono additivi sarà presente un qualcosa che permetterà di calcolare il volume finale, mentre nel caso i volumi siano additivi basta impostare questo sistema : V3 = V1 + V2 M1V1 + M2V2 = M3V3 Diluizioni : Dato che il numero di moli rimarrà invariato a causa del fatto che non si aggiunge soluto ma si aggiunge solvente si ha che il numero di moli rimarrà appunto invariato mentre la concentrazione cambia, quindi si può scrivere che : mol1 = mol2 → M1V1 = M2V2 Cap 2 : Metodi ottici di analisi Assorbanza : La legge di Lambert – Beer (valida per radiazioni monocromatiche) esprime che l’assorbanza è pari a : 𝐴= 𝜀𝑥𝑏𝑥𝐶 A = - log T Per una miscela di più componenti : 𝐴 = 𝜀1 𝑥 𝑏1 𝑥 𝐶1 + 𝜀2 𝑥 𝑏2 𝑥 𝐶2 + … Per i farmaci: 𝐴1% 1𝑐𝑚 = 𝜀 𝑥 10 𝑃𝑀 A = 𝐴1% 1𝑐𝑚 𝑥 𝑏 𝑥 𝐶 𝐴 C = 𝐴1% 1𝑐𝑚 Trasmittanza : La trasmittanza esprime l’assorbimento di radiazioni elettromagnetiche in termini quantitativi. 𝐼 𝜌 0 𝜌0 T=𝐼 = A = log 1/T = log I0 / I = ε x b x C La trasmittanza può essere anche espressa in termini di percentuale T % = T x 100 = 10 2 - A A = log 100/T % = 2 – log T % Cap 3 : Intervallo di fiducia e test Una misura non è mai reale, essa è compresa in un intervallo di fiducia espressa come : μ=𝑥± 𝑡𝑥𝑠 √𝑛 Si ricorda che t è la t di Student e rappresenta un coefficiente che ci permette di dare al risultato un intervallo di fiducia Test F : Il test F rappresenta un metodo per confrontare più metodi analitici. È dato da un rapporto tra varianze. Se la varianza ottenuta è maggiore rispetto a quella tabulata non si ha miglioramento del metodo (cioè il secondo metodo non è più preciso del primo) invece se è minore del risultato tabulato si ha un miglioramento del metodo (cioè il secondo metodo è più preciso). Si ricorda che bisogna mettere la varianza più elevata al numeratore in modo tale che il risultato di F sia maggiore o uguale di 1 (altrimenti il valore non sarà mai confrontabile con i risultati tabulati). 𝑠𝐴2 𝑡𝑒𝑠𝑡 𝐹 = 2 𝑠𝐵 Test Q : Il test Q permette di vedere se un valore in un set di dati può essere mantenuto o scartato se ritenuto anomalo. 𝑣𝑎𝑙𝑜𝑟𝑒 𝑝𝑖ù 𝑣𝑖𝑐𝑖𝑛𝑜 𝑎𝑙 𝑣𝑎𝑙𝑜𝑟𝑒 𝑎𝑛𝑜𝑚𝑎𝑙𝑜 − 𝑣𝑎𝑙𝑜𝑟𝑒 𝑎𝑛𝑜𝑚𝑎𝑙𝑜 𝑑𝑖𝑠𝑡𝑎𝑛𝑧𝑎 𝑡𝑒𝑠𝑡 𝑄 = = 𝑣𝑎𝑙𝑜𝑟𝑒 𝑝𝑖ù 𝑙𝑜𝑛𝑡𝑎𝑛𝑜 𝑑𝑎𝑙 𝑣𝑎𝑙𝑜𝑟𝑒 𝑎𝑛𝑜𝑚𝑎𝑙𝑜 − 𝑣𝑎𝑙𝑜𝑟𝑒 𝑎𝑛𝑜𝑚𝑎𝑙𝑜 𝑖𝑛𝑡𝑒𝑟𝑣𝑎𝑙𝑙𝑜 Se Q tabulato è maggiore del Q calcolato allora il valore può essere tenuto. Cap 4 : Errori Precisione : è la capacità dello strumento di dare valore quanti più possibili vicini tra loro in una serie di misure effettuate sullo stesso campione della grandezza in esame. Viene misurata con la deviazione standard. Quando bisogna vedere in un esercizio chi è il più preciso si ha che, chi ha il valore di deviazione standard più basso (più vicino allo zero) è il più preciso. Ci sono anche altre grandezze che danno una misura della precisione, ma in un esercizio si usa sempre la deviazione standard. Σ (𝑋𝑖 − 𝑥)2 Deviazione standard del campione → 𝑠 = √ 𝑛−1 Devianza → 𝑑 2 = (𝑥𝑖 − 𝑥)2 Deviazione standard relativa → RDS = Varianza → s2 = 𝑆 𝑥 Σ (𝑥𝑖 − 𝑥)2 𝑛 −1 𝑠 Coefficiente di variazione → CV = 𝑥 100 Deviazione standard della popolazione (n > 30 misurazioni) → σ = √ Σ (𝑋𝑖 − 𝑥)2 𝑛 Si ricorda che il valore (n - 1) sono i gradi di libertà della misura. Questa è una definizione statistica e si usa in quanto in una serie di misure non possiamo essere certi di individuare il valore successivo sapendo il valore precedente. Accuratezza : è la capacità dello strumento di dare una misura della grandezza quanto più vicina possibile al valore reale. Essa viene controllata effettuando la misura di un campione noto di quella grandezza con la taratura dello strumento. L’accuratezza in un esercizio va calcolata con l’errore relativo percentuale e il valore più piccolo tra le varie misure è il più preciso. Si ricorda che il valore può essere anche negativo. Errore assoluto sistematica (BIAS) → 𝐸𝑎 = (𝑥 − 𝜇) Errore assoluto casuale → 𝐸𝑎 = (𝑥𝑖 − 𝑥) Errore assoluto associato a una misura → 𝐸𝑎 = (𝑥𝑖 − 𝑥) + (𝑥 − 𝜇) = 𝑥𝑖 − 𝜇 Errore relativo → 𝐸𝑟 = 𝐸𝑎 𝜇 = 𝑥𝑖 − 𝜇 𝜇 Errore relativo percentuale → 𝐸𝑟% = 𝐸𝑟 𝑥 100 = 𝑥𝑖 − 𝜇 𝜇 Propagazione dell’errore : Le misure sono soggette ad errore quindi, quando facciamo operazioni matematiche che coinvolgono questi dati, anche i risultati saranno soggetti ad errori e questi derivano sia dagli errori delle misure utilizzate e oltre a ciò anche il risultato stesso sarà soggetto ad errori. Propagazione degli errori per somma e differenza → e tot = √𝑒𝑎1 + 𝑒𝑎2 + … Se l’equazione associata è : 𝑦 = 𝑎𝑥𝑏 𝑐 Propagazione degli errori per moltiplicazione e divisione → % er = √%𝑒𝑟1 + %𝑒𝑟2 + … Ea = (% er / 100) x y Nel caso, le deviazioni standard dei numeri del calcolo è più piccola degli altri, considerando l’equazione associata si ha : S y = y √(𝑆𝑎⁄𝑎)2 + (𝑆𝑏⁄𝑏)2 + (𝑆𝑐⁄𝑐 )2 Cap 5 : Retta dei minimi quadrati La retta dei minimi quadrati permette di trovare una correlazione tra tutti i punti anche se essi non sono direttamente tra loro correlati, in pratica è possibile con questo metodo detto anche “metodo della regressione lineare” di trovare una retta che sia valida per tutti i punti. Però non è detto che tutti i punti abbiano necessariamente una retta di correlazione possibile e per vedere appunto se esiste una correlazione si usa il coefficiente di Pearson. Per risolvere un esercizio sulla retta dei minimi quadrati si seguono questi passi : 1. Calcolo di 𝑥 𝑒 𝑦 2. Calcolo di (𝑥𝑖 − 𝑥); (𝑥𝑖 − 𝑥)2 ; (𝑦𝑖 − 𝑦); (𝑦𝑖 − 𝑦)2 per ogni singolo valore dato 3. Calcolo del coefficiente di Pearson → 𝑅 = Σ (𝑥𝑖 – 𝑥)(𝑦𝑖 − 𝑦) se il valore trovato è compreso tra -1 e 1 √Σ(𝑥𝑖 – 𝑥)2 (𝑦𝑖 − 𝑦)2 (-1 < R < 1) allora si ha una correlazione tra i punti dati ed è possibile calcolare il coefficiente angolare e il termine noto altrimenti si conclude l’esercizio dicendo che non essendoci correlazione tra i punti la retta non può essere costruita. 4. Se è possibile una correlazione (quindi R è compreso tra -1 e 1) si può calcolare il coefficiente angolare 𝑚= Σ (𝑥𝑖 – 𝑥)(𝑦𝑖 − 𝑦) Σ(𝑥𝑖 – 𝑥)2 5. Ora si calcola il termine noto. Data l’equazione della retta si può scrivere che 𝑦 = 𝑚𝑥 + 𝑞 → 𝑞 = 𝑦 − 𝑚𝑥 6. Ora conosciamo tutti i valori dell’equazione della retta. L’esercizio fornirà o l’assorbimento dell’incognita o la concentrazione molare, a seconda di cosa si ha bisogna sostituirlo o a x (se abbiamo la concentrazione molare) o la y (se abbiamo l’assorbimento dell’incognita) e risolvere l’equazione classica della retta y = mx + q Precisazioni sulla retta dei minimi quadrati La retta dei minimi quadrati come detto permette di ottenere la miglior retta tra i punti che bisogna correlare, ma non si possono correlare infiniti punti, esiste un limite, detto limite di linearità tale che da questo punto la retta dei minimi quadrati diventa una curva e da quel punto in poi risulterà impossibile avere una correlazione tra l’assorbanza e la concentrazione, anche se si utilizzano altri metodi analitici di analisi. Precisazione sul coefficiente di Pearson Il coefficiente di Pearson permette di controllare se i punti tra loro sono correlabili. I valori che si trovano tra -1 e 1 esprimono un retta correlabile ma si tratta di un numero fittizio, la vera corre labilità si ha con R maggiore o uguale a 0,95, ciò non toglie che con valori minori la retta non sia correlabile, ma nell’esercizio bisogna specificare che la vera correlabilità si ha dopo 0,95 (Convalida del metodo analitico). Cap 6 : Carte di controllo Le carte di controllo servono per determinare se lo strumento risponde bene alle specifiche di garanzia di qualità. Per calcolare se lo strumento risponde a queste garanzie si effettuano delle misure con un campione note ogni giorno e se la pesata rientra nell’intervallo di limite superiore o inferiore allora non si hanno problemi per lo strumento. Limite di controllo superiore → LCS = 𝜇 + Limite di controllo inferiore → LCI = 𝜇 − 3𝜎 √𝑛 3𝜎 √𝑛 Cap 7 : Standard Per il calcolo della concentrazione nel metodo dello standard esterno si ha che : 𝑉𝑐 𝑒𝑠𝑡𝑟𝑎𝑡𝑡𝑜 (𝑚𝑙) 𝑉𝑐 𝑖𝑛𝑖𝑒𝑡𝑡𝑎𝑡𝑜 (𝑚𝑙) 𝑉𝑐 𝑖𝑛𝑖𝑧𝑖𝑎𝑙𝑒 (𝑚𝑙) 𝐴𝜇𝑔 𝑥 [𝐴] = Per il calcolo della concentrazione dello standard interno si ha che : 𝐴𝑟𝑒𝑎 𝑑𝑒𝑙 𝑝𝑖𝑐𝑐𝑜 𝑑𝑒𝑙𝑙′ 𝑎𝑛𝑎𝑙𝑖𝑡𝑎 𝑠𝑡𝑎𝑛𝑑𝑎𝑟𝑑 Fattore di risposta → FR = 𝐴𝑟𝑒𝑎 𝑑𝑒𝑙 𝑝𝑖𝑐𝑐𝑜 𝑑𝑒𝑙𝑙𝑜 𝑠𝑡𝑎𝑛𝑑𝑎𝑟𝑑 𝑖𝑛𝑡𝑒𝑟𝑛𝑜 [𝐴] = 𝐴𝑟𝑒𝑎 𝑑𝑒𝑙 𝑝𝑖𝑐𝑐𝑜 𝑑𝑒𝑙𝑙 ′ 𝑎𝑛𝑎𝑙𝑖𝑡𝑎𝑛𝑒𝑙 𝑐𝑎𝑚𝑝𝑖𝑜𝑛𝑒 1 𝑥 𝑥 [𝑆𝑡𝑎𝑛𝑑𝑎𝑟𝑑 𝑖𝑛𝑡𝑒𝑟𝑛𝑜] 𝐴𝑟𝑒𝑎 𝑑𝑒𝑙 𝑝𝑖𝑐𝑐𝑜 𝑑𝑒𝑙𝑙𝑜 𝑠𝑡𝑎𝑛𝑑𝑎𝑟𝑑 𝑖𝑛𝑡𝑒𝑟𝑛𝑜 𝐹𝑅 Per il metodo delle aggiunte standard abbiamo che : 𝐴1 𝐴𝑡𝑜𝑡 = [𝑥] [𝑥]+ [𝑆𝑡𝑎𝑛𝑑𝑎𝑟𝑑] Cap 8 : Stechiometria Dati gli elementi di A (aA) e bisogna conoscere (bB) dove “a” e “b” sono i coefficienti stechiometrici di A e B gA gB gA / PMA mol B PMB mol A mol A x (b/a) mol B x (a/b) VA VA MA mol B molB / MB VB Se invece abbiamo alcune informazioni su A e vogliamo conoscerne altre gA gA / PMA mol A PMA gA mol A VA MA VA molA / MA VA