caricato da
common.user12769
Nomenclatura Chimica: IUPAC e Tradizionale

Nomenclatura chimica
1
Esistono alcuni composti che possiedono un nome proprio che permette di identificarli univocamente.
I più comuni sono:
Na2CO3 → soda
CaO
→ calce viva
B2H6 → diborano CH4 → metano NH3 → ammoniaca H2O → acqua
NaOH → soda caustica Ca(OH)2 → calce spenta Al2O3→ allumina SiH4 → silano N2H4 → idrazina
PH3 → fosfina
AsH3 → arsina
E per tutti gli altri?
Si può assegnare un nome ad una sostanza chimica attenendosi alla Nomenclatura IUPAC2, meno
utilizzata ma universalmente riconosciuta, o alla Nomenclatura Tradizionale. Inoltre è importante
distinguere la nomenclatura chimica nel caso della chimica inorganica o della chimica organica.
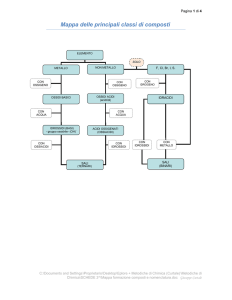
Nomenclatura della chimica inorganica
Nomenclatura IUPAC: detta anche nomenclatura sistematica si basa essenzialmente sulla
stechiometria del composto cioè mette in evidenza il tipo di atomi, o di gruppi chimici presenti,
facendoli precedere da opportuni prefissi che ne indicano il numero. In particolare:
n. atomi
1 →
2 →
3 →
4 →
5 →
prefisso
mono
di
tri
tetra
penta
n. atomi
6 →
7 →
8 →
9 →
10 →
prefisso
esa
epta
octa
nona
deca
n. atomi
11 →
12 →
13 →
14 →
15 →
prefisso
undeca
dodeca
trideca
tetradeca
pentadeca
n. atomi
16 →
17 →
18 →
19 →
20 →
prefisso
esadeca
eptadeca
octadeca
nonadeca
icosa
Nomenclatura Tradizionale: si basa sulla correlazione tra prefissi e suffissi e il numero di
ossidazione degli atomi presenti nel composto. E’ inoltre fortemente legata alle proprietà
chimico-fisiche dei composti.
Per prima cosa è conveniente raggruppare i composti chimici in gruppi derivanti dalla divisione
degli elementi in metalli (Me) e non metalli (nMe), in particolare:
Nomenclatura IUPAC
Elementi presenti
Nomenclatura Tradizionale
nel composto3
Me + H
H + nMe
Me + O
nMe + O
Me + nMe
Me + O + H
H + nMe + O
Me + nMe + O
Idruri
Composti binari
Composti ternari
Ossidi
Sali binari
Idrossidi
Ossiacidi
Sali ternari
Idruri
Idracidi
Ossidi (basici)
Ossidi acidi (Anidridi)
Sali binari
Idrossidi
Ossiacidi
Sali ternari
1
Appunti redatti dal prof. Salvietti D. ITIS “Galileo Galilei” Arezzo.
2
International Union of Pure and Applied Chemistry redatta dal 1959 e periodicamente aggiornata.
Da ora in avanti con il simbolo Me sarà indicato un generico metallo con il simbolo nMe un generico non metallo.
Ovviamente H : idrogeno, O : ossigeno.
3
1
Inoltre i nomi scritti per esteso di elementi e composti devono essere minuscoli (es: boro e non Boro,
cloruro d'argento e non Cloruro d'Argento).
Composti binari
Entrambi le nomenclature prevedono che nella formula bruta dei composti binari debba essere
scritto per primo l’elemento meno elettronegativo quindi ad esempio:
HCl e non “ClH”
NaBr e non “BrH”
CaO e non “OCa”
NaH e non “HNa”
Eccezioni: Esistono composti per i quali non viene applicata questa regola preferendo metterne in
evidenza le caratteristiche ad esempio: NH3 e tutti gli idruri di Au, Pt, Ir, Os, Ru, Rh, Pd.
1. Idruri { HxMe – nMeHx }4
Secondo la Nomenclatura IUPAC gli idruri sono composti chimici binari costituiti da un atomo di
un metallo o di un non metallo e da uno o più atomi di idrogeno il cui numero di ossidazione può
essere ±1. Generalmente si possono sintetizzare facendo reagire direttamente il metallo con
l’idrogeno. Ad esempio:
Cl2 + H2 → 2 HCl
2 Li + H2 → 2 LiH
La nomenclatura IUPAC tratta gli idruri (e tutti i composti binari) proponendo di aggiungere un
prefisso (di derivazione greca: di-, tri-, tetra-, penta-, esa-, epta-, ecc.) che indichi il numero di
volte in cui ogni elemento è presente nel composto. Per primo dovrà essere inoltre indicato
l’elemento più elettronegativo seguito dal suffisso “uro” (il contrario di quanto previsto per la
formula bruta) ad esempio:
FeH3 prende il nome di TRIidrURO di ferro.
FeH2 prende il nome di DIidrURO di ferro.
HCl prende il nome di clorURO di idrogeno.
H2S prende il nome di solfURO di diidrogeno.
La nomenclatura tradizionale tiene conto delle diverse caratteristiche chimiche di queste sostanze e
considera idruri solo i metalli legati all’idrogeno (che quindi avrà numero di ossidazione -1)
mentre chiama idracidi (acidi binari) quei composti costituiti da un non metallo e l’idrogeno (che
assumerà numero di ossidazione +1).
Nel primo caso (idruri) viene mantenuta la dicitura idruro seguita dal complemento di
specificazione (di) quindi il nome del metallo preso in considerazione. Se lo stesso metallo forma
più di un composto con l'idrogeno, allora bisogna prendere in considerazione i differenti valori
del numero di ossidazione del metallo nei vari composti.
Nel composto in cui il metallo assume numero di ossidazione minore, la nomenclatura tradizionale
prevede di far seguire il nome del metallo dal suffisso -oso.
4
Il pedice “X” indica quanti atomi di un dato elemento sono presenti nella formula.
2
Nel composto in cui il metallo assume numero di ossidazione maggiore, la nomenclatura
tradizionale prevede di far seguire il nome del metallo dal suffisso –ico ad esempio:
AlH3 prende il nome di idruro di alluminio.
FeH2 (n. ossidazione del Fe +2) prende il nome di idrURO ferrOSO.
FeH3 (n. ossidazione del Fe +3) prende il nome di idrURO ferrICO.
Casi Particolari: Esistono idruri nei quali il metallo è più elettronegativo dell’idrogeno. Si tratta di
Au, Pt, Ir, Os, Ru, Rh, Pd per i quali si adottano comunque le regole appena indicate tralasciando il
segno del numero di ossidazione. E’ inoltre evidente che esistono metalli con 3,4…..fino a 7 numeri
di ossidazione per i quali le regole appena indicate non sono esaustive. In questi casi la nomenclatura
tradizionale rimanda alla considerazione che un metallo non forma idruri con qualunque numero di
ossidazione (questo però richiede la conoscenza della sua “chimica”) in ogni caso ci si può rifare a
quanto verrà spiegato nel caso degli ossidi e delle anidridi (vedi prossimo paragrafo).
Per quanto concerne gli idracidi (H+nMe) il nome è preceduto dal termine acido quindi il non
metallo seguito dal suffisso “-idrico”:
HCl (n. ossidazione del Cl: -1) prende il nome di acido clorIDRICO.
H2S (n. ossidazione del S: -2) prende il nome di acido solfIDRICO
Casi Particolari: a questo gruppo di composti appartengono anche sostanze che possiedono un nome
proprio, quindi non seguono le regole appena descritte: Acqua, Ammoniaca, Fosfina, Metano, Arsina,
Silano.
2. Ossidi { MexOy – nMexOy }5
La nomenclatura IUPAC definisce ossidi quei composti chimici in cui uno o più atomi di ossigeno
(numero di ossidazione -2) lega con uno o più atomi di un elemento Nella maggior parte dei casi si
possono sintetizzare facendo reagire direttamente il metallo con l’ossigeno, ad esempio:
4 Fe + 3 O2 → 2 Fe2O3
C + O2 → CO2
Secondo la nomenclatura IUPAC si parla si ossidi basici se l’elemento interessato è un metallo, di
ossidi anfoteri se si tratta di un semimetallo e di ossidi acidi nel caso di un non metallo. Essendo
composti binari saranno seguite le stesse regole prima esposte con l’unica differenza che per
l’elemento più elettronegativo (sempre l’ossigeno se si esclude il composto OF2 difluoruro di
ossigeno) non occorre il suffisso “–uro” quindi non si scrive ossigenuro ma “ossido”:
N2O prende il nome di ossido di DIazoto.
N2O3 prende il nome di TRIossido di DIazoto.
La nomenclatura tradizionale, tenendo conto delle diverse caratteristiche chimiche di queste
sostanze, parla di ossidi (basici) solo nel caso in cui sia un metallo a legarsi con l’ossigeno definendo
anidridi quei composti costituiti da un non metallo e dall’ossigeno (che mantiene il numero di
ossidazione -2 tranne il caso di OF2 fluoruro di ossigeno).
Per gli ossidi basici, la nomenclatura tradizionale propone il termine “ossido” seguito da
complemento di specificazione e il nome del metallo preso in considerazione ad esempio:
5
I pedici “X” e “Y” indicano quanti atomi di un dato elemento sono presenti nella formula.
3
Li2O prende il nome di ossido di litio.
Al2O3 prende il nome di ossido di alluminio
Se lo stesso metallo forma più di un composto con l'ossigeno, allora bisogna prendere in
considerazione il suo numero di ossidazione nei suoi diversi composti.
Nel composto in cui il metallo assume numero di ossidazione minore, la nomenclatura tradizionale
prevede di far seguire il nome del metallo dal suffisso -oso.
Nel composto in cui il metallo assume numero di ossidazione maggiore, la nomenclatura
tradizionale prevede di far seguire il nome del metallo dal suffisso –ico ad esempio:
FeO (n. ossidazione del Fe +2) prende il nome di ossido ferrOSO.
Fe2O3 (n. ossidazione del Fe +3) prende il nome di ossido ferrICO.
Qualora i composti fossero più di due (fino ad un massimo di quattro), si adotta la regola secondo la
quale i due composti con numero di ossidazione minore hanno suffisso “-oso” e in particolare il
minimo avrà anche prefisso “ipo-“; mentre quelli con numero di ossidazione maggiore hanno
suffisso “–ico” e in particolare il massimo avrà anche prefisso “per-“.
Le anidridi seguono le stesse regole degli ossidi sostituendo però il termine “anidride” a quello
di “ossido”:
Cl2O (n. ossidazione del Cl +1) prende il nome di anidride IPOclorOSA.
Cl2O3 (n. ossidazione del Cl +3) prende il nome di anidride clorOSA.
Cl2O5 (n. ossidazione del Cl +5) prende il nome di anidride clorICA.
Cl2O7 (n. ossidazione del Cl +7) prende il nome di anidride PERclorICA.
3. Sali binari { MexnMey }4
I sali binari sono composti chimici generalmente ottenuti facendo reagire un idracido6 o un non
metallo con un idrossido7 oppure direttamente con un metallo; ecco alcuni esempi:
HCl + NaOH → NaCl + H2O
HBr + Fe → FeBr2 + H2
Cl2 + Ca → CaCl2
Sono quindi costituiti da uno o più atomi di un metallo legato con uno o più atomi di un non
metallo (derivante dall’idracido). Ovviamente, visto che tra i due elementi il metallo è sempre
quello meno elettronegativo il suo numero di ossidazione sarà positivo, viceversa sarà negativo
il numero di ossidazione del non metallo. La nomenclatura IUPAC adotta le stesse regole
utilizzate per tutti i composti binari, la desinenza “-uro” completerà il nome del non metallo
(elemento più elettronegativo):
NaCl prende il nome di clorURO di sodio.
Au2S3 prende il nome di TRIsosolfURO di DIoro.
Au2S prende il nome di (mono)solfURO di DIoro.
La nomenclatura tradizionale propone che il nome del non metallo con desinenza in “-uro” (che
andrà a sostituire “–idrico” dell’acido) sia seguito da complemento di specificazione (di) quindi il
6
7
Vedi paragrafo 1.
Vedi paragrafo 4.
4
nome del metallo con eventuale suffisso e/o prefisso adeguato secondo le regole descritte in
precedenza (vedi ossidi).
NaCl prende il nome di clorURO di sodio.
Au2S3 (n. ossidazione del Au +3) prende il nome di solfURO aurICO.
Au2S (n. ossidazione del Au +1) prende il nome di solfURO aurOSO.
4. Altri composti binari
Per completezza di trattazione bisogna ricordare che esistono composti binari costituiti dall’unione
di due non metalli (più metalli insieme vanno invece a costituire le così dette leghe metalliche che
sono delle soluzioni quasi sempre solide). In questo caso si possono applicare le regole appena
esposte per i sali binari, ad esempio:
Formula
SiC
SbAs
Si3N4
AlN
ICl
Nomenclatura IUPAC
carburo di silicio
arsenuro di antimonio
tetranitruro di trisilicio
nitruro di alluminio
cloruro di iodio
Nomenclatura tradizionale
carburo di silicio
arsenuro antimonioso
nitruro di silicio
nitruro di alluminio
cloruro di iodio
Composti ternari
5. Idrossidi { Me(OH)x }3
Gli idrossidi sono composti chimici ternari generalmente ottenuti per idratazione (reazione che
comporta aggiunta acqua) di un ossido basico8 o direttamente dai metalli (alcalini o alcalino –
terrosi) a contatto con l’acqua ad esempio:
CaO + H2O → Ca(OH)2
2Na + 2H2O → 2NaOH + H2
Pertanto sono costituiti da un atomo di metallo e tanti gruppi ossidrili (OH-)9 quanto il suo
numero di ossidazione10. Come appare evidente dalle reazioni sopra per primo va scritto il metallo
quindi il gruppo OH. Per gli idrossidi, la nomenclatura IUPAC si attiene alle stesse regole
adottate per gli ossidi, con la sola differenza che il termine “ossido di” si sostituisce con
“idrossido di”; ad esempio:
Al(OH)3 prende il nome di TRIidrossido di alluminio.
Fe(OH)3 prende il nome di TRIidrossido di ferro.
Fe(OH)2 prende il nome di DIidrossido di ferro.
La nomenclatura tradizionale adotta lo stesso metodo utilizzato per gli ossidi, con la sola
differenza che il termine “ossido di” si sostituisce con “idrossido di”. ad esempio:
Al(OH)3 prende il nome di idrossido di alluminio.
Fe(OH)3 (n. ossidazione del Fe +3) prende il nome di idrossido ferrICO.
8
Vedi paragrafo 1.
Il gruppo ossidrile (OH – ) possiede una carica negativa in perfetto accordo con la somma del numero di ossidazione di O
(-2) e di H (+1).
10
Infatti per avere un composto neutro servirà un numero ossidrili (carica -1) pari al numero di ossidazione del metallo
(carica positiva).
9
5
Fe(OH)2 (n. ossidazione del Fe +2) prende il nome di idrossido ferrOSO.
6. Acidi { HxnMeyOz }11
Gli acidi sono composti chimici in cui uno o più atomi di idrogeno (numero di ossidazione sempre
+1) si legano con uno più atomi di un non metallo e con uno o più atomi di ossigeno (numero di
ossidazione sempre -2). Se non è presente ossigeno (O) si parla di idracidi12, se c’è ossigeno (O)
di ossoacidi. Questi ultimi sono composti ternari e si possono generalmente ottenere per idratazione
(reazione comporta aggiunta di acqua) degli ossidi acidi (anidridi)13. Ad esempio:
Cl2O + H2O → 2HClO
SO3 + H2O → H2SO4
Come appare evidente dalle formule sopra prima va messo l’idrogeno (H), poi il non metallo ed
infine l’ossigeno (O). Per gli ossiacidi, la nomenclatura IUPAC prevede l'accostamento della
dicitura “acido” ad un termine costituito da due parti, la prima che indica il numero di atomi di
ossigeno con il l’aggiunta di “osso” preceduto dal corrispondente prefisso greco e la seconda che
indica il non metallo con desinenza rigorosamente in “-ico”, il tutto seguito dal numero di
ossidazione del non metallo scritto in numeri romani e chiuso tra parentesi:
HClO2 (n. ossidazione del
HClO4 (n. ossidazione del
H2CO3 (n. ossidazione del
H2SO4 (n. ossidazione del
H2SO3 (n. ossidazione del
Cl +3) prende il nome di acido DIossoclorico (III).
Cl +7) prende il nome di acido TETRAossoclorico (VII).
C +4) prende il nome di acido TRIossocarbonico (IV).
S +6) prende il nome di acido TETRAossosolforico (VI).
S +4) prende il nome di acido TRIossosolforico (IV).
La nomenclatura tradizionale prevede l'accostamento del termine “Acido” con la seconda parte
del nome del corrispondente ossido acido (anidride)12cioè quella nella quale il non metallo
possiede il medesimo numero di ossidazione14. In altre parole una volta determinato il numero di
ossidazione del non metallo si fa seguire alla dicitura “acido” il nome del non metallo al quale
andranno aggiunti gli stessi prefissi e suffissi utilizzati per i corrispondenti ossidi acidi (anidridi).12
HClO (n. ossidazione del Cl +1) prende il nome di acido IPOclorOSO [deriva dall’idratazione
dell'anidride ipoclorosa (Cl2O)]
HClO4 (n. ossidazione del Cl +7) prende il nome di acido PERclorICO [deriva dall'idratazione
dell’anidride perclorica (Cl2O7)]
H2CO3 (n. ossidazione del C +4) prende il nome di acido carbonICO [deriva dall'idratazione
dell’anidride carbonica (CO2)]
H2SO4 (n. ossidazione del S +6) prende il nome di acido solforICO [deriva dall'idratazione
dell’anidride solforica (SO3)]
H2SO3 (n. ossidazione del S +4) prende il nome di acido solforOSO [deriva dall'idratazione
dell’anidride solforosa (SO2)]
Casi particolari: esistono ossidi acidi (anidridi) che possono reagire con un numero diverso di molecole di
acqua originando acidi differenti. Per la nomenclatura IUPAC non è un problema e si applicano le regole
già viste.15 Viceversa nella nomenclatura tradizionale per distinguerli si aggiunge un opportuno prefisso.
In particolare quando viene aggiunta una sola molecola di acqua dopo la dicitura “acido” si mette “meta” se
le molecole sono due “piro”, se sono tre “orto”:
11
I pedici “X” , “Y”, “Z”, indicano quanti atomi di un dato elemento sono presenti nella formula.
Vedi paragrafo 1.
13
Vedi paragrafo 2.
14
Allo studente “l’incombenza” di verificare che il non metallo possiede il medesimo numero di ossidazione sia
nell’acido sia nel corrispondente ossido acido (anidride).
15
In realtà andrebbero applicate delle piccole varianti la cui trattazione va oltre lo scopo del presente corso.
12
6
P2O5 +(1)H2O → 2HPO3 prende il nome di acido METAfosforICO.
P2O5 + 2H2O → H4P2O7 prende il nome di acido PIROfosforICO.
P2O5 + 3H2O → 2H3PO4 prende il nome di acido ORTOfosforICO.
B2O3 + H2O → 2HBO2 prende il nome di acido METAborICO.
B2O3 + 3H2O → 2H3BO3 prende il nome di acido ORTOborICO.
Ovviamente se l’anidride origina una sola delle tre forme non è necessario usare alcun prefisso.
Infine la forma “piro” può essere ottenuta da due molecole di “acido orto” che unendosi si disidratano cioè
perdono una molecola di H2O:
2H3PO4 →
→ H4P2O7 + H2O
7. Sali { Mx(nMyOz)w }16
In generale i sali sono composti chimici in cui uno o più atomi di un metallo si legano con uno o
più atomi di un non metallo (sali binari)17 ed eventualmente con uno o più atomi di ossigeno, (sali
ternari). In definitiva, come già accennato nel paragrafo 3 se non è presente l’ossigeno si parla di
sali binari viceversa di sali ternari (ossosali).
I sali ternari sono composti chimici generalmente ottenuti facendo reagire un ossoacido18 con un
idrossido19 oppure direttamente con un metallo. La differenza con i sali binari15 risiede nell’impiego,
in questa occasione, di un ossoacido16 e non di un idracido,20 ad esempio:
HClO + NaOH → NaClO + H2O
4HNO3 + Fe → Fe(NO3)3 + NO + 2H2O
Come appare evidente dalle reazioni sopra nelle formule prima va messo il metallo, poi il non
metallo ed infine l’ossigeno (O). Per gli ossosali, la nomenclatura IUPAC prevede che il termine
derivante dall'acido21, con desinenza rigorosamente in “–ato” e sempre seguito dal numero di
ossidazione del non metallo, sia seguito da complemento di specificazione (di) e dal nome del
metallo, eventualmente seguito dal numero di ossidazione dello stesso (in numero romano
chiuso tra parentesi) qualora ci fossero possibilità di incertezza. ad esempio:
LiClO2 prende il nome di DIossoclorato (III) di litio [Li possiede solo n. ossidazione +1 che quindi
può essere omesso].
CuSO4 (numeri di ossidazione Cu : +2 ; S : +6) prende il nome di TETRAossosolfato (VI) di
rame (II).
Nel caso in cui sia presente più di un atomo di metallo è necessario aggiungere il solito prefisso che ne
indichi il numero. Se invece il termine derivante dall’acido si trova tra parentesi i prefissi da utilizzare
sono indicati la seguente tabella:
n. atomi
2 →
6 →
prefisso
bis
esakis
n. atomi
3 →
7 →
prefisso
tris
eptakis
n. atomi
4 →
8 →
prefisso
tetrakis
octakis
n. atomi
5 →
9 →
Ecco alcuni esempi esplicativi:
16
I pedici “X”, “Y”, “Z”, “W” indicano quanti atomi di un dato elemento sono presenti nella formula.
Vedi paragrafo 3
18
Vedi paragrafo 6.
19
Vedi paragrafo 5.
20
Vedi paragrafo 1.
21
Si parla anche di anione e si ottiene togliendo uno o più ioni idrogeno, (H+), dall’acido corrispondente.
17
7
prefisso
pentakis
nonakis
Fe(ClO4)3 (numeri di ossidazione Fe : +3 ; Cl : +7) prende il nome di TRIS(TETRAossoclorato)
(VII) di ferro (III).
Fe(ClO4)2 (numeri di ossidazione Fe : +2 ; Cl : +7) prende il nome di BIS(TETRAossoclorato)
(VII) di ferro (II).
Na2CO3 (numeri di ossidazione Na : +1 ; C : +4) prende il nome di TRIossocarbonato (IV) di DI
sodio.
Cu2SO4 (numeri di ossidazione Cu : +1 ; S : +6)prende il nome di TETRAossosolfato (VI) di DI
rame (I).
La nomenclatura tradizionale propone l'accostamento di due termini: il primo deriva dall'anione
dell'acido (vedi sopra) con il suffisso cambiato (in particolare se il suffisso era “-oso”, nel sale sarà
“-ito” mentre se era “-ico”, nel sale sarà “–ato”); il secondo altro non è che il metallo con
eventualmente le desinenze “oso” o “ico”:
LiClO2 (numeri di ossidazione Li : +1 ; Cl : +3) prende il nome di clorITO di litio .
Fe(ClO4)3 (numeri di ossidazione Fe : +3 ; Cl : +7) prende il nome di PERclorATO ferrICO.
Fe(ClO4)2 (numeri di ossidazione Fe : 23 ; Cl : +7) prende il nome di PERclorATO ferrOSO.
Na2CO3 (numeri di ossidazione Na : +1 ; C : +4) prende il nome di carbonATO di sodio.
CuSO4 (numeri di ossidazione Cu : +2 ; S : +6) prende il nome di solfATO rameICO.
Cu2SO4 (numeri di ossidazione Cu : +1 ; S : +6) prende il nome di solfATO rameOSO.
8. Consigli
Per assegnare il nome ad un composto chimico partendo dalla sua formula bruta conviene operare in
maniera razionale e sistematica seguendo una serie di passaggi di seguito indicati:
a) Scegliere la nomenclatura da utilizzare (pensare ad entrambi può generare confusione).
b) Individuare il gruppo di appartenenza del composto.
c) Riepilogare le regole da seguire e finalmente…..
d) Assegnare il nome.
Esempio: SO3:
a) decido di utilizzare la nomenclatura IUPAC.
b) secondo tale nomenclatura questo composto appartiene agli ossidi.
c) Devo utilizzare la dicitura “ossido” preceduta da un’indicazione del numero di ossigeni
presenti e seguita dal nome dell’elemento.
d) TRIOSSIDO DI ZOLFO.
Anche per scrivere la formula di un composto partendo dal suo nome conviene operare in maniera
razionale e sistematica seguendo i passaggi di seguito indicati:
a) Individuare la nomenclatura utilizzata.
b) Individuare il gruppo di appartenenza del composto.
c) Scrivere gli elementi che costituiscono il composto seguendo l’ordine che caratterizza il suo gruppo di
appartenenza (infatti di qualunque gruppo si tratti l’ordine con cui vengono scritti gli elementi non è
mai casuale).
8
d) Riepilogare le regole da seguire e finalmente…..
e) Completare la formula bruta ponendo alla destra di ogni simbolo un pedice che indichi il
corrispondente numero di atomi di quell’elemento presenti nel composto.
Esempio: anidride solforica
a)
b)
c)
d)
Visto che si parla di anidridi si tratta della nomenclatura tradizionale.
Il gruppo di appartenenza sono le anidridi.
Il composto contiene 2 elementi scrivo per primo quello meno elettronegativo : SO.
Devo individuare i numeri di ossidazione dei due elementi: trattandosi di anidride l’ossigeno
ha -2, lo zolfo possiede +2, +4, +6. Il primo numero di ossidazione non è presente nelle
anidridi, quindi c’è da distinguere +4 (suffisso OSO) e +6 (suffisso ICO) come in questo
caso. La somma dei numeri di ossidazione moltiplicati per il numero di atomi di ciascun
elemento della molecola deve fare 0 a meno che non si tratti di uno ione.
e) SO3.
9