caricato da
common.user8814
Contrazione PDF(1)

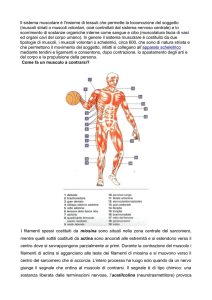
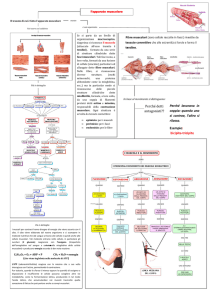
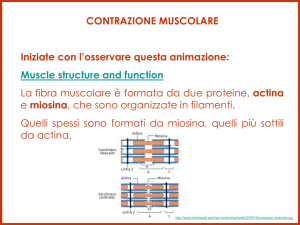
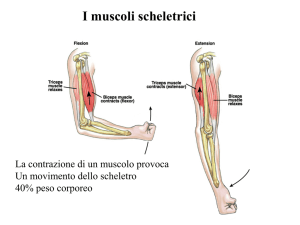
Muscolo-scheletrico struttura e funzione Fig. 1 Sezione di muscolo scheletrico e disposizione delle guaine di tessuto connettivale (A). L’endomisio copre le singole fibre. Il perimisio circonda gruppi di fibre chiamate fasci e l’epimisio avvolge l’intero muscolo in una guaina di tessuto connettivale. Il sarcolemma, una membrana sottile ed elastica, ricopre la superficie di ciascuna fibra muscolare. (B) Dettagli della struttura del tendine. Le microfibrille originano da cinque molecole di tropocollagene fra loro parallele che si uniscono a formare fibrille e poi fibre di collagene, circondate dall'endotenonio. Il tendine è ricoperto dall’epitenonio, una guaina di tessuto connettivo contenente il supporto vascolare, linfatico, nervoso. L’epitenonio penetra all'interno del tendine prendendo il nome di endotenonio. Più superficialmente l’epitenonio è ricoperto da paratenonio, tessuto connettivo costituito essenzialmente da fibre collagene di tipo I e tipo II, fibre elastiche e uno strato interno di cellule sinoviali. Epitenonio e paratenonio prendono il nome di peritendine (µm=10-6 m; nm=10-9 m). (C) Sezione trasversale del reticolo sarcoplasmatico e del sistema dei tubuli-T che circonda le miofibrille. Si noti lo stretto contatto fra i mitocondri, la rete delle membrane intracellulari e il sistema dei tubuli. Prima di iniziare un chiarimento sui termini. Il termine contrazione muscolare viene normalmente riferito a processi che coinvolgono la generazione di tensioni muscolari associate all'accorciamento muscolare. Nel muscolo striato possono verificarsi tre eventi durante la generazione di tensione: 1. Il muscolo si accorcia (azione concentrica) 2. Il muscolo rimane della stessa lunghezza (azione statica-isometrica) 3. Il muscolo si allunga (azione eccentrica) I termini contrazione e azione sono da considerare equivalenti e fanno riferimento allo stesso evento anche se il termine azione muscolare è più corretto. Organizzazione macroscopica del muscolo scheletrico Gli esseri umani possiedono tre tipi di muscolo, il muscolo cardiaco, il muscolo liscio e il muscolo scheletrico, che presentano specifiche differenze funzionali e anatomiche. Il muscolo cardiaco condivide diverse caratteristiche comuni al muscolo-scheletrico, entrambi appaiono striati, si contraggono e si accorciano allo stesso modo. Il muscolo liscio non presenta striature ma condivide con il muscolo cardiaco la regolazione involontaria operata dal sistema nervoso autonomo. Il muscolo-scheletrico opera sotto controllo volontario. L'individuo può facilmente controllare la velocità di movimento, l'ampiezza del movimento e il numero di ripetizioni effettuate di un determinato gesto. Nell'esecuzione di un gesto il giocatore controlla tutti gli aspetti dei movimenti coordinati e, si spera, perfettamente sincronizzati, di braccia, gambe e busto. La situazione è ben diversa per il tessuto muscolare cardiaco e liscio perché l'attività di questi tessuti avviene involontariamente, sebbene la mediazione dei centri nervosi centrali possa esercitare una certa influenza. Questo determina una generale assenza di controllo volontario della frequenza con cui batte il cuore, o di quanto velocemente il cibo si muove attraverso il sistema digestivo. Ciascuno degli oltre 600 e più muscoli scheletrici del corpo contiene vari involucri di tessuto connettivo fibroso. La figura 1 illustra una sezione trasversale della struttura dei muscoli scheletrici e della disposizione degli involucri di tessuto connettivo, che comprendono le migliaia di strutture cilindriche chiamate fibre. Queste fibre lunghe, sottili e multinucleate sono disposte parallele l'una all'altra, con l'asse di contrazione orientato lungo l'asse maggiore della fibra. Il loro numero probabilmente rimane in gran parte invariato a partire dal secondo trimestre di sviluppo fetale. La lunghezza della singola fibra varia da alcuni millimetri, nei muscoli degli occhi, a quasi 30 cm nei grandi muscoli antigravitari della gamba (con una larghezza che raggiunge 0,15 mm). Curiosità sui muscoli Muscoli esterni dell'occhio: i muscoli degli occhi provvedono costantemente a riaggiustare le svariate posizioni dell'occhio durante la veglia. Quando la testa si muove, i muscoli esterni regolano la posizione dell'occhio per mantenere costante il punto di fuoco. In un'ora di lettura continua di questi appunti, i muscoli degli occhi compiono circa 10.000 movimenti coordinati per mantenere una corretta visione. Eppure anche questi muscoli sono soggetti alla fatica. Cambiare frequentemente la posizione della testa e concentrarsi su diversi oggetti su diversi piani focali aiuta a limitare l'affaticamento dei muscoli oculari. LIVELLI DI ORGANIZZAZIONE L'endomisio, un sottile strato di tessuto connettivo, avvolge ciascuna fibra muscolare e la separa dalle fibre vicine. Un altro strato di tessuto connettivo, il perimisio, circonda un ammasso di fibre muscolari fino a 150 fibre, denominato fascicolo. Una fascia di tessuto connettivo fibroso, l’epimisio, circonda l'intero muscolo. Questa guaina protettiva si rastrema alle sue estremità distale e prossimale mentre si fonde e si unisce alle guaine di tessuto intramuscolare a formare il tessuto connettivo denso e resistente del tendine. I tendini collegano entrambe le estremità del muscolo al periostio, il rivestimento più esterno dell'osso. I tessuti del tendine si intrecciano con il collagene delle fibre dell'interno dell'osso. Questo costituisce un potente legame tra i muscoli e le ossa, che rimangono di fatto inseparabili tranne in caso di stress estremi, quando si può giungere alla resezione o al completo distacco nell'inserzione tendinea dell'osso. L'osso lungo presenta un'estremità allargata tale da garantire una più stabile unione fra osso e tendine. A seconda delle dimensioni dell'osso, il termine tubercolo, tuberosità o trocantere descrive questa specifica porzione dell’osso. La forza esercitata dall'azione muscolare si trasmette direttamente al fascio di tessuto connettivale che circonda le unità contrattili del muscolo e ai tendini, che poi eserciterà trazione sull'osso nel punto di inserzione fra osso e tendine. Le forze esercitate sotto sforzo muscolare sulle inserzioni tendinee vanno da 20 a 50 N per cm2 di area di sezione trasversale. L'origine del muscolo si riferisce al punto in cui il tendine si unisce a una parte dello scheletro relativamente stabile, generalmente l'estremità prossimale o il fulcro del sistema a leva o quella più vicina alla linea mediana del corpo; il punto di unione più distale del muscolo sull'osso in movimento rappresenta l’inserzione. La Figura 1B illustra i dettagli ultrastrutturali del tendine. Il collagene proteico comprende circa il 70% della massa secca del tendine. Al di sotto dell'endomisio e a circondare ogni singola fibra muscolare troviamo il sarcolemma, una membrana sottile ed elastica che avvolge le fibre del tessuto muscolare e che comprende la membrana plasmatica (plasmalemma) e la lamina basale. La membrana plasmatica, con una struttura a doppio strato di matrice lipidica, consente la propagazione dell'onda elettrochimica di depolarizzazione sulla superficie della fibra muscolare. Il sarcolemma presenta profonde invaginazioni tubulari connesse tra loro in senso trasversale e longitudinale, deputate alla propagazione dell'impulso all'interno della fibrocellula. Nel corso della depolarizzazione la membrana isola inoltre la fibra muscolare da quella adiacente. La membrana basale è una struttura laminare specializzata costituita da proteine di membrana e fasci di fibrille di collagene che si fondono con le fibre collagene nel rivestimento esterno del tendine. Tra la membrana basale e la plasmamembrana si trovano le cellule staminali muscolari, conosciute anche come cellule satelliti, i mioblasti normalmente quiescenti che partecipano alla crescita cellulare rigenerativa e forniscono possibili adattamenti fisiologici all'esercizio nel recupero della lesione. L'incorporazione di nuclei di cellule satelliti nelle fibre muscolari preesistenti sembra fornire una convincente spiegazione all'ipertrofia delle fibre muscolari conseguenti all'esercizio fisico. Il sarcoplasma o protoplasma acquoso della fibra contiene enzimi, grassi e particelle di glicogeno, i mitocondri e altri organelli specializzati. La Figura 1C descrive il reticolo sarcoplasmatico, un ampio reticolo longitudinale di canali tubulari e vescicole. Questo sistema altamente specializzato garantisce l'integrità strutturale alla cellula. Consente la rapida propagazione dell'onda di depolarizzazione dalla superficie esterna della fibra al suo ambiente interno attraverso il sistema dei tubuli-T per innescare la contrazione muscolare. Il reticolo sarcoplasmatico che circonda ciascuna miofibrilla contiene "pompe" biologiche che riassorbono Ca2+ dal sarcoplasma della fibra. Questo produce un gradiente di concentrazione di calcio tra il reticolo sarcoplasmatico (elevata [Ca2+]) e il sarcoplasma che circonda i filamenti (bassa [Ca2+]). COMPOSIZIONE CHIMICA DEI MUSCOLI L'acqua costituisce circa il 75% della massa muscolare scheletrica mentre le proteine ne rappresentano il 20%. Il restante 5% contiene sali e altre sostanze, compresi i gruppi fosfato ad alta energia, urea, lattato, minerali calcio, magnesio e fosfato, vari enzimi, ioni sodio, potassio e cloruro, aminoacidi, grassi e carboidrati. Tra le più abbondanti proteine espresse a livello muscolare troviamo la titina, la più grande proteina del corpo umano composta da 27.000 aminoacidi (rappresenta circa il 10% di tutta la massa muscolare), la miosina (circa il 60% delle proteine muscolari), l'actina e la tropomiosina. Ogni 100 g di tessuto muscolare contengono circa 700 mg di mioglobina, una proteina globulare la cui funzione specifica è quella di legare reversibilmente l’ossigeno APPORTO EMATICO Arterie e vene che decorrono parallelamente lungo le fibre muscolari sono in grado di garantire un elevato apporto ematico al muscolo. Questi vasi si diramano in numerose arteriole, capillari e venule che realizzano un’estesa rete all'interno e intorno all'endomisio. Questa importante vascolarizzazione assicura a ogni singola fibra muscolare un adeguato apporto di sangue ossigenato proveniente dal distretto arterioso è un rapido allontanamento dell'anidride carbonica attraverso la circolazione venosa. Durante un lavoro muscolare che comporta un consumo di ossigeno dell'ordine di 4 l/min, il consumo di ossigeno dei muscoli in attività aumenta di circa 70 volte rispetto al basale, raggiungendo un valore di 11 ml per 100 g di tessuto al minuto, corrispondente a un consumo di O2 muscolare totale di 3400 ml・min per un atleta professionista impegnato in attività aerobiche di resistenza. La rete vascolare locale trasporta grandi quantità di sangue ai tessuti metabolicamente attivi per rispondere all'aumentato fabbisogno di ossigeno. Nel corso di attività che comportano un'alternanza di contrazione e rilassamento dei muscoli (attività di tipo dinamico) come il nuoto, la corsa o il ciclismo, il flusso di sangue ai muscoli è oscillante: diminuisce nel corso della contrazione muscolare e aumenta nella fase di rilasciamento muscolare. L'alternanza di contrazione rilasciamento permette l'afflusso di sangue al muscolo e favorisce nel contempo il ritorno venoso al cuore tramite un effetto di spremitura delle vene (azione di pompa muscolare scheletrica). L’aumento di perfusione muscolare si realizza anche in virtù della maggior vascolarizzazione capillare. La rapida dilatazione dei capillari muscolari (il reclutamento capillare) tende a compensare l'effetto pulsatorio dell'afflusso di sangue al muscolo. Si può stimare che vengano reclutati circa 200-500 capillari per mm2 di sezione muscolare; in pratica ogni fibra muscolare sarebbe in contatto alla sua superficie con almeno quattro capillari. Negli atleti impegnati in attività di resistenza, da cinque a sette capillari contattano ogni singola fibra muscolare, questo positivo adattamento assicura un più alto afflusso di sangue al muscolo è un adeguata ossigenazione tissutale nel momento di maggior bisogno. La situazione di perfusione muscolare è diversa nel caso in cui l'attività fisica comporti contrazioni muscolari di entità rilevante e mantenuta per un tempo relativamente prolungato (attività di tipo statico, come esercitare una forza tesa a spostare un oggetto vincolato). In effetti, quando il muscolo esercita una forza pari a circa il 60% della tensione massimale per un tempo pari a diversi secondi, si verifica, a causa dell'aumento della pressione intramuscolare, una completa occlusione delle arterie, che azzera il flusso di sangue al muscolo. Se questa condizione si protrae per un tempo sufficientemente lungo, il muscolo non può che trarre energia dai depositi intramuscolari dei fosfati ad alto contenuto energetico e dalle reazioni glicolitiche anaerobiche. Fig. 2 Organizzazione macroscopica e microscopica del muscolo scheletrico. (A) Fasci di singole fibre muscolari formano l'intero muscolo. (B) Le fibre contengono le miofibirille costituite da filamenti di actina e miosina. (C-F) Veduta microscopica di un singolo sarcomero con evidenziati i filamenti di actina e miosina, la sezione trasversa dei filamenti e la tipica colorazione del sarcomero Capillarizzazione del muscolo Uno degli adattamenti legati all'allenamento di tipo aerobico è l'aumento della densità dei capillari nel distretto muscolare; l'aumento del rapporto fra il numero dei capillari e le fibre muscolari che si osserva nei muscoli ben allenati consente di spiegare il miglioramento delle performance atletiche che si osserva nel corso dell'allenamento aerobico di resistenza. Un miglioramento della perfusione a livello del microcircolo migliora i processi diffusivi dei gas respiratori, favorisce gli scambi di nutrienti e ormoni e promuove la rimozione dei metaboliti; inoltre viene favorito il processo di termodispersione. Studi condotti mediante microscopia elettronica dimostrano che il numero di capillari e la loro densità per unità di superficie (numero di capillari per mm2 di sezione muscolare) è del 40% maggiore negli atleti dediti ad attività sportive aerobiche di resistenza rispetto a soggetti sedentari di controllo. Tale differenza è circa uguale alla differenza di VO2 max che si osserva tra i due gruppi (41%). Vi sono anche evidenze che correlano il massimo consumo di ossigeno alla densità capillare dei muscoli. Una migliore vascolarizzazione capillare risulta ovviamente favorevole in attività che richiedono un elevato metabolismo energetico aerobico allo stato stazionario. Lo stiramento delle pareti e lo sforzo di taglio che si esercita sulle cellule endoteliali dei vasi sanguigni in condizioni di elevato flusso di sangue, come si verifica nel corso di intenso lavoro muscolare, stimola la proliferazione dei capillari rilevabile nei soggetti che praticano un intenso allenamento aerobico. Ultrastruttura del muscolo scheletrico La Figura 2A-F presenta i vari livelli di organizzazione subcellulare delle fibre muscolari. Ogni singola fibra muscolare multinucleata contiene un gran numero di piccole unità funzionali dette fibrille o miofibrille disposte longitudinalmente nella fibra stessa. Queste fibrille o miofibrille hanno un diametro pari a 1 µm (1 µm = 1/1000 mm) e a loro volta sono composti da unità elementari dette filamenti o miofilamenti, sempre disposti in parallelo e parallelamente all'asse maggiore della miofibrilla. I miofilamenti sono organizzati in coordinati assemblaggi di due proteine principali, l'actina e la miosina, che rappresentano circa l'85% del complesso miofibrillare. Sono presenti, inoltre, altri 12-15 proteine che svolgono una funzione strutturale o che rientrano nel processo di interazione molecolare che sostiene il fenomeno della contrazione muscolare. Fra queste troviamo le seguenti sei proteine: 1. La tropomiosina, che rappresenta il 5% delle proteine del miofilamento, è localizzata lungo il filamento di actina; 2. La troponina (comprende troponina-1, T, C), localizzata nel filamento di actina e che rappresenta il 3% delle proteine totali; 3. L'𝛼-actinina, distribuita nella regione delle bande Z (7% delle proteine totali); 4. La 𝛽-actinina, reperibile nei filamenti di actina (1% delle proteine totali); 5. La proteina M, identificata nel sarcomero a livello delle strisce M (meno dell'1% delle proteine totali); 6. La proteina C (meno dell'1% delle proteine totali), coinvolta nel garantire l'integrità strutturale del sarcomero. IL SARCOMERO A basso ingrandimento microscopico, l'alternanza di bande chiare e scure lungo l'asse longitudinale della fibra muscolare determina la tipica striatura. I dettagli strutturali che contribuiscono a conferire l'aspetto striato sono forniti in Figura 3. La zona più chiara viene denominata banda I. Mentre la zona più scura banda A. La linea Z è posta a metà della banda I, è strettamente aderente al sarcolemma e provvede a stabilizzare l'intera struttura. Tra le due linee Z si ripete l’unità funzionale e strutturale elementare della fibra muscolare denominata sarcomero. I filamenti di actina e miosina del sarcomero contribuiscono principalmente alla meccanica della contrazione muscolare. In ogni fibrilla i sarcomi sono disposti in serie, i vari filamenti sono disposti in parallelo. A riposo, la lunghezza media del sarcomero è pari a 2,5 µm. Una miofibrilla lunga 15 mm contiene circa 6000 sarcomi in serie. La lunghezza del sarcomero determina grandemente le proprietà funzionali del muscolo. La disposizione del filamento sottile di actina e di quello spesso di miosina nel sarcomero è tale che esiste una zona di sovrapposizione fra i due filamenti. Il centro della banda A corrisponde alla cosiddetta zona H, una zona di bassa densità ottica nella quale mancano i filamenti di actina. La zona H presenta nel suo centro la linea M, che corrisponde al centro del sarcomero. A livello della linea M sono presenti proteine strutturali di supporto alle molecole di miosina. La Figura 3B presenta una visione dettagliata della struttura del sarcomero e la Tabella 1 riassume le funzioni relative alle proteine strutturali che compongono il sarcomero. Allineamento delle fibre muscolari La disposizione delle fibre muscolari può variare in relazione all'asse maggiore del ventre muscolare, inteso come la linea immaginaria che congiunge i punti di inserzione del muscolo, nel senso che la disposizione delle fibre può avvenire secondo una precisa angolazione rispetto a quella linea che rappresenta l'asse di generazione della forza. Questa possibilità di diverso orientamento delle fibre modifica alquanto la capacità del muscolo di generare forza (Fig. 4). Se l'orientamento delle fibre è parallelo all'asse principale del muscolo (come, per esempio, nel caso del muscolo bicipite brachiale), le fibre sono dette fusiformi. Se sono poste in modo obliquo rispetto all'asse principale del muscolo con angolo in genere inferiore a 30°, sono dette pennate. Figura 3 (A) disposizione dei miofilamenti nel sarcomero. Un sarcomero è delimitato all'estremità dalle linee Z. (B) visione dettagliata del sarcomero che tiene conto di tutte le strutture proteiche elencate in Tabella 1 Filamento sottile Actina Principale proteina che reagisce con la miosina nel processo di contrazione Tropomiosina Concorre alla variazione conformazionale della molecola di actina Troponina Lega il Ca2+ e influenza l'attività della tropomiosina. Il legame con il Ca2+ rappresenta lo stimolo che induce l'attivazione del ciclo dei ponti trasversali Nebulina È disposta in prossimità dell'actina e si ritiene che controlli il numero di monomeri dell'actina uniti in uno stesso filamento sottile Miosina Scinde l'ATP ed è responsabile del colpo di forza della testa della miosina Strisce C Proteina C Mantiene la regolare disposizione spaziale dei filamenti di miosina.consente di mantenere le proteine H di filamenti spessi adiacenti a distanza costante durante la contrazione.può anche controllare il numero di molecole di miosina in un filamento spesso Linea M Proteina M Contribuisce a mantenere la regolare disposizione spaziale dei filamenti spessi Miomesina Rappresenta un forte punto di ancoraggio per la proteina Titina M-CK È localizzata in prossimità delle teste della miosina; consente la formazione di ATP a partire dalla fosfocreatina 𝜶-actina Mantiene la disposizione spaziale dei filamenti sottili Desmina Forma connessioni fra linee Z adiacenti appartenenti a diverse miofibrille; aiuta a mantenere l'allineamento del sarcomero garantendo il tipico aspetto striato. Titina Aiuta a mantenere il filamento spesso centrato rispetto alle due linee Z durante la contrazione muscolare; si ritiene che controlli anche il numero di molecole di miosina contenuto in un filamento spesso Filamento spesso Linea Z Elementi elastici Tabella 1 Le 12 proteine che concorrono alla struttura del sarcoma ero e loro funzione Fig. 4 (A) Varie tipologie di disposizione delle fibre del muscolo scheletrico umano. (B) Sviluppo della forza massima (Fmax) in un muscolo fusiforme senza angolo di pennazione (𝟇=0°, cos 𝟇=1) e con angolo di pennazione (𝟇=30°, cos 𝟇=87). Nel secondo caso la forza sviluppata è F = Fmax x 0,87, con una perdita quindi è il 13% della forza massima erogata da ciascuna fibra sul tendine, facendo esclusivamente riferimento alla meccanica muscolare. L'angolo di pennazione aumenta il numero di fibre che si compattano in un dato volume del muscolo (in basso a destra). Nel confronto tra diversi individui, per un dato muscolo la capacità contrattile e proporzionalmente correlata alla massa muscolare. A causa dell'effetto dell'angolo di pennazione, non necessariamente ne consegue che la massa muscolare di per sé correli con una equivalente erogazione della forza nei diversi gruppi muscolari. Nel muscolo soleo, per esempio, l'angolo tra le fibre e l’asse del muscolo è di 25°, mentre nel caso del vasto mediale è di soli 5°; l'angolo è uguale a zero per il muscolo sartorio. La pennazione consente alle singole fibre di rimanere corte, mentre l'intero muscolo può raggiungere una considerevole lunghezza. Una fibra fusiforme non presenta pennazione, così la sua sezione trasversale rappresenta la vera sezione anatomica. Nel muscolo pennato, la complessa organizzazione del tessuto connettivo, dei tendini, e le fibre relativamente corte, determinano una sezione trasversa che è più grande di quello delle fibre fusiformi, poiché più sarcomeri sono compresi in un dato volume muscolare. Si definisce come sezione trasversale fisiologica (physiologic cross-sectional area PCSA) la sezione che risulta dalla somma delle sezioni di tutte le fibre muscolari presenti in un muscolo. Un angolo di pennazione insolitamente elevato, pari a 30°, determina una riduzione pari a solo il 13% nella capacità di generare forza da parte della singola fibra; questo fatto si traduce in un enorme aumento nella capacità totale di impacchettamento delle fibre. La pennazione consente quindi di raggruppare un gran numero di fibre in una sezione trasversa più piccola. I muscoli pennati tendono a sviluppare considerevole potenza. Nella Fig. 4 e illustrato l'effetto della pennazione sul impaccamento delle fibre e sulla capacità di generare forza. Le fibre in un muscolo fusiforme sono disposte parallelamente all'asse maggiore del muscolo. In questo caso la lunghezza della fibra è uguale alla lunghezza del muscolo e la forza generata dalla fibra si trasmette direttamente al tendine. Questa disposizione favorisce un'elevata velocità di accorciamento durante la contrazione. Nel caso di un muscolo unipennato, la disposizione obliqua delle fibre muscolari rispetto al tendine aumenta l’area della sezione effettiva del muscolo rispetto alla disposizione fusiforme. I muscoli con angolo di penna maggiore sono in grado di esercitare maggior forza e potenza ma con velocità di contrazione minore rispetto ai muscoli fusiformi (a parità di altri fattori), poiché più sarcomeri simultaneamente contribuiscono all'azione muscolare. Un muscolo pennato presenta due gruppi di fibre muscolari posti obliquamente rispetto all'asse centrale, costituito da un tendine di inserzione comune (questo è il caso del muscolo gastrocnemio e del retto femorale). Un muscolo multipennato, come il deltoide, si compone di numerosi fasci che convergono, con diversi angoli, su un tendine comune a entrambe le estremità. I muscoli pennati differiscono da quelli fusiformi per le seguenti tre caratteristiche: 1. contengono generalmente fibre più corte; 2. presentano un numero più alto di singole fibre (maggior numero di miofilamenti); 3. generano movimenti di minor ampiezza. Organizzazione del complesso fusiforme Nel complesso muscolare di tipo "parallelo" (noto anche come muscolo a fibre in serie) le singole fibre sono disposte parallelamente alla linea di trazione, l'asse maggiore del muscolo. Nel muscolo con organizzazione di tipo "fusiforme semplice" le fibre si distribuiscono per l'intera lunghezza del muscolo, mentre nella modalità "a complesso parallelo" le fibre si Fig.5 A sinistra: caratteristiche strutturali del muscolo della gamba. I quadricipiti e i flessori plantari presentano un'elevata erogazione della forza in funzione del ridotto rapporto lunghezza della fibra/lunghezza del muscolo (FL:ML) e delle relativamente grandi aree trasversali fisiologiche (PCSA). Il bicipite femorale e il muscolo dorsoflessore presentano un'architettura progettata per un'elevata velocità di contrazione in riferimento al relativamente elevato rapporto FL:ML e alla lunghezza della fibra. In A e B sono rappresentate le curve forza lunghezza e forza velocità per un muscolo fusiforme e per un muscolo pennato che non differiscono per la composizione delle proteine contrattili totali. La curva forza lunghezza (A) mostra come il muscolo fusiforme presenti uno spettro più ampio di lunghezza è una bassa erogazione della forza rispetto al muscolo pennato. L'inferiore erogazione della forza è dovuta al fatto che per una data lunghezza del muscolo i singoli sarcomeri si allungano di meno, facendo sì che il cambiamento di lunghezza del muscolo sia distribuito di fatto su più sarcomeri. Una più ampia PCSA (C) determina una più grande erogazione della forza. La curva forza-velocità (B) mostra come il muscolo fusiforme, che presenta fibre muscolari più lunghe, presenti una più alta velocità di contrazione a una più bassa erogazione della forza assottigliano per terminare, a circa metà del ventre muscolare, sulla matrice connettivale e/o sulle fibre muscolari adiacenti. Questa disposizione consente un raggruppamento di fibre parallele relativamente corte all'interno di un muscolo lungo (come, per esempio, nel muscolo sartorio, di 50 cm di lunghezza). Questa specifica organizzazione strutturale con numerose terminazioni intrafascicolari genera inoltre tensione laterale, sia attraverso il tessuto connettivo nel tendine sia attraverso le fibre adiacenti e in serie nel tessuto connettivo, in punti strategici lungo la superficie della fibra. questo ipotetico esempio le differenze si possono così riassumere: il muscolo fusiforme genera una forza massima inferiore, ma può generare forza su uno spettro di lunghezza più ampio per la presenza di singole fibre muscolari più lunghe e per la ridotta sezione fisiologica (Fig. 5C); il muscolo pennato dispone di fibre più corte e presenta una sezione fisiologica più grande ed è in grado, quindi, di generare una forza doppia. Per quanto riguarda la relazione forza-velocità, il muscolo fusiforme presenta fibre muscolari più lunghe e raggiunge una velocità di contrazione superiore, erogando però una forza minore. Rapporto tra lunghezza della fibra muscolare e lunghezza del muscolo Disposizione dei filamenti di actina e miosina Il rapporto tra la lunghezza della fibra muscolare e la lunghezza del muscolo oscilla in genere tra 0,2 0,6, il che indica che anche nel caso dei muscoli più lunghi, come quelli degli arti superiori e inferiori, la lunghezza delle fibre è inferiore a quello del muscolo. L'entità del rapporto tra la lunghezza della fibra e lunghezza del muscolo per quattro muscoli dell'arto inferiore è presentata nella Figura 5A. Le fibre dei muscoli quadricipiti hanno in media un angolo di pennazione di 4,6°, con una sezione fisiologica totale (PCSA) di 21,7 cm² e una lunghezza media di 68 mm. Nel caso del bicipite femorale, invece, le fibre hanno una lunghezza media di 111 mm e una sezione fisiologica totale di 11,7 cm². In termini di forza, il quadricipite femorale è in grado di generare una forza superiore di circa il 50% rispetto al bicipite femorale, che però è in grado di contrarsi a velocità superiore. Questa differenza può essere giustificare come, nel corso di uno scatto, come nella partenza dei 100 m piani, il bicipite femorale possa strapparsi come conseguenza di uno squilibrio nell’erogazione delle forze generate, durante l'attivazione massimale, rispettivamente dal bicipite e dal quadricipite femorale. Questo squilibrio può in parte essere dovuto a un deficit di forza nel bicipite femorale nei confronti del quadricipite femorale, e può predisporre i soggetti dediti ad attività sportive che prevedono "sprint" a ricorrenti lesioni del bicipite femorale. Rapporto tra la forza generata dal bicipite è quella generata dal quadricipite femorale può essere facilmente calcolato dividendo il momento massimale flessore del ginocchio (bicipite femorale) per il momento estensore del ginocchio (quadricipite femorale). Quando gli allenatori sportivi e fisioterapisti valutano questi rapporti e rilevano deficit maggiori del previsto, durante la valutazione funzionale di inizio stagione, possono prescrivere, come parte integrante della riabilitazione funzionale, specifici allenamenti muscolari a velocità pre impostate, studiate appositamente per poi migliorare il deficit bicipitequadricipite. La Figura 5 A-B illustra le relazione forza lunghezza e forza velocità per un muscolo fusiforme e per un muscolo pennato che presenta la stessa quantità di proteine contrattili totali e identica tipologia di fibre. In In una fibra muscolare vi sono migliaia di filamenti di actina e miosina affiancati gli uni agli altri. Nella Figura 6A è illustrata la precisa disposizione spaziale in senso longitudinale dei due tipi di filamenti in un sarcomero a riposo, mentre la Figura 6B presenta in senso trasversale l'organizzazione spaziale di tipo esagonale dei filamenti di actina e miosina. I filamenti di miosina Figura 6 (A). Ultrastruttura della disposizione spaziale dei filamenti di actina e miosina in un sarcomero in un muscolo a riposo. (B) rappresentazione schematica di una microfotografia al microscopio elettronico che mostra la sezione trasversa delle miofibrille in una singola fibra muscolare. Si nota la distribuzione ad esagono dei filamenti sottili di actina che circondano i filamenti spessi di miosina e l'orientamento dei ponti trasversali che si estendono dal filamento spesso a quello sottile. sono composti da un fascio di molecole che presentano code polipeptidi che e teste globulari. I filamenti di actina si compongono di due catene di monomeri accoppiate legate fra loro da catene polipeptidiche di tropomiosina. Un filamento spesso di miosina (del diametro di circa 150 Å e di lunghezza di 1,5 µm) e circondato da sei filamenti di actina del diametro di 50 Å e di lunghezza di 1 µm. Questa particolare disposizione dei filamenti determina una suggestiva configurazione substrutturale. Una miofibrilla del diametro di 1 mm contiene 450 filamenti spessi di miosina al centro del sarcomero e 900 filamenti sottili di actina che si staccano dagli estremi del sarcomero e si protendono verso il centro del sarcomero stesso. Una singola fibra muscolare lunga 1 cm e del diametro di 100 µm contiene circa 8000 miofibrille, ogni miofibrilla contiene 4500 sarcomeri, in totale i sarcomeri contengono 16 miliardi di filamenti di miosina e 64 miliardi di filamenti di actina. La Figura 7 illustra l'orientamento spaziale delle varie componenti molecolari del sarcomero. I ponti della miosina si staccano dal filamento di miosina con un andamento a spirale e si protendono, mediante strutture filamentose, verso l'actina nella zona in cui actina e miosina si sovrappongono. I ponti sono regolarmente spaziati a distanza di circa 450 Å lungo il filamento di miosina. Le teste globulari di miosina si staccano perpendicolarmente dal filamento spesso di miosina per andare ad agganciarsi al filamento sottile di actina così da formare, durante il processo di contrazione, legami funzionali tra i due miofilamenti. Una singolare caratteristica del miofilamento spesso è quella di presentare le due teste della miosina orientate in modo opposto alle due estremità del filamento stesso. L'idrolisi dell'ATP attiva le due teste, ponendole in una posizione ottimale per legarsi ai siti attivi dell'actina, tirando così filamenti sottili e le linee Z verso il centro del sarcomero. aggancio e sgancio dei ponti della miosina con l’actina. La tropomiosina si distribuisce lungo tutta la lunghezza della doppia elica dell'actina e, dal punto di vista chimico, previene la formazione del legame tra actina e miosina. Il complesso della troponina è disposto a intervalli spaziali regolari lungo la molecola di actina e possiede un'elevata affinità per gli ioni calcio (Ca2+). Gli ioni Ca 2+ sono coinvolti nel meccanismo della contrazione muscolare e nella genesi della fatica muscolare. Per esempio, è proprio l'azione del calcio insieme a quella della troponina che inizia il processo della contrazione, innescando il legame tra i filamenti di miosina e actina e lo scivolamento degli uni sugli altri. Quando una fibra muscolare viene stimolata dal nervo motore, le molecole di troponina subiscono una modificazione conformazionale che genera una trazione sulla tropomiosina. Come risultato di questa trazione la tropomiosina viene spostata più profondamente all'interno della struttura elicoidale dell’actina: il risultato finale è che si scoprono e si rendono liberi i punti di attacco dell'actina per i ponti della miosina, dando quindi inizio al processo della contrazione muscolare. Una marcata riduzione della concentrazione degli ioni Ca2+ a livello dei tubuli trasversi, in associazione a modificazioni intrinseche dell'apparato contrattile e della funzione del reticolo sarcoplasmatico, sono alla base dello sviluppo della fatica muscolare, che si osserva nel corso di attività fisica prolungata. La banda M corrisponde a strutture proteiche poste trasversalmente e longitudinalmente che svolgono una funzione di sostegno per i filamenti di miosina, così che p o s s a n o m a n t e n e re i l c o r re t t o orientamento nel sarcomero. Come si può vedere dalla Figura 7, le parti orientate perpendicolarmente del ponte M funzionano da supporto meccanico per sei molecole di miosina disposte spazialmente secondo un esagono. Sistema tubulare intracellulare La Figura 8 illustra la complessa disposizione dei sistemi canalicolari all'interno della fibra muscolare. L'estremità laterale di ogni canale tubolare termina in una struttura vescicolare a sacco (cisterna) che immagazzina ioni Ca2+. Un'altra rete di tubuli, il sistema dei tubuli trasversi o sistema dei tubuli T, è disposta perpendicolarmente alla direzione Figura 7 Dettagli dei filamenti proteici spessi e sottili; sono indicati anche la delle miofibrille. Il sistema dei tubuli T tropomiosina, il complesso della troponina e il ponte M. La miosin-ATPasi è è rappresentato da invaginazioni della situata sulle teste globose della miosina. La testa, appunto, opportunamente membrana della cellula muscolare, veri attivata, libera l'energia dell'ATP che serve per il processo di contrazione e propri tunnel scavati nella cellula che muscolare. attraversano la cellula da parte a parte. I tubuli T corrono parallelamente alle La tropomiosina e la troponina sono altre due cisterne, e ogni tubulo T è adiacente a due cisterne una importanti molecole presenti nella struttura a elica della disposizione che prende il nome di triade. Esistono miosina. Queste molecole intervengono nel processo di due triadi, disposte nella zona corrispondente alle linee Z, per ogni sarcomero, e questa configurazione si ripete regolarmente lungo tutta l'estensione della fibra muscolare. Meccanica della contrazione muscolare: il modello a filamenti scorrevoli La teoria propone che le variazioni di lunghezza del muscolo dipendano dallo scivolamento dei filamenti spessi rispetto ai filamenti sottili, senza che questi varino effettivamente di lunghezza. La base molecolare di questo comportamento dipende dal fatto che i ponti della miosina sono in grado di reagire con l'actina e variare la loro conformazione strutturale (permettendo l'aggancio, la rotazione e il d i s t a c c o d a i fi l a m e n t i d i a c t i n a ) , realizzando quindi la possibilità di movimento reciproco dei due miofilamenti, il che risulta, in definitiva, in una variazione di lunghezza del sarcomero. Questo si traduce in un'importante variazione delle dimensioni relative delle bande e delle zone all'interno del sarcomero e nel trascinamento delle linee Z verso il centro del sarcomero. L'ATP è coinvolto in questo processo in quanto la sua idrolisi fornisce l'energia necessaria alla variazione di conformazione strutturale delle teste della Figura 8 spaccato tridimensionale di una fibro cellula muscolare per miosina. Come illustrato in Figura 9 mostrare il reticolo sarcoplasmatico e la disposizione del complesso sistema durante la contrazione l'accorciamento del dei tubuli T. sarcomero si realizza per lo scivolamento del filamento di actina su quello di miosina, I tubuli T attraversano la fibra e si aprono all'esterno l'actina si insinua tra le molecole di miosina per un della cellula muscolare. Le triadi e il sistema dei tubuli T determinato cammino e penetra nella zona H sono coinvolti nel processo di conduzione dell'onda di avvicinandosi alla linea M durante il processo di depolarizzazione, associata al potenziale d'azione, dalla contrazione (e si muove in direzione opposta durante superficie della membrana a tutta la cellula muscolare e nel processo di innesco delle reazioni chimiche che portano alla contrazione muscolare. Quando un nervo motore, dal suo terminale presinaptico, libera una sufficiente quantità di neuromediatore eccitatorio, si genera a livello postsinaptico, nella cellula muscolare prospiciente la sinapsi, un fenomeno elettrico detto potenziale d'azione (transitoria positivizzazione del potenziale intracellulare). La propagazione del potenziale d'azione, lungo il sistema dei tubuli T, stimola le cisterne della triade a rilasciare ioni Ca2+, che diffondono a breve distanza per "attivare" i filamenti di actina. La contrazione muscolare inizia nel momento in cui i ponti dei filamenti di miosina si agganciano temporaneamente ai siti attivi posti sui filamenti di actina. Quando la stimolazione elettrica termina, la concentrazione citoplasmatica degli ioni Ca 2+ diminuisce; questo si traduce nel rilasciamento del muscolo. In un certo qual modo, la propagazione del potenziale d'azione dipende dal mantenimento del gradiente di Na+ e K+ a cavallo della membrana sarcoplasmatica. Una diminuzione del gradiente chimico di questi due elettroni, conseguente a una ridotta attività della pompa Na+/K+ ATPasi, agisce in modo marcato sull'eccitabilità della fibra muscolare e conseguentemente sulle performance della contrattilità muscolare. Figura 9 Riorganizzazione strutturale dei filamenti di actina e miosina a riposo e durante la contrazione muscolare. l'allungamento o il rilasciamento del muscolo). In questo modo la maggior variazione strutturale in termini di struttura si verifica a carico della banda I, che si restringe nel corso della contrazione. Questa banda si riduce d’ampiezza quando le linee Z sono tirate verso il centro del sarcomero. Non vi è variazione nella dimensione della banda A (che corrisponde alla lunghezza dei filamenti di miosina in un sarcomero). La zona H finisce per non essere più identificabile se i filamenti di actina si avvicinano molto, fino a entrare in contatto, nella parte centrale del sarcomero. Quando viene mantenuta una contrazione isometrica si genera forza senza che si verifichi variazione di lunghezza del sarcomero, l'ampiezza della banda I e A rimane costante: in questa condizione sia una continua interazione chimica tra i miofilamenti (sono gli stessi gruppi molecolari che interagiscono ripetutamente). Nel caso di una contrazione eccentrica la banda A si allarga, mentre la fibra si allunga durante la generazione della forza. AZIONE MECCANICA DEI PONTI TRASVERSALI La miosina svolge un ruolo meccanico ma anche enzimatico nel processo della contrazione muscolare. La parte globulare del ponte della miosina ( detta testa) contiene un’ATPasi che può essere attivata dall’actina a livello del punto preciso di attacco della testa della miosina sulle molecole dell’actina. L’attivazione dell’enzima porta all’idrolisi dell’ATP, che libera l'energia necessaria al fenomeno meccanico di scivolamento dei mio filamenti. La ciclica oscillazione in avanti e all'indietro delle teste della miosina (alimentata dall'energia liberata dall'idrolisi dell'ATP) realizza un movimento molto simile a quello delle pale dei remi nell'acqua Figura 10. Ma a differenza dei remi, che in una barca si muovono in modo sincrono, i punti laterali della miosina non si muovono in sincronia. Infatti, se così fosse, l'azione muscolare risultante sarebbe fatta di tanti successivi sussulti di contrazione al posto di essere, come in effetti è, un fenomeno fuso, continuo e finemente graduato. Nel corso di una contrazione ogni ponte va incontro a successivi episodi di aggancio e sgancio in modo indipendente dagli altri. In ogni momento circa il 50% dei punti della miosina è agganciato all'actina e in questo caso si parla di complesso dell'actomiosina, che di fatto sviluppa l'azione contrattile, mentre gli altri ponti si trovano in varie fasi del processo di aggancio e sgancio. Come illustrato nella figura 10, ogni ponte contribuisce a un piccolo spostamento longitudinale in riferimento al fenomeno complessivo dello scivolamento dei miofilamenti. I ponti stabiliscono un punto di contatto e poi, ruotando esercitano una forza che causa una progressione dei filamenti sottili lungo i filamenti spessi, a questo punto si verifica lo sgancio e ricomincia il processo. Sperimentazioni condotte con estrema accuratezza hanno determinato che la miosina genera una forza compresa fra 1 e 10 piconewton (pN; 10-12 N), con un movimento della miosina compreso fra 1 e 10 nanometri (nm; 10-9 m) in un intervallo di tempo pari a circa 5 ms. Figura 10 (A) posizione dei filamenti di actina e miosina durante i movimenti di oscillazione delle teste (ponti) della miosina. (B) l'azione meccanica legata alla rotazione di ogni testa contribuisce a generare uno scivolamento tra i filamenti di actina e miosina e quindi ad accorciare il sarcomero. Aggancio e sgancio tra actina e miosina e ruolo dell’ATP Durante la contrazione muscolare i ponti della miosina oscillano in continuazione dalla posizione di aggancio a quella di rilascio realizzando lo scivolamento dei miofilamenti. Questo naturalmente se il muscolo, nel corso della contrazione si può accorciare (contrazione concentrica). Se al muscolo non è consentito accorciarsi (contrazione isometrica), allora i ponti possono solamente agganciarsi sugli stessi punti di attacco dell’actina. Il distacco del ponte della miosina dall’actina si realizza quando la molecola di ATP si lega al complesso actomiosina. Questa reazione consente al ponte della miosina di liberarsi del legame e di riportarsi nella condizione iniziale, pronto a rigenerare un nuovo legame. Reazione di dissociazione dell’attica: Actomiosina + ATP ➝ Actina + Miosina - ATP L’energia, che si libera dall’idrolisi dell’ATP ad ADP e fosfato inorganico, viene convertita in energia meccanica. Uno dei siti attivi della testa del ponte della miosina presenta l’enzima adenosin-trifosfatasi miofibrillare (miosin-ATPasi), attivato dall’actina stessa. Questo enzima provoca la scissione dell’ATP e l'energia chimica che si libera si trasforma in energia meccanica. La velocità di scissione dell'ATP è relativamente bassa se actina e miosina non sono agganciate, tuttavia aumenta di molto se fra i due filamenti si stabilisce l’aggancio. Si ritiene inoltre che l'energia che si libera dalla scissione dell'ATP causi un’oscillazione della testa della miosina che facilita il legame del ponte con l'appropriato sito dell’actina. Questa modalità di trasferimento energetico causa un cambiamento conformazionale della testa della miosina che facilita il legame con la molecola di actina. Il filamento di actina scivola verso le teste che hanno modificato la loro conformazione e si generano quindi contatti tra actina e miosina in vari punti. Prima della contrazione, la testa della miosina è letteralmente piegata attorno alla molecola di ATP, avvolta come la spira di una molla. Avvenuto l'aggancio con l'actina e in concomitanza con la scissione dell'ATP, si verifica il rilascio di energia meccanica che corrisponde a una variazione della conformazione strutturale della testa della miosina stessa, che sostanzialmente si estende ed esercita una forza tale (colpo di forza) da generare lo scorrimento dei miofilamenti. Avviamento eccitazione-contrazione Con il termine accoppiamento eccitazionecontrazione si intende la sequenza degli eventi, innescati dal fenomeno elettrico suscitato dalla liberazione del mediatore chimico a livello della placca neuromuscolare in seguito all'attivazione del nervo motore che, attraverso l'aumento della concentrazione di Ca2+ intracellulare, si conclude con la contrazione muscolare. Il Ca2+ intracellulare svolge un ruolo primario nel regolare l'attività contrattile metabolica di una fibra muscolare. La concentrazione di Ca2+ all'interno di una fibra muscolare a riposo rimane relativamente bassa rispetto a quella del fluido extracellulare che bagna la cellula. La stimolazione delle fibre muscolari provoca un immediato, piccolo aumento del Ca2+ intracellulare, che procede l'attività contrattile. Il potenziale d'azione si distribuisce sulla superficie della cellula muscolare e, attraverso un sistema di tubuli T, giunge in prossimità delle cisterne del reticolo sarcoplasmatico, dove causa la liberazione degli ioni calcio (Ca 2+ ), la cui concentrazione intracellulare è molto importante per regolare il livello di contrattilità del muscolo. Quando la zona delle cisterne viene raggiunta dal potenziale d'azione, si ha un aumento del contenuto intracitoplasmatico del Ca2+. Il calcio, legandosi con la troponina, rimuove l'inibizione chimica alla realizzazione dell'aggancio tra actina e miosina. In presenza di Ca2+ si realizza dunque l'aggancio tra actina e miosina e il muscolo si prepara alla "contrazione" questo rende anche possibile l'azione facilitante dell'actina sull’enzima miosin-ATPasi che causa la scissione dell'ATP e la liberazione di energia. La sequenza delle reazioni può essere così schematizzato: Actina + Miosin-ATPasi ➝ Actmiosina + ATPasi Quando i siti attivi su actina e miosina sono uniti, la miosin-ATPasi è attivata per la scissione dell'ATP. L'energia generata da questo processo causa il movimento dei ponti della miosina e il muscolo genera tensione. Actomiosina ATP ➝ Actomiosina + ADP + P + Energia Il ponte si disaccoppia dall’actina quando l’ATP si lega al ponte di miosina. Il ciclo può ricominciare fintanto che la concentrazione del calcio rimane sufficientemente elevata da rimuovere l'inibizione esercitata dal complesso troponina-tropomiosina sul legame actina-miosina. Se la stimolazione lungo il nervo motore viene a mancare, il calcio dal citoplasma ripassa all'interno delle cisterne, e pertanto prevale l'inibizione del complesso troponina-tropomiosina e quindi actina e miosina rimangono separate, almeno in presenza di ATP. Infatti, nel rigor mortis, il muscolo si irrigidisce subito dopo la morte poiché la mancanza di ATP non consente lo sgancio tra l'actina e la miosina. La Figura 11 riassume la serie di eventi (accoppiamento eccitazione-contrazione) che caratterizzano l'interazione tra i filamenti di actina e di miosina con il Ca2+ e l’ATP, in una fibra muscolare rilasciata e in una fibra muscolare contratta. Rilasciamento muscolare Quando cessa la stimolazione proveniente dal nervo motore, la concentrazione citoplasmatica del calcio diminuisce, e si instaura nuovamente l'azione inibitoria del complesso troponina-tropomiosina sul legame actina-miosina. Il calcio passa di nuovo nelle cisterne, dove si concentra mediante un meccanismo attivo operato da specifici trasportatori (pompe). La scomparsa del calcio "inattiva" i punti di aggancio dell'actina per la miosina. Sostanzialmente, il processo di inattivazione include due aspetti: 1. non si rende possibile il legame meccanico tra le teste della miosina e filamenti di actina; 2. viene inibita l'attività della miosin-ATPasi, il cui ruolo è quello di favorire la scissione dell’ATP. Il rilasciamento muscolare si realizza quando i filamenti di actina e di miosina ritornano al loro stato iniziale. Figura 11 interazione tra filamenti di actina e miosina, ioni calcio e ATP in condizioni di riposo e durante contrazione muscolare. In condizioni di rilasciamento la troponina e la tropomiosina interagiscono con l'actina per prevenire la possibilità di legame tra i punti della miosina e l’actina. Durante la contrazione avviene il legame dei ponti trasversali della miosina all'actina dopo che il calcio si è legato a troponina e tropomiosina Sequenza degli eventi che caratterizzano la contrazione muscolare La Figura 12 riassume in modo schematico la sequenza degli eventi che portano alla contrazione muscolare. La sequenza inizia con l'attivazione del nervo motore che normalmente corrisponde a un ordine motorio impartito dalla corteccia. L'impulso si propaga quindi lungo l'intera superficie della fibra muscolare (sarcolemma), che viene così depolarizzata. Successivamente si hanno le seguenti nove fasi: 1. La generazione di un potenziale d'azione nel motoneurone fa sì che le piccole vescicole contenute nel compartimento assonale liberano l'acetilcolina (ACh) dal terminale presinaptico. L'acetilcolina, una volta diffusa nello spazio sinaptico, va a legarsi a particolari gruppi molecolari sulla membrana postsinaptica, i recettori per l’ACh. Esiste una simmetria quasi perfetta tra “l’impronta" delle vescicole presinaptiche che contengono ACh e "l'impronta" dei recettori postsinaptici che legano l’ACh. 2. Il potenziale d'azione muscolare depolarizza i tubuli trasversali a livello della banda A del sarcomero alla giunzione A-I. 3. La depolarizzazione del sistema dei tubuli T provoca il rilascio del calcio dalle cisterne terminali del reticolo sarcoplasmatico. 4. Il calcio, una volta nel citoplasma, si lega al complesso troponina-tropomiosina sul filamento di actina e ciò rimuove l'inibizione al legame tra actina e miosina. 5. Durante la contrazione muscolare l'actina si combina con il complesso miosin-ATP. L'actina attiva inoltre l'enzima miosin-ATPasi che idrolizza l’ATP. La scissione dell'ATP fornisce l'energia necessaria alla variazione di conformazione strutturale dei punti della miosina: da ciò ne risulta un effetto meccanico di scivolamento tra actina e miosina e si genera tensione. 6. Perché lo scivolamento si realizzi, la miosina si deve staccare dall’actina. Questo si realizza mediante un nuovo legame della miosina con l’ATP (che deve essere disponibile nel citoplasma). I filamenti spessi e sottili scorrono così l'uno sopra l'altro e il muscolo si accorcia. 7. L'attivazione dei ponti trasversali continua fintanto c h e l a c o n c e n t r a z i o n e d e l C a2+ r i m a n e sufficientemente elevata da inibire la formazione del complesso troponina-tropomiosina. 8. Se si arresta la stimolazione nervosa (quindi la liberazione di acetilcolina), la concentrazione citoplasmatica del calcio diminuisce rapidamente. Il c a l c i o r i t o r n a n e l l e c i s t e r n e d e l re t i c o l o sarcoplasmatico grazie a un trasporto attivo operato dall'idrolisi dell’ATP. 9. La riduzione della concentrazione citoplasmatica del calcio ripristina l'inibizione del complesso troponina-tropomiosina sull'aggancio actinamiosina. La condizione di sgancio si mantiene fintanto che è disponibile ATP nel citoplasma. Tipologia delle fibre muscolari I muscoli scheletrici non contengono una tipologia o m o g e n e a d i fi b re m u s c o l a r i c o n l e s t e s s e caratteristiche metaboliche e proprietà contrattili. In riferimento alla terminologia relativa ai criteri di classificazione, si considerano due tipi di fibre muscolari che sono ben distinguibili in base ai meccanismi primari che usano per produrre ATP, al tipo di innervazione del motoneurone e al tipo di catena pesante della miosina espressa. La distribuzione delle diverse tipologie di fibre muscolari varia nei diversi muscoli e da individuo a individuo. Fibre a contrazione rapida (tipo II) Le fibre muscolari a contrazione rapida presentano le quattro seguenti proprietà: 1. un'elevata velocità di trasmissione del potenziale d'azione; 2. un'elevata attività della miosin-ATPasi; 3. rapido rilascio e riassorbimento del Ca2+ grazie a un reticolo sarcoplasmatico molto sviluppato; 4. un'elevata velocità di aggancio e sgancio dei ponti trasversali. Queste quattro proprietà determinano sul piano dell'accoppiamento tra eccitazione e contrazione lo Figura 12 illustra la sequenza degli eventi che portano alla contrazione e al rilassamento del muscolo. I numeri indicano la sequenza delle nove fasi. A livello della giunzione neuromuscolare, con la liberazione delle vescicole di acetilcolina dal terminale assonale del motoneurone spinale prende avvio il processo di trasmissione. Il segnale elettrochimico attraversa lo spazio sinaptico tra la terminazione neuronale e la fibra muscolare. L'impulso elettrico, diffonde lungo il sistema dei tubuli T fino a raggiungere in profondità l'apparato contrattile delle miofibrille. sviluppo di forze elevate con elevata velocità di contrazione. Quest'ultima può essere da tre a cinque volte superiore rispetto alle fibre classificate come lente. Le fibre rapide possiedono un sistema glicolitico di produzione energetica a breve termine ben sviluppato. L'attivazione delle fibre rapide è ovviamente indispensabile in tutte le attività rapide di tipo anaerobico che richiedono elevata velocità e in tutte le altre attività di potenza che sono principalmente incentrate sul metabolismo energetico di tipo anaerobico. L'attivazione delle fibre rapide risulta determinante anche in quelle attività che richiedono una continua alternanza di soste e scatti, come nei giochi di squadra. Tutte queste attività richiedono una pronta disponibilità di ATP che solo la via di produzione energetica di tipo anaerobico può garantire. Le fibre di tipo due si distribuiscono in tre sottotipi primari: tipo IIa, tipo IIb e tipo IIc. La fibra di tipo IIa mostra una rapida velocità di accorciamento è una capacità moderatamente ben sviluppata di trasferimento di energia sia da fonti aerobiche (alto livello dell'enzima aerobico succinato deidrogenasi o SDH) sia da fonti anaerobiche (alto livello dell'enzima anaerobico fosfofruttochinasi, o PFK). Queste fibre rappresentano le fibre velociossidative-glicolitiche (FOG). La fibra di tipo IIb possiede il massimo potenziale anaerobico e la più rapida velocità di accorciamento; rappresenta la "vera" fibra glicolitica veloce (FG). Una fibra di tipo IIc, per quanto concerne le caratteristiche fisiologiche e metaboliche, cade a metà strada tra le altre due. Fibre a contrazione lenta (tipo I) Fibre a contrazione lenta utilizzano l'energia liberata dall'ATP prodotta prevalentemente attraverso la via aerobica. Le fibre lente presentano le quattro seguenti proprietà: 1. possiedono una minore attività miosin-ATPasica; 2. i movimenti del calcio attraverso le cisterne si verificano con velocità inferiore, così come inferiore e la velocità di contrazione; 3. la capacità glicolitica è molto meno sviluppata rispetto alle fibre rapide; 4. possiedono un maggior numero di mitocondri di maggiori dimensioni. Queste caratteristiche, unite all'elevata concentrazione mitocondriale di coenzimi che contengono ferro e all'alta concentrazione citoplasmatica di mioglobina, conferiscono alle fibre lente il caratteristico colore rosso. Queste fibre sono coinvolte soprattutto nelle attività di resistenza di tipo aerobico. Le fibre lente, o rosse, sono dunque specificatamente differenziate per il metabolismo aerobico, risultano molto resistenti all’affaticamento e quindi adatte all'attività aerobica prolungata. Per queste fibre è stato anche proposta la sigla SO per indicare la loro lenta velocità di contrazione e attività di tipo ossidativo che le caratterizza. A differenza delle fibre rapide, che si affaticano rapidamente, le fibre SO (più precisamente, le unità motorie) vengono selettivamente reclutate nel corso di attività di tipo aerobico. La valutazione dei profili di riduzione del contenuto di glicogeno a livello muscolare indica che nel corso di attività aerobiche intense e prolungate vengono quasi esclusivamente coinvolte le fibre muscolari lente. Anche dopo un esercizio di resistenza della durata di 1 2 o re , i l p o c o g l i c o g e n o r i m a s t o s i t ro v a esclusivamente nelle fibre veloci che sono rimaste inattive. Le fibre lente ossidative godono di una maggior densità del letto capillare che le circonda e, in relazione al flusso di sangue che raggiunge il muscolo, le fibre SO sono favorite nel riceverne quindi una quantità superiore rispetto alle fibre rapide. Vi sono condizioni nelle quali entrambi i tipi di fibre sono coinvolti: si tratta di attività con intensità prossime al massimo consumo di ossigeno con l'aggiunta di una componente anaerobica, tipicamente il mezzofondo in atletica, ma anche in altri sport nei quali la richiesta energetica e dello stesso tipo come nel nuoto, pallacanestro, calcio. Differenti tipologie di fibre muscolari nei diversi gruppi di atleti Sono state fatte interessanti osservazioni sperimentali relativamente alla tipologia muscolare e alla possibile influenza dell'allenamento sulle caratteristiche metaboliche e funzionali delle stesse fibre. In media, adulti e adolescenti maschi e femmine possiedono il 45-50% di fibre di tipo lento nei muscoli delle gambe e delle braccia. Per quanto riguarda le fibre rapide, esse si distribuiscono equamente tra tipo IIa e tipo IIb. Non esistono differenze legate al sesso, ma grandi differenze interindividuali. Inoltre, la composizione è relativamente simile in tutti i gruppi muscolari. La tipologia muscolare si correla strettamente alle caratteristiche atletiche. Atleti che eccellono nelle prove di resistenza possiedono un'elevata concentrazione di fibre lente nei gruppi muscolari che vengono attivati dalla specifica pratica sportiva. Viceversa per i campioni delle discipline di scatto c'è prevalenza delle fibre rapide. La Figura 13 riporta la distribuzione percentuale delle fibre lente in vari gruppi di atleti. Come si vede, gli atleti che eccellono le prove di resistenza, come maratona e sci di fondo, possiedono la maggior concentrazione di fibre lente (fino al 90-95% nel muscolo gastrocnemio) e anche la maggior potenza aerobica. Il sollevatore di pesi, i giocatori di hockey e gli scattisti, invece, hanno una bassa concentrazione di fibre lente e una bassa capacità aerobica. Per maschi e femmine che praticano il mezzofondo vi è eguale concentrazione di fibre rapide e lente. Questo vale anche per i lanciatori, i saltatori in lungo in alto. Le caratterizzazioni presentate nella figura 13 valgono per atleti che hanno effettivamente raggiunto livelli di eccellenza nelle loro specifiche discipline sportive. Tuttavia, anche tra costoro, la semplice composizione muscolare non è sufficiente a fare di un atleta un campione. Infatti, molti ricercatori hanno messo in evidenza che, sulla base della semplice composizione muscolare non è possibile fare alcuna estrapolazione Il testo del salto verticale Il test del salto verticale consiste nel misurare il massimo spostamento verticale del baricentro che un soggetto è in grado di raggiungere con la singola prova di salto: 1.La posizione di partenza: il soggetto si pone a fianco della parete in stazione eretta, talloni a terra e braccia distese lungo i fianchi. Con la mano destra (la sinistra se mancino) sporca di gesso tocca la parete lasciando un segno. 2.La misura in cm dell'altezza massima raggiunta sul tabellone del polpastrello del dito medio Figura 13 composizione delle fibre muscolari (percentuale fibre a contrazione lenta, rappresenta la posizione di lato sinistro) e massimo consumo di ossigeno (lato destro) atleti impegnati in diverse partenza. discipline sportive.le barre bianche esterne indicano la variabilità. 3.Il soggetto flette le gambe a 90° e sposta le braccia all’indietro. riguardo le capacità prestazionali. Questo non risulta in 4. Il soggetto esegue un salto andando a toccare il più effetti sorprendente, poiché la prestazione atletica è in alto possibile con la mano sporca di gesso, il frutto dell'integrazione di molti fattori che riflettono tabellone posto sul muro. caratteristiche fisiologiche, biochimiche, neurologiche e 5. Si effettuano tre prove con un intervallo di recupero biomeccaniche e non solo dipendenti dalla tipologia di 3-5 minuti e si registra la migliore. muscolare. 6. Sì calcola la differenza tra l'altezza raggiunta sul In termini di dimensioni delle fibre gli atleti delle tabellone del tocco della mano dell'atleta durante il discipline di resistenza hanno fibre muscolari di calibro salto con l'altezza della posizione di partenza e si relativamente normale, con una leggera tendenza a un ottiene così l’elevazione. incremento del diametro delle fibre lente. Viceversa, i 7. La differenza tra la misurazione iniziale a riposo è la sollevatori di pesi e altri atleti coinvolti in specialità di misura raggiunta con salto corrisponde alla potenza hanno fibre muscolari, in particolare quelle massima forza esplosiva degli arti inferiori. rapide, di calibro elevato, superiore almeno del 45% rispetto a un soggetto sedentario o atleta di resistenza Stima della potenza anaerobica di età simile. Questa diversità dipende dall'effetto La seguente equazione, applicabile a maschi e specifico che deriva dall'allenamento di forza che femmine, fornisce una stima della potenza alattacida induce un aumento della componente contrattile, in (potenza anaerobica massimale) espressa in watt modo particolare dei filamenti di actina e miosina, oltre (PAPW) a partire dalla misura dell'elevazione raggiunta che al contenuto intracellulare di glicogeno. La solo al salto verticale espressa in cm (VJcm) e dalla misura differenza tra i sessi in relazione alla composizione della massa del soggetto espressa in chilogrammi muscolare e legata al fatto che in genere negli atleti (BMKg). maschi è maggiore tanto la massa muscolare quanto la sezione delle fibre muscolari. (PAPW) = 60,7 (VJcm) + 45,3 (BMKg) - 2055 TEST DEL SALTO VERTICALE PER LA DETERMINAZIONE DELLA POTENZA ANAEROBICA ALATTACIDA La possibilità di successo in molte attività sportive sono direttamente collegati alla capacità di generare forza in modo esplosivo. Il test di valutazione della forza dinamica, il salto verticale da fermo, e spesso impiegato per la valutazione del sistema ATP-CP, cioè del sistema di potenza alattacida. il test è volto a fornire una valutazione della forza esplosiva espressa dagli arti inferiori. Esempio Un giovane di sesso maschile di 18 anni che pesa 78 kg, al test del salto verticale registra un'elevazione pari a 43 cm (con un'altezza alla posizione di partenza pari a 185 cm è un altezza massima al salto pari a 228 cm); stimare la potenza alattacida in watt: (PAPW) = 60,7 (43 cm) + 45,3 (78 Kg) - 2055 = 4088,5 W La media della potenza alattacida (potenza di tipo anaerobico) misurata con questo protocollo di salto verticali e pari a 4620,2 (SD ± 822,5) W per gli uomini e 2993,7 (SD ± 542,9) W per le donne.