caricato da
serluigi
Chimica: Nomenclatura, Tavola Periodica e Ossidi
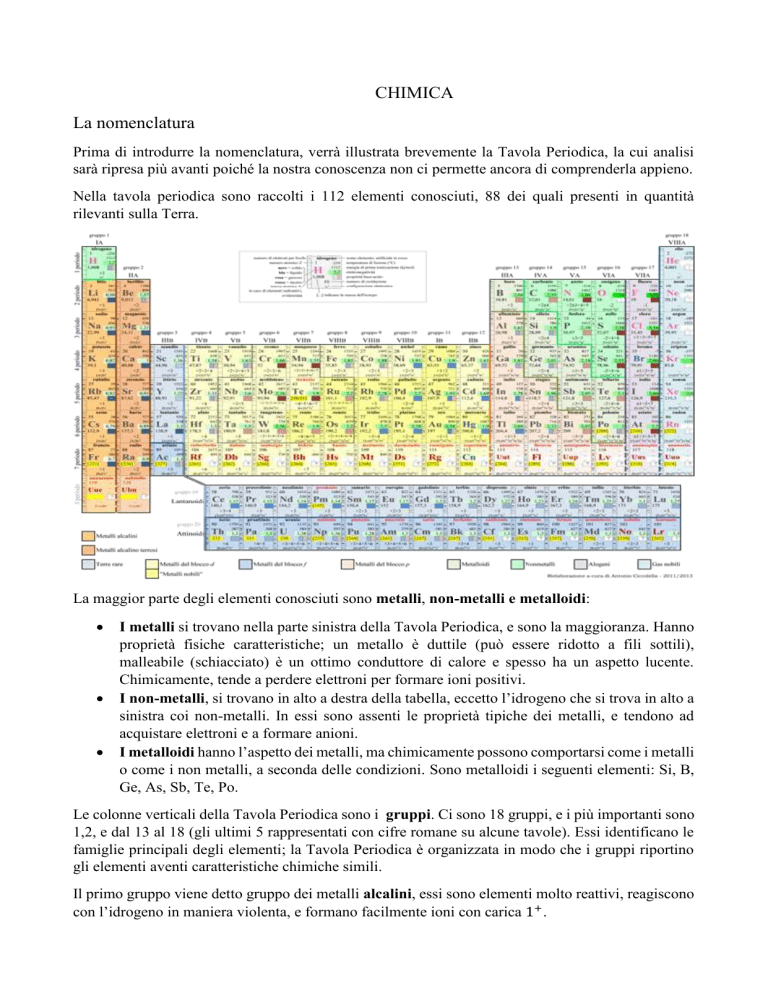
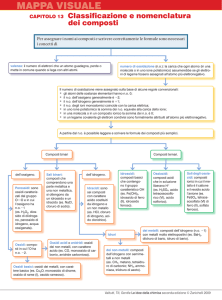
CHIMICA La nomenclatura Prima di introdurre la nomenclatura, verrà illustrata brevemente la Tavola Periodica, la cui analisi sarà ripresa più avanti poiché la nostra conoscenza non ci permette ancora di comprenderla appieno. Nella tavola periodica sono raccolti i 112 elementi conosciuti, 88 dei quali presenti in quantità rilevanti sulla Terra. La maggior parte degli elementi conosciuti sono metalli, non-metalli e metalloidi: I metalli si trovano nella parte sinistra della Tavola Periodica, e sono la maggioranza. Hanno proprietà fisiche caratteristiche; un metallo è duttile (può essere ridotto a fili sottili), malleabile (schiacciato) è un ottimo conduttore di calore e spesso ha un aspetto lucente. Chimicamente, tende a perdere elettroni per formare ioni positivi. I non-metalli, si trovano in alto a destra della tabella, eccetto l’idrogeno che si trova in alto a sinistra coi non-metalli. In essi sono assenti le proprietà tipiche dei metalli, e tendono ad acquistare elettroni e a formare anioni. I metalloidi hanno l’aspetto dei metalli, ma chimicamente possono comportarsi come i metalli o come i non metalli, a seconda delle condizioni. Sono metalloidi i seguenti elementi: Si, B, Ge, As, Sb, Te, Po. Le colonne verticali della Tavola Periodica sono i gruppi. Ci sono 18 gruppi, e i più importanti sono 1,2, e dal 13 al 18 (gli ultimi 5 rappresentati con cifre romane su alcune tavole). Essi identificano le famiglie principali degli elementi; la Tavola Periodica è organizzata in modo che i gruppi riportino gli elementi aventi caratteristiche chimiche simili. Il primo gruppo viene detto gruppo dei metalli alcalini, essi sono elementi molto reattivi, reagiscono con l’idrogeno in maniera violenta, e formano facilmente ioni con carica 1+ . I membri del gruppo 2 sono i metalli alcalino-terrosi, che formano ioni con carica 2+ quando reagiscono con i metalli. Il gruppo 16 è quello dei calcogeni. Nel gruppo 17, o VII A vi sono gli alogeni, che in natura sono presenti allo stato gassoso come molecole biatomiche. Gli elementi del gruppo 18, o VIII A sono noti come gas nobili, chiamati così perché reagiscono con pochissimi elementi, tant’è che fino al 1960 venivano chiamati gas neutri. Esistono tutti come gas monoatomici. Le righe orizzontali sono invece i periodi, numerati dall’alto verso il basso, sette in tutto. In basso sono presenti due righe, contenenti 14 elementi, e collocate là solo per questioni di spazio. La prima riga è detta serie dei lantanidi (o terre rare) la seconda riga è la serie degli attinidi. Tutti i rimanenti gruppi prendono poi il nome dell’elemento con numero atomico più basso, e quindi, quello più in alto. LA NOMENCLATURA Agli albori della chimica per indicare i composti i chimici utilizzavano nomi comuni, come sali di epsom, sali di magnesia, gesso. Ma col progredire della chimica ci si rese conto che l’uso dei nomi comuni avrebbe provocato una terribile confusione, sono noti infatti più di 4 milioni di composti. La soluzione è quella di adottare un sistema in cui il nome del composto sia correlato alla sua composizione. Dopo aver imparato ad usare il sistema un chimico dovrebbe essere in grado di dare un nome ad un composto osservandone la formula, e viceversa, comporne la formula dal nome. Pur non approfondendo ancora l’argomento, per parlare di nomenclatura è utile introdurre il concetto di elettronegatività. L’elettronegatività Per definizione, essa è: la capacità di un atomo di attrarre gli elettroni condivisi in un legame con un altro atomo. Nel 1932, lo scienziato statunitense Linus Pauling costruì una scala dell’elettronegatività sulla base dei valori sperimentali delle energie di legame delle molecole biatomiche. Per convenzione, Pauling scelse come elemento su cui basare la scala, l’idrogeno, assegnandogli un elettronegatività di 2,1. LINUS PAULING (1901-1994) La conoscenza dell’elettronegatività ci permette di scoprire quale tipo di legame si formerà tra degli atomi. Nella Tavola Periodica, l’elettronegatività: Aumenta lungo un gruppo dal basso verso l’alto Aumenta lungo un periodo da sinistra verso destra Possiamo perciò dire che l’elettronegatività aumenta col carattere non metallico dell’elemento. Il numero di ossidazione Definizione: Si definisce numero di ossidazione (N.O.) di un certo elemento, la carica effettiva che quell’elemento ha in un composto in cui compare come ione. Oppure, se si tratta di un composto con legami covalenti, la cariche che l’elemento assume se si contano gli elettroni condivisi nel seguente modo: gli elettroni di legame vengono affidati all’atomo più elettronegativo, e quelli condivisi da atomi di uno stesso elemento sono divisi in parte due. Il numero di ossidazione può essere positivo o negativo, intero o frazionario. Anche se il numero di ossidazione è presente nella tavola periodica, ecco alcune regole per identificarlo subito, esso infatti è fondamentale per attribuire un nome al composto: Tutte le sostanze elementari allo stato metallico o molecolare, hanno N.O.= 0 In un composto neutro la somma delle cariche è zero In uno ione, il N.O. è uguale alla sua carica In una reazione chimica, la somma di tutti i N.O. partecipanti deve essere zero I metalli alcalini hanno 𝑁. 𝑂. = +1 I metalli alcalino-terrosi 𝑁. 𝑂. = +2 Gruppo 3 e 13 𝑁. 𝑂. = +3 Gruppi 4 𝑁. 𝑂. = +4 L’ossigeno assume i seguenti numeri di ossidazione: 𝑁. 𝑂. = −2 nella maggior parte dei composti quando è legato con il fluoro, l’unica molecola più elettronegativa di lui, nel composto 𝑂𝐹2 assume 𝑁. 𝑂. = +2 𝑁. 𝑂. = −1 nei composti perossidi 1 𝑁. 𝑂. = − 2 nei composti superossidi L’idrogeno ha 𝑁. 𝑂. = +1 sempre tranne negli idruri metallici, dove ha 𝑁. 𝑂. = −1 Ora che conosciamo come ricavare un numero di ossidazione e sappiamo cos’è l’elettronegatività possiamo iniziare a nominare i composti. E’ utile sapere che, per motivi storici, esistono 3 tipi di nomenclatura: La nomenclatura I.U.P.A.C. (Union of pure and applied chemistry) che consente di evidenziare, in modo chiaro ed immediato, la relazione che c’è fra il nome di un composto e la sua formula chimica La nomenclatura TRADIZIONALE: è basata sulla suddivisione degli elementi in metalli e non metalli, e tiene conto dello stato di ossidazione degli atomi La nomenclatura secondo STOCK: che indica gli stati di ossidazione con cifre romane poste tra parentesi. Iniziamo con… I composti binari Sono i composti contenenti due elementi. Particolari composti binari sono gli ossidi: Ossidi Ossidi basici Ossidi acidi Gli ossidi basici sono composti formati dai metalli dei gruppo 1 e 2 e dai metalli di transizione ai loro numeri di ossidazione più bassi. Hanno una formula del tipo: 𝑋𝑛 𝑂𝑚 . A temperatura e pressione ambiente sono dei solidi, e si ottengono per reazione diretta tra il metallo e l’ossigeno. La formula dell’ossido è determinata dalla carica dello ione positivo. E l’ossigeno ha sempre 𝑁. 𝑂. = −2 N.B. Nella nomenclatura, si scrive sempre a destra l’elemento più elettronegativo! Nella nomenclatura Iupac, si scrive Prefisso-ossido di prefisso-Elemento I prefissi dipendono dai pedici! Ossia dai piccoli numeri sotto il simbolo dell’elemento che ne indicano la quantità in atomi. I prefissi sono: mono,di,tri,tetra,penta,esa,octa,nona,deca ecc..! Nella nomenclatura Tradizionale, si scrive invece: Ossido + Elemento-suffisso Dove il suffisso dipende dal numero di ossidazione: Si mette il suffisso –oso per i numeri di ossidazione più bassi, e nel caso si abbiano più di due numeri di ossidazione, il più basso comporterà l’aggiunta del prefisso -ipo Il suffisso –ico per i numeri di ossidazione più alti, nel caso si abbiano più numeri di ossidazione, il più alto comporterà l’aggiunta del prefisso –per Inoltre, se N.O. dell’elemento è unico si scrive il nome del metallo. Nella nomenclatura Stock si scrive: Ossido di +ELEMENTO (N.O. in cifre romane) Ad esempio BeO in Iupac sarebbe ossido di berillio, nella Tradizionale ossido di berillio (infatti il berillio ha solo un numero di ossidazione); e in Stock, ossido di berillio (II). Oppure, CuO è in Iupac l’ossido di rame, per la Tradizionale l’ossido rameico (numeri di ossidazione del rame sono +1 e +2) e in Stock ossido di rame (II). Gli ossidi acidi sono composti binari formati da un elemento non-metallico+ossigeno ed hanno formula del tipo 𝑋𝑚 𝑂𝑛 . Questi ossidi sono di natura covalente perché per i non-metalli la differenza di elettronegatività con l’ossigeno è bassa. Si inseriscono in questa categoria anche alcuni elementi di transizione che ad alti numeri di ossidazione si comportano come ossidi acidi. Questo tipo di elementi di dicono anfoteri. Sono anfoteri il Cromo (Cr) e il Manganese (Mn), la cui nomenclautra è: FORMULA 𝐶𝑟 𝑂 𝐶𝑟2 𝑂3 𝐶𝑟 𝑂3 IUPAC N.O.=+2 Ossido di cromo N.O.=+3 Triossido di dicromo N.O.=+6 Triossido di cromo FORMULA 𝑀𝑛 𝑂 𝑀𝑛2 𝑂3 𝑀𝑛 𝑂2 𝑀𝑛 𝑂3 𝑀𝑛2 𝑂7 N.O.=+2 N.O.=+3 N.O=+4 N.O.=+6 N.O.=+7 IUPAC Ossido di manganese Triossido di dimanganese Diossido di manganese Triossido di manganese Esossido di dimanganese TRADIZIONALE Ossido cromoso Ossido cromico Anidride cromica TRADIZIONALE Ossido manganoso Ossido manganico Diossido di manganese Anidride manganica Anidride permanganica Nella nomenclatura Iupac e nella Stock gli ossidi acidi vengono denominati allo stesso modo degli ossidi basici. Nella Tradizionale invece vi sono alcuni cambiamenti, dovuti a motivi storici. Prima gli ossidi acidi venivano chiamati anidridi, perciò, nella Tradizionale, gli ossidi acidi si nominano: Anidride (prefisso)-ELEMENTO-(suffisso) Dove il prefisso e il suffisso si riferiscono al numero di ossidazione e sono gli stessi degli ossidi, però al femminile. Ossia: ipo per …… ….. ….. ….. osa osa ica ica ATTENZIONE NEL CASO DELL’AZOTO! I nomi degli ossidi che si formano con l’azoto non rispettano alcuna regola; sono così per motivi storici: FORMULA ELEMENTO 𝑁2 𝑂 𝑁 𝑂 𝑁2 𝑂3 𝑁 𝑂2 𝑁2 𝑂5 IUPAC Ossido di diazoto Ossido di azoto Triossido di diazoto Diossido di azoto Pentossido di diazoto TRADIZIONALE Protossido di azoto Ossido di azoto Anidride nitrosa Anidride nitroso-nitrica Anidride nitrica I PEROSSIDI I perossidi sono quei composti in cui il N.O. dell’ossigeno è -1. Essi contengono un atomo di ossigeno in più rispetto agli ossidi corrispondenti, infatti il legame covalente tra i due ossigeni crea una sorta di competizione tra le nuvole elettroniche dei due ossigeni, portando il loro numero di ossidazione da -2 (numero di ossidazione dell'ossigeno nella quasi totalità dei suoi composti) a -1. Non sono molto diffusi e sono caratterizzati dal gruppo ----O----O---- Nella nomenclatura Tradizionale si scrive: perossido di ELEMENTO Nella nomenclatura Iupac si scrive invece: biossido di (prefisso)-elemento Il più importante perossido, e il perossido di idrogeno 𝐻2 𝑂2 chiamata comunemente acqua ossigenata. Esistono altre due categorie di composti binari, formati da un elemento e dall’idrogeno. Questi sono gli idracidi e gli idruri. Gli idracidi Gli idracidi sono composti in cui si legano un atomo di idrogeno con un elemento del gruppo 17 (un alogeno) oppure con un atomo di zolfo o un atomo di selenio, o con lo ione cianuro (𝐶𝑁 − ). La loro formula è del tipo: 𝐻𝑚 𝑋𝑛 . Nella nomenclatura tradizionale si scrive: acido (elemento)-idrico Es: HF è l’acido fluoridrico, HBr è l’acido bromidrico, HCN è l’acido cianidrico Nella iupac invece: elemento-uro di idrogeno Es: HF è il floruro di idrogeno, HBr è il bromuro di idrogeno, HCN è il cianuro di idrogeno. Gli idruri Idruri Idruri salini (o metallici) Idruri covalenti Se abbiamo metallo+idrogeno, allora si parla di idruri salini o metallci. Se abbiamo non-metallo+idrogeno allora si parla di idruri covalenti. Negli idruri, il N.O. dell’idrogeno è sempre -1. Sia nella nomenclatura Iupac che in quella tradizionale, i composti si nominano allo stesso modo. La loro formula è del tipo 𝑋𝑛 𝐻𝑚 Nella tradizionale: idruro di +nome elemento Nella iupac: prefisso-idruro di +nome elemento Molti idruri covalenti hanno, nella nomenclatura tradizionale nomi ritenuti ad esempio: FORMULA P𝐻4 As𝐻3 N𝐻3 C𝐻4 Si𝐻4 TRADIZIONALE fosfina arsina ammoniaca metano silano IUPAC Tetraidruro di fosforo Triidruro di arsenico Triridruro di azoto Tetraidruro di carbonio Tetraidruro di silicio Degli idruri metallici è da sottolineare l’allumina (Al𝐻3 ), che in iupac si chiama tetraidruro di alluminio. ▲▲▲▲▲▲▲▲▲▲▲▲ Prima di introdurre i Sali, altri composti binari, è meglio introdurre i composti ternari che derivano dagli ossidi basici e acidi, grazie ai quali sarà possibile spiegare poi la formazione dei Sali. Verranno analizzati prima gli Idrossidi OSSIDO BASICO + 𝐻2 𝑂 = Idrossido Gli idrossidi sono composti ionici che si formano facendo reagire l’ossido basico con dell’acqua. Sono formati dallo ione positivo del metallo e dall’anione O𝐻 − (detto ione idrossido o ossidrile) che ha sempre N.O.=-1. La loro formula è così: 𝑋𝑛 (𝑂𝐻)𝑚 . Lo ione idrossido va sempre messo tra parentesi poiché esso costituisce un’entità unica (è un atomo di ossigeno legato ad un atomo di idrogeno). Per la nomenclatura degli idrossidi, valgono le seguenti regole: Iupac: prefisso-idrossido di +elemento Tradizionale: idrossido elemento-suffisso (i suffissi sono oso (N.O. più basso) e ico (N.O. più alto)) Stock: idrossido di+elemento (N.O.) Ad esempio: Fe(𝑂𝐻)2 , in Iupac è il diidrossido di ferro, nella Tradizionale idrossido ferroso, nella Stock idrossido di ferro (II) In acqua gli idrossidi si scindono nei propri componenti, liberando lo ione 𝑂𝐻 − . Tutte le sostanze che fanno ciò sono chiamate basi. Ed è per questo motivo gli ossidi da cui si ottengono gli idrossidi sono detti basici. OSSIACIDI Ossido acido + 𝐻2 𝑂 = Ossiacido Sono composti ternari formati da idrogeno, ossigeno ed un non-metallo con formula 𝐻𝑛 𝑋𝑚 𝑂𝑠 Si generano dalle anidridi per reazione con l’acqua e il loro numero di atomi si ricava sommando gli atomi presenti nella reazione. Sono detti acidi perché in acqua di dissociano (a volte non completamente) in ioni 𝐻 + che vanno ad unirsi alle molecole d’acqua formando lo ione 𝐻3 𝑂+ detto, ione sonio. Inoltre gli idrogeni legati all’ossigeno presenti nell’ossiacido vengono detti acidi. Solitamente tutti gli idrogeni di un acido inorganico sono acidi. Le eccezioni si hanno con 𝐻3 𝑃 𝑂2, l’acido ipofosforoso e 𝐻3 𝑃 𝑂3, l’acido ipofosforico. Infatti nell’acido ipofosforoso due H sono legati al fosforo e non all’ossigeno, mentre nell’acido ipofosforico un idrogeno è legato al fosforo. Un acido contenente 1 o più H acidi si dice monoprotico oppure poliprotico (dipende dal numero di idrogeni acidi). Riguardo alle regole di nomenclatura: Ipuac: acido prefisso-osso-elemento-ico Tradizionale: acido prefisso-elemento-suffisso (Prefissi: ipo, e per; suffissi: oso, ico) Attenzione! Nel caso dell’azoto, solo l’anidride nitrosa 𝑁2 𝑂3 e l’anidride nitrica 𝑁2 𝑂5 danno ossidi acidi. Solo il Carbonio (IV) dà ossiacidi Fosforo, Boro, Arsenico e Silicio possono combinarsi con più di una molecola di 𝐻2 𝑂 , a seconda del numero di ossidazione. Più precisamente: Se N.O. è pari, allora, si può sommare con 1 o 2 molecole d’acqua e acquisterà (nella nomenclatura tradizionale) i rispettivi prefissi meta e orto. Se N.O. è dispari, si può sommare con 1, 2 e 3 molecole d’acqua acquistando rispettivamente i prefissi: meta, piro, orto. I SALI Quando un acido reagisce con una base, si formano i Sali. Infatti, in acqua l’acido si dissocia in un anione e ioni idrogeno 𝐻 + , mentre la base in cationi e ioni idrossili (𝑂𝐻 − ). Il catione e l’anione si uniscono a formare il sale, mentre lo ione idrogeno (che nient’altro sarebbe se non un protone) e lo ione idrossile formano una molecola d’acqua. In generale, la formula dei sai è 𝐶𝐴𝑇𝐼𝑂𝑁𝐸𝑛 𝐴𝑁𝐼𝑂𝑁𝐸𝑚 . E in tutte le forme di nomenclatura, si scrive prima il nome del catione, e poi quello dell’anione. Perciò bisogna imparare a nominare gli ioni. ANIONI Si ottengono, togliendo dagli acidi gli atomi di idrogeno, e ponendo tante cariche negative quanti sono gli atomi di idrogeno che sono stati tolti. Iniziamo ad analizzare i tipi di anioni: -Anioni monoatomici: 𝐾 − (ione caluro), 𝑁𝑎− (ione natruro) i quali si nominano, sia in iupac che nella tradizionale come: ione +elemento-uro Può accadere che l’elemento sia ancora legato ad uno o più idrogeni. In tal caso si scriverà: Iupac: ione idrogeno elemento-uro Tradizionale: ione elemento-uro acido Ad esempio: 𝐻𝑆 − per la tradizionale è lo ione solfuro acido, per la iupac è lo ione idrogeno solfuro. -Anioni omopoliatomici: in cui l’unico elemento è presente più volte: 𝑂22− . Per la nomenclatura di questi anioni valgono le regole dei monoatomici. -Ossoanioni: sono gli anioni che contengono ancora dell’ossigeno. Nella iupac: ione+prefisso-osso-elemento-ato (N.O. del nonmetallo) Nella tradizionale: Si parte dall’acido coniugato (che si ottiene aggiungendo tanti H quanti ne occorrono per far tornare la molecola neutra) e si fanno le seguenti sostituzioni ai suffissi: -oso -ico -idrico -ito -ato -uro E in generale si scrive: ione elemento-suffisso. Es: 𝐶𝑂32− deriva dall’acido carbonico! Perciò si chiamerà ione carbonato. Come nel caso degli ioni omopliatomici, è possibile che atomi di idrogeno rimangano legati agli anioni. Ciò accade perché separare un atomo da un anione richiede molta più energia rispetto alla separazione di un idrogeno da un atomo neutro. Perciò, se non vi è abbastanza energia nella reazione, l’idrogeno rimane legato all’ossigeno. Diverso composto, diverse regole di nomenclatura: Iupac: ione pref-idrogeno- pref-osso-elemento-ato (N.O. elemento) Tradizionale: ione elemento-suffisso acido -Anioni Basici: sono gli anioni che contengono lo ione ossidrile, come (𝑂𝐻)𝐶𝑙2− Iupac: ione prefisso-idrossi-elemento-uro Tradizionale: ione cloruro prefisso-basico (il prefisso è dato dai numeri greci mono, di, tri, tetra ecc…) CATIONI Si scrivono ponendo in alto a destra dell’elemento un numero di cariche positive pari al numero di ossidazione del metallo. Nomenclatura: Iupac: ione elemento (N.O.) Tradizionale: ione elemento-suffisso(i suffissi sono –oso e –ico, a seconda del numero di ossidazione) Es: 𝑁𝑎+ ione sodio, 𝐹𝑒 2+ è lo ione ferro (II) o, nella tradizionale, lo ione ferroso. Esistono anche i cationi poliatomici. La regola di denominazione è la seguente: ione elemento-onio Ora che conosciamo come denominare gli ioni, possiamo parlare dei Sali. Come ho spiegato prima nascono dall’unione di cationi e anioni che si sono separati dalle basi e dagli acidi. Si dice che un sale è di un certo acido se condivide con quell’acido lo stesso ossoanione. Si parlerà così di Sali acidi. Si dice che un sale è di un certo metallo se condivide con quel metallo lo stesso catione. Si parlerà cosi di Sali metallici. I Sali aventi in comune lo stesso anione prendono il generico nome dell’anione e ne costituiscono una famiglia. Ad esempio, dall’anione floruro nascono i floruri. Per le regole di nomenclatura: Iupac: nome anione + nome catione Tradizionale: nome anione (nella tradizionale naturalmente) + nome catione (nella tradizionale) Ad esempio: 𝐶𝑎𝐶2 è il carburo di calcio, 𝐶𝑎(𝐻2 𝑃𝑂2 )2 è il bis-diidrogenodiossofosfato (I) di calcio nella iupac, o fosfato di calcio nella tradizionale. I SALI DOPPI I Sali doppi sono composti che derivano dall’unione di due Sali semplici aventi l’anione in comune e il catione diverso (raramente accade il contrario). Non abbiamo studiato come si nominano. Un esempio di sale doppio è l’allume di rocca 𝐾𝐴𝑙(𝑆𝑂4 )2. IDRATI Gli idrati si formano quando delle molecole di acqua rimangono intrappolate all’interno di un solido ionico durante la cristallizzazione per effetti di legame. La nomenclatura degli idrati è: nome composto (solitamente sale)+prefisso(che indica il numero di molecole d’acqua)-idrato Ad esempio: 𝐶𝑢𝑆𝑂4·5𝐻2 𝑂 è un tetraossosolfato di rame pentaidrato Queste sono le regole di nomenclatura. Essendo la chimica una materia vastissima, perché riguarda tutto ciò che ci circonda, persino noi stessi, i nomi sono milioni! E non sempre si seguono queste regole, (principalmente per motivi che riguardano la storia dell’elemento) perciò alcuni nomi vanno studiati a memoria. Eccone un elenco, che dovrà andare aumentando. NOMI PARTICOLARI COMPOSTI Allimina: 𝐴𝑙2 𝑂3 Calce viva: 𝐶𝑎𝑂 Potassaa caustica: 𝐾2 𝑂 Silice o quarzo:𝑆𝑖𝑂2 Acido solforico (questo è da tenere a mente perché è importantissimo nelle reazioni chimiche): 𝐻2 𝑆𝑂4 Metano: 𝐶𝐻4 Fosfina: 𝑃𝐻4 Arsina: 𝐴𝑠𝐻3 Silano: 𝑆i𝐻4 Ammoniaca: 𝑁𝐻3 Acido fosforoso: 𝐻3 𝑃𝑂3 Ione caluro: 𝐾 − Ione natruro: 𝑁𝑎 − Acido cianidrico: 𝐻𝐶𝑁 Ione cianuro: 𝐶𝑁 − Ione fosforile: 𝑃𝑂+ Ione carbonile: 𝐶𝑂+ Ione nitrosile: 𝑁𝑂+ Calce spenta: 𝐶𝑂𝐻 Ione ossido: 𝑂2− con 𝑁. 𝑂. = −2 Ione perossido: 𝑂22− con 𝑁. 𝑂. = −1 1 Ione superossido: 𝑂2− con 𝑁. 𝑂. = − 2 1 Ione ozonuro: 𝑂3− con 𝑁. 𝑂. = − 3