caricato da
dekoh
Biosintesi e degradazione dei nucleotidi

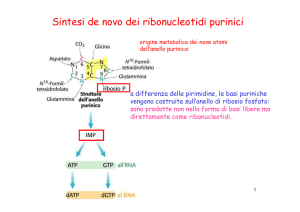
lOMoARcPSD|3196971 Biosintesi e degradazione dei nucleotidi Sintesi Esistono due vie per arrivare ai nucleotidi: la sintesi ex novo ed il riciclo. La sintesi ex novo inizia con precursori metabolici quali aminoacidi, ribosio 5-fosfato, CO2 e N H3 mentre il riciclo sfurutta le basi e i nucleosidi rilasciati durante il breakdown degli acidi nucleici. La sintesi ex novo è uguale in tutti gli organismi viventi e non prevede come intermedi le basi libere, cioè non si ha un meccanismo di sintesi delle basi con seguente attacco al ribosio: gli anelli vengono invece costruiti uno o due atomi alla volta per le purine o sotto forma di orotato per le pirimidine. Parecchi precursori sono condivisi dalle vie di sintesi per purine e pirimidine di cui uno fondamentale è il fosforibosil pirofosfato (PRPP); un aminoacido per ciascuno tipo di base è inoltre precursore fondamentale: glicina per le purine ed aspartato per le pirimidine. Sintesi ex-novo delle purine Il primo passo è la donazione di un gruppo amminico dalla glutammina al C-1 del PRPP dando come risultato altamente instabile la 5-fosforibosilammina su cui verrà costruito l’anello purinico. Il secondo step è l’aggiunta dei tre atomi provenienti dalla glicina. Una molecola di ATP viene consumata per attivare il gruppo carbossile della glicina sotto forma di acil fosfato. Il gruppo aggiunto viene a questo punto formilato da parte dell’N 10 -formiltetraidrofolato e un azoto viene messo a disposizione dalla glutammina prima della chiusura della struttura a formare un anello imidazolico che prende il nome di 5-ammini imidazolo ribonucleotide. Arrivati alla costruzione dell’anello imidazolico tre dei sei atomi necessari al seondo anello sono già in posizione. A questo punto si ha carbosilazione diretta grazie all’enzima AIR carbossilasi; l’aspartato dona ora il suo gruppo amminico in due step mentre l’ultimo carbonio è dato dall’N 10 -formiltetraidrofolato: il primo intermedio con un anello purinico completo è l’inosinato (IMP). La conversione dell’inositato ad adenilato richiede l’inserimento di un gruppo amminico derivante dall’aspartato e questo avviene in due reazioni simili a quelle usate per inserire N-1 nell’anello purinico; una differenza sostanziale è che l’energia per la sintesi arriva qui da GTP mentre nel passaggio precedente da ATP. Il prodotto di formazione è l’adenilosuccinato che viene poi trasformato in adenilato (AMP) grazie all’azione dell’adenilosuccinato liasi con perdita netta di fumarato. A partire dall’inosinato è possibile ottenere anche guanilato (GMP) in due passaggi: il primo è una deidrogenazione promossa da IMP deidrogenasi e N AD+ dipendente e porta alla formazione di xantilato (XMP); il secondo step è il Scaricato da simone lardi ([email protected]) lOMoARcPSD|3196971 trasferimento di un gruppo amminico derivante dalla glutammina a formare guanilato con spesa di un ATP. Controllo della sintesi purinica Il controllo della sintesi purinica si basa su meccanismi a feedback relativi ai prodotti delle varie reazioni preparatorie. Un passaggio di regolazione è unico per le purine ed è quello della formazione della 5-fosforibosilammina a partire da PRPP con catalisi della glutamminaPRPP amidotrasferasi: questo enzima viene inibito da IMP, AMP e GMP. Gli altri shunt di controllo sono nello schema. Sintesi ex-novo delle pirimidine I ribonucleotidi pirimidinici comuni sono la citidina 5’-monofosfato (CMP) e l’uridina 5’-monofosfato (UMP). L’anello pirimidinico a sei atomi viene costruito per primo e poi attaccato al ribosio 5-fosfato in un processo che richiede il carbamoil fosfato, un intermedio del ciclo dell’urea (veniva formato per reazione di ammoniaca, bicarbonato e ATP grazie all’enzima carbamoil fosfato sintetasi I) che però per questo scopo viene sintetizzato da un enzima diverso, la carbamoil fosfato sintetasi II. Il carbamoil fosfato a questo punto reagisce con l’aspartato a dare N-carbamoilaspartato in una reazione catalizzata dall’aspartato transcarbamoilasi. Il secondo passaggio è la rimozione d’acqua dal N-carbamoilaspartato a dare L-diidroorotato: Queste prime tre reazioni vengono catalizzate da enzimi che fanno parte di una singola proteina trifunzionale che prende l’acronimo di CAD. A questo punto l’L-diidroorotato viene ossidato a orotato in una reazione in cui N AD+ è l’accettore di elettroni grazie alla catalisi della diidroorotatodeidrogenasi. Scaricato da simone lardi ([email protected]) lOMoARcPSD|3196971 Una volta formato l’orotato il ribosio 5’fosfato, fornito sotto forma di PRPP, viene attaccato a dare uridilato (o uridina 5’monofosfato o UMP), che viene poi fosforilato a formare UTP. CTP viene formato a partire da UTP per azione della citidilato sintetasi in cui solitamente la glutammina dona un gruppo azotato. Controllo della sintesi pirimidinica Il controllo (nei batteri) avviene soprattutto a livello del primo passaggio della sintesi, cioè sull’attività dell’enzima aspartato transcarbamoilasi, che viene inibito da CTP. Sintesi dei nucleosidi trifosfati I nucleotidi da usare nelle biosintesi tipicamente vengono convertiti in nucleosidi trifosfati grazie a vie comuni a tutte le cellule. La fosforilazione da AMP ad ADP è promossa dall’adenilato chinasi nella reazione AT P + AM P ⇋ 2ADP L’ADP formato in questa reazione viene poi fosforilato ad ATP dagli enzimi glicolitici o attraverso la fosforilazione ossidativa. L’ATP promuove anche la formazione di altri nucleosidi difosfati in una classe di reazioni catalizzate da enzimi chiamati nucleoside monofosfato chinasi; la reazione generica è: AT P + N M P ⇋ ADP + N DP I nucleosidi difosfati vengono convertiti in trifosfati da parte di un enzima ubiquitario, la nucleoside difosfato chinasi, che catalizza la reazione N T Pdonatore + N DPaccettore ⇋ N DPdonatore + N T Paccettore L’enzima non è specifico per purine/pirimidine o per ribosio/desossiribosio anche se N T Pdonatore è quasi sempre ATP per via della sua concentrazione sempre alta nella cellula. Sintesi dei desossiribonucleotidi I desossiribonucleotidi, colonna portante del DNA, vengono sintetizzati dai ribonucleotidi corrispondenti per riduzione diretta al carbonio 2 del ribosio in una reazione catalizzata dalla ribonucleotide reduttasi. La reazione di riduzione richiede una coppia di idrogeni che vengono donati da NADPH attraverso una proteina carrier di nome tioredossina (possiede due gruppi -SH in grado di accettare gli idrogeni provenienti da NADPH). La forma ossidata della proteina viene ridotta da NADPH in una reazione catalizzata dalla tioredossina reduttasi e la forma ridotta viene usata dalla ribonucleotide reduttasi per ridurre il nucleotide difosfato a trifosfato. Una seconda fonte di equivalenti riducenti è il glutatione GSH che serve da riducente per una proteina simile alla tioredossina, la glutaresoddina che fa da tramite del potere riducente alla reduttasi. Scaricato da simone lardi ([email protected]) lOMoARcPSD|3196971 Il DNA contiene la timina invece dell’uracile e la sintesi di questa base azotata coinvolge solamente desossiribonucleotidi. Il precursore del timidilato (dTMP) è il dUMP; la conversione da dUMP a dTMP è catalizzata dall’enzima timidilato sintasi. Un’unità monocarboniosa idrossimetilica (−CH2 OH) viene trasferita da N 5 , N 10 -metilentetraidrofolato al dUMP e ridotta poi a un gruppo metile a spese del tetraidrofolato che viene ossidato a diidrofolato. Il diidrofolato formato in questa reazione viene ridotto a tetraidrofolato dall’enzima diidrofolato reduttasi e questa rigenerazione è essenziale per tutti i processi che richiedono il tetraidrofolato. Scaricato da simone lardi ([email protected])