Il trapianto di cornea:
attualità e prospettive
RIASSUNTO
Lo scopo di questa rassegna è di fornire una panoramica della situazione attuale
e delle prospettive del trapianto di cornea in Italia. Il trapianto consiste nella sostituzione della porzione centrale della cornea con un lembo corneale omologo.
L’intervento è effettuato utilizzando cornee prelevate entro 24 ore dal decesso da
donatori selezionati. Le cellule basali dell’epitelio del limbus (la periferia corneale) sono le cellule staminali dell’epitelio che riveste la cornea. In caso di deficit
del limbus, il trapianto di cornea non è una misura sufficiente, perché fornisce
solo un sostituto temporaneo dell’epitelio del ricevente, senza ricostituire la funzionalità delle cellule staminali. Il successo del trapianto si identifica con la possibilità di restituire all’occhio operato una capacità visiva migliore o paragonabile a
quella dell’occhio controlaterale. La percentuale complessiva di sopravvivenza
del trapianto è circa 90% a un anno, 74% a 5 anni, 62% dopo 10 anni. La causa
più frequente di fallimento è il rigetto immunologico, seguito dallo scompenso
tardivo per esaurimento del lembo. Nessuno studio esteso è mai stato pubblicato
sul risultato dei trapianti di cornea in Italia. Il CORneal Transplant Epidemiological Study, che Fondazione Banca degli Occhi sta conducendo da quattro anni,
produrrà informazioni sui risultati a medio e lungo termine dei trapianti di cornea in Italia. Il compito di una banca degli occhi è raccogliere, selezionare, conservare e distribuire tessuti oculari per chirurgia elettiva o interventi urgenti.
Parole chiave
Trapianto di cornea, cheratoplastica perforante, cheratoplastica lamellare, superficie oculare, banche degli occhi.
Corneal transplantation: present and perspectives
SUMMARY
The aim of this review is to provide an overview of the current status and the future
perspectives of corneal transplantation in Italy. Corneal transplantation is performed by
replacing the central portion of the recipient cornea with a donor button, retrieved from
selected donors within 24 hours from the death. The basal cells of the limbus (the corneal
periphery) are the corneal epithelial stem cells. In case of limbal deficiency, the corneal
transplantation does not represent a sufficient measure, because it provides only a
temporary replacement of the recipient epithelium, and it does not restore the limbal stem
cells function. The success of the corneal transplantation can by defined by the possibility
to restore in the operated eye a visual acuity better, or at least comparable, to the contra
lateral eye. The overall survival rate of the transplanted corneas is about 90% (after 1
year), 74% (5 years), 62% (10 years). The most frequent cause of failure is the
immunological rejection, followed by the late failure due to graft exhaustion. Up to now
there are not published studies on the outcome of corneal transplantation in Italy. The
CORneal Transplant Epidemiological Study, that the Veneto Eye Bank Foundation is
performing since four years, will produce information on the intermediate and long term
outcome of corneal transplantation in Italy. The aim of an eye bank is to procure, select,
store and deliver ocular tissue for elective and urgent surgery.
Key words
Corneal transplantation, penetrating keratoplasty, lamellar keratoplasty, ocular surface,
eye banks.
101
3/ 2005
Diego Ponzin1
Alessandro Galan2
1
Fondazione Banca degli
Occhi, Venezia-Mestre
2
U.O. Oculistica, Ospedale
S. Antonio, Padova
Il trapianto di cornea:
attualità e prospettive
l
D. Ponzin et al.
Trapianti 2005; IX: 101-113
Introduzione
Il primo tentativo di trapianto di cornea di cui esista documentazione è
stato eseguito nel 1838 da Kissam, che trapiantò ad un paziente una
cornea di maiale, senza l’utilizzo di anestesia1. Lo xenotrapianto fallì, come una serie di ulteriori tentativi. Tuttavia nel 1905 Edward
Konrad Zirm, un oculista di Vienna (1863-1944), eseguì il primo trapianto di cornea su di un paziente dell’attuale Repubblica Ceca,
Alois Glogar, che nell’agosto del 1904 si era provocato una grave
ustione da calce agli occhi.
Nel 1905, Karl Brauer, un bimbo di 11 anni, ebbe un grave trauma da
schegge metalliche in un occhio. Quattro mesi dopo, il piccolo fu portato nella clinica di Zirm a Olomouc, una zona rurale dell’Austria.
Zirm, non riuscendo a salvare l’occhio di Brauer, lo enucleò e ne utilizzò il tessuto corneale per trapiantarlo negli occhi di Glogar. In uno
dei due occhi il trapianto rimase funzionante, permettendo a Glogar
un certo recupero visivo2. Il dottor Zirm viene quindi ricordato come
il pioniere che ha eseguito con successo il primo trapianto di cornea.
Lo scopo di questa rassegna è di fornire una panoramica della situazione attuale e delle prospettive del trapianto di cornea in Italia.
l
Anatomia e fisiopatologia della cornea e del limbus
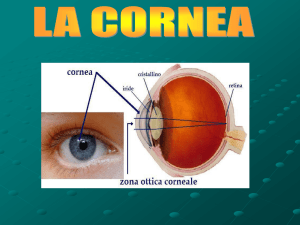
La cornea rappresenta la porzione anteriore del bulbo oculare. Grazie
alla sua trasparenza e curvatura essa si comporta come una potente
lente, permettendo alla luce di raggiungere le strutture interne dell’occhio e stimolare la retina. Il mantenimento della trasparenza e
della fisiologica curvatura della cornea, che è priva di vasi sanguigni,
è essenziale per la visione3.
La cornea è delimitata esternamente da un epitelio squamoso non cheratinizzato che poggia, mediante una membrana basale, su di uno stroma povero di acqua. Lo strato più interno, a contatto con l’umore acqueo della camera anteriore, è costituito da un monostrato di cellule
(endotelio), che forma un mosaico regolare di elementi esagonali.
L’epitelio, che viene costantemente rinnovato, è costituito da 3-4 strati
esterni di cellule piatte, 1-3 strati intermedi e uno strato di cellule basali colonnari. Le cellule degli strati esterni ed intermedi sono postmitotiche, e si differenziano progressivamente fino a desquamarsi,
mentre lo strato basale, costituito da transient amplifying cells variamente differenziate, rappresenta il comparto mitoticamente attivo.
Lo stroma è composto principalmente da collagene, la cui disposizione in
fibre di diametro e spaziatura uniformi è essenziale per la trasparenza
della cornea; inoltre sono presenti glicoproteine e proteoglicani.
L’endotelio corneale della specie umana non possiede attività mitotica
e il numero di cellule si riduce progressivamente con l’età (0,5% per
anno a partire dall’età adulta). Inoltre, la perdita endoteliale può essere accelerata da patologie o insulti di varia natura.
Una lesione dell’endotelio provoca un aumento di spessore della cornea,
102
Il trapianto di cornea:
attualità e prospettive
che diventa edematosa e perde la trasparenza4. Il rigonfiamento della
cornea è dovuto all’ipertonicità dello stroma rispetto al film lacrimale
e all’umore acqueo. Poiché i fluidi e i soluti entrano continuamente
nello stroma, lo spessore e la trasparenza della cornea devono essere
mantenuti mediante una costante rimozione dei fluidi. Il meccanismo
attraverso il quale l’endotelio rimuove i fluidi dallo stroma, noto come
pompa endoteliale, è costituito da trasportatori e canali ionici che
promuovono un flusso di ioni dallo stroma all’umore acqueo (soprattutto Na+ e HCO3-), seguito da un movimento di acqua.
Il limbus è la zona di transizione tra cornea e congiuntiva bulbare. Le
cellule basali dell’epitelio del limbus sono le cellule staminali dell’epitelio corneale. Tali cellule sono scarsamente differenziate, hanno
un alto potenziale proliferativo ed una bassa attività mitotica, e producono le transient amplifying cells, che si moltiplicano ma hanno un
potenziale proliferativo limitato. La scoperta del ruolo delle cellule
del limbus corneale ha contribuito alla definizione della superficie
oculare, una unità anatomo-funzionale che comprende il film lacrimale, l’epitelio corneale e l’epitelio congiuntivale.
l
D. Ponzin et al.
Trapianti 2005; IX: 101-113
Le patologie corneali e della superficie oculare
Tutte le malattie che provocano una grave alterazione della trasparenza e
della curvatura della cornea conducono alla cecità parziale o totale.
Se queste malattie sono incurabili, o il danno da esse prodotto è irreversibile, il trapianto di cornea rappresenta l’unica possibilità terapeutica. Secondo l’Organizzazione Mondiale della Sanità (OMS), le patologie della cornea, a livello internazionale, sono responsabili del 20%
dei casi di cecità, al secondo posto dopo la cataratta. Nei paesi in via di
sviluppo prevalgono le patologie corneali secondarie ad infezioni, nei
paesi occidentali il trapianto di cornea viene eseguito principalmente
per patologie congenite o secondarie a interventi chirurgici.
Le malattie che producono alterazioni di curvatura sono rappresentate
dal cheratocono, un’ectasia congenita che colpisce i giovani, provoca
uno sfiancamento della cornea e ne compromette la struttura (tabella I). Le alterazioni della trasparenza comprendono: malattie congeIndicazione
Italia
USA
PK (%)
LK (%)
PK (%)
LK (%)
Cheratocono
47
66
15
12
Ritrapianto
14
3
11
0
Cheratopatia bollosa
12
0
20
0
Cheratite
6
8
6
23
Distrofia
6
3
4
3
Trauma
4
2
4
5
Cicatrice corneale
3
3
1
25
Altro
8
15
39
32
103
Tabella I. Principali indicazioni
cliniche al trapianto di cornea
in Italia (dati estratti dal data
base di Fondazione Banca Occhi
relativi a 2001 cornee distribuite per PK e 118 lenticoli distribuiti per LK) e in USA (Eye Bank
Association of America, dati relativi a 31.178 cornee distribuite per PK e 414 lenticoli distribuiti per LK) nel 2004. Il cheratocono si manifesta nei giovani
(età media dei pazienti operati
con cornee fornite da Fondazione: 36 anni). I soggetti affetti
da cheratopatia bollosa sono in
genere anziani (età media: 68
anni). Nel caso delle distrofie le
conseguenze sulla visione diventano importanti in età adulta (età media: 59 anni).
Il trapianto di cornea:
attualità e prospettive
nite, le distrofie corneali (figura 1), patologie ereditarie che producono un danno all’endotelio, o provocano l’accumulo di sostanze
anomale nello stroma, con conseguenze sulla visione che diventano importanti in età
adulta; malattie infiammatorie, come l’infezione prodotta dal virus Herpes; malattie degenerative, come la cheratopatia bollosa, manifestazione clinica della perdita della funzione endoteliale che può rappresentare la
complicanza di interventi come l’estrazione
della cataratta e si verifica negli anziani; malattie traumatiche, come le perforazioni. Infine, un gruppo di pazienti è rappresentato da
soggetti sottoposti a ritrapianto, sia come
conseguenza di un rigetto, sia per esaurimento della funzionalità del lembo corneale.
La superficie oculare può essere compromessa
da traumi o patologie che distruggono le cellule staminali dell’epitelio, o la congiuntiva. La perdita delle cellule staminali dell’epitelio
corneale (deficit limbare) determina difetti epiteliali persistenti o recidivanti, ulcere stromali, sostituzione della superficie corneale con
epitelio congiuntivale e formazione di un danno neovascolare. Questo predispone alla formazione di leucomi, ulcere settiche o trofiche,
melting e rischio di perforazioni corneali. Se in questa situazione si esegue un trapianto di cornea, l’intervento è destinato all’insuccesso, per
problemi di riepitelizzazione.
l
D. Ponzin et al.
Trapianti 2005; IX: 101-113
Figura 1. Cornea di paziente di
51 anni, affetto da distrofia granulare, una patologia congenita, autosomica dominante, che
produce un progressivo accumulo di proteina amiloide nello
stroma centrale, prevalentemente anteriore, della cornea.
In genere l’acuità visiva risulta
essere compromessa nel corso
della quinta decade di vita.
Lampada a fessura, 10 X. Archivio Fondazione Banca Occhi.
Il trapianto di cornea
Il trapianto consiste nella sostituzione della
porzione centrale della cornea con un lembo corneale omologo che in genere ha un
diametro di 8,0–8,5 mm (cheratoplastica
perforante, PK, figura 2). L’intervento è effettuato utilizzando cornee prelevate entro
24 ore dal decesso da donatori selezionati,
viene condotto in anestesia generale o locale e dura da 30 a 60 minuti. Il tessuto sano
viene suturato alla porzione residua della
cornea patologica mediante un filo di nylon
10/0, che viene lasciato in situ per 12-18
mesi. L’intervento comporta una degenza di
pochi giorni o viene eseguito in day hospital, è seguito da un rapido
recupero visivo e non richiede una terapia immunosoppressiva sistemica. I rischi di rigetto sono contenuti, perché la cornea è priva di
vasi sanguigni. Se esso si manifesta, può essere controllato mediante
una terapia topica a base di cortisonici. Quando si parla di trapianto
di cornea, si intende normalmente l’intervento di tipo perforante,
104
Figura 2. Trapianto di cornea, 6
mesi dopo l’intervento. Il lembo è
trasparente, la riepitelizzazione è
completa. La sutura, di tipo continuo, sarà rimossa dopo 12-18 mesi
dall’intervento. Lampada a fessura, 16 X. Archivio dott. A Galan.
Il trapianto di cornea:
attualità e prospettive
che viene eseguito in condizioni random, senza tipizzazione del donatore e del ricevente.
Negli anni Quaranta Louis Paufique (1899-1981), un eminente oculista
francese, ha sviluppato la cheratoplastica lamellare (LK), con lo scopo di sostituire solo gli strati patologici superficiali di una cornea alterata, lasciando intatte le strutture sane più profonde. Come la PK,
anche la LK può essere distinta in ottica (effettuata per ottenere la
riabilitazione visiva dell’occhio interessato), tettonica (serve a ristabilire lo spessore o l’integrità della cornea) e terapeutica (ha lo scopo di rimuovere una patologia in atto, come una neoplasia o un’infezione)5. La LK tettonica o terapeutica può essere seguita, se necessario, da una cheratoplastica perforante a scopo ottico.
In base al tipo di preparazione del tessuto e dell’occhio ricevente, distinguiamo una LK manuale (lo stroma corneale viene dissezionato
con una spatola smussa), meccanizzata (preparazione con microcheratomo), e con laser ad eccimeri. In base al
tipo di tecnica chirurgica la LK può essere
superficiale (viene sostituito lo stroma anteriore), a spessori differenziati (una LK superficiale in cui si innesta un lenticolo più
spesso dello stroma che è stato asportato),
profonda (sostituzione di tutto lo stroma,
fino alla membrana di Descemet), posteriore
(sostituzione di stroma posteriore, membrana di Descemet ed endotelio) L’evoluzione
della tecnica chirurgica ha migliorato i risultati visivi, ampliando le indicazioni della LK.
L’intervento viene condotto in anestesia generale o locale, e può durare fino a 90 minuti. Un lenticolo sano (figura 3) viene suturato al letto residuo della cornea, dalla quale sono stati rimossi gli strati patologici. Il
filo di sutura viene lasciato in situ per 3-4
mesi6. La LK presenta alcuni vantaggi rispetto alla PK. Poiché si tratta di una procedura extraoculare, le potenziali complicanze associate all’apertura del bulbo (infezioni intraoculari, cataratta, ipertono,
emorragia espulsiva) vengono eliminate. Inoltre l’intervento è assai
raramente seguito da reazioni di rigetto immunologico.
In caso di deficit del limbus corneale, il trapianto di cornea non è una
misura sufficiente, perché fornisce solo un sostituto temporaneo
dell’epitelio del ricevente, senza ricostituire la funzionalità delle cellule staminali; quando le cellule epiteliali del donatore esauriscono
la loro capacità mitotica, il trapianto fallisce. Se il limbus è solo parzialmente danneggiato, l’applicazione di membrana amniotica può
essere sufficiente a stimolare la riepitelizzazione della cornea, evitando interventi più impegnativi6.
La membrana amniotica, lo strato più interno delle membrane fetali, è
costituita da uno strato di cellule epiteliali poggianti su di una mem-
105
D. Ponzin et al.
Trapianti 2005; IX: 101-113
Figura 3. Lenticolo corneale preparato con microcheratomo,
uno strumento che utilizza una
lama che, con movimenti ad
alta frequenza, taglia lo stroma
corneale garantendo una buona regolarità della superficie.
L’aspetto è simile a quello di
una lente a contatto. Generalmente il chirurgo utilizza la
stessa tecnica per la preparazione del letto corneale del ricevente, sul quale innesterà il lenticolo. La qualità della superficie
è un fattore importante per l’acuità visiva dopo l’intervento.
Microscopio elettronico a scansione, 16 X. Archivio Fondazione Banca degli Occhi.
Il trapianto di cornea:
attualità e prospettive
brana basale, a sua volta ancorata ad uno stroma avascolare, di natura collagenica. Si tratta di un tessuto non immunogenico (le cellule
non esprimono antigeni HLA-A, -B, -C e -DR), dotato di proprietà
trofiche, anti-dolorifiche e anti-infiammatorie. Dal 1995 la membrana amniotica viene utilizzata in chirurgia oculare ricostruttiva, nel
trattamento di patologie corneali, della superficie oculare e di cheratalgie, nella chirurgia del glaucoma, da sola o in associazione con
altre procedure. La ricostituzione della superficie corneale può essere seguita, a distanza di tempo, dalla PK a scopo ottico.
l
I risultati
Da quando è stato effettuato per la prima volta, il trapianto di cornea
ha subito una costante evoluzione. Il successo del trapianto si
identifica quasi sempre con la possibilità di restituire all’occhio
operato una capacità visiva migliore, o almeno paragonabile, a
quella dell’occhio controlaterale. Secondo dati di letteratura (gli
unici due studi prospettici, multicentrici, disponibili a livello internazionale, che abbiano coinvolto un numero elevato di pazienti, sono quelli dell’Australian Corneal Graft Registr y e il Corneal
Transplant Follow-up Study, eseguito nel Regno Unito), la percentuale complessiva di sopravvivenza della cornea trapiantata (capacità del lembo di rimanere trasparente) è circa 90% a un anno,
74% a 5 anni, 62% dopo 10 anni. Nel caso di occhi “ad alto rischio”, che presentano neovascolarizzazione corneale, infiammazione, o un deficit del limbus, la percentuale di sopravvivenza del
lembo a 10 anni è inferiore al 35%7.
Questi dati sono simili alle percentuali di successo del trapianto di
rene, un organo vascolarizzato. La causa più frequente di fallimento della cheratoplastica perforante è il rigetto immunologico,
seguito dallo scompenso tardivo per esaurimento del lembo. Ciò
induce a ritenere che il concetto di sito immunologicamente privilegiato sia da riconsiderare (la nozione che la cornea sia uno dei
siti immunologicamente privilegiati dell’organismo, derivata più
di 100 anni fa da osservazioni sperimentali, è stata applicata all’occhio da Medawar nel 1948, sulla base dell’osser vazione che
tale organo non dispone di un drenaggio linfatico. L’esistenza di
un’atipicità delle reazioni immunologiche che si svolgono nell’occhio è stata successivamente confermata sperimentalmente e sviluppata concettualmente).
La sopravvivenza del lembo non è il solo parametro che stabilisce il
successo dell’intervento (un lembo trasparente può non garantire
una buona capacità visiva). Inoltre il risultato visivo non deve essere espresso solo come acuità visiva naturale e best corrected visual
acuity, ma anche come migliore acuità visiva ottenuta con una correzione tollerabile dal paziente. La risoluzione di un’eventuale sintomatologia dolorosa, il ripristino dell’anatomia, il risultato estetico, la percezione del paziente relativamente al risultato funzionale
106
D. Ponzin et al.
Trapianti 2005; IX: 101-113
Il trapianto di cornea:
attualità e prospettive
e all’adeguatezza dell’intervento sono altri indicatori utili. Inoltre,
il giudizio sulla trasparenza corneale va accompagnato da dati
come la pachimetria, la densità e la morfologia dell’endotelio, lo
stato dell’epitelio. Infine, anche il monitoraggio di indicatori negativi, come gli eventi avversi e le complicanze, deve essere preso in
considerazione.
Alcuni fattori prognostici in grado di influenzare l’esito di trapianti
sono già stati individuati, ma il loro peso relativo rimane da stabilire. Essi comprendono la patologia del ricevente (infiammazione
e vascolarizzazione della cornea al momento del trapianto), il
grado di deterioramento dell’endotelio e la dimensione lembo
trapiantato, l’esperienza del chirurgo (numero di trapianti eseguiti annualmente), il numero di trapianti subiti in precedenza
dallo stesso occhio, l’istocompatibilità nel caso di soggetti a rischio di rigetto.
In letteratura non sono ancora stati pubblicati studi sufficientemente illustrativi dell’esito a lungo termine del trapianto di cornea. Gli studi
multicentrici relativi a un elevato numero di pazienti sono basati su
un follow-up breve (un anno), e gli studi con follow-up lunghi comprendono pochi pazienti. Nessuno studio esteso è mai stato pubblicato sul risultato dei trapianti di cornea in Italia. Il CORneal Transplant Epidemiological Study, che Fondazione Banca degli Occhi sta
conducendo da quattro anni, in collaborazione con l’Università di
Padova e numerosi centri di trapianto italiani, risponde ai requisiti
elencati. Si tratta di uno studio longitudinale (prospettico), multicentrico che produrrà informazioni sui risultati a medio e lungo termine dei trapianti di cornea in Italia.
%
Evento avverso o complicanza
Trasmissione di
patologia sistemica
0
(da trentanni non si verificano casi)
Trasmissione locale di patologia
(cheratite, endoftalmite)
0,1 - 2,0 (conservazione a 4°C)
0,1 (conservazione in coltura)
Fallimento precoce
(lembo trapiantato diffusamente edematoso
al primo giorno post-PK, mancata risoluzione
dell’edema nei giorni successivi e assenza
di cause identificabili per il fallimento)
1,2 - 2,1 (conservazione a 4°C)
Fallimento tardivo
(graduale scompenso del trapianto in assenza
di cause apparenti, con refrattarietà
al trattamento con corticosteroidi e assenza
di storia recente di episodi di rigetto)
5–8
0,2 (conservazione in coltura)
Rigetto
32
Glaucoma
6
Recidiva di patologia
1
107
D. Ponzin et al.
Trapianti 2005; IX: 101-113
Tabella II. Incidenza annuale di
alcuni eventi avversi e complicanze nel trapianto di cornea. I
dati relativi alla conservazione
in coltura confermano che tale
tecnica consente di distribuire
cornee di qualità più affidabile.
Fonte: Fondazione Banca Occhi.
Eye Bank Association of America, 2004. Wilhelmus KR. Arch
Ophtalmol 1995; Bourne WM.
Cornea 2001; Ing JJ et al.
Ophthalmology 1998; Waldock
A, Cook SD. Br J of Ophthalmol
2000; Stechschulte SU, Azar DT.
Int Ophthalmol Clin 2000; Australian Corneal Graft Registry
1996; Corneal Transplant Follow-up Study 1994.
Il trapianto di cornea:
attualità e prospettive
l
Eventi avversi e complicanze del trapianto
Si intende per evento avverso una patologia trasmissibile, correlata e attribuibile alla procedura di trapianto, comprese le infezioni (endoftalmiti, cheratiti e patologie virali sistemiche), oppure un problema
relativo alla qualità biologica della cornea trapiantata, come lo
scompenso precoce o un lembo con alterazioni distrofiche. Si parla
di complicanza in presenza di un evento clinico in grado di compromettere l’esito del trapianto. Si parla infine di fallimento quando il
trapianto deve essere ripetuto per qualsiasi motivo, indipendentemente dalla trasparenza della cornea.
Eventi avversi, complicanze e fallimenti, dal punto di vista clinico, possono essere ulteriormente distinti in precoci e tardivi8. Gli eventi precoci
sono: mancanza di tenuta o altri problemi della sutura, difetti epiteliali persistenti, cheratopatia filamentosa, pressione intraoculare elevata,
emorragia della coroide, ipoema, cheratiti, endoftalmiti e scompenso
precoce. Gli eventi tardivi comprendono la crescita dell’epitelio in camera anteriore, gli errori di refrazione, il rigetto, il glaucoma, la trasmissione di patologie sistemiche e lo scompenso tardivo.
Attualmente il trapianto di cornea è gravato da un’incidenza molto bassa di eventi avversi, che comprendono lo scompenso precoce, il lembo con alterazioni distrofiche e la trasmissione locale di infezioni,
che si verifica in una percentuale inferiore a quella di altri interventi
sul segmento anteriore (tabella II). La maggior parte dei fallimenti
è attribuibile a complicanze come il rigetto e lo scompenso tardivo.
l
Le banche degli occhi
Il compito di una banca degli occhi è raccogliere, selezionare, conservare e distribuire cornee idonee e altri tessuti oculari, per chirurgia
elettiva o interventi urgenti9.
La prima banca degli occhi, costituita da Paton a New York nel 1944, ha
posto le basi per lo sviluppo di numerose banche, sia negli Stati Uniti che nel resto del mondo. Le banche statunitensi sono riunite nella
Eye Bank Association of America, un ente certificatore che associa 79
banche e impone ai suoi affiliati l’osservanza di linee-guida. Nel
2004 tali banche hanno raccolto 90.825 cornee, di cui 46.841 (52%)
sono state distribuite per PK, negli Stati Uniti (32.106), o esportate
in altri paesi, anche europei.
Le 83 banche degli occhi europee, riunite nella European Eye Bank Association, un’organizzazione tecnico-scientifica che chiede agli affiliati
di dichiarare i parametri di qualità adottati, nel 2003 hanno raccolto
41.709 cornee, di cui 21.689 (52%) distribuite per trapianto.
La prima banca degli occhi italiana è stata Fondazione Banca degli Occhi nel Veneto che, dall’inizio degli anni Novanta, opera sul territorio nazionale. In seguito sono nate altre strutture e, nel 2003, è stata
costituita la Società Italiana Banche degli Occhi (SIBO), con l’impegno di approfondire gli aspetti scientifici, elaborare linee-guida e in-
108
D. Ponzin et al.
Trapianti 2005; IX: 101-113
Il trapianto di cornea:
attualità e prospettive
teragire con le istituzioni che regolano e rappresentano l’attività di
procurement e trapianto (Società Oftalmologica Italiana, Società Italiana Trapianto di Cornea, Ministero della Salute, Centro Nazionale
Trapianti, Centri di Coordinamento Regionali e Interregionali).
Grazie all’esistenza della SIBO è stato possibile raccogliere i dati relativi all’attività di procurement e trapianto di cornea in Italia. Nel
2004, le 14 banche degli occhi italiane hanno raccolto 12.482 cornee, di cui 5387 (43%) sono state distribuite per PK e LK. Questi
dati, negli ultimi quattro anni, sono rimasti stabili (tabella III).
Sebbene non si conosca l’epidemiologia delle malattie corneali nel nostro paese, è possibile stimare la necessità di trapianto e il fabbisogno di cornee in Italia confrontando la nostra situazione con quella
di altre nazioni. I trapianti eseguiti ogni milione di abitanti sono 110
negli Stati Uniti, e 91 in Italia. Il confronto con gli Stati Uniti è interessante perché, nell’ultimo decennio, il numero di trapianti/anno
si è mantenuto costante, o in leggera flessione. Negli Stati Uniti,
quindi, è stata raggiunta una situazione di equilibrio tra il numero
dei pazienti che ogni anno necessitano di trapianto e la disponibilità
di cornee. È possibile prevedere che il fabbisogno italiano potrà essere soddisfatto qualora sia raggiunto un tasso simile a quello degli
Stati Uniti. Di conseguenza, per un tasso di 110 trapianti/1.000.000
abitanti/anno, il procurement in Italia deve aumentare a 14.00016.000 cornee/anno, per assicurare la disponibilità, posto come riferimento l’attuale percentuale di utilizzo del 43%, di 6000-7000 cornee idonee. Alla luce dei miglioramenti organizzativi promossi dal
Centro Nazionale Trapianti, dai Coordinamenti Regionali e Locali,
e dalle singole banche degli occhi nella promozione della donazione delle cornee per trapianto, tale traguardo appare vicino.
Nazione
Popolazione
(milione di abitanti)
Trapianti
Tasso
(trapianti/milione
abitanti/anno)
Italia
59
5387
91
Alcune nazioni UE*
307
13.213
43
Stati Uniti
292
32.106
110
l
Selezione dei donatori
Il successo del trapianto dipende anche dall’applicazione di procedure
volte a minimizzare il rischio di trasmissione di patologie sistemiche
e infezioni oculari dal donatore al ricevente. Il rischio deve essere
mantenuto a livelli tali da rendere favorevole il rapporto rischio/beneficio del trapianto di cornea, che non è un intervento salvavita ma
ha lo scopo di migliorarne la qualità.
109
D. Ponzin et al.
Trapianti 2005; IX: 101-113
Tabella III. Trapianti di cornea
in Italia (2004), alcune nazioni
della Unione Europea (2003) e
Stati Uniti (2004). Fonte: Fondazione Banca Occhi. Eye Bank
Association of America, 2004.
ISTAT, 2004. US Census Bureau,
2004. * Le nazioni della Unione
Europea considerate: Austria,
Belgio, Danimarca, Francia,
Germania, Irlanda, Grecia, Regno Unito, Svezia, Spagna,
Olanda (Directory 2005, European Eye Bank Association).
Il trapianto di cornea:
attualità e prospettive
Gli agenti eziologici che possono essere potenzialmente trasmessi con
la cornea comprendono batteri, funghi e protozoi (trasmissione locale), i virus e le cellule neoplastiche (trasmissione locale e sistemica), i prioni (trasmissione sistemica). In realtà i virus per cui esiste
una trasmissione documentata sono il virus dell’epatite B (due casi
antecedenti al 1985, data di inizio dell’applicazione dello screening
sierologico per HBV) e il virus della rabbia (quattro casi). La possibilità di trasmissione di cellule neoplastiche è limitata al retinoblastoma, un raro tumore del tessuto retinico (un caso in letteratura).
Inoltre è stata segnalata la presenza di cellule neoplastiche in cornee
prelevate da donatori deceduti per leucemia. Questo, assieme ad
una possibile eziologia virale, ha fatto sì che leucemie, linfomi, mielomi, nonché i tumori maligni del segmento anteriore dell’occhio
costituiscano criteri di esclusione. Tutte le altre neoplasie maligne
non costituiscono una controindicazione all’utilizzo delle cornee
per trapianto e non è mai stato documentato un aumento di incidenza di tumori nei riceventi di cornee provenienti da donatori deceduti per neoplasia. Per quanto riguarda i prioni, sono documentati quattro casi di trasmissione di encefalopatia spongiforme (un solo
caso definito, tre probabili), che risalgono agli anni ‘70, e quattro
casi di innesti di tessuti oculari provenienti da un donatore affetto
da encefalopatia spongiforme che, fino ad oggi, non hanno dato
luogo a conseguenze cliniche. L’OMS ha individuato nel 1997 i
gruppi a rischio per la possibile trasmissione dell’encefalopatia
spongiforme, che sono persone affette da encefalopatia spongiforme e loro famigliari, persone che hanno assunto l’ormone della crescita dal 1963 al 1985, o che hanno ricevuto innesti di dura madre, e
persone affette da malattie neurologiche di eziologia sconosciuta.
Il donatore di tessuti oculari viene selezionato attraverso l’identificazione (che assicura la rintracciabilità perenne), la documentazione
di ora, luogo, circostanze di decesso e prelievo, l’intervallo post-mortem, l’età (per motivi legati alla qualità dei tessuti oculari), la raccolta dell’anamnesi patologica prossima e remota, l’ispezione in situ
dei tessuti oculari e i test sierologici (ricerca di anti-HIV 1 e 2, antiHCV, antigene HBs e TPHA). L’esistenza di un periodo finestra,
durante il quale non è possibile rilevare alcuna risposta sistemica
alla presenza del virus, impone la raccolta dell’anamnesi sociale e
un’ispezione fisica, per escludere la presenza di comportamenti a
rischio. La fonte delle informazioni deve essere documentata ed è
costituita dalla cartella clinica e/o dal medico curante, personale
infermieristico, patologo, referto autoptico, medico di famiglia, famigliari o conoscenti vicini al deceduto.
Poiché da più di 30 anni non viene documentato un caso di trasmissione di patologia sistemica, si può concludere che, con l’applicazione delle attuali linee-guida, il rischio di trasmissione di patologie sistemiche associato al trapianto di cornea è teorico, oppure
molto basso.
110
D. Ponzin et al.
Trapianti 2005; IX: 101-113
Il trapianto di cornea:
attualità e prospettive
l
D. Ponzin et al.
Trapianti 2005; IX: 101-113
La conservazione della cornea
La conservazione della cornea ha lo scopo di mantenere inalterate le
caratteristiche del tessuto, in particolare il numero e la vitalità delle
cellule endoteliali, dal prelievo al trapianto.
Il più antico metodo, introdotto da Filatov nel 1935, consiste nella conservazione del bulbo oculare del donatore in una camera umida. Il
bulbo viene avvolto in una garza inumidita con soluzione salina sterile e conservato in un contenitore ermetico. Questo metodo è affidabile per 24 ore. Gli svantaggi sono emersi quando, a partire dagli
anni Cinquanta, è stata riconosciuta l’importanza dell’endotelio corneale. Poiché nella camera anteriore dell’occhio del cadavere sono
presenti enzimi idrolitici e metaboliti tossici, in concentrazione proporzionale alla durata dell’intervallo post-mortem, la cornea deve essere al più presto isolata dal bulbo oculare, e conservata in condizioni
idonee. Per questi motivi, tale metodo è oggi utilizzato solo in combinazione con altri sistemi di conservazione.
Nel 1974, McCarey e Kaufman hanno proposto un liquido per la conservazione a 4°C della cornea. A 4°C il metabolismo delle cellule corneali è ridotto e la funzione della pompa endoteliale è assente. A causa dell’ipertonicità dello stroma, una cornea immersa in un liquido
di coltura assume acqua e si rigonfia. Tale fenomeno ritarda il ripristino della trasparenza dopo l’intervento e può impedire una corretta sutura del lembo. Il liquido di McCarey e Kaufman contiene destrano (peso molecolare 40.000 KD), che trattiene l’acqua e mantiene lo spessore e la trasparenza corneale per 48-72 ore. Il liquido è stato seguito da altre formulazioni, tutte derivate da esso e costituite da
un medium per colture cellulari, antibiotici (gentamicina da sola o in
associazione), agenti deturgescenti (destrano e condroitin solfato),
substrati metabolici, antiossidanti, fattori di crescita. Poiché le cornee
conservate a 4°C vanno incontro a fenomeni degenerativi, esse vengono in genere trapiantate entro 5 giorni anche se, in particolari situazioni, è possibile arrivare fino a 10 giorni di conservazione. Tale
tecnica è semplice e la bassa temperatura, assieme agli antibiotici presenti, limita la crescita di eventuali specie microbiche contaminanti.
In questo lasso di tempo, tuttavia, non è possibile fare controlli microbiologici e, talvolta, si ha difficoltà a programmare l’intervento.
Negli anni Settanta è stata introdotta anche la conservazione della cornea in coltura a 30-37°C. La cornea viene inizialmente mantenuta in
un liquido per colture cellulari, contenente antibiotici, un antimicotico, L-glutamina e fattori di crescita. Questa fase può durare anche
quattro settimane. Il tessuto si rigonfia e pertanto, prima dell’intervento, viene trasferito in un liquido contenente destrano ad alto peso
molecolare (500.000 KD) che, in 24 ore, riporta lo spessore corneale
a valori paragonabili a quelli primitivi. Il lungo periodo di conservazione consente di programmare gli interventi, avere tessuti disponibili
per interventi urgenti, effettuare test di istocompatibilità e controlli
microbiologici, che consentono di distribuire tessuti esenti da crescita
111
Il trapianto di cornea:
attualità e prospettive
di micororganismi. Un altro aspetto interessante è dato dalla possibilità di fare più controlli dell’endotelio. Infine, a questa temperatura la
cornea risponde ai fattori di crescita ed esibisce fenomeni riparativi. I
tessuti che contengono alterazioni iniziali possono quindi essere recuperati. Gli svantaggi sono attribuibili alla complessità del metodo.
Non esistono studi clinici che dimostrino una differenza nell’esito a
lungo termine del trapianto eseguito con cornee conservate a 4°C o
in coltura; entrambi le tecniche, correttamente applicate, sembrano
garantire risultati sovrapponibili. In Italia la conservazione in coltura è stata introdotta da Fondazione Banca degli Occhi a partire dal
1996. Da allora è stata progressivamente adottata anche dalle altre
banche e oggi la maggior parte dei trapianti di cornea italiani viene
eseguita con questa metodologia.
l
La selezione della cornea
La selezione della cornea si basa sulla ricerca di malattie intrinseche dell’occhio, congenite o acquisite, segni di precedente chirurgia intraoculare, e sulla valutazione di densità, vitalità, presenza di alterazioni
morfologiche (pleiomorfismo, polimegatismo, distrofie, degenerazioni) dell’endotelio corneale. È opinione diffusa che la cornea per trapianto debba avere una densità endoteliale non inferiore a 2200-2500
cellule/mm2. L’età non è un parametro affidabile per selezionare la
cornea. A partire da 40 anni, un numero significativo di donatori ha
una densità endoteliale inferiore a 2000 cellule/mm2 e può presentare alterazioni distrofiche dell’endotelio, mentre donatori di età superiore a 80 anni possono fornire cornee idonee al trapianto. Per questi
motivi il limite superiore e inferiore dell’età del donatore può variare
da centro a centro, e dipende anche da considerazioni di efficienza.
l
La distribuzione
Le banche degli occhi devono distribuire i tessuti secondo principi etici
(coloro che erogano servizi sanitari hanno il dovere di accertarsi che
essi siano di buona qualità e disponibili per tutti coloro che ne hanno
bisogno). Il trapianto di cornea rappresenta quasi sempre una procedura elettiva e, nell’attuale situazione italiana, il problema dei tempi di attesa è ridimensionato. Nelle regioni che fanno riferimento a banche degli occhi efficienti il tempo di attesa è 1-3 mesi, e viene garantita la disponibilità immediata di tessuti nel caso di situazioni cliniche urgenti
(perforazione corneale in atto o imminente, dolore, fallimento di precedente trapianto), o particolari, come l’età pediatrica del paziente.
l
Conclusioni e prospettive future
Il trapianto di cornea rappresenta il più vecchio, il più comune e forse
il più efficace trapianto di tessuto. Se si pensa che il primo intervento è stato eseguito circa trent’anni dopo la scoperta dei microbi, e
112
D. Ponzin et al.
Trapianti 2005; IX: 101-113
Il trapianto di cornea:
attualità e prospettive
trent’anni prima dell’arrivo degli antibiotici nella pratica clinica, si
capisce come la storia del trapianto di cornea comprenda anche
qualche grave incidente e numerosi insuccessi.
Attualmente, nel mondo, si eseguono più di 100.000 trapianti di cornea
all’anno. Si tratta di una procedura sicura, associata ad un basso tasso
di morbilità. Le linee-guida internazionali e nazionali garantiscono
un riferimento per operare con elevati livelli di qualità e, anche nel
nostro paese, le possibilità di trapianto e l’attività delle banche degli
occhi sono presenti in molte regioni. I trapianti sono pianificati e i
tempi di attesa sono diminuiti, anche se ci sono ancora differenze tra
le diverse regioni. Il monitoraggio permanente degli esiti dei trapianti rappresenta una tappa obbligata nell’evoluzione della chirurgia e
delle banche degli occhi italiane, e consentirà un ulteriore miglioramento dell’efficacia ed efficienza di tutte le attività.
Le sfide che chirurghi e banche degli occhi sono chiamati a raccogliere dipendono dal progresso delle conoscenze. I concetti di patologia
della superficie oculare e deficit delle cellule staminali limbari hanno, in alcune situazioni cliniche, trasformato il ruolo del trapianto,
passato da procedura con scarse probabilità di successo a momento
finale di una serie di interventi (innesto di membrana amniotica o
di cellule staminali, trattamento con fattori di crescita) che consentono di curare patologie corneali per le quali, fino a qualche anno
fa, non esistevano terapie. La possibilità in futuro di disporre di cellule staminali autologhe della congiuntiva, oltre a quelle del limbus
corneale, allargherà le applicazioni di queste tecnologie e consentirà di eseguire il trapianto anche in patologie al momento difficilmente trattabili. La superficie oculare, infine, si presta all’applicazione di tecniche di terapia genica; la scoperta che il gene responsabile
di alcune distrofie corneali viene espresso dall’epitelio offre la possibilità di manipolare il genoma delle cellule staminali della cornea
che, una volta innestate, potrebbero arrestare o curare la patologia.
D. Ponzin et al.
Trapianti 2005; IX: 101-113
BIBLIOGRAFIA
twenty-five years.
Cornea 2000; 19: 611-6.
1. Kissam RS.
Cheratoplastice in man.
NY J Med 1844; 2: 281.
6. Rama P, Giannini R, Bruni A, Gatto C, Tiso R, Ponzin D.
Further evaluation of amniotic membrane banking for
transplantation in ocular surface diseases.
Cell Tissue Bank 2001; 2: 155-63.
2. Zirm E.
Eine erfolgreiche totale Keratoplastik.
Graefes Arch Ophthalmol 1906; 64: 580-93.
3. Gipson IL.
Anatomy of the conjunctiva, cornea, and limbus.
In: Smolin G, Thoft RA, eds. The cornea. Boston: Little,
Brown and Company publisher; 1994: 3-22.
4. Edelhauser HF.
Physiology.
In: Smolin G, Thoft RA, eds. The cornea. Boston: Little,
Brown and Company publisher; 1994: 25-42.
5. Terry M.
The evolution of lamellar grafting techniques over
7. Waldock A, Cook SD.
Corneal transplantation: how successful are we?
Br J Ophthalmol 2000; 84: 813-5.
8. Stechschulte SU, Azar DT.
Complications after penetrating keratoplasty.
Int Ophthalmol Clin 2000; 40: 27-43
9. Ponzin D.
Eye banking at the Fondazione Banca degli Occhi del
Veneto: present and perspectives.
Organs and Tissues 2003; 2: 111-9.
113