I MECCANISMI PATOGENETICI
Michelangelo Buonocore
Fondazione Salvatore Maugeri
Clinica del Lavoro e della Riabilitazione, IRCCS
Istituto Scientifico di Pavia
Servizio di Neurofisiopatologia
Per una migliore comprensione dei meccanismi fisiopatologici che sostengono il dolore è necessario
distinguere tra dolore fisiologico e dolore patologico.
Col termine di dolore fisiologico si intende il dolore evocato da stimoli di elevata intensità potenzialmente
in grado di provocare dei danni tessutali. Il dolore fisiologico ha funzione protettiva nei confronti
dell’insorgenza della lesione e precede l’insorgenza di dolore patologico. Il dolore patologico, al
contrario, compare quando i meccanismi di protezione dalla lesione non riescono ad evitare l’insorgenza
del danno tessutale.
Il dolore fisiologico è solo evocato e tipicamente cessa con la fine della stimolazione che l’ha generato.
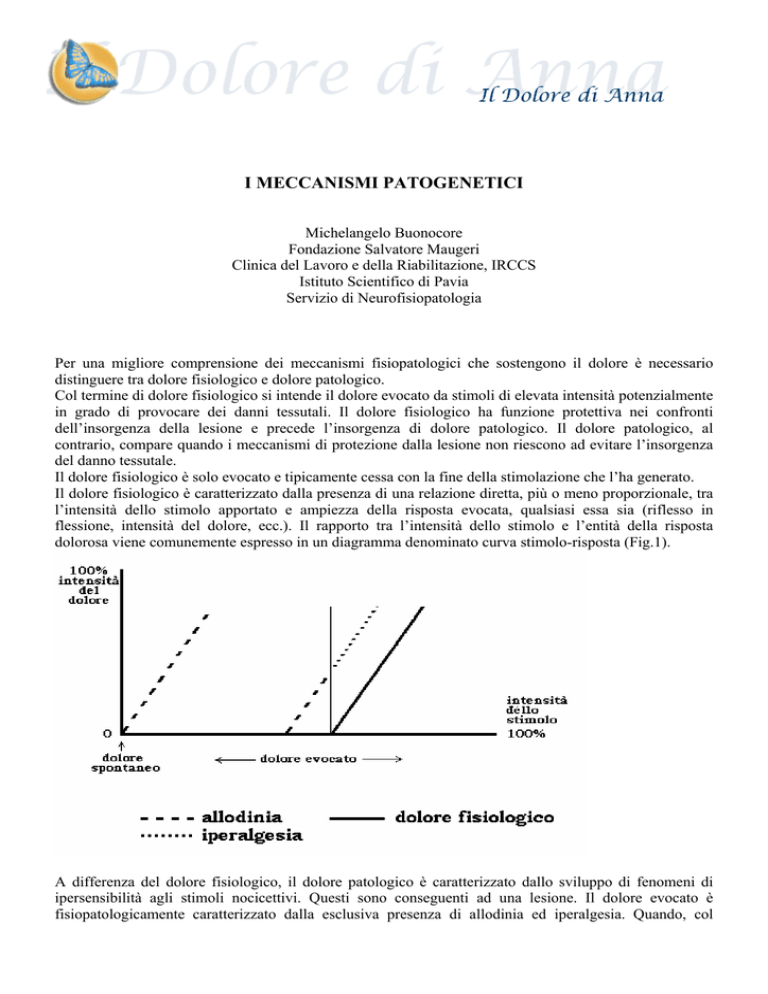
Il dolore fisiologico è caratterizzato dalla presenza di una relazione diretta, più o meno proporzionale, tra
l’intensità dello stimolo apportato e ampiezza della risposta evocata, qualsiasi essa sia (riflesso in
flessione, intensità del dolore, ecc.). Il rapporto tra l’intensità dello stimolo e l’entità della risposta
dolorosa viene comunemente espresso in un diagramma denominato curva stimolo-risposta (Fig.1).
A differenza del dolore fisiologico, il dolore patologico è caratterizzato dallo sviluppo di fenomeni di
ipersensibilità agli stimoli nocicettivi. Questi sono conseguenti ad una lesione. Il dolore evocato è
fisiopatologicamente caratterizzato dalla esclusiva presenza di allodinia ed iperalgesia. Quando, col
progredire della lesione, l’ipersensibilità agli stimoli raggiunge livelli particolarmente elevati compare
anche il dolore spontaneo.
A differenza che nel dolore fisiologico, mediato esclusivamente da fibre nervose di piccolo calibro, nel
dolore patologico anche le fibre nervose di grande calibro possono concorrere alla genesi di sensazioni
dolorose.
Come appare nella figura 2, il dolore patologico nasce dalla presenza di meccanismi patogenetici, in parte
noti ed in parte ancora oggi sconosciuti, scatenati dai processi patologici (infiammazione, lesione nervosa,
deafferentazione) che l’evento lesivo (trauma, neoplasia, infezione, disfunzione ecc.) ha provocato. Il
rapporto diretto non è quindi tra tipo di dolore ed evento lesivo ma bensì con i meccanismi patogenetici.
Due traumi identici possono provocare tipi di dolore diversi a causa di diversi meccanismi indotti.
EVENTO LESIVO
|
PROCESSO PATOLOGICO
|
MECCANISMO PATOGENETICO
|
DOLORE
Figura 2: il succedersi degli eventi: l’evento lesivo causa uno o più processi patologici, che a loro volta
innescano i meccanismi patogenetici del dolore.
Meccanismi di base
I meccanismi patogenetici di base del dolore sono essenzialmente due: l’ipersensibilità che si genera nei
nocicettori e l’ipersensibilità che si genera nelle fibre nervose. La prima rappresenta la caratteristica
essenziale del dolore nocicettivo, la seconda quella del dolore neuropatico (Fig.3).
Figura 3 : il dolore che origina dalle terminazioni nervose nocicettive (nocicettori) viene definito dolore
nocicettivo, quello che origina direttamente nel sistema nervoso dolore neuropatico.
L’ipersensibilità dei nocicettori rappresenta il meccanismo patogenetico del dolore di tutte le lesioni
tissutali. Esso è caratterizzato dal fatto che i nocicettori, che normalmente vengono attivati solo da stimoli
di elevata intensità, in caso di lesione tissutale vengono attivati anche da stimoli di bassa o media
intensità. Quando l’ipersensibilità raggiunge gradi elevati, i nocicettori diventano talmente ipersensibili da
scaricare in assenza di stimoli, sostenendo in tal modo il dolore spontaneo (Fig.1).
L’ipersensibilità dei nocicettori è in genere dovuta alla liberazione di sostanze algogene ma può essere
dovuta in parte allo sviluppo di adrenosensibilità sulle terminazioni nervose integre. In caso di lesione
tissutale le terminazioni libere sviluppano una sensibilità alle catecolamine per cui possono scaricare
quando entrano in contatto con queste ultime. Non è necessario che ci sia una iperattività simpatica per
scatenare questo meccanismo, basta il contatto con le catecolamine normalmente circolanti nel sistema
circolatorio.
Un particolare meccanismo che può portare all’ipersensibilità dei nocicettori è rappresentato dall’
infiammazione neurogena. Con tale termine si indica il processo che porta alla liberazione antidromica di
sostanze pro-infiammatorie e pertanto potenzialmente pro-nocicettive. In caso di attivazione delle fibre
nocicettive, l’impulso che viaggia ortodromicamente in direzione centripeta, può eccitare rami collaterali
dell’assone attivato. In tal modo si possono generare impulsi che, viaggiando antidromicamente, ritornano
al tessuto da cui è originariamente partito il primo stimolo nocicettivo. L’attivazione antidromica degli
assoni che veicolano impulsi nocicettivi si accompagna alla liberazione, a livello delle terminazioni
libere, di sostanza P e CGRP (Calcitonin Gene-Related Peptide). Ne consegue lo sviluppo, a livello
tessutale, di fenomeni infiammatori che, per come sono generati, vengono appunto chiamati col nome di
infiammazione neurogena.
Un particolare tipo di ipersensibilità nocicettoriale è quella dei nocicettori del tronco nervoso. Il dolore
del tronco nervoso (nerve trunk pain) rappresenta un tipo particolare di dolore nocicettivo che origina da
nocicettori localizzati all’interno dei nervi periferici ed in particolare nella loro parte connettivale. Il
dolore del tronco nervoso possiede pertanto la peculiarità di essere un dolore nocicettivo che consegue ad
una lesione nervosa periferica.
Finora sono stati descritti meccanismi patogenetici riferibili a ipersensibilità dei nocicettori senza lesioni
o disfunzioni lungo le vie nervose (meccanismi del dolore nocicettivo).
Adesso saranno illustrati una serie di meccanismi del dolore che sono sostenuti da lesioni o disfunzioni
lungo le vie nervose (meccanismi del dolore neuropatico).
Un primo meccanismo neuropatico è rappresentato dall’ipersensibilità delle fibre nervose periferiche con
genesi ectopica di impulsi sugli assoni lesi. Le fibre nervose lese del moncone prossimale di un nervo
sviluppano una sensibilità a diversi stimoli chimici quali l’ischemia, gli ioni potassio, le sostanze alfaadrenergiche. Un tipico esempio di sviluppo di ipersensibilità in fibre sensitive lese è dato dal neuroma,
formazione che si verifica in seguito ad un anomalo processo di reinnervazione. Col termine di neuroma
viene comunemente definito quel groviglio di assoni che si forma nella sede della lesione del connettivo
in seguito a tale crescita caotica. In corrispondenza del neuroma ci sono pertanto numerose terminazioni
ipersensibili corrispondenti alle terminazioni dei monconi assonali prossimali. Il neuroma si forma tutte le
volte che le fibre nervose reinnervanti non riescono a raggiungere il bersaglio della reinnervazione, ma il
dolore compare solo in una piccola parte dei neuromi. Anche se la genesi ectopica di impulsi che si
osserva sul moncone prossimale di un assone periferico sensitivo leso può essere spontanea e verificarsi
indipendentemente dalla somministrazione di stimoli particolari, è verosimile che il neuroma diventi
doloroso solo quando esso viene stimolato meccanicamente e cioè quando rimane compresso o viene
stirato dai movimenti. Per una corretta interpretazione patogenetica va segnalato come le fibre
amieliniche afferenti di tipo C, che sicuramente mediano il dolore in corso di lesioni tessutali non
nervose, mostrino una scarsissima tendenza a scaricare spontaneamente in caso di lesione nervosa
periferica.
Anche a livello della lesione nervosa senza danno assonale è frequente il riscontro di una ipereccitabilità
che può portare ad una scarica spontanea di impulsi o ad una genesi di impulsi conseguenti a stimolazione
della zona lesionale. In quest’ultima situazione gli stimoli algogeni possono essere apportati direttamente
sulla parte lesa oppure conseguenti all’attivazione fisiologica dell’assone. Quest’ultimo meccanismo è
particolarmente interessante perchè giustifica alcune forme di allodinia confinate all’interno del territorio
del nervo leso. Esso è noto coi termini di moltiplicazione di impulsi o scarica postuma. Tali
denominazioni derivano dal fatto che un impulso, generato fisiologicamente dal recettore, una volta
raggiunto il sito lesionale subisce una moltiplicazione che può dare origine anche ad una vero e proprio
treno di stimoli. Tra le fibre che possono subire la moltiplicazione di impulsi vi sono anche quelle di
grande calibro (A-beta). Ne consegue che uno stimolo che nasce in periferia come stimolo innocuo, ad
esempio tattile, può generare una sensazione distorta a causa della moltiplicazione di impulsi che subisce
a livello lesionale. Quando la sensazione evocata dallo stimolo che ha subito la distorsione diventa
spiacevole, si genera un’allodinia che è strettamente confinata nel territorio del nervo stimolato.
Un terzo meccanismo di ipersensibilità delle fibre nervose periferiche è quello dell’ eccitazione incrociata
(cross-excitation) tra fibre periferiche. Attualmente si conoscono tre meccanismi di eccitazione incrociata:
il “crosstalk” chimico, il “crosstalk” efaptico, la scarica postuma incrociata (crossed afterdischarge). Il
“crosstalk” chimico è rappresentato dalla possibilità che una sostanza liberata da una fibra integra vada ad
eccitare la fibra lesa. Un esempio di tale meccanismo di eccitazione incrociata è dato dallo sviluppo di
adrenosensibilità sulle fibre lese. Il “crosstalk” efaptico si verifica quando si realizza un accoppiamento
elettrico tra due fibre lese. In queste condizioni un impulso che viaggia lungo una fibra può eccitare una
fibra che decorre nelle vicinanze. La trasmissione efaptica non necessita di un danno assonale, ma può
verificarsi anche in presenza di un processo di demielinizzazione. In caso di scarica postuma incrociata
(crossed afterdischarge) la stimolazione non nocicettiva del campo recettivo dei neuroni integri vicini
induce, nei neuroni lesi, un aumento significativo della loro scarica spontanea. Tale meccanismo si
verifica quando in una lesione assonale parziale di un nervo periferico si verifica una trasmissione di
informazione tra fibra non lesa e fibra lesa.
Oltre alle fibre nocicettive integre in caso di lesione tissutale anche le fibre nocicettive lese sviluppano
adrenosensibilità. Ciò permette alle catecolamine di attivare direttamente le fibre nervose lese.
Le lesioni radicolari presentano alcune differenze patogenetiche rispetto alle lesioni del nervo periferico.
La più importante di tutte è rappresentata dal fatto che in caso di lesione assonale degenera la parte di
prolungamento centripeto più prossimale, quella che connette la fibra periferica al sistema nervoso
centrale. Ne consegue che la cellula nervosa periferica, pur rimanendo in gran parte integra, perde la sua
connessione con il sistema nervoso centrale e non può pertanto generare alcuna sensazione. Quindi, a
livello radicolare, solo le ectopie che si generano da fibre nervose senza danno assonale possono evocare
dolore o disestesie.
Finora sono state analizzate situazioni patogenetiche in cui il generatore del dolore era a livello del
sistema nervoso periferico. Verranno di seguito illustrati i meccanismi patogenetici del dolore
localizzati nel sistema nervoso centrale. La prima stazione centrale importante per la genesi del dolore è
il midollo spinale dove sono localizzati, nel corno posteriore, due tipi di neuroni nocicettivi: il neurone
nocicettivo specifico, nelle lamine più esterne, ed il neurone nocicettivo ad ampio spettro dinamico (o
neurone convergente, o WDR), situato nelle lamine più interne. Tutte le volte che in periferia si verifica
un’attivazione persistente di fibre amieliniche, sia da genesi recettoriale che da genesi ectopica, i neuroni
spinali ed in particolare i neuroni WDR diventano ipersensibili agli stimoli. Ne consegue che sia lesioni
tissutali che lesioni nervose periferiche sono in grado di rendere ipersensibili tali neuroni spinali. I
neuroni nocicettivi spinali subiscono influenze regolatorie (inibitorie ed eccitatorie) provenienti dai centri
superiori. Quindi essi possono diventare ipersensibili agli stimoli anche e semplicemente per
un’aumentata facilitazione discendente. Un terzo meccanismo importante che può portare alla
ipersensibilità dei neuroni spinali è la riduzione o la perdita della loro fisiologica inibizione. I neuroni
spinali subiscono l’influenza inibitoria sia da neuroni inibitori spinali segmentari, sia da neuroni che
hanno il loro corpo cellulare a livello sovraspinale. Ne consegue che condizioni patologiche che portino
ad una ridotta attività o a una perdita di attività di tali neuroni inibitori si accompagnino ad una
ipereccitabilità dei neuroni nocicettivi spinali con ipersensibilità agli stimoli nocicettivi. Ci sono alcune
lesioni che direttamente o indirettamente aboliscono significativamente l’inibizione operata sui neuroni
nocicettivi. In tali situazioni il neurone nocicettivo può incominciare a scaricare spontaneamente,
indipendentemente cioè da ogni tipo di stimolazione. E’ questa una condizione molto grave perchè il
dolore che ne segue, denominato anche dolore da deafferentazione, è particolarmente resistente alle
terapie.
In caso di sviluppo di ipersensibilità a livello dei neuroni centrali, e midollari in particolare, si può
verificare l’insorgenza di dolore riferito. Questo è sostenuto dal fatto che i neuroni nocicettivi centrali
sono connessi a neuroni periferici le cui fibre decorrono in nervi differenti. Questa convergenza è fatta in
parte da sinapsi latenti che diventano attive solo nel momento in cui si verificano le condizioni per lo
sviluppo di una ipersensibilità dei neuroni nocicettivi midollari.
Un capitolo particolare nella patogenesi del dolore è rappresentato dai meccanismi sovraspinali del
dolore, ancora in gran parte inesplorati. I meccanismi della elaborazione corticale del dolore sono a
tutt’oggi oscuri. E’ ormai ampiamente accettato che tale elaborazione prevede l’attivazione di diverse
aree cerebrali, sovra e sottocorticali. Sicuramente una stazione importante è rappresentata dal talamo,
dove terminano i neuroni della via spino-talamica e “partono” i neuroni talamo-corticali. Tra i possibili
meccanismi di genesi del dolore che insorge in seguito a lesioni che interessano il sistema nervoso
centrale, la deafferentazione di neuroni talamici rappresenta uno tra i più probabili e importanti. Una
possibile fonte di dolore disestesico è invece rappresentata da lesioni demielinizzanti midollari che
interessano i cordoni posteriori con un meccanismo patogenetico simile alla “moltiplicazione di impulsi”
evidenziata nel nervo periferico.
L’arrivo degli impulsi nocicettivi a livello encefalico attiva meccanismi che influenzano lo stato psichico
del paziente. Questo, a sua volta può influenzare la percezione del dolore. Non è infrequente il riscontro,
soprattutto tra i pazienti con dolore cronico, di un peggioramento del dolore in seguito a reazioni di
all’erta, quali si verificano in occasione di forti emozioni o condizioni stressanti. Mentre lo stress acuto
tende a spostare a destra la curva stimolo-risposta (analgesia da stress), quello cronico la sposta a sinistra,
con conseguente sviluppo di allodinia/iperalgesia. In altri termini, il dolore cronico può indurre un
distress che può causare dolore, creando un circolo vizioso.
La presenza di una correlazione tra funzioni superiori e dolore è anche dimostrata dalla frequente
osservazione, nel malato con dolore cronico, di patologie psichiatriche associate, soprattutto depressione
ed ansia. Il dolore si associa anche a modificazioni neuro-endocrine. Per esempio, la soglia del dolore, a
livello sistemico, può variare in funzione dell’attività della midollare del surrene.
Allo stato attuale comunque i meccanismi sovraspinali del dolore rimangono in gran parte oscuri.
Meccanismi delle sindromi dolorose complesse
Gli eventi traumatici, le lesione infiammatorie e l’invasione neoplastica, primitiva o metastatica, sono i
principali responsabili di forme algiche complesse. La complessità deriva dalla presenza di segni e
sintomi di diversa natura, spiegabili solo per il contemporaneo sovrapporsi di più meccanismi
patogenetici e dalla variabilità che si riscontra nella evoluzione della malattia.
Per definire queste sindromi algiche viene spesso utilizzato il termine di “dolore misto”. Misto non è il
dolore, che è o nocicettivo o neuropatico (non esiste un altro tipo di dolore), ma bensì il quadro clinico
che li vede contemporaneamente presenti. Misti possono essere i processi patologici ed i rispettivi
meccanismi patogenetici. Nel linguaggio comune si utilizza spesso la dizione di “dolore neuropatico” per
indicare una sindrome clinica che andrebbe meglio identificata con altre definizioni. Utilizzare il termine
“dolore neuropatico” ad esempio per un quadro algico causato da una lesione nervosa periferica può
essere fuorviante e mascherare la contemporanea presenza di un dolore nocicettivo che il trauma ha
contemporaneamente provocato nel nervo e nei tessuti vicini. Sarebbe preferibile utilizzare una
definizione come lesioni nervose postraumatiche o sindromi regionali complesse (CRPS II o complex
regional pain sindrome tipo II) e lasciare il termine “neuropatico” solo per definire il dolore che può
essere presente. Il tipo di dolore si riconosce per le sue caratteristiche riguardanti i vari aspetti con cui si
manifesta e per i meccanismi patogenetici che lo generano.
Come illustrato precedentemente, esistono due principali tipi di dolore, uno nocicettivo ed uno
neuropatico, entrambi caratterizzati dalla presenza di meccanismi patogenetici propri (Fig. 3).
Nelle sindromi complesse non avremo affatto quadri chiari dei due tipi di dolore ma forme diverse in base
alla diversa sovrapposizione dei due tipi di dolore con segni e sintomi diversi e comuni. Sappiamo anche
che è possibile una reciproca interferenza tra i processi patologici dei due tipi di dolore, come accade
nella contemporanea lesione di vari tessuti. Ciò si verifica ad esempio quando la liberazione di sostanze
flogistiche dalla lesione nervosa (nota come infiammazione neurogena) complica una situazione tissutale
o quando la presenza di mediatori della flogosi in un tessuto agiscono sui siti ectopici del nervo vicino
coinvolgendolo.
Un altro punto cruciale nel dolore periferico è dato dal rapporto tra dolore e via nervosa coinvolta. Il
dolore che origina dalla stimolazione dei nocicettori tissutali viene condotto ai neuroni spinali dalle fibre
amieliniche C e mieliniche A-delta. Il dolore disestesico che nasce dalle ectopie nervose è condotto in
genere dalle fibre mieliniche A-beta, fibre che generalmente conducono stimoli non dolorosi provenienti
dalla cute (Fig. 4). Queste ultime fibre possono connettersi ai neuroni spinali ad ampio spettro dinamico
sensibilizzati dagli input nocicettivi delle fibre C ed essere responsabili dell’allodinia delle aree non
interessate dalle lesioni algogene.
Nocicettivo (fibre C-Adelta)
A
Primo Neurone
Secondo Neurone
Terzo Neurone
Corteccia
Nocicettori
B
Corno dorsale
Via spinotalamica
Talamo
Neuropatico (fibre Adelta e Abeta)
Colonne posteriori
Figura 4 : le vie nervose coinvolte nella nocicezione. A: il processo patologico è rappresentato
dall’infiammazione e dalle sostanze algogene liberate nei tessuti. B: alla base del danno nervoso vi può
essere un trauma, una neuropatia, una fibrosi, un stato di tossicità, una compressione, un neuroma.
Nella comprensione delle forme algiche complesse va chiarito il ruolo del sistema nervoso autonomo che
può rappresentare uno dei fattori principali della complessità. La presenza di catecolamine (liberate dai
terminali adrenergici o presenti nel circolo ematico) legandosi ai recettori presenti nei vasi
(prevalentemente alfa 1) inducono vasocostrizione mentre possono ridurre la soglia di stimolazione dei
nocicettori o dei siti ectopici (alfa 1). Le catecolamine agiscono, con un meccanismo a feed-back, sul
terminale simpatico (recettori alfa 2) inibendo la loro stessa liberazione ma favorendo (insieme al Nerve
Grow Factor) la fuoriuscita di prostaglandine e contribuendo in tal modo al processo flogistico tissutale.
Il termine adrenosensibilità identifica questa situazione in cui si manifesta una aumentata sensibilità dei
recettori tissutali ed ectopici alle catecolamine.
BIBLIOGRAFIA
Asbury AK, Fields HL.
Pain due to peripheral nerve damage: an hypothesis.
Neurology. 1984 Dec;34(12):1587-90.
Buonocore M, Bonezzi C.
Sindromi algiche neuropatiche: dalla diagnosi al reinserimento professionale. Proposta di un modello per
una rapida valutazione ed una terapia basata sul meccanismo patogenetico
G Ital Med Lav Ergon. 2001 Oct-Dec;23(4):484-93.
Campbell JN.
Nerve lesions and the generation of pain.
Muscle Nerve 2001,24:1261-1273.
Portenoy RK
Basic mechanisms.
In: Portenoy RK e Kanner RM (Eds):
Pain Management: Theory and Practice.
F.A. Davis Company, Philadelphia, 1996: 19-39.
Serra J, Ochoa J, Campero M.
Human Studies of Primary Nociceptors in Neuropathic Pain.
In: Hansson T, Fields HL, Hill RG, Marchettini P (Eds)
Neuropathic Pain: Pathophysiology and treatment.
Progress in Pain Research and Management, Vol. 21
IASP Press, Seattle, 2001: 63-83.
Woolf CJ, Decosterd I.
Implications of recent advances in the understanding of pain pathophysiology for the assessment of pain
in patients.
Pain, 1999, Supplement 6: S141-S147.
Woolf CJ, Mannion RJ
Neuropathic pain: aetiology, symptoms, mechanisms, and management.
Lancet, 1999, 353: 1959-64.
Woolf CJ, Salter MW.
Neuronal plasticity: increasing the gain in pain.
Science. 2000 Jun 9;288(5472):1765-9.