UNIVERSITA’ POLITECNICA DELLE MARCHE
FACOLTA’ DI MEDICINA E CHIRURGIA
DOTTORATO DI RICERCA IN NEUROSCIENZE
CARATTERIZZAZIONE DELLE CELLULE CHE ESPRIMONO GAT-1, IL
PRINCIPALE TRASPORTATORE DEL GABA, NELLA SOSTANZA
BIANCA SOTTOCORTICALE DEL RATTO
Relatore:
Tesi di dottorato di:
Prof. Fiorenzo Conti
Dott.ssa Silvia Bassi
Triennio 2012-2014
1
INDICE
Introduzione
3
Materiali e Metodi
6
Risultati
11
Discussione
21
Bibliografia
25
2
INTRODUZIONE
L’acido γ-aminobutirrico, GABA, è il principale neurotrasmettitore inibitorio nella corteccia
cerebrale, dove gioca un ruolo fondamentale nel controllo dell’eccitabilità neuronale e
nell’elaborazione di informazioni (Krnjevic, 1997; Somogyi et al, 1998), nella plasticità sinaptica
(Jones, 1993) e nella sincronizzazione neuronale (Buszaki, 1995).
La maggior parte del GABA nella neocorteccia deriva da neuroni non piramidali aventi terminali
assonici che formano sinapsi simmetriche con neuroni piramidali e non-piramidali (DeFelipe and
Farinas, 1992; Kisvarday et al, 1990). I neuroni GABAergici sono stati trovati in tutti gli strati della
corteccia cerebrale, anche se mostrano una certa preferenza per gli strati IV e II-III e corrispondono
al 20% di tutti i neuroni corticali (Beaulieu, 1993).
Diversi fattori sono responsabili degli effetti postsinaptici del GABA: fattori presinaptici
(probabilità di rilascio e numero di siti di rilascio), fattori che agiscono a livello del vallo sinaptico
(diffusione e trasportatori) e fattori postsinaptici (localizzazione, numero e stechiometria dei
recettori) (Cherubini and Conti, 2001). Il GABA extracellulare viene ricaptato da alcuni
trasportatori di membrana ad alta affinità (GAT). Questo meccanismo è essenziale al fine di
controllare precisamente la durata e l’intensità dell’azione del GABA sui suoi recettori, modulando
inoltre l’inibizione sia fasica sia tonica (Bragina e al, 2008).
Nel sistema nervoso (sia in quello dei roditori che in quello dell’uomo) sono stati identificati 4
diversi trasportatori del GABA: tutti con un elevato grado di omologia nella sequenza
amminoacidica, attuano tutti un trasporto Na+/Cl‾ dipendente ma si differenziano per la loro
distribuzione tissutale (GAT-1, GAT-2, GAT-3 e BGT-1) (Borden, 1996).
Tra i trasportatori del GABA il GAT-1 è indubbiamente il più espresso nella corteccia cerebrale; la
sua distribuzione è già stata descritta attraverso studi di mappatura mediante ibridazione in situ
(Durkin et al, 1995; Minelli et al, 1995) e successivamente con tecniche di microscopia ottica ed
3
elettronica. Gli studi di ibridazione in situ nella neocorteccia di ratto hanno dimostrato che la
maggior parte delle cellule che esprimono GAT-1 sono neuroni ma sono stati descritti anche alcuni
astrociti (Minelli et al, 1995). Tutti i neuroni che esprimono l’enzima GAD67 (acido glutammico
decarbossilasi, isoforma 67 kDa), un marcatore specifico delle cellule GABAergiche, esprimono
anche GAT-1, al contrario non tutte le cellule in cui è presente l’RNA messaggero codificante per
GAT-1, esprimono GAD67; tra quest’ultime, alcune sono neuroni piramidali (glutamatergici),
suggerendo che anche alcuni neuroni non GABAergici esprimono GAT-1 (Minelli et al, 1995).
Precedentemente, alcuni studi di immunocitochimica (Minelli et al, 1995; Conti et al, 2004) hanno
dimostrato che l’immunoreattività di GAT-1 è associata esclusivamente a strutture di tipo
puntiforme che rappresentano terminali assonici e fibre. Il pattern ultrastrutturale di GAT-1 è
composto da profili assonici e gliali; la marcatura a livello assonico è intensa e sparsa
nell’assoplasma di assoni mielinizzati e in numerosi terminali assonici che formano sinapsi
simmetriche. L’immunoreattività specifica per GAT-1 è stata trovata anche in processi astrocitari
distali sparsi nel neuropilo e a volte in stretta relazione con terminali positivi anch’essi per GAT-1.
Questi risultati sono in linea con quanto evidenziato da studi di elettrofisiologia che mostrano la
presenza di corrente mediata da GAT-1 negli astrociti neocorticali (Kinney and Spain, 2002).
L’inibizione mediata dal GABA esercita un potente controllo su tutta l’attività neuronale e i
trasportatori del GABA, soprattutto GAT-1, contribuiscono alla modulazione di questa attività; di
conseguenza alterazioni dell’attività o dell’espressione dei trasportatori possono avere un ruolo
cruciale nella patogenesi di alcune malattie (Conti et al, 2004), come ad esempio la schizofrenia
(Curley et al, 2013), la sclerosi laterale amiotrofica (Milanese et al, 2010) e alcuni tipi di epilessia
(Fueta et al, 2003).
La distribuzione e la localizzazione di GAT-1 è stata ampiamente studiata nella sostanza grigia
corticale (Conti et al, 2004), nel talamo (Villalba et al, 2006), nello striato (Jin et al, 2011) e
nell’ippocampo (Lee et al, 2006), mentre non si può dire lo stesso per quello che riguarda la
4
sostanza bianca. Sebbene sia stato visto che le fibre positive per GAT1 sono presenti anche nella
sostanza bianca sottocorticale e soprattutto nel corpo calloso (Minelli et al,1995; Conti et al, 1998,)
questo aspetto non è mai stato approfondito.
In virtù dell’importanza di GAT-1 nei processi fisiologici e fisiopatologici, questo studio si pone
l’obiettivo di studiare in modo sistematico la distribuzione e la natura delle cellule che esprimono
questo trasportatore nella sostanza bianca sottocorticale mediante microscopia ottica, elettronica e
confocale.
5
MATERIALI E METODI
Animali e preparazione del tessuto
Sono stati usati ratti albini adulti (200-225gr; n=10; Sprague-Dawley; Charles River, Milano, Italia)
sottoposti ad un ciclo luce-buio di 12 ore a partire dalle 6. Cibo ed acqua erano permessi ad libitum.
Il protocollo sperimentale per la gestione e la cura degli animali è stato approvato dalla
Commissione Etica per la Ricerca Animale dell’Università Politecnica delle Marche. Gli
esperimenti sono stati condotti in accordo con la Direttiva 86/609 del Consiglio della Comunità
Europea (24 Novembre, 1986) e approvati dal servizio veterinario locale.
Gli animali sono stati anestetizzati con un’iniezione intraperitoneale di cloralio idrato 12% in
soluzione fisiologica (0,9% P/V di NaCl) perfusi per via transcardiaca con soluzione salina seguita
da una soluzione fresca di paraformaldeide 4% in tampone fosfato (TF) 0.1M. Successivamente, i
cervelli sono stati rimossi, post-fissati nella stessa soluzione per 2 ore a 4 °C e tagliati in sezioni
coronali di 80 µm di spessore, con l’utilizzo di un Vibratomo.
Procedure
Immunoperossidasi. Le sezioni dei cervelli post-fissati sono state trattate con H2O2 (1% in TF per
30 minuti) per disattivare l’attività della perossidasi endogena; successivamente sono state lavate in
TF, incubate per 1 ora in albumina bovina (BSA; 5% in TF) e poi immerse in una soluzione
contenente l’anticorpo primario (Tabella 1) per due ore a temperatura ambiente e 12 ore a 4°C. Il
giorno seguente le sezioni sono state lavate in TF, incubate in BSA 5% in TF per 20 minuti poi per
un’ora a temperatura ambiente, in una soluzione contenente l’anticorpo secondario (Tabella 1). Le
sezioni sono state successivamente lavate in TF, incubate nella soluzione contenente il complesso
avidina-biotina perossidasi (ABC Elite PK6100; Vector, Burlingame, CA, USA; 1:100 in TF, 40
minuti), lavate di nuovo in TF e poi incubate con 3,3’idroclorodiaminobenzidina (DAB; 0,05% in
6
Tris 0,05M con 0,03% di H2O2; 5 minuti). La specificità del metodo è stata verificata sostituendo
gli anticorpi primari con TF o BSA.
Le sezioni che erano destinate ad essere visualizzate in miscoscopia ottica sono state poi lavate in
TF, montate su vetrini cromallumati, lasciate asciugare all’aria, disidratate in xilolo, coperte con
vetrini coprioggetto e infine esaminate al microscopio ottico Leitz Orthoplan (Wetzlar, Germania).
Al termine della procedura, le sezioni destinate alla visualizzazione in microscopia elettronica sono
state post-fissate in tetrossido di osmio (1% in TF, 45 minuti) e colorate con acetato di uranile (1%
in tampone tris-maleato; pH 6.0, un’ora). Dopo disidratazione in etanolo e ossido di propilene, le
sezioni sono state incluse nella resina Epon/Spurr, compresse tra fogli Aclar (Electron Microscopy
Sciences, Hatfield, PA, USA) e polimerizzate a 60°C per 48 ore. Sono stati tagliati blocchi di
tessuto contenenti la sostanza bianca sottocorticale, selezionati dopo uno studio al microscopio
ottico, incollati su un blocchetto di resina e sezionati all’ultramicrotomo (MTX; Research and
Manufactoring Company, Tucson, AZ, USA). Le sezioni ultrafini ottenute (~60 nm), sono state
raccolte e montate su griglie, incubate in acetato di uranile e citrato di piombo ed esaminate al
microscopio elettronico Philips EM 208 (Eindhoven, Olanda) collegato ad una fotocamera CCD
MegaView-II ad alta risoluzione (Soft Imaging System; Munster, Germania). L’identificazione dei
profili marcati è stata condotta utilizzando criteri morfologici già noti (Peters et al, 1991).
7
Tabella 1. Anticorpi primari e secondari
Anticorpi Primari
Anticorpi
Specie°
Diluizioni*
Produttori
Caratterizzazione
GAT-1
R
1:400 (EM e
DAB)
Donato dal Dr. N.C. Brecha (Department of
Neurobiology, UCLA, Los Angeles, CA)
GAT-1
GP
1:500 (IF)
Synaptic System/274104
GFAP
M
1:800 (IF)
SIGMA/G3893
NeuN
M
1:60 (IF)
Chemicon/MAB377
CD11b
M
1:100 (IF)
Serotec/MCA275G
NG2
R
1:200 (IF)
Chemicon/AB5320
RIP
M
1:800 (IF)
Chemicon/MAB1580
Minelli et al. 1995
Guo et al. 2009
Hu et Quick 2008
Quick et al. 2004
Seki et al. 2007
Komitova et al. 2009
Yang et al., 2008
Mullen et al. 1992
Fuentes-Santamaria et al. 2013
Casanovas et al. 2008
Levine et al. 1993
Stallcup et al. 1981
Friedman et al. 1989
Sakakibara et al. 2008
Anticorpi Secondari
Coniugati a
Specie°
Diluizioni
Produttore
Alexa Fluor® 488
GP
1:200
Jackson ImmunoResearch, West Grove, PA/706-546-148
Alexa Fluor® 594
M
1:200
Jackson ImmunoResearch, West Grove, PA/715-586-150
Alexa Fluor® 647
M
1:200
Jackson ImmunoResearch, West Grove, PA/715-606-150
Alexa Fluor® 594
R
1:200
Jackson ImmunoResearch, West Grove, PA/711-586-152
Biotin-SP
R
1:100
Jackson ImmunoResearch, West Grove, PA/111-066-003
° GP, porcellino d’india; M, topo; R, coniglio;
*IF, immunofluorescenza; WB, western blotting; EM, microscopia elettronica; IP, immunoperossidasi.
Immunofluorescenza. Le sezioni dei cervelli post-fissati sono state esposte a doppia marcatura. Il
tessuto è stato incubato dapprima in BSA al 5 % in TF per 1 ora e successivamente in una soluzione
contenente la miscela di anticorpi primari diretti contro GAT-1 e uno fra i seguenti anticorpi GFAP,
NeuN, RIP e NG2 per 2 ore a temperatura ambiente e tutta la notte a 4°C. Il giorno seguente, dopo i
lavaggi in TF, le sezioni sono state incubate in BSA 5% in TF per 20 minuti e poi in una miscela
8
contente appropriati anticorpi secondari coniugati a diversi fluorocromi (Tabella 1) ed esaminate al
microscopio confocale Leica TCS-SP2.
Le concentrazioni finali degli anticorpi sono state definite testando diverse diluizioni e scegliendo
quelle con il migliore rapporto tra segnale di fondo e marcatura specifica.
Gli esperimenti di controllo sono stati effettuati incubando le sezioni con i due anticorpi primari ed
un anticorpo secondario o con un anticorpo primario e due secondari, rivelando un’assenza di
reattività crociata.
Raccolta dei dati
Microscopia ottica. Per l’analisi morfologica delle cellule positive a GAT-1 nella sostanza bianca
sottocorticale è stato utilizzato il microscopio ottico Nikon eclipse E600 collegato alla
microfotocamera Nikon DS Camera Control Unit DS-L3. Le immagini sono state acquisite con un
obbiettivo a 40X. L’esame delle dimensioni delle cellule positive per GAT-1 è stato eseguito
misurando i differenti diametri cellulari (è stata presa la distanza maggiore tra le due estremità della
cellula) attraverso il programma Image J (v.1.45s; National Institutes of Health, USA).
I relativi dati sono stati poi inseriti nel programma di analisi statistica GraphPrism v.4.0 (GraphPad
Software, San Diego, CA, USA) per poterne ottenere una curva di distribuzione.
Microscopia elettronica. Sono stati studiati cellule e profili GAT-1+ sulla superficie di sezioni
ultrafini. I dati quantitativi ottenuti derivano dall’analisi di 6-7 sezioni ultrafini (ogni sezione
ultrafine è 500µm X 500µm) di sostanza bianca sottocorticale per animale (sono stati analizzati 2
animali). I campi microscopici che presentavano prodotto elettrodenso di immunoperossidasi sono
stati acquisiti a 12,000 o 20,000 X e successivamente analizzati.
Microscopia confocale. I dati sono stati raccolti dalla sostanza bianca sottocorticale (4 sezioni per
animale; 10 animali) utilizzando il microscopio confocale. La funzione average è stata utilizzata per
migliorare il rapporto segnale-rumore dell’immagine. Per le acquisizioni è stato usato un obbiettivo
9
a 40X (apertura numerica 0,75), un pinhole di 1,0 unità Airy, dimensione dell’immagine 512 x 512
pixel e campi di 286,29 µm. L’acquisizione è stata effettuata sul piano Z (z-step di 0,6 µm) per
ciascun fluorescente; il gain e l’offset del fotomoltiplicatore sono stati impostati in modo tale da non
saturare i pixel più luminosi. Con lo scopo di ottenere un’ottima risoluzione ogni immagine è stata
collezionata in modo da visualizzare i somi cellulari sul piano del nucleo.
Per stimare il grado di co-localizzazione tra le cellule positive per GAT-1 e i diversi marcatori in
primo luogo è stato definito un livello-soglia per la pulizia di tutte le immagini in modo da poter
ottimizzare il rapporto tra rumore di fondo e marcatura specifica. In seguito, per verificare la doppia
marcatura, è stata fatta una sovrapposizione tra le immagini con immunoreattività positiva per
GAT-1 (canale verde) e le immagini con immunoreattività positiva per gli altri marcatori cellulari:
NeuN, GFAP, CD11b, NG2 e RIP (canale rosso o blu). Dopo la sovrapposizione, i canali si sono
fusi rivelando sia i profili cellulari doppiamente marcati, cioè le cellule considerate positive, sia i
profili cellulari senza doppia marcatura, ovvero negative.
I risultati ottenuti sono stati poi oggetto di analisi statistica mediante il programma GraphPrism
v.4.0.
10
RISULTATI
Immunoreattività per GAT-1+ in cellule della sostanza bianca sottocorticale
L’analisi al microscopio ottico della sostanza bianca sottocorticale (4 animali, 4 sezioni per ogni
animale) ha rivelato la presenza di numerose cellule GAT-1+. Queste cellule apparivano
morfologicamente diverse tra loro.
Alcune cellule erano di dimensioni molto ridotte, di forma rotondeggiante con il profilo cellulare
abbastanza regolare e con processi appena accennati (Figura 1 A). Alcune cellule, invece, erano di
media grandezza, presentavano un forma ovoidale o rotondeggiante, con profili piuttosto regolari.
In questi casi, era ben distinguibile il citoplasma omogeneo confinato all’esterno e un nucleo
centrale di medie dimensioni; inoltre, presentavano processi cellulari appena accennati (Figura 1 B).
Sono state trovate anche altre cellule di medie dimensioni, ma con forma allungata piramidale e con
processi di lunghezza molto superiore e molto più marcati. Anche in questi casi si avevano dei
profili piuttosto regolari e ben definiti, all’interno era ben distinguibile un nucleo eccentrico di
grosse dimensioni e una porzione inferiore di citoplasma (Figura 1 C). Infine, sono state individuate
cellule di dimensioni notevoli, con forma regolare ed allungata aventi un grande nucleo centrale
rotondeggiante in cui si poteva individuare anche il nucleolo. Si notavano anche una dispersione
omogenea del citoplasma e un accenno di processi (Figura 1 D).
Vista la grande variabilità morfologica delle suddette cellule, ne sono stati misurati i relativi
diametri, che sono stati poi inseriti nel programma di analisi statistica GraphPrism v.4.0 per poter
creare una curva di distribuzione (Figura 2).
La curva di distribuzione ha evidenziato in maniera più chiara la variabilità delle cellule GAT-1+
nella sostanza bianca sottocorticale. Infatti, come si evince dalla Fig. 2, i loro diametri vanno da un
minimo di 3 µm a un massimo di 29 µm, suggerendo che appartengano a diversi tipi cellulari.
11
Figura 1. Morfologia delle cellule GAT1+ nella sostanza bianca sottocorticale visualizzate
mediante immunoperossidasi. Taratura: 20 µm.
Figura 2. Distribuzione dei diametri cellulari delle cellule positive per GAT-1 della sostanza bianca
sottocorticale.
12
Natura delle cellule GAT1+ nella sostanza bianca sottocorticale
L’indagine ultrastrutturale mediante microscopia elettronica in pre-embedding eseguita in campioni
di sostanza bianca sottocorticale ha rivelato la positività di GAT-1 in un’estesa varietà di cellule e
profili con caratteristiche morfologiche molto diverse tra loro.
In particolare GAT-1 è stato visualizzato in cellule che presentavano caratteristiche ultrastrutturali e
organelli tipici dei neuroni del sistema nervoso centrale. La maggior parte del soma era occupato da
un grande nucleo rotondeggiante o ovale, con dispersioni regolari di cromatina omogenee e con la
presenza di nucleolo. Nel citoplasma a livello somatico gli organelli più visibili erano i corpi di
Figura 3. Neuroni GAT-1+ nella sostanza bianca sottocorticale. A, le frecce indicano la presenza di
prodotto elettrondenso che codifica per GAT-1. B, riquadro allargato della figura A, che evidenzia
un terminale assonico che forma una sinapsi simmetrica (punta di freccia) sul soma del neurone
marcato. C e D, terminale assonico GAT-1+ che forma una sinapsi simmetrica con un neurone non
marcato. E, un assone mielinizzato GAT-1+. Ax, assone; AxT, terminale assonico; N, nucleo; n,
nucleolo; cyt, citoplasma. Taratura: 2µm (A), 1,5µm (B, C, D e E).
13
Nissl, composti dalle cisterne del reticolo endoplasmatico rugoso (Figura 3 A). Si notavano anche i
profili dell’apparato di Golgi, i mitocondri e alcuni granuli di lipofuscine (Peters and al. 1991).
Inoltre, i somi dei suddetti neuroni ricevevano contatti sinaptici (sinapsi assoassoniche) (Kostovic
and Rakic, 1980) (Figura 3 B, C e D) e abbiamo riscontrato anche assoni mielinizzati GAT-1+
(Figura 3 E).
Figura 4. Astrociti GAT-1+ nella sostanza bianca sottocorticale. A-C, prodotto elettrondenso
(frecce) in astrociti fibrosi di diverse dimensioni. D, processo astrocitario fibroso GAT-1+ (frecce)
nella sostanza bianca sottocorticale. E, processo gliale perivascolare GAT-1+ (frecce). bv, vaso
sanguigno. Taratura: 2µm (A e C), 3µm (D e E), 5µm (B).
Un’altra categoria di cellule che ha mostrato positività per GAT-1 sia nel citoplasma sia nei suoi
processi è quella degli astrociti fibrosi (Figura 4). Questi erano caratterizzati da nuclei a forma di
14
fagiolo o irregolari, ma omogenei nella densità. Il citoplasma presentava organelli relativamente
sparsi e solo pochi profili mitocondriali; erano presenti, inoltre, cisterne del reticolo endoplasmatico
rugoso e dell’apparato di Golgi. La componente citoplasmatica più marcata negli astrociti fibrosi
erano le numerose fibrille o filamenti che si trovavano in tutto il soma e si estendevano come fibre
parallele nei processi (Peters and al. 1991) (Figura 4 A, B e C). Inoltre sparsi nella sostanza bianca
sottocorticale erano visibili anche processi appartenenti ad astrociti fibrosi con immunoreattività
specifica per GAT-1 (Figura 4 D e E).
Figura 5. Oligodendrociti GAT-1+ nella sostanza bianca sottocorticale. A, immunoreattività per
GAT-1 (frecce) nel citoplasma di un oligodendrocito presumibilmente immaturo (caratterizzato da
un’elevata densità di mitocondri citoplasmatici e forma relativamente regolare). Da notare la
vicinanza con un astrocito GAT-1+ (frecce). B e C, oligodendrociti maturi immunoreattivi per
GAT-1 dispersi nel citoplasma e confinati vicino alla membrana plasmatica (frecce). O,
oligodendrocito; A, astrocito; N,nucleo. Taratura: 2µm (A, B e C).
15
Una serie di cellule GAT-1+ presentavano alcune caratteristiche normalmente considerate proprie
degli oligodendrociti maturi (Vaughan and Peters, 1974; Peters et al. 1976; Kaplan and Hinds 1980;
Peters et al. 1991): avevano infatti agglomerati di cromatina elettrondensa, citoplasma a densità
media o alta, un nucleo eccentrico, reticolo endoplasmatico elettrolucente e il contorno cellulare
smussato (Figura 5 B e C).
Oltre agli oligodendrociti maturi sono stati trovati positivi per GAT-1 anche oligodendrociti
immaturi, così classificati poiché presentavano microtubuli dispersi, piccoli mitocondri densi,
processi sottili, citoplasma più chiaro rispetto alla forma matura e un breve profilo del reticolo
endoplasmatico (Kaplan and Hinds, 1980) (Figura 5 A).
In alcuni casi l’immunoreattività per GAT-1 era presente in cellule appartenenti alla microglia.
Queste erano caratterizzate da un nucleo ovale ed allungato e da agglomerati di cromatina al di sotto
Figura 6. Microglia GAT-1+ nella sostanza bianca sottocorticale. A e B, immunoreattività per
GAT-1 (frecce) nelle cellule microgliali, caratterizzate dalla presenza di lisosomi e da nuclei con
agglomerati di cromatina elettrondensa. L, lisosomi; N, nucleo. Taratura: 2µm (A e B).
16
della membrana nucleare e in tutto il nucleoplasma. Per certi aspetti il nucleo assomigliava a quello
degli oligodendrociti, ma gli agglomerati di cromatina delle cellule microgliali erano generalmente
più grandi e occupavano una proporzione maggiore di volume nucleare (Peters et al, 1991).
Come negli oligodendrociti anche nella microglia il citoplasma appariva denso; a differenza di
questi, però, le cellule microgliali avevano pochi microtubuli. Inoltre, i corpi densi e i granuli di
lipofuscine sono stati visti più spesso nella microglia inattivata che nelle cellule microgliali attivate
(Pannese, 1994) (Figura 6 A e B).
Quantificazione dei quattro tipi cellulari GAT1+ nella sostanza bianca sottocorticale
Dopo aver individuato i tipi cellulari che esprimono GAT-1 nella sostanza bianca sottocorticale
(neuroni, astrociti, oligodendrociti maturi e immaturi e microglia) abbiamo quantificato la
distribuzione percentuale di GAT-1 tra i diversi tipi cellulari mediante studi di doppia marcatura in
immunofluorescenza. Gli anticorpi usati per questo studio sono i seguenti:
GABA Transporter 1 (GAT1), un anticorpo policlonale ottenuto immunizzando il porcellino d’india
contro un peptide sintetico (aa 585-599) corrispondente alla parte ammino terminale di GAT1. È un
anticorpo specifico per il cervello e ha una distribuzione relativamente omogenea in tutte le parti di
esso (Jursky et al, 1994). E’ espresso soprattutto nei neuroni e in alcuni astrociti, la sua
immunoreattività è associata esclusivamente a strutture puntate simili a terminali assonici e fibre
nella neocorteccia di ratti, scimmie e uomini (Conti et al, 2004).
ANTI-Neuronal Nuclei (NeuN), un anticorpo monoclonale che reagisce con una proteina nucleare
non caratterizzata. Questo anticorpo marca principalmente il nucleo dei neuroni e in modo più
leggero il citoplasma. Marca la maggior parte dei tipi di cellule neuronali in tutto il sistema nervoso
del topo e del ratto tra cui i neuroni del cervelletto, della corteccia cerebrale, dell’ ippocampo, del
talamo, del midollo spinale ed anche i neuroni del sistema nervoso periferico (Mullen et al, 1992).
Anti-Glial Fibrillary Acid Protein (GFAP), un anticorpo monoclonale che si lega con i filamenti
intermedi (IFs) presenti negli astrociti. I filamenti intermedi hanno un caratteristico diametro di 10
17
nm e sono una classe distinta di filamenti citoscheletrici molecolarmente eterogenei definiti da
criteri
ultrastrutturali,
immunologici
e
biochimici.
I
filamenti
intermedi
differiscono
significativamente dagli altri elementi del citoscheletro della cellula, cioè microtubuli e
microfilamenti, e sono componenti della maggior parte delle cellule eucariotiche. Marca le cellule
con la classica morfologia e distribuzione degli astrociti fibrillari. È stato testato per la
localizzazione immunocitochimica di GFAP nei tessuti umani, suini, e di ratto. Questo anticorpo
marca astrociti e cellule gliali di Bergmann, gliomi, e altri tumori derivanti da cellule gliali. Questo
anticorpo non fa reazioni crociate con vimentina, che è frequentemente co-espressa in cellule di
glioma e in alcuni astrociti (Komitova et al, 2009).
Anti-NG2 chondroitin sulfate proteoglycan (NG2), un anticorpo policlonale che identifica sia i
proteoglicani intatti che la proteina stessa. L’anticorpo anti NG2 reagisce con le superfici di
un’insolita classe di cellule gliali che si trovano nel sistema nervoso centrale, sia durante lo sviluppo
che nell’adulto, e che hanno le proprietà dei precursori degli oligodendrociti (cioè, le cellule
progenitrici O-2A). Reagisce anche con le superfici dei condroblasti, delle cellule endoteliali
capillari in proliferazione, con alcune linee cellulari di melanoma umano, blasti leucemici in
leucemia linfoblastica acuta (Levine and Nishiyama, 1996).
Anti-oligodendrocytes (RIP), un anticorpo monoclonale che identifica gli oligodendrociti e le loro
guaine mieliniche nel sistema nervoso centrale nell’adulto di topo e di ratto. Marca i somi e i
processi citoplasmatici sia degli oligodendrociti precoci sia di quelli maturi. Inoltre, esperimenti di
doppia marcatura dimostrano che questo anticorpo marca i processi contenenti la proteina basica
della mielina, ma non quelli contenenti la proteina acidica fibrillare gliale, ciò dimostra che rileva
selettivamente gli oligodendrociti ma non gli astrociti (Friedman et al, 1989).
Anti-integrin alpha m chain, mac-1 (CD11b), un anticorpo monoclonale che riconosce il CD11b del
ratto (clone OX-42), noto anche come integrina alfa-M, il recettore per il componente iC3b del
complemento. Questo anticorpo è espresso sulla maggior parte dei macrofagi, compresi i macrofagi
18
peritoneali attivati (e i residenti), le cellule di Kupffer e circa il 35% dei macrofagi alveolari.
L'anticorpo marca anche cellule dendritiche, granulociti e microglia nel cervello (Robinson et al,
1986).
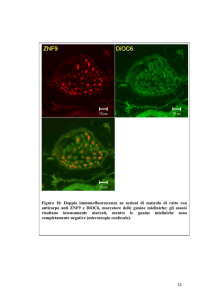
Figura 7. Co-localizzazione tra GAT-1+ e markers di cellule gliali nella sostanza bianca
sottocorticale. A-E, cellule GAT-1+ (cellule verdi; colonna di sinistra) che co-esprimono NeuN,
GFAP, NG2, RIP e CD11b (cellule blu o rosse, colonna al centro). Le rispettive co-localizzazioni
sono illustrate nella colonna di destra. Taratura: 20µm (A-E).
19
E’ stato analizzato il gradi di co-localizzazione nella sostanza bianca sottocorticale, tra l’anticorpo
GAT-1 e gli anticorpi specifici per i diversi tipi cellulari: NeuN per i neuroni, GFAP per gli
astrociti, RIP e NG2 per gli oligodendrociti rispettivamente maturi e immaturi e CD11b per la
microglia (Materiali e Metodi).
Dopo l’analisi dei dati di immunofluorescenza per ogni marcatore abbiamo ottenuto le seguenti
percentuali:
NeuN. Sono state analizzate 190 cellule GAT-1+ provenienti da 121 campi ottenuti da 8 animali e il
30,65% ± 6,72% sono risultate NeuN+;
GFAP. Sono state analizzate 228 cellule GAT-1+ provenienti da 80 campi ottenuti da 7 animali e il
32,22% ± 3,85% sono risultate GFAP+;
NG2. Sono state analizzate 222 cellule GAT-1+ provenienti da 97 campi ottenuti da 7 animali e per
il l’11,75% ± 2,72% sono risultate NG2+;
RIP. Sono state analizzate 222 cellule GAT-1+ provenienti da 97 campi ottenuti da 7 animali e il
14,78% ± 2,02% sono risultate RIP+;
CD11b. Sono state analizzate 317 cellule GAT-1+ provenienti da 147 campi ottenuti da 9 animali e
il 20,48% ± 4,03% sono risultate CD11b+.
Figura 8. Percentuale di cellule che co-esprimono GAT-1 e markers gliali.
20
DISCUSSIONE
I dati emersi dal nostro studio dimostrano che la popolazione di cellule GAT-1+ nella sostanza
bianca sottocorticale è composta per il 30,65% da neuroni, per il 32,22% da astrociti, per l’11,75%
da oligodendrociti immaturi, per il 14,78% da oligodendrociti maturi e per il 20,48% da microglia.
Distribuzione del GABA e di GAT-1 nella sostanza bianca:
confronto con studi precedenti
Studi precedenti hanno dimostrato la presenza di neuroni GABAergici, assoni e terminali sinaptici
contenenti GABA nella sostanza bianca di diverse strutture del sistema nervoso centrale
(Schmechel et al, 1984; Davanger et al, 1991; Wang et al, 2001;), portandoci a pensare che
probabilmente anche lì vi era liberazione di GABA e di conseguenza anche trasportatori per il
GABA, come GAT-1, dovevano presumibilmente essere presenti.
Per quanto riguarda GAT-1 era già stato rilevato nella sostanza bianca sottocorticale e nel corpo
calloso del ratto soprattutto espresso in terminali assonici, ma mai nei corpi cellulari (Conti et al,
2004). Altri studi hanno individuato RNA messaggero che codifica per GAT1 nella sostanza bianca
del nervo ottico del ratto adulto (Howd et al, 1997) e trasportatori del GABA in oligodendrociti
della sostanza bianca del cervello dell’uomo, della scimmia e del gatto (Henjum and Hassel, 2006).
I dati del presente studio vanno quindi a colmare alcune delle lacune presenti in questo ambito. In
primo luogo è stata studiata la sostanza bianca sottocorticale, su cui nessuno studio si è mai
concentrato prima. Inoltre, se è vero che parte dei nostri risultati sono in perfetto accordo con ciò
che era stato visto precedentemente nel corpo calloso e nel nervo ottico, dove la presenza di GAT-1
viene indicata nei neuroni e negli astrociti, è vero anche che la positività della microglia per GAT-1
è un dato totalmente nuovo e inaspettato.
Confronto con la distribuzione del GAT1 nella sostanza grigia.
Considerando che il nostro studio si è concentrato sulla localizzazione di GAT-1 nella sostanza
bianca sottocorticale possiamo confrontare questi dati anche con quelli precedentemente pubblicati
21
dal nostro gruppo riguardanti la localizzazione di GAT-1 nella sostanza grigia, anche in virtù del
fatto che è stato utilizzato per tutti questi studi lo stesso anticorpo anti-GAT-1.
Questi studi hanno dimostrato che nella neocorteccia di ratto la maggior parte delle cellule che
esprimono GAT-1 sono neuroni, ma sono stati descritti anche alcuni astrociti (Minelli et al, 1995).
Recentemente, è stato dimostrato che gli astrociti rappresentano circa il 40% degli elementi che
esprimono GAT-1 nella sostanza grigia (Melone et al, 2014, 2013). Confrontando questi dati con
quelli ottenuti dal nostro lavoro possiamo notare che mentre nella sostanza bianca sottocorticale
GAT-1 viene espresso da tutti i tipi cellulari (neuroni, astrociti, oligodendrociti e microglia) presenti
in essa, nella sostanza grigia solo i neuroni e gli astrociti contengono GAT-1. Questo ci induce a
pensare che GAT-1 potrebbe svolgere ruoli differenti nella sostanza grigia e nella sostanza bianca
sottocorticale.
Ipotesi sulla funzione di GAT-1nelle cellule della sostanza bianca sottocorticale
Sostanzialmente il GAT-1 può transitoriamente legare il GABA extracellulare e traslocarlo
all’interno della cellula, andando così a modularne la concentrazione extracellulare e di
conseguenza la sua azione (Scimeni, 2014). Considerando che nella sostanza bianca sono stati
individuati anche i recettori per il GABA, sia GABAA sia GABAB, (Wu and Sun, 2014), e in questo
lavoro abbiamo dimostrato la presenza di terminali sinaptici GAT-1+ che formano sinapsi con
neuroni, è verosimile che anche nella sostanza bianca una delle possibili funzioni di GAT-1 sia
quella di regolare la disponibilità di GABA a livello recettoriale.
GAT-1 può operare anche al contrario (funzione reverse), può cioè rilasciare GABA nello spazio
extracellulare. Questo si verifica tuttavia solo in condizioni ioniche appropriate, cioè quando il
gradiente ionico è favorevole all’estrusione di Na+/Cl‾ e quando la concentrazione di GABA
all’interno della cellula è sufficientemente alta da potersi legare ai trasportatori (Scimeni, 2014). Si
può quindi ipotizzare che nella sostanza bianca sottocorticale GAT-1 possa svolgere anche la
funzione reverse, determinando la liberazione di GABA anche in prossimità di popolazioni cellulari
in cui non sono presenti sinapsi GABAergiche. Questo potrebbe svolgere un ruolo importante nella
22
maturazione di queste popolazioni cellulari o semplicemente nel mantenimento di un livello
uniforme di GABA all’interno della sostanza bianca sottocorticale. Ovviamente per validare queste
ipotesi occorrerebbe eseguire altri esperimenti, uno dei quali potrebbe essere quello di verificare se
le cellule GAT-1+ trovate nella sostanza bianca sottocorticale presentino dei livelli intracellulari di
GABA particolarmente alti al fine di permettere il funzionamento di GAT-1 in modalità inversa.
In precedenti lavori è stato visto che i precursori degli oligodendrociti che esprimono NG2 formano
sinapsi con i terminali dei neuroni. Alcune di queste sinapsi sono GABAergiche e le stesse cellule
NG2 esprimono il recettore GABAA (Lin and Bergles, 2004). Inoltre, è noto che l’applicazione
esogena di GABA può indurre un aumento della concentrazione intracellulare di Ca2+ nelle cellule
NG2+ (Mangin and Gallo, 2011). È quindi possibile ipotizzare che la presenza di GAT-1 in queste
cellule sia di supporto alla funzione del GABA, che nelle cellule NG2+ sembra essere legata alla
loro maturazione in oligodendrociti maturi.
Implicazioni fisiopatologiche
Considerando il ruolo di primo piano che GAT-1 ha nel mantenimento dei livelli fisiologici di
GABA, è facile dedurre che il suo malfunzionamento possa portare a situazioni patologiche.
Per esempio, risultati ottenuti in sinaptosomi evidenziano che sia i neuroni spinali sia gli astrociti
possono produrre un eccessivo rilascio di glutammato dopo l'attivazione di GAT-1 (Raiteri et al,
2003, 2004), suggerendo una sinergia tra il grado di attivazione di GAT-1 e i livelli di glutammato
extracellulare nel midollo spinale dei topi affetti da sclerosi laterale amiotrofica (Milanese et al,
2010). Nella parte conclusiva di questo articolo, gli autori prospettano la possibilità che altre cellule
non-neuronali, come per esempio la microglia o gli oligodendrociti, possano contribuire a questo
fenomeno. Con il nostro studio abbiamo contribuito a fornire una probabile risposta, dal momento
che abbiamo rilevato la presenza di GAT-1 anche negli oligodendrociti e nella microglia.
Studi recenti hanno mostrato che le cellule NG2+ hanno la capacità di formare sinapsi con i neuroni
durante il processo di ri-mielinizzazione spontanea a seguito a fenomeni di demielinizzazione
(Mangin and Gallo, 2011). Ciò può indurre a pensare che GAT-1 possa avere implicazioni nella
23
fisiopatologia di malattie demielinizzanti, per esempio la sclerosi multipla, influenzando la
maturazione degli oligodendrociti e la loro capacità di produrre mielina.
24
BIBLIOGRAFIA
Beaulieu C (1993). Numerical data on neocortical neurons in adult rat, with special reference to the
GABA population. Brain Res 609:284-292.
Borden LA (1996). GABA transporter heterogeneity: pharmacology and cellular localization.
Neurochem Int 29:335-356.
Bragina L, Marchionni I, Omrani A, Cozzi A, Pellegrini-Giampietro DE, Cherubini E and Conti F
(2008). GAT-1 regulates both tonic and phasic GABA(A) receptor-mediated inhibition in the
cerebral cortex. J Neurochem 105:1781-1793.
Buszaki G and Chrobak JJ (1995). Temporal structure in spatially organized neuronal ensembles: a
role for interneuronal networks. Curr Opin Neurobiol 5:504-510.
Casanovas A, Hernández S, Tarabal O, Rosselló J, Esquerda JE (2008). Strong P2X4 purinergic
receptor-like immunoreactivity is selectively associated with degenerating neurons in transgenic
rodent models of amyotrophic lateral sclerosis. J Comp Neurol 506:75-92.
Cherubini E and Conti F (2001). Generating diversity at GABAergic synapses. Trends Neurosci
24:155-162.
Conti F, Melone M, De Biasi S, Minelli A, Brecha NC and Ducati A (1998). Neuronal and glial
localization of GAT-1, a high-affinity gamma-aminobutyric acid plasma membrane transporter, in
human cerebral cortex: with a note on its distribution in monkey cortex. J Comp Neurol 396:5163.
Conti F, Minelli A and Melone M (2004). GABA transporters in the mammalian cerebral cortex:
localization, development and pathological implications. Brain Res Brain Res Rev 45:196-212.
Curley AA, Eggan SM, Lazarus MS, Huang ZJ, Volk DW and Lewis DA (2013). Role of glutamic
acid decarboxylase 67 in regulating cortical parvalbumin and GABA membrane transporter 1
expression: implications for schizophrenia. Neurobiol Dis 50:179-86.
Davanger S, Ottersen OP, Storm-Mathisen J (1991). Glutamate, GABA, and glycine in the human
retina: an immunocytochemical investigation. J Comp Neurol 311:483-494.
DeFelipe J and Farinas I (1992). The pyramidal neuron of the cerebral cortex: morphological and
chemical characteristics of the synaptic inputs. Prog Neurobiol 39:563-607.
25
Durkin MM, Smith KE, Borden LA, Weinshank RL, Branchek TA and Gustafson EL (1995).
Localization of messenger RNAs encoding three GABA transporters in rat brain: an in situ
hybridization study. Brain Res Mol Brain Res 33:7-21.
Friedman B, Hockfield S, Black JA, Woodruff KA and Waxman SG (1989). In situ demonstration
of mature oligodendrocytes and their processes: an immunocytochemical study with a new
monoclonal antibody, rip. Glia 2(5):380-90.
Fueta Y, Vasilets LA, Takeda K, Kawamura M and Schwarz W (2003). Down-regulation of
GABA-transporter function by hippocampal translation products: its possible role in epilepsy.
Neuroscience 118(2):371-8.
Fuentes-Santamaria V, Alvarado JC, Cruz Gabaldón-Ull M and Juiz JM (2013). Upregulation of
insulin-like growth factor and interleukin 1β occurs in neurons but not in glial cells in the cochlear
nucleus following cochlear ablation. J Comp Neurol 521:3478-3499.
Guo C, Stella SL, Hirano AA and Brecha NC (2009). Plasmalemmal and vesicular gammaaminobutyric acid transporter expression in the developing mouse retina. J Comp Neurol 512:6-26.
Henjum S and Hassel B (2006). High-affinity GABA uptake and GABA-metabolizing enzymes in
pig forebrain white matter: A quantitative study. Neurochem Int 50:365-370.
Howd AG, Rattray M and Butt AM (1997). Expression of GABA transporter mRNAs in the
developing and adult rat optic nerve. Neurosci Lett 235:98-100.
Hu J and Quick MW (2008). Substrate-mediated regulation of γ-aminobutyric acid transporter 1 in
rat brain. Neuropharmacol 54:309-318.
Jin XT, Paré JF and Smith Y (2011). Differential localization and function of GABA transporters,
GAT-1 and GAT-3, in the rat globus pallidus. Eur J Neurosci 33(8):1504-18.
Jones EG (1993). GABAergic neurons and their role in cortical plasticity. Cereb Cortex 3:361-372.
Jursky F, Tamura S, Tamura A, Mandiyan S, Nelson H and Nelson N (1994). Structure, function
and brain localization of neurotransmitter transporters. J exp Biol 196:283-295.
Kaplan MS and Hinds JW (1980). Gliogenesis of astrocytes and oligodendrocytes in the neocortical
grey and white matter of the adult rat: electron microscopic analysis of light radioautographs. J
Comp Neurol 193:711-727.
Kinney GA and Spain WJ (2002). Synaptically evoked GABA transporter currents in neocortical
glia. J Neurophysiol 113:2899-2908.
26
Kisvarday ZF, Gulsays D, Beroukas JB, Chubb IW and Somogyi P (1990). Synapses, axonal and
dendritic patterns of GABA-immunoreactive neurons in human cerebral cortex. Brain 113:793-812.
Komitova M, Zhu X, Serwanski DR and Nishiyama A (2009). NG2 cells are distinct from
neurogenic cells in the postnatal mouse subventricular zone. J Comp Neurol 512:702-716.
Kostovic I and Rakic P (1980). Cytology and time of origin of interstitial neurons in the white
matter in infant and adult human and monkey telencephalon. J Neurocytol 9:219-242.
Krnjevic K (1997). Role of GABA in cerebral cortex. Can J Physiol Pharm 75:439-451.
Lee TS, Bjørnsen LP, Paz C, Kim JH, Spencer SS, Spencere DD, Eid T and de Lanerolle NC
(2006). GAT-1 and GAT-3 expression are differently localized in the human epileptogenic
hippocampus. Acta Neuropathol 111(4):351-63.
Levine JM, Stincone F and Lee YS (1993). Development and differentiation of glial precursor cells
in the rat cerebellum. Glia 7:307-321.
Levine JM and Nishiyama A (1996). The NG2 chondroitin sulfate proteoglycan associated with
immature cells. Perspect Dev Neurobiol 3(4):245-59.
Lin S. and Bergles DE (2004). Synaptic signaling between GABAergic interneurons and
oligodendrocyte precursor cells in the hippocampus. Nat Neurosci 7(1):24-32.
Mangin J-M and Gallo V (2011). The curious case of NG2 cells: transient trend or game changer?.
ASN Neuro 3(1):37-49.
Melone M, Ciappelloni S, Conti F (2013). A quantitative analysis of cellular and synaptic
localization of GAT-1 and GAT-3 in rat neocortex. Brain Struct Funct
Melone M, Ciappelloni S, Conti F (2014). Plasma membrane transporters GAT-1 and GAT-3
contribute to heterogeneity of GABAergic synapses in neocortex. Front Neuroanat 8:72.
Milanese M, Zappetti S, Jacchetti E, Bonifacino T, Cervetto C, Usai C and Bonanno G (2010). In
vitro activation of GAT-1 transporters expressed in spinal cord gliosomes stimulates glutamate
release that is abnormally elevated in the SOD1/G93A(+) mouse model of amyotrophic lateral
sclerosis. J Neurochem 113(2):489-501.
Minelli A, Brecha NC, Karschin C, De Biasi S and Conti F (1995). GAT-1, a high-affinity GABA
plasma membrane transporter, is localized to neurons and astroglia in the cerebral cortex. J
Neurosci 15:7734-7746.
Mullen RJ, Buck CR and Smith AM (1992). NeuN, a neuronal specific nuclear protein in
vertebrates. Development 116:201-211.
27
Pannese E (1994). Neurocytology. Fine structure of neurons, nerve processes and neuroglial cells.
Thieme Medical Publishers, Inc New York.
Peters A, Palay SL and Webster H deF (1976). The fine structure of nervous system: The neurons
and supporting cells. WB Saunders Company, Philadelphia.
Peters A, Palay SL and Webser H deF (1991). The fine structure of nervous system neurons and
their supportive cells. Oxford University Press, New York.
Quick MW, Hu J, Wang D and Zhang H-Y (2004). Regulation of a γ-Aminobutyric Acid
Transporter by Reciprocal Tyrosine and Serine Phosphorylation. J Biol Chem 279:15961-15967.
Raiteri L, Paolucci E, Prisco S, Raiteri M and Bonanno G (2003). Activation of a glycine
transporter on spinal cord neurons causes enhanced glutamate release in a mouse model of
amyotrophic lateral sclerosis. Br J Pharmacol 138:1021–1025.
Raiteri L, Stigliani S, Zappettini S, Mercuri NB, Raiteri M and Bonanno G (2004). Excessive and
precocious
glutamate
release
in
a
mouse
model
of
amyotrophic
lateral
sclerosis.
Neuropharmacology 46:782–792.
Robinson AP, White TM and Mason DW (1986). Macrophage heterogeneity in the rat as delineated
by two monoclonal antibodies MRC OX-41 and MRC OX-42, the latter recognizing complement
receptor type 3. Immunology 57(2):239-47.
Sakakibara S, Nakadate K, Tanaka-Nakadate S, Yoshida K, Nogami S, Shirataki H and Ueda S
(2008). Developmental and spatial expression pattern of alpha-taxilin in the rat central nervous
system. J Comp Neurol 511(1):65-80.
Schmechel DE, Vickrey BG, Fitzpatrick D and Elde RP, (1984). GABAergic neurons of
mammalian cerebral cortex: widespread subclass defined by somatostatin content. Neurosci Lett
47:227-232.
Scimemi A (2014). Structure, function and plasticity of GABA transporters. Front Cell Neurosci
8:161.
Seki T, Namba T, Mochizuki H and Onodera M (2007). Clustering, Migration, and Neurite
Formation of Neural Precursor Cells in the Adult Rat Hippocampus. J Comp Neurol 502:275-290.
Somogy P, Tamás G, Lujan R and Buhl EH (1998). Salient features of synaptic organization in the
cerebral cortex. Brain Res Brain Res Rev 26(2-3):113-35.
Stallcup WB (1981). The NG2 antigen, a putative lineage marker: immunofluorescent localization
in primary cultures of rat brain. Dev Biol 83(1):154-65.
28
Vaughan DW and Peters A (1974). Neuroglial cells in the cerebral cortex of rats from young
adulthood to old age: an electron microscope study. J Neurocytol 3:405-429.
Villalba RM, Raju DV, Hall RA and Smith Y (2006). GABA(B) receptors in the
centromedian/parafascicular thalamic nuclear complex: an ultrastructural analysis of GABA(B)R1
and GABA(B)R2 in the monkey thalamus. J Comp Neurol 496(2):269-87.
Wang Z, Li JY, Dahlström A and Danscher G (2001). Zinc-enriched GABAergic terminals in
mouse spinal cord. Brain Res 921:165-172
Yang Z, You Y and Levison SW (2008). Neonatal hypoxic/ischemic brain injury induces
production of calretinin-expressing interneurons in the striatum. J Comp Neurol 511:19-33.
29