242
Editoriale
Recenti Prog Med 2012; 103: 242-247
Aritmie cardiache in età geriatrica
Giorgio De Benedetto, Roberta De Angelis, Chiara Fossati, Alessia Bellomo, Maria Alfarano,
Benedetta Marigliano, Cristina Lo Iacono, Vincenzo Marigliano
Riassunto. La decisione di instaurare una terapia antiaritmica in un paziente geriatrico dipende dalle caratteristiche
dei sintomi e dalla morbilità e dalla mortalità potenziali. Alcune aritmie possono provocare sintomi fastidiosi ma non
influenzare la prognosi a lungo termine, mentre altre, con
sintomatologia lieve o assente, possono avere prognosi negativa.
Cardiac arrythmias in the elderly.
Parole chiave. Aritmie cardiache, età geriatrica, ritmo cardiaco.
Key words. Cardiac arrhythmias, cardiac rhythm, elderly.
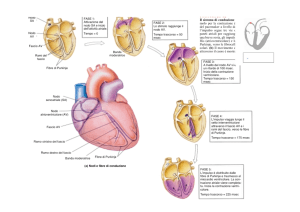
Effetti dell’invecchiamento
sull’elettrofisiologia cardiaca
e sulla valutazione delle aritmie cardiache
che per lo sviluppo di disturbi del ritmo atriale e
ventricolare. Per quanto concerne le alterazioni della frequenza, il ritmo basale in posizione supina non
subisce variazioni di rilievo in età geriatrica rispetto all’età giovane adulta, mentre diminuisce la capacità di risposta del cuore quando si passa in posizione ortostatica1. La prevalenza dei battiti ectopici atriali aumenta con l’età. Brevi salve di tachiaritmie sopraventricolari si rinvengono in più del
50% dei soggetti ultrasessantacinquenni, mentre la
fibrillazione atriale (AF) e le bradiaritmie si identificano come condizioni patologiche proprie dell’età
geriatrica. Anche le aritmie ventricolari aumentano, infine, con l’età1.
Il significato prognostico di tutti questi disturbi
del ritmo è, tuttavia, strettamente correlato alla
presenza o meno di una sottostante patologia cardiovascolare. Questo articolo fornirà una rapida visione delle caratteristiche delle principali aritmie
dell’età geriatrica e alcuni consigli utili per un adeguato approccio terapeutico.
Nei pazienti anziani senza evidente patologia
cardiovascolare il numero dei miociti cardiaci diminuisce progressivamente, mentre i miociti residui vanno incontro a fenomeni di ipertrofia. Contemporaneamente, si può riscontrare un aumento
delle fibre elastiche e collagene in tutte le parti della matrice interstiziale e del tessuto di conduzione1.
Attorno al nodo seno atriale, con l’avanzare dell’età, si associa un progressivo accumulo di tessuto
adiposo, che determina una graduale separazione
fra le cellule che compongono il nodo di Keith e
Flack e la muscolatura circostante. Il numero delle
cellule pace-maker, inoltre, diminuisce progressivamente, ed è stato evidenziato come, a partire dai 75
anni di età, meno del 10% dell’originario patrimonio cellulare resti funzionante. Ancora, nei soggetti
anziani si evidenziano calcificazioni dello scheletro
cardiaco, che includono l’anulus aortico e mitralico,
il corpo fibroso centrale e la sommità del setto atrioventricolare (AV)1. A causa della loro prossimità con
queste strutture, il nodo AV, il fascio di His, le branche destra e sinistra sono frequentemente colpite
dai fenomeni di invecchiamento. L’aumento della
durata del potenziale d’azione e una diminuita risposta autonomica sono allo stesso modo parte integrante del processo di senescenza. Nel loro complesso, queste modificazioni forniscono il substrato
per l’aumentata propensione età correlata nei confronti di alterazioni cronotrope e dromotrope, oltre
Summary. The prescription of antiarrhythmic therapy in
the elderly depends on the characteristics of clinical symptoms and on the potential morbidity and mortality. Some
cardiac arrhythmias may cause bothersome symptoms but
do not affect the long-term prognosis. However, other dysrhythmias with mild or no symptoms may be associated
with a poor prognosis.
Bradaritmie e pacemaker in età geriatrica
Il processo di invecchiamento è associato ad
una progressiva fibrosi del nodo seno atriale e del
sistema di conduzione AV; tale fenomeno degenerativo esita in bradicardia, che può essere ulteriormente esacerbata dall’insorgere di ulteriori
condizioni patologiche o iatrogene. Tutto ciò, spesso, pone indicazione all’impianto di un pacemaker
(PM).
Dipartimento di Scienze Cardiovascolari, Respiratorie, Nefrologiche e Geriatriche, Policlinico Umberto I, Sapienza Università di Roma.
Pervenuto il 9 febbraio 2012.
G. De Benedetto et al.: Aritmie cardiache in età geriatrica
Le attuali linee-guida per l’impianto di PM sono
quelle aggiornate dall’American College of Cardiology (ACC) e dall’American Heart Association
(AHA). Nelle righe che seguono forniamo una visione sinottica delle attuali indicazioni all’impianto del PM, oltre che i risultati dei più importanti e
recenti clinical trial sull’utilizzo del PM in età geriatrica.
Indicazione di Classe I all’impianto di PM permanente sono il blocco AV di III grado e il blocco
AV di II grado avanzato in pazienti sintomatici. La
terapia di pacing è altresì raccomandata nei pazienti con malattie neuromuscolari e blocco AV di
III grado, anche se asintomatici, perché l’evoluzione delle alterazioni della conduzione AV è scarsamente prevedibile in questi soggetti. I pazienti affetti da patologia del sistema di conduzione (blocco bi- o tri- fascicolare all’ECG) manifestatasi con
un episodio sincopale o pre-sincopale sono candidati, in assenza di spiegazioni alternative per i loro sintomi, all’impianto di PM. Per quanto riguarda la malattia del nodo del seno (Sick Sinus Syndrome, SSS), il PM è indicato in pazienti con bradicardia sintomatica (sincope, pre-sincope, dispnea
ed intolleranza allo sforzo) associata ad una disfunzione del nodo del seno atriale (pause, bradicardia persistente o incompetenza cronotropa). Nei
pazienti anziani, SSS è spesso associata all’insorgenza di tachiaritmie atriali (sindrome bradi-tachi), inclusa AF2. A causa della frequente associazione fra SSS e AF, i pacemaker di tipo VVI e VVIR
sono stati inizialmente considerati la terapia di pacing più adatta per questa condizione. Studi recenti, tuttavia, indicano che la presenza di uno stimolo a livello atriale può costituire, nei pazienti
con SSS, un elemento in grado di ridurre l’incidenza di progressione verso AF. Gli attuali miglioramenti della tecnologia, anche nel campo dei PM,
consente di impiantare dispositivi che possono passare dalla modalità di funzionamento DDD a VVI
o DDI in caso di AF parossistica2,3. Queste considerazioni hanno portato ad un progressivo aumento dell’utilizzo del PM bicamerale nei pazienti
anziani. Alcuni esperti, tuttavia, ritengono che il
pacing in modalità AAI o AAIR sia la modalità di
pacing migliore, perché consente un’attivazione
ventricolare più fisiologica ed è tecnicamente meno complesso2,3 (tabella 1).
Ciononostante, questo approccio non è stato ampiamente adottato nella pratica clinica, perché un
follow-up a lungo termine nei pazienti in età geriatrica ha mostrato la progressione del blocco AV nel
10% dei casi. Nonostante la capacità di mantenere
la durata del blocco AV costante nel tempo e la possibilità di modificare la propria modalità di funzionamento supportino il razionale per l’utilizzo del
PM bicamerale, dati recenti indicano che, nei pazienti con SSS, la stimolazione a partire dall’apice
del ventricolo sinistro possa determinare un aumento dell’incidenza di insufficienza cardiaca, e,
quindi, di successiva ri-ospedalizzazione3.
Fibrillazione atriale
La fibrillazione atriale colpisce circa 2,3 milioni di
persone negli USA ed è attualmente il più comune
disturbo del ritmo tra i pazienti ospedalizzati con
una diagnosi di disritmia primitiva. L’età media dei
pazienti è 75 anni: l’84% di essi ha un’età superiore
ai 65 anni. Dati provenienti da studi su AF cronica
effettuati in Nord America, in Gran Bretagna e in
Islanda indicano una prevalenza dallo 0,5% all’1%
nella popolazione generale. In due studi separati, ristretti a pazienti con un età superiore ai 60 anni, l’incidenza variava dal 5% al 15% dopo un periodo di
follow-up variabile da 5 a 15 anni. La genesi di questa “epidemica” AF è correlata all’espansione della
popolazione geriatrica4,5. AF ha un impatto sostanziale sia sulla morbilità che sulla mortalità. È un fattore di rischio indipendente per ictus, responsabile di
circa 75000 accidenti cerebrovascolari all’anno. AF
è altresì associata con un aumento di più di due volte della mortalità per tutte le cause. Nonostante AF
coesista spesso con altre condizioni morbose, specialmente malattie cardiovascolari e polmonari, il
tasso di mortalità resta comunque più alto se si aggiustano i dati considerando le suddette condizioni4.
I dati supportano l’idea che l’uso degli anticoagulanti per la prevenzione primaria e secondaria
dell’ictus sia il provvedimento farmacologico più
impellente nel trattamento di AF. L’incidenza annuale di icuts con AF non valvolare, cronica o parossistica è, in assenza di anticoagulazione, approssimativamente del 5%, in confronto ad un valore di circa l’1% per popolazioni confrontabili con il
campione in esame e in ritmo sinusale.
Tabella 1. Trial clinici randomizzati sulla selezione della modalità di selezione dei pace maker in età geriatrica.
Trial, anno
Pazienti arruolati
Età media
Follow-up (anni)
Modalità Pacing
PASE, 1998
407
76
2,5
CTOPP, 2000
2568
73
3
MOST, 2002
2010
74
2,7
VVIR vs DDDR
UK-PACE, 2003
2021
80
4,6
VVI/VVIR vs DDD/DDDR
VVIR vs DDDR
VVIR vs DDDR (o AAIR)
Legenda: CTOPP= Canadian Trial Of Physiologic Pacing; MOST= Mode Selection Trial; PASE= Pace Maker Selection in the Elderly; UK-PACE= UK
Pacing and Cardiovascular Events
243
244
Recenti Progressi in Medicina, 103 (6), giugno 2012
I fattori di rischio per ictus in pazienti con AF
rapia anticoagulante deve essere protratta per alincludono precedenti eventi cerebrovascolari, stomeno 4 settimane dopo la cardioversione, perché
ria di ipertensione, diabete mellito, insufficienza
lo stunning atriale aumenta il rischio di formacardiaca, età avanzata. I fattori di rischio incluzione di trombi (tabella 2).
dono aumento volumetrico dell’atrio sinistro e riPer quanto concerne la terapia di AF, due sono
dotta funzione sistolica del ventricolo sinistro.
i possibili approcci: il controllo della frequenza e il
Dati che derivano da studi di prevenzione primacontrollo del ritmo (tabella 3). Per quanto riguarda
ria indicano che il rischio annuale di ictus in pail controllo della frequenza, nonostante nei pazienti con uno o più fattori di rischio clinici varia
zienti con AF associata ad instabilità emodinamidal 4% al 12% e che la terapia con warfarin riduca, angina persistente o stenosi aortica critica sia
ce il rischio del 60%-70%. Nei pazienti con età surichiesta una cardioversione urgente, molti dei sinperiore ai 75 anni, tuttavia, l’effetto benefico deltomi della fase acuta possono essere controllati da
la terapia con warfarin viene in parte vanificato
una pronta riduzione della frequenza ventricoladall’aumentato rischio di severe complicanze
re7,8. La digitale diminuisce la frequenza ventricoemorragiche, specialmente nelle donne. L’aspirilare aumentando il tono vagale ed aumentando la
na è sostanzialmente meno efficace del warfarin
refrattarietà del nodo AV. Tuttavia, sia nelle forme
per la prevenzione di eventi trombo-embolici, speacute che croniche, la digossina è generalmente
cialmente in pazienti anziani con fattori di rischio
meno efficace nel controllo della frequenza rispetper ictus. Tuttavia, è associata con un rischio mito sia ai β-bloccanti che ai Ca2+ antagonisti. Non ci
nore di complicanze emorragiche, inclusa l’emorsono dati che supportino l’utilizzo della digossina
ragia cerebrale. Il ruolo di farmaci antiaggregannella cardioversione farmacologica o nel manteniti piastrinici più moderni, come il clopidogrel, o di
mento del ritmo sinusale.
agenti antitrombotici, come
lo ximelagatran per la prevenzione di eventi trombo- Tabella 2. Terapia antitrombotica nei pazienti con fibrillazione atriale: approccio basato sul riembolici in pazienti anzia- schio.
ni con AF è ancora da deCaratteristiche
Terapia
Grado di
terminarsi6. Nei pazienti
dei pazienti
antirombotica
raccomandazione
geriatrici, la decisione se
iniziare o meno una terapia Età >60, no patologia cardiaca
Aspirina
I
anticoagulante con warfaAspirina
I
rin deve essere presa bilan- Età <60, patologia cardiaca ma non fattori
di rischio*
ciando l’aumento del riAspirina
I
schio di emorragia cerebra- Età 60-74, no fattori di rischio
le e il rischio di sanguinaEtà 65-75 con DM o CAD
Anticoagulante orale
I
mento in seguito ad eventi
Anticoagulante orale
I
traumatici. Sono richiesti Età >75, donne
un attento monitoraggio
Età >65 o più, Insufficienza Cardiaca
Anticoagulante orale
I
del dosaggio di warfarin
Anticoagulante orale
I
somministrato e una fre- Frazione di Eiezione <35%
quente valutazione dei liMalattia Reumatica Cardiaca (stenosi mitralica) Anticoagulante orale
I
velli di INR. Il rischio di
tromboembolismo legato ad Protesi Valvolare, pregresso tromboembolismo Anticoagulante orale
I
una cardioversione improvTrombo Atriale persistente
Anticoagulante orale
IIa
visa nei pazienti con AF
che si è presentata meno di Legenda: DM= Diabete Mellito; CAD= Coronaropatia.
48 ore prima, è basso. Nei
*I fattori di rischio per tromboembolismo includono insufficienza cardiaca, frazione di eiezione ventripazienti con AF da più di colare sinistra <35% e storia di ipertensione arteriosa.
48 ore o di durata sconosciuta, la terapia con warfarin è raccomandata per
quattro settimane prima di Tabella 3. Trial clinici sulla fibrillazione atriale: controllo della frequenza vs controllo del ritmo.
procedere alla cardioversioTrial, anno
Numero pazienti
Tipo di AF
End point primario
ne (sia elettrica che farmacologica). Dati recenti sug- PIAF, 2000
252
Persistente
Sintomi
geriscono che l’ecocardioAFFIRM, 2002
4060
Persistente/Parossistica Mortalità da tutte le cause
grafia transesofagea sia efficace nell’escludere la pre- RACE, 2002
522
Persistente
Composito
senza di trombi a livello
200
Persistente
Composito
atriale e di consentire una STAF, 2003
Legenda: AF= Fibrillazione atriale; AFFIRM= Atrial Fibrillation Follow-Up Investigation of Rhythm Manacardioversione precoce nei
pazienti con AF di durata gement; PIAF= Pharamcological Intervention in Atrial Fibrillation; RACE= Rate Control Versus Electrical
sconosciuta. Tuttavia, la te- Cardioversion for Persistent Atrial Fibrillation Study; STAF= Strategies of Treatment of Atrial Fibrillation.
G. De Benedetto et al.: Aritmie cardiache in età geriatrica
La digossina può teoricamente facilitare la AF
nell’abbreviare il periodo di refrattarietà atriale e
nell’aumentare la automaticità atriale. I β-bloccanti e i Ca2+ antagonisti riducono la frequenza ventricolare in AF ritardando la conduzione a livello del
nodo AV. La scelta tra queste due famiglie di farmaci
dipende primariamente dal contesto clinico. Per
esempio, i primi sono preferibili nei pazienti con AF
parossistica precipitata da un’ischemia coronarica
acuta, mentre i secondi vengono preferenzialmente
scelti dopo il riscontro di un’anamnesi positiva per
asma9. La clonidina, un’agonista dei recettori alpha 2 centrali, può essere moderatamente utile per
ridurre la frequenza ventricolare attraverso la riduzione dell’attività del sistema simpatico a livello
cerebrale7,8. Nei pazienti anziani, l’ottimizzazione
del controllo della frequenza mediante farmaci può
essere reso difficoltoso dalla presenza di comorbilità e dalla suscettibilità agli effetti collaterali (bradiaritmie, peggioramento del grado di insufficienza
cardiaca). Inoltre, il controllo della frequenza può
essere insufficiente ad alleviare i sintomi in alcuni
pazienti, come quelli con cardiomiopatia ipertrofica, nei quali il ripristino del ritmo sinusale può essere di beneficio.
Per quanto concerne il controllo del ritmo, invece, si può dire che, nella fase acuta, esso può essere ottenuto mediante una cardioversione farmacologica o non farmacologica. L’efficacia dei farmaci
antiaritmici per la cardioversione di AF, sia per via
intravenosa che per via orale, è altamente variabile, con un range che va dal 30% al 75%. L’efficacia
varia altresì con l’età del paziente, la durata dell’aritmia, la presenza di flutter atriale, una sottostante disfunzione del ventricolo sinistro e le dimensioni del ventricolo sinistro. L’ibutilide, un farmaco antiaritmico di classe III, è più efficace nel ripristinare il ritmo sinusale nel flutter atriale rispetto ad AF. La dofetilide, un altro farmaco di classe III, è efficace nella profilassi orale e nei pazienti con disfunzione del ventricolo sinistro. Una singola dose orale di propafenone è stata altresì valutata per la cardioversione di AF, ed ha mostrato un
eccellente profilo di efficacia e di sicurezza8,10. In
generale, i più alti tassi di cardioversione sono stati registrati per AF parossistiche piuttosto che persistenti. I pazienti anziani possono essere a rischio
aumentato di azione pro-aritmica da parte di questi farmaci, per cui necessitano di un più attento
monitoraggio. L’efficacia dell’amiodarone endovena
per l’interruzione di AF di recente insorgenza è oggetto di discussione. Tuttavia, i dati più recenti
sembrano non supportare l’utilizzo dell’amiodarone nella cardioversione acuta. La cardioversione
esterna a corrente diretta può ripristinare il ritmo
sinusale dal 75% al 90% dei pazienti con AF. La cardioversione con device o catetere interno ha un’efficacia riportata prossima al 100%, anche nei pazienti in cui la cardioversione esterna non ha ottenuto risultati soddisfacenti. La cardioversione interna trova indicazione in quei soggetti in cui la
cardioversione esterna ha fallito ed in quei casi in
cui il ripristino del ritmo sinusale è obbligatorio6,7.
A proposito del mantenimento del ritmo sinusale in pazienti con AF ricorrente, sono opportune alcune considerazioni circa la terapia antiaritmica
cronica. I farmaci antiaritmici di classe IA come la
chinidina, la disopiramide e la procainamide; farmaci di classe IC come la flecainide e il propafenone; e farmaci di classe III come il sotalolo, amiodarone e la dofetilide sono stati utilizzati per prevenire la ricorrenza di AF, con un’efficacia che va dal
30% all’80% durante il primo anno di follow-up.
L’amiodarone è più efficace e sicuro nei follow-up a
breve e medio termine rispetto a farmaci di classe
I, per i quali va sempre considerato il rischio potenziale di sviluppare un’aritmia ventricolare. Tuttavia, l’amiodarone risulta essere associato a molti
effetti collaterali non cardiologici nell’utilizzo a lungo termine, che determinano un’interruzione della
terapia pari al 20% dei casi ad 1 anno. In generale,
i farmaci con sostanziali effetti inotropi negativi,
come procainamide, disopiramide e flecainide sono
controindicati nei pazienti con disfunzione sistolica.
I farmaci di classe IC non dovrebbero essere utilizzati nei pazienti con una sottostante malattia coronarica. I farmaci di classe IA e di classe III prolungano il tempo di ripolarizzazione ventricolare e l’intervallo QT portando al blocco dei canali del potassio. Propafenone, sotalolo ed amiodarone hanno un
effetto β-bloccante che potrebbe essere clinicamente significativo nei pazienti anziani con disfunzione
del nodo del seno o del nodo AV. Nei pazienti con
malattia del fascio di His e delle fibre del Purkinje,
inoltre, i farmaci di classe I dovrebbero essere impiegati con cautela, a causa della potenziale azione
di rallentamento della conduzione infranodale. Dofetilide, sotalolo e i metaboliti attivi della procainamide, infine, sono principalmente escreti dal rene e dovrebbero essere utilizzati con cautela nei pazienti con concomitante disfunzione renale.
Per quanto concerne le terapie non farmacologiche di AF, possiamo dire che, in assenza di una unica, efficace strategia farmacologica, molti sforzi sono stati condotti nel tentativo di sviluppare nuove
metodiche di trattamento non farmacologico. Prima che l’applicazione di queste metodiche possa essere ampiamente applicata negli anziani, tuttavia,
sarà necessario ottenere altri risultati definitivi riguardanti la sopravvivenza e gli effetti avversi di
questi trattamenti. Anche in questo caso, riteniamo utile distinguere due possibili approcci: quello
del ripristino della frequenza e quello del controllo
del ritmo; nel primo caso, qualora la terapia farmacologica non dovesse sortire effetti, l’ablazione
del nodo AV e il pacing permanente sono efficaci nel
controllo della frequenza ventricolare. Nonostante
l’ablazione del nodo AV non elimini né AF né la necessità della terapia anticoagulante, essa consente
la regressione della sintomatologia clinica e migliora la qualità della vita, la tolleranza allo sforzo
fisico e la performance ventricolare sinistra. Inoltre, dati recenti suggeriscono che il pacing biventricolare dopo l’ablazione del nodo AV è associato ad
un miglioramento al test del cammino rispetto al
pacing convenzionale.
245
246
Recenti Progressi in Medicina, 103 (6), giugno 2012
Nonostante l’efficacia dell’ablazione del nodo AV
e dell’impianto del PM per il controllo dei sintomi in
pazienti con AF, persiste tuttora il dubbio che la
creazione di un blocco AV permanente e l’impianto
del PM possano determinare gravi conseguenze a
lungo termine. Tuttavia, attualmente, non ci sono
dati definitivi a riguardo.
Per quanto concerne il controllo del ritmo, invece, episodi ricorrenti di AF sintomatica sono piuttosto frequenti in pazienti di tutte le età. Le opzioni di trattamento non farmacologico di AF vengono
sempre più utilizzate per mantenere il ritmo sinusale in questi pazienti. Tuttavia, i potenziali beneficî devono essere accuratamente valutati, soppesandoli con i rischi derivanti dall’esecuzione di tali
procedure invasive, soprattutto nei pazienti anziani con comorbilità. La tecnica chirurgica è altamente efficace nel trattamento di AF refrattaria, ed
è diventata un’importante procedura aggiuntiva
per i pazienti con AF sottoposti ad interventi cardiochirurgici per altre ragioni. Il tasso di successo
a lungo termine è attorno al 90% a 4-5 anni dall’intervento. L’esperienza chirurgica, inoltre, ha fornito nuovo impeto allo sviluppo delle tecniche di
ablazione transcatetere di AF.
Attualmente, esistono due approcci transcatetere per colpire il substrato aritmo-genico di AF. L’isolamento delle vene polmonari, la prima tipologia di
approccio, si basa sul presupposto secondo il quale
la maggior parte di AF viene scatenata o innescata
da focolai situati allo sbocco delle vene polmonari e
a livello della giunzione atriale sinistra. Questo approccio sembra essere il più efficace nei pazienti con
AF parossistica senza una preesistente patologia
cardiaca; di solito, questi soggetti sono più giovani
ed hanno meccanismo di inizio di AF basato principalmente sulla presenza di un trigger. Il secondo
approccio, invece, si basa sul principio secondo cui
AF sarebbe sostanzialmente sostenuta, nei soggetti con AF permanente e preesistente patologia cardiaca, da un diffuso substrato aritmogenico a livello atriale; di solito, questi pazienti sono anziani.
Quest’ultima tecnica prevede una più ampia area
di ablazione, che comprenda lo sbocco delle vene
polmonari, l’atrio sinistro e l’atrio destro. La percentuale di successo delle tecniche di ablazione
transcatetere si è dimostrata essere alquanto variabile; alcuni hanno tentato di spiegare tale variabilità con le differenze esistenti nella selezione
del campione oggetto di studio, l’esperienza dell’operatore, le tecniche di ablazione usate e così via.
Le principali complicanze delle tecniche di ablazione includono morte, ictus, tamponamento cardiaco,
perforazione esofagea e stenosi delle vene polmonari. Un approccio alternativo al trattamento di
episodi di AF parossistica è l’impianto di un defibrillatore. Questo dispositivo è sicuro ed efficace nel
porre fine a fibrillazione atriale. Tuttavia, la sua
applicazione clinica è limitata a causa della sgradevole esperienza (avvertita dai pazienti senza alterazione dello stato di coscienza) nel caso di attivazione del defibrillatore, oltre che dall’assenza di
dati sui potenziali effetti benefici a lungo termine.
Tachiaritmie sopraventricolari
I principî di terapia farmacologica e non farmacologica delle tachiaritmie sopraventricolari (TPSV)
sono simili a quelle descritte per AF. Tuttavia, la
maggior parte delle TPSV possiede un substrato
aritmogenico isolato e ben definito. β-bloccanti e Ca
2+ antagonisti sono efficaci nel trattamento di
TPSV che originano o utilizzano il nodo seno atriale e il nodo AV come componente della tachiaritmia;
e per il trattamento di TPSV mediate da catecolamine. I farmaci antiaritmici di Classe I e di Classe
III sono efficaci nel trattamento delle TPSV che si
innescano attraverso una via accessoria. Anche la
terapia di ablazione è altamente efficace; indicazioni di Classe I per questo tipo metodica sono: 1) tachicardia da rientro nel nodo AV sintomatica; 2) flutter atriale ricorrente; 3) TPSV associata a pre-eccitazione ventricolare se la tachiaritmia è resistente
alla terapia; 4) tachiaritmia ventricolare a rapida
risposta ventricolare come risultato di conduzione
attraverso una via accessoria. L’incidenza di complicazioni maggiori associate a TPSV è del 3%; il rischio di complicanze minori è circa dell’8%. Il rischio
complessivo di complicazioni tromboemboliche è circa dello 0,6%.
Tachiaritmie ventricolari
L’età avanzata è associata ad un progressivo aumento nell’incidenza di battiti ectopici ventricolari
e di tachicardie ventricolari non sostenute in pazienti con o senza malattie cardiache manifeste.
Questi trend sono stati attribuiti alla presenza di
una patologia cardiaca non diagnosticata, ad un aumento della massa ventricolare sinistra, ad alti livelli di catecolamine sieriche e alle modificazioni
età correlate nei miociti cardiaci e nella matrice extracellulare. La gestione delle aritmie ventricolari
nei pazienti anziani è simile a quello della popolazione generale. Nei pazienti con tachiaritmia ventricolare non sostenuta si richiede un’attenta valutazione della presenza di patologie cardiache, comprendente anche la possibile presenza di patologia
coronarica e disfunzione del ventricolo sinistro.
Battiti prematuri ventricolari e tachiaritmie ventricolari non sostenute sono associate ad una prognosi benigna in assenza di patologie cardiache di
rilievo. Il rischio morte cardiaca improvvisa è aumentato nei pazienti con bassa frazione di eiezione
da causa ischemica e non. La prevenzione della
morte cardiaca improvvisa richiede ottimizzazione
della terapia nei confronti della sottostante malattia di base e l’uso del cardiodefibrillatore impiantabile (ICD). È doveroso notare che, nonostante
nessuna delle indicazioni per l’impianto di ICD alluda in modo particolare ai pazienti anziani, una
valutazione individuale e la determinazione degli
obiettivi terapeutici primari sono particolarmente
pertinenti in questa popolazione a causa delle frequenti comorbilità e della inferiore aspettativa di
vita nei soggetti molto anziani.
G. De Benedetto et al.: Aritmie cardiache in età geriatrica
Prevenzione secondaria
della morte cardiaca improvvisa
Le indicazioni per l’impianto di un cardiodefibrillatore impiantabile per la prevenzione secondaria della morte cardiaca improvvisa includono:
1) arresto cardiaco dovuto a tachicardia ventricolare o a fibrillazione ventricolare non legata a causa transitoria o reversibile (infarto acuto del miocardio); 2) tachicardia ventricolare sostenuta,
spontanea in associazione a malattia cardiaca
strutturale; 3) sincope di origine non determinata
con tachicardia ventricolare sostenuta clinicamente ed emodinamicamente significativa o fibrillazione ventricolare indotta qualora la terapia farmacologica sia inefficace, non tollerata o non preferita. Trial clinici randomizzati che hanno comparato l’ICD con la terapia antiaritmica tradizionale hanno dimostrato l’utilità dell’ICD nel ridurre l’incidenza di morte cardiaca improvvisa; tuttavia nessun trial ha dimostrato tale efficacia nei pazienti molto anziani.
Prevenzione primaria
della morte cardiaca improvvisa
I risultati di molti trial recentemente completati hanno importanti implicazioni nella prevenzione primaria della morte cardiaca improvvisa.
In pazienti con malattia coronarica, precedente
infarto del miocardio e frazione di eiezione uguale o inferiore al 30%, è stato dimostrato un miglioramento nella sopravvivenza dopo l’impianto
profilattico di un ICD, rispetto alla sola terapia
medica10,11.
Terapia di risincronizzazione cardiaca e ICD
La terapia di risincronizzazione cardiaca (CRT)
migliora la capacità funzionale e la qualità di vita
nei pazienti con insufficienza cardiaca congestizia
persistente classe III-IV NYHA, nonostante un’ottimale terapia medica; esiste altresì l’evidenza che
la CRT possa modificare il rimodellamento strutturale in pazienti selezionati. Nonostante i singoli
trial sulla CRT non abbiano la forza statistica per
definire la sopravvivenza, una meta-analisi dei risultati di quattro trial randomizzati coinvolgenti
più di 800 pazienti ha trovato che la CRT riduce la
mortalità nei pazienti con insufficienza cardiaca.
Più recentemente, il Comparison of Medical Therapy, Pacing and Defibrillation in Chronic Heart
Failure Trial ha dimostrato che la CRT riduce
l’ospedalizzazione e che la CRT con l’ICD riduce la
mortalità nello scompenso cardiaco. Tuttavia, va
sottolineato che sono disponibili davvero pochi dati sull’utilizzo di questi dispositivi nelle persone
molto anziane.
Quindi, le raccomandazioni per l’impiego della
CRT e dell’ICD in questo gruppo di età deve essere
individualizzato, prendendo in considerazione
l’aspettativa di vita del paziente, le patologie mediche concomitanti e gli obiettivi terapeutici12.
Bibliografia
1. Lakatta EG. Age associated cardiovascular changes
in health: impact on cardiovascular disease in older
persons. Hearth Failure Rev 2002; 7: 29-49.
2. Abraham WT, Fisher WG, Smith Al, et al.; for the
Multicenter InSync Randomized Clinical Evaluation
(Miracle) Study Group. Cardiac resyncronization in
chronic heart failure. N Engl J Med 2002; 346: 184553.
3. Ozcan C, Jahangir A, Friedman PA, et al. Long term
survival after ablation of the atrioventricular node
and implantation of a permanent pacemaker in patients with atrial fibrillation. N Engl J Med 2001;
344: 1043-51.
4. Wyse DG, Waldo AL, DiMarco JP, et al.; for the Atrial Fibrillation Follow-up Investigation of Rhythm
Managment (AFFIRM) Investigators. A comparison
of rate control and rhythm control in patients with
atrial fibrillation. N Engl J Med 2002; 347: 182533.
5. Iwasaki YK, Nishida K, Kato T, Nattel S. Atrial fibrillation pathophysiology: implications for management. Circulation 2011; 124: 2264-74.
6. Al-Khatib SM, Alexander JH, Lopes RD, Mahaffey
KW, Patel MR, Granger CB. Promise of factor Xa inhibition in atrial fibrillation. Curr Cardiol Rep 2012;
14: 70-8.
7. Ammirati F, Colivicchi F, Santini M; for the Syncope
Diagnosis and Treatment Study Investigators. Permanent cardiac pacing versus medical treatment for
the prevention of recurrent vasovagal syncope: a
multicenter, randomized, controlled trial. Circulation
2001; 104: 52-57.
8. Carlsson J, Miketic S, Windeler J, et al.; for the
STAF investigators. Randomized trail of rate-control versus rhythm control in persistent atrial fibrillation: the Strategies of Treatment of Atrial Fibrillation (STAF) study. J Am Coll Cardiol 2003; 41:
1690-6.
9. Erdmann E. Safety and tolerability of beta-blockers:
prejudice & reality. Indian Heart J 2010; 62: 132-5.
10. Hohnloser SH, Kuck K-H, Lilienthal J. Rhythm or
rate control in atrial fibrillation: Pharmacological Intervention in Atrial Fibrillation (PIAF): a randomized trial. Lancet 2000; 356: 1789-94.
11. Gatzoulis KA, Tsiachris D, Dilaveris P, et al. Implantable cardioverter defibrillator therapy activation for high risk patients with relatively well preserved left ventricular ejection fraction. Does it really work? Int J Cardiol 2012; 246: 1789-94.
12. Bansch D, Antz M, Boczor S, et al.; for the CAT Investigators. Primary prevention of sudden cardiac
death in idiopathic dilated cardiomyopathy: the Cardiomyopathy Trial (CAT). Circulation 2002; 105:
1453-8.
Indirizzo per la corrispondenza:
Dott. Giorgio De Benedetto
Policlinico Umberto I
Dipartimento di Scienze Cardiovascolari,
Respiratorie, Nefrologiche e Geriatriche
Viale del Policlinico, 55
00161 Roma
E-mail: [email protected]
247