Verifica alcol e derivati 3ª CH – 12 Aprile 2008 PROBLEMI SVOLTI - FILA A
1. Qual è il componente più volatile in un miscuglio acqua-metanolo? Tale miscuglio sarà omogeneo o
eterogeneo? Che tipo di distillazione si dovrà utilizzare per separare dal miscuglio il componente più
volatile?
Come tutti sanno, il normale etanolo CH3CH2OH è miscibile con acqua in tutte le proporzioni, per cui dovrà
essere miscibile anche il metanolo,CH3OH, che ha la parte apolare più corta. Sempre per la stessa ragione,
(molecola più piccola = minori forze intermolecolari) sapendo che l’alcol etilico bolle a temperatura più
bassa dell’acqua, possiamo essere certi che le forze intermolecolari nel metanolo saranno nel complesso
minori e che quindi tale liquido bollirà a temperatura ancora più bassa dell’omologo C2. Essendo il
miscuglio omogeneo, il componente più volatile, ossia l’alcool, sarà separabile dall’acqua tramite
distillazione frazionata, utilizzando la colonna di Vigreux raffreddata ad aria e prelevando solo la frazione
che condensa a una temperatura prossima al punto di ebollizione dell’alcool metilico.
2. Si deve preparare una aldeide (p.eb. = 48 °C) tramite ossidazione del 1-propanolo (p.eb. = 97 °C)
con dicromato di potassio. Come si deve operare per realizzare la preparazione?
Si immette il 1-propanolo in un pallone di reazione con refrigerante di Liebig obliquo e imbuto di carico,
contenente la miscela cromica (soluzione acquosa di acido solforico e dicromato di potassio) e si riscalda
l’alcool fino a raggiungere quasi l’ebollizione con il mantello termico. Introdurre ghiaccio nel becher di
raccolta del distillato, all’estremità del condensatore, perché il prodotto ottenuto è estremamente volatile,
come denunciato dal suo basso p.eb. Interrompere o ridurre il riscaldamento e far gocciolare la miscela
cromica lentamente. L’aldeide si formerà istantaneamente intorno alle gocce di miscela cromica, che essendo
in difetto esauriranno subito il loro potere ossidante, quindi ed evaporerà e sarà condensata sul ghiaccio.
3. Il 2-bromopropano prodotto con resa del 50 % in una reazione Sn1 ha un punto di ebollizione non
sufficientemente diverso dal 2-propanolo di partenza. Sapendo che il LogPow dell’alcool e del
bromuro sono rispettivamente +0,05 e +2,14, descrivere un procedimento adatto a separare il
prodotto.
Il prodotto della reazione di sostituzione del 2-propanolo con HBr acquoso non può essere separato per
distillazione, ma può essere separato per estrazione ripetuta con solvente (s. diclorometano), dopo aver
aggiunto acqua in cui tutti reagenti sono completamente solubili.
4. Scrivere i prodotti delle reazioni del 2-propanolo con a) potassio metallico; b) dicromato di potassio;
c) acido solforico a 180 °C.
OH
a)
OH
+
Na
K2Cr2O7/H2SO4
b)
OH
H2SO4, 180°C
c)
O
-
O
+
+
+
+
Na
+ H2
Cr
3+
H2O
OH
5.
Dare il nome a questo alcool, disegnare l’alchene da cui esso può essere ottenuto
con resa elevata e in assenza di prodotti secondari, e dire quale tipo di reazione si è scelta.
L’alcool è il 4-metilesan-3-olo. Per ottenere questo alcool, l’alchene di partenza deve avere uno dei carboni
del doppio legame in corrispondenza dell’OH, cioè in C-3 (si conta da destra), e l’altro in C-2 o in C-4. Per
ragionare sulle due ipotesi occorre disegnare entrambi gli alcheni. Nell’ipotesi C2=C3 i carboni interessati
all’addizione di acqua sono ugualmente sostituiti, quindi qualunque sia il metodo adottato, l’idrogeno si
addizionerà sia in C2 sia in C3 e si otterrà un miscuglio dei due alcoli, 4-metilesan-2-olo e 4-metilesan-3-olo.
Nel caso C3=C4 c’è invece il C4 più sostituito, dove si addizionerà l’idrogeno se si utilizzerà la reazione di
idroborazione ossidativa, che dà come prodotto l’alcool “anti-markovnikov”, cioè quello desiderato.
H+/H2SO4
OH
OH
4-methylhex-2-ene
OH
1. BH3/THF; 2.H2O2/OH3-methylhex-3-ene
4-methylhexan-3-ol
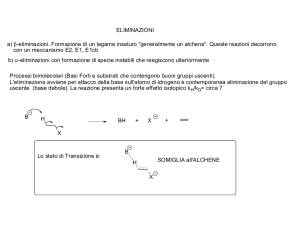
6. Mettere in evidenza, nel seguente substrato, l’idrogeno eliminato e i prodotti della reazione di tale
Cl
alogenuro con t-BuO- Na+:
.
Come noto Il terz-butossido (t-BuO- ), essendo ingombro stericamente a causa dei tre gruppi metilici, non
riesce a svolgere la sua funzione di nucleofilo (dovrebbe andare sul carbonio del substrato dove è legato il
cloro). Ma non è inibito nella sua funzione come base forte di catturare H+, poiché il piccolo protone non ha
difficoltà a trasferirsi anche in condizioni di ingombro sterico. Avverrà dunque una reazione E2. Gli idrogeni
eliminabili dal substrato sono quelli posti sui due carboni vicini al carbonio dove è legato il cloro, cioè quello
in comune con l’anello e il metile.
.. -
H
H3C
H
Cl
O
C
-
+ Cl +
CH3
t-BuO
H
H
CH3
-
H3C
C
O
..
-
CH3
t-BuO-
CH3
alchene meno sostituito
CH3
CH3
Cl H C
3
OH
CH3
C
-
+ Cl +
H3C
alchene più sostituito
In base alla regola di Saytzeff la seconda reazione sarà più favorita
C
CH3
OH
7. Scrivi un alcool secondario avente formula C5H10O capace di reagire facilmente con Br2 per dare
C5H10Br2O.
L’alcol saturo con 5 atomi di carbonio dovrebbe avere 5x2 + 2 = 12 atomi di idrogeno. Poiché questo ne ha
10, deve possedere un anello o un doppio legame nella struttura. Dovendo reagire con Br2 l’ipotesi del ciclo
si può scartare e dobbiamo introdurre un doppio legame nella struttura. Per poter essere stabile, l’ossidrile
non deve trovarsi sul carbonio del legame pi greco, ma a debita distanza da esso (altrimenti si avrebbe un
enolo). Poiché l’alcol è secondario, il suo OH deve stare nel C2 o nel C3 della catena da 5. Nel primo caso il
doppio legame potrà stare tra C3 e C4 o tra C4 e C5. Nel 3-pentenolo il legame pi greco dovrà stare per forza
a un’estremità. In formule abbiamo le seguenti possibilità:
OH
OH
OH
OH
8. Scrivi i prodotti delle seguenti reazioni
H2/Pt
Br
HBr
anti-markownikov
OH
NaOH
+
-
+ Na Br
OH
1. BH3 / THF
2. H2O2 / OH-
O
H+ / CH3OH
O
OH
K2Cr2O7 / H+
H+ / H2O
9. Scrivi una sintesi adatta a ottenere il propil-etil-etere
Considerato che si tratta di un etere asimmetrico, possiamo utilizzare la sintesi di Williamson o l’addizione
elettrofila di un alcol a un alchene.
.. -
O
+
Br
CH2
OH +
H2C
(Sn2)
+ Br
O
H+
-
O
La sintesi di Williamson può ovviamente essere realizzata anche con l’alcossido dell’1-propanolo e lo ioduro
o bromuro di etile, mentre nell’addizione i due ruoli di nucleofilo (alchene) ed elettrofilo (alcool protonato)
non possono essere invertiti, poiché altrimenti il primo (propene) addizionerebbe l’-OCH2CH3 in C2 anziché
in C1 (regola di Markownikov).
Verifica alcol e derivati 3ª CH – 12 Aprile 2008 Soluzioni commentate - Fila B
1. La preparazione di un etere come il cicloesil-n-butil-etere, tramite sintesi di Williamson, da un
alcool e un bromuro, richiede due stadi. Descrivere la modalità di realizzazione in laboratorio della
prima fase che coinvolge solo l’alcool.
Le sintesi di Williamson degli eteri sono sostituzioni nucleofile SN2 efficaci su alogenuri primari come
substrati. Perciò, dato che il cicloesile è secondario, il corrispondente bromuro non potrà essere utilizzato
come substrato per la reazione SN2, mentre allo scopo sarà utilizzabile il 1-bromobutano, primario, in cui
l’atomo di bromo sarà sostituito dall’alcossido derivato dal cicloesanolo.
Il primo stadio richiesto comporterà pertanto la formazione dell’alcossido a partire dal cicloesanolo. La
reazione, che sfrutta il comportamento acido del protone unito all’ossigeno dell’ –OH degli alcoli (pag. 136),
si effettua aggiungendo il metallo alcalino, o altre basi molto forti, con l’alcool desiderato, e aspettando il
tempo necessario allo sviluppo completo dell’idrogeno gassoso :
2
OH
+ 2 Na
2
O
-
+ 2 Na+ + H2
2. Per effettuare una reazione di sostituzione si deve bollire un miscuglio di substrato e reattivo in
solvente acetone (p.eb. 56 °C) per mezzora. Specificare le condizioni sperimentali in cui far avvenire la
reazione.
Se il miscuglio viene fatto bollire così a lungo l’acetone solvente sarà completamente evaporato. L’unico
modo di mantenere il miscuglio all’ebollizione ed evitare la scomparsa del solvente è di montare un
refrigerante verticale raffreddato ad acqua che faccia ricondensare e ricadere l’acetone stesso nel miscuglio.
Perciò, come già spiegato dal “gruppo teoria”, tale tecnica si chiama ebollizione a ricadere. Della reazione in
sé non si sa abbastanza da permettere la definizione di ulteriori dettagli operativi.
3. Qual è il componente più volatile in un miscuglio acqua - NaOH – 1-ottanolo (p.eb 195 °C)? Tale
miscuglio sarà omogeneo o eterogeneo? Che tipo di distillazione si dovrà operare per separare l’alcool
dal miscuglio?
Il componente più volatile è l’acqua. Poiché la coppia ottanolo - acqua viene utilizzata come coppia solvente
apolare/polare di riferimento per la determinazione del parametro di ripartizione LogPow, appare evidente
che i due solventi siano altamente immiscibili. Deve essere anche lampante il fatto che l’1-ottanolo è formato
in prevalenza da una catena idrocarburica e apolare di ben otto carboni, a fronte di un unico legame a
idrogeno, con ciò rendendo tale alcool nettamente apolare e immiscibile con acqua. La semplice separazione
per stratificazione in imbuto separatore sarebbe perciò la tecnica più spedita per il recupero di tale 1-ottanolo.
Ma in base al problema occorre specificare quale tipo di distillazione si avrebbe con tale miscuglio
eterogeneo di ottanolo e NaOH acquoso. La distillazione avverrebbe in corrente di vapore: i vapori di 1ottanolo sarebbero trascinati dal vapore acqueo (il componente più volatile) a 98-100 °C (cioè a temperature
molto più basse del suo p.eb.).
4. Scrivere i prodotti delle reazioni dell’etanolo con a) potassio metallico; b) dicromato di potassio; c)
acido solforico a 180 °C.
a) 2 CH3CH2OH + 2 K
CH3CH2O¯ K+ + H2
b) CH3CH2OH + K2Cr2O7/H+ CH3COOH + Cr3+ + H2O (l’ossidazione di un alcool primario procede fino
ad acido carbossilico se non si usa un ossidante selettivo o se non si elimina per evaporazione l’aldeide
appena formata da un difetto di ossidante. La reazione bilanciata si ricava dalle semireazioni (bilanciate
senza numeri di ossidazione, ma con i criteri: 1) atomi (es. 2 davanti a Cr3+); 2) ossigeni con H2O; 3)
idrogeni con H+; 4) elettroni per pareggiare le cariche.
Ossidazione:
CH3CH2OH + H2O
CH3COOH + 4 H+ + 4 e- da moltiplicare per 3
Riduzione:
Cr2O72- +14H+ + 6 e-
2Cr3+ + 7H2O
Completa:
3 CH3CH2OH + 2 Cr2O72- + 16 H+
da moltiplicare per 2
3 CH3COOH + 4 Cr3+ + 11 H2O
In forma neutra:
3 CH3CH2OH + 2 K2Cr2O7 + 8 H2SO4
3 CH3COOH + 2 Cr2(SO4)3 + 2 K2SO4 + 11 H2O
c) considerate le condizioni estreme (temperatura, acidità), la reazione c) non può comportare che
l’eliminazione di acqua e formazione del doppio legame (pag. 61).
H
CH3 CH2 OH =
H2C
OH
CH2
H2SO4, 180 °C
-H2O
H2C
CH2
OH
Dare il nome a questo alcool, disegnare l’alchene da cui esso può essere ottenuto con
5.
resa elevata e in assenza di prodotti secondari, e dire quale tipo di reazione si è scelta.
L’alcool secondario in oggetto si chiama 2-metil-cicloesanolo. Per ottenerlo partendo da un alchene occorre
addizionare una molecola di acqua a un alchene avente uno dei carboni del doppio legame dove si dovrà
legare l’OH, cioè sul C1. L’altro carbonio del legame π si troverà o in C2 (dove c’è anche il metile) o in C-6
(il carbonio più in alto nella formula). Quindi avremo due ipotesi da valutare:
A
addizione H2O
6
5
B
4
addizione H2O
3
1
OH
2
2-metillcicloesanolo
Nel caso A potremo forzare l’OH ad andare sul carbonio meno sostituito con un’addizione di acqua antiMarkownikov. Questo risultato può essere ottenuto in modo certo e pulito solo tramite idroborazione
ossidativa (l’idrogeno andrà nel carbonio 2).
OH
BH3/THF
H
H2O2/OH-
L’ipotesi B non è invece praticabile perché anche l’idroborazione ossidativa non sarebbe abbastanza
selettiva tra due carboni sostanzialmente equivalenti, ed originerebbe una miscela di due alcoli, tra cui quello
desiderato (che dovrebbe essere in seguito separato):
OH
BH3/THF
H2O2/OH-
H
H
+
OH
6. Mettere in evidenza, nel seguente substrato, l’idrogeno eliminato e i prodotti della reazione di tale
Cl
alogenuro con t-BuO- Na+:
A causa dell’ingombro sterico dei suoi metili, il terz-butossido di sodio, pur essendo una base forte, è
inefficace come nucleofilo, specialmente se anche il gruppo uscente (-Cl) si trova legato a un carbonio
sostituito. Perciò esso, invece di sostituire il cloro, agirà da base catturando un protone, come detto nel testo
del problema. Dal momento che dovrà avvenire una reazione di eliminazione, con formazione di un doppio
legame, l’idrogeno dovrà essere eliminato a) da un carbonio che ne possieda almeno uno, b) da un carbonio
adiacente a quello del gruppo uscente (quello con Cl). Solo il carbonio metilico a sinistra nella formula
possiede atomi di idrogeno. Quindi potremo avere un solo prodotto possibile:
H
-
Cl
Cl
SN2
CH2
O:
OH
+
-
H2C
7. Scrivi un alcool terziario avente formula C6H12O capace di reagire facilmente con Br2 per dare
C6H12Br2O.
L’alcol saturo con 6 atomi di carbonio dovrebbe avere 6x2 + 2 = 14 atomi di idrogeno. Poiché questo ne ha
12, deve possedere un anello o un doppio legame nella struttura. Dovendo reagire con Br2 l’ipotesi del ciclo
si può scartare e dovremo introdurre un doppio legame nella struttura. Per poter essere stabile, l’ossidrile non
deve trovarsi sul carbonio del legame pi greco, ma a debita distanza da esso (altrimenti si avrebbe un enolo
in stabile). Iniziamo a scrivere l’alcool terziario unendo tre carboni al carbonio alcolico:
Sono stati necessari quattro atomi di carbonio. Gli altri due potranno essere messi vari modi e
OH
serviranno per formare il doppio legame.
OH
OH
OH
OH
H2C
8. Scrivi i prodotti delle seguenti reazioni. L’alchene
Br
Br2
corrisponde a
Br
CH3
H /H2O
OH
OH
1. BH3 / THF
2. H2O2 / OH-
CH2
C
CH2
CH2
CH2
o
CH2
+
CH2
H2C
CH2
CH3
HBr
Br
COOH
K2Cr2O7 / H+
O
H+ / CH3CH2OH
CH3
HBr
(Markovnikov)
Br
9. Scrivi una sintesi adatta a ottenere il di-propiletere.
Trattandosi di un etere simmetrico si può eliminare l’acqua da due molecole di 1-propanolo tramite H2SO4 a
media temperatura (~ 130 °C): CH3CH2CH2O H HO CH2CH2CH3
CH3CH2CH2-O-CH2CH2CH3.
Non è proponibile l’addizione Markownikov del 1-propanolo al propene, poiché porterebbe all’isopropili-
OH
propil-etere:
H+
+
O
Pertanto l’unica alternativa è la sintesi di Williamson:
O
-
+
Br
H+
O
+
Br
-