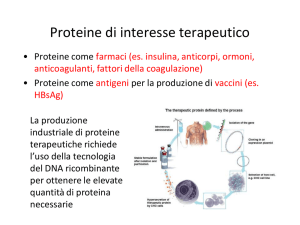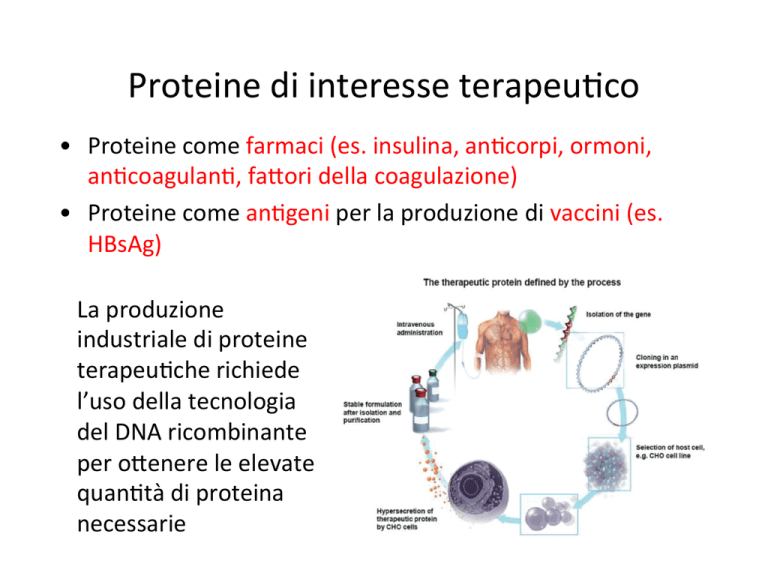
Proteine di interesse terapeu.co • Proteine come farmaci (es. insulina, an.corpi, ormoni, an.coagulan., fa8ori della coagulazione) • Proteine come an.geni per la produzione di vaccini (es. HBsAg) La produzione industriale di proteine terapeu.che richiede l’uso della tecnologia del DNA ricombinante per o8enere le elevate quan.tà di proteina necessarie Cara8eris.che dei sistemi di produzione di proteine terapeu.che Biosintesi dell’insulina nelle cellule β del pancreas Catena A 21 aa Catena B 30 aa ESONE 1 Unite da due pon. S-­‐S ESONE 2 PREPROINSULINA Pep.de segnale PROINSULINA C B A INSULINA Nell’apparato di Golgi un enzima rimuove 33 aa che cos.tuiscono il pep.de C L’insulina forma esameri stabilizza. dallo zinco PRODUZIONE DI INSULINA RICOMBINANTE IN BATTERI - Plasmidi separa. codificano per la catena A e B in ceppi di E. coli separa. -­‐ Le catene A e B sono prodo8e so8o il controllo del promotore lac come proteine di fusione con la regione N-­‐terminale di LacZ -­‐ Le sequenze LacZ sono eliminate con tra8amento con bromuro di cianogeno (scinde legami Met-­‐X) -­‐ Le catene A e B sono mescolate assieme e tramite un processo chimico in condizioni ossidan. si formano i pon. S-­‐S e viene purificata la forma na.va Produzione di insulina ricombinante nel lievito Saccharomyces cerevisiae (via della proinsulina) Pro-­‐insulina fusa al pep.de segnale dell’α-­‐factor per produrre insulina secreta. Processamento mediato dalla proteasi Kex2, mini-­‐pep.de C, catena B mancante di Thr30 (che viene aggiunta in un secondo momento mediante transpep.dazione). Espressione cos.tu.va so8o il controllo del promotore TPI (trioso-­‐
fosfato isomerasi) Schema del processo industriale di produzione dell’insulina ricombinante mediante la via della proinsulina. Analoghi dell’insulina approva. per l’uso come farmaci Proprietà farmacocine.che degli analoghi dell’insulina Eritropoie.na L’eritropoie.na (EPO) è un ormone che s.mola la produzione di globuli rossi. E’ una glicoproteina di 165 aa con 4 catene di carboidra. (3 N-­‐ e 1 O-­‐glicosilazione). La N-­‐glicosilazione è necessaria per la secrezione e la stabilità dell’EPO nel plasma. La O-­‐
glicosilazione non sembra avere influenza sull’aavità biologica dell’EPO. EPO ricombinante prodo8a in CHO e in lievito Produzione di eritropoietina umana in Pichia pastoris
Espressione sotto il controllo
del promotore AOX1, segnale di
secrezione α-factor, induzione
per 40 ore, resa 50 mg/L (12-13
copie del vettore integrate nel
genoma)
Harvested
Fermentation Broth
Centrifugation
Produzione di eritropoietina
umana in Pichia pastoris
Microfiltration
Ultrafiltration #1
Blue-dye Chromatography
Hydroxyapatite Chromatography
* Cation Exchange Chromatography #1
Ultrafiltration #2
PEGylation
Cation Exchange Chromatography #2
Ultrafiltration #3
Sterile Filtration
Final Product
*This step was only applied at scales larger than 40 liters
Stru8ura degli an.corpi In base al .po di catena pesante: IgG, IgE, IgD monomeriche IgA dimeriche IgM pentameriche Pon. disolfuro Glicosilazione Risposta immunitaria e organizzazione genica delle IgG An.corpi monoclonali Linee cellulari stabilizzate -­‐ linfoci. + cellule di mieloma HGPRT-­‐ in presenza di un agente di fusione -­‐ crescita su terreno seleavo HAT (ipoxan.na, aminopterina, .mina) -­‐ L’aminopterina è un an.bio.co che inibisce la sintesi de novo degli acidi nucleici. Ipoxan.na e .mina perme8ono di sopravvivere a cellule HGPRT+, che possono usare le vie di recupero HGPRT è un enzima della via di recupero delle purine. Produzione di an.corpi nel lievito Pichia pastoris Ceppo ingegnerizzato per produrre oligosaccaridi del .po Man5GlcNAc2 Espressione so8o il controllo del promotore AOX1 Resa 1.26 g/l dopo 146 ore di coltura con biomassa circa 400 g/l peso fresco di cellule (8.6 mg/l/ora) U.lizzo di an.corpi in terapia • Campi di applicazione clinica –
–
–
–
Malaae cardiovascolari Malaae infiammatorie e autoimmuni Immunosoppressione Neoplasie ematologiche ed epiteliali • Uso in terapia an.cancro: proprietà dell’an.gene bersaglio – Espressione stabile e omogenea nelle cellule tumorali, trascurabile in cellule sane – Elevata densità di espressione – Mancanza di forme circolan. – Capacità di aavare i processi di morte cellulare • An#corpi chimerici (80% umani): i domini costan. della molecola murina sono sta. sos.tui. con le loro rispeave contropar. umane prendendo le sequenze geniche della catena leggera k e della catena pesante delle IgG1, le Ig più efficien. ad aavare il complemento e la citotossicità delle cellule effe8rici • An#corpi umanizza# (95% umani): le CDR murine sono state inserite in an.corpi umani Murino Chimerico Umanizzato
An.corpi: come uccidono le cellule tumorali Azione dire6a • Citotossicità complemento-­‐
mediata quando proteine del complemento legano la Fc dell’an.corpo che si è legato alla cellula bersaglio, la cellula va incontro a lisi • Citotossicità cellulare an#corpo-­‐
dipendente la Fc dell’an.corpo legato alla cellula bersaglio è riconosciuta da suoi rece8ori su cellule effe8rici ed avviene lisi cellulo-­‐mediata o fagocitosi della cellula tumorale • Apoptosi Agisce in questo modo Rituximab Azione indire6a • Inibizione della crescita • Alterazioni del ciclo cellulare La trasduzione del segnale è inibita perché l’an.corpo si lega al rece8ore per un fa8ore di crescita sulla cellula tumorale in modo da bloccare il legame del ligando endogeno portando all’inibizione della fosforilazione di rece8ori .rosin-­‐chinasici e di even. di segnalazione a valle della cascata regola.va. Sfru8ano ques. meccanismi Trastuzumab e Bevacizumab Rituximab An.corpo chimerico dire8o dire8o contro CD20. E’ stato il primo an.corpo monoclonale ad avere successo nella terapia per il linfoma non-­‐Hodgkin e ad o8enere le licenza dalla FDA nel 1997. CD20 è una proteina trans-­‐membrana con le seguen. proprietà: • è espressa a livelli eleva. sul 95% delle cellule B affe8e da linfoma, ma non su altre cellule del corpo • è espressa sui linfoci. B sani ma non sui loro precursori immaturi (perme8endo la ricos.tuzione di un compar.mento di cellule B dopo la terapia) e sulle plasmacellule (perme8endo una produzione con.nua di immunoglobuline) • dopo il legame con l’ an.corpo non va in circolo nel plasma e non viene internalizzata • è essenziale per il differenziamento e la proliferazione dei linfoci. B L’aavazione del complemento è fondamentale nell’efficacia dell’an.corpo ma è molto importante anche l’induzione dell’apoptosi mediante influsso di calcio. Trastuzumab (Hercep.n) An.corpo IgG1 umanizzato dire8o contro HER2 • HER2 è un proto-­‐oncogene che codifica il rece8ore .rosin-­‐chinasico del fa8ore di crescita epidermico umano • Il rece8ore HER2 è una proteina transmembrana che si trova su numerosi tessu. epiteliali e che viene iper-­‐espressa nel 20-­‐30% dei casi di tumore al seno (>2 milioni di copie contro 20000-­‐50000 nelle cellule epiteliali normali). L’ iper-­‐espressione di solito è dovuta ad una amplificazione del gene • Trastuzumab lega con alta affinità HER2 ed induce l’internalizzazione del suo rece8ore e quindi il blocco della trasduzione del segnale • I tumori con iper-­‐espressione di HER2 vengono iden.fica. o mediante analisi immunoistochimica (posi.vità a HER2-­‐3) o con la FISH (evidenzia la presenza di amplificazione genica) • È stato il primo an.corpo monoclonale contro tumori solidi ad essere approvato dalla FDA. E’ riconosciuto come agente singolo nella terapia di seconda linea nei tumori al seno HER2+ metasta.ci Bevacizumab È un an.corpo monoclonale umanizzato che inibisce la segnalazione angiogenica legando VEGF in modo da prevenire la sua interazione con VEGFr1 e VEGFr2. Ha ricevuto l’ approvazione della FDA nel 2004 come tra8amento di prima linea per il cancro colore8ale metasta.zzato in associazione con 5-­‐FU • VEGF è un fa8ore di crescita proangiogenico che regola la proliferazione e la permeabilità vascolare ed è un fa8ore an.apopto.co per i nuovi vasi sanguigni • Agisce tramite due rece8ori, VEGFr1 e VEFGr2, che sono espressi sull’endotelio vascolare. La loro espressione in genere aumenta in risposta a ipossia, oncogeni e citochine. γ-­‐carbossilazione delle proteine La cascata della coagulazione del sangue • Disordini gene.ci della coagulazione: – emofilia A (fa8ore VIII) – emofilia B (fa8ore IX) • La World Federa.on of Haemophilia s.ma che nel mondo ci siano 400.000 emofiliaci. • La produzione dei fa8ori della coagulazione necessari per ques. pazien. a8raverso la tecnologia del DNA ricombinante perme8e di superare i problemi di contaminazioni virali che rendono meno sicuri i deriva. del plasma. Fa8ore VIII Il fa8ore VIII è una proteina di 2332 aa che ha una stru8ura a domini A1-­‐A2-­‐B-­‐A3-­‐C1-­‐C2. Il dominio B viene inizialmente rimosso e nel plasma il fa8ore VIII è associato al fa8ore di von Willebrandt (vWF), che lo stabilizza. Il dominio C2 è coinvolto nel legame a vWF e alle membrane. Fa8ore VIII ricombinante
• Espresso in cellule di mammifero BHK e CHO a livelli bassi: secrezione poco efficiente. Cos. molto eleva. (oltre 100.000 $/anno per paziente) • Produzione di fa8ore VIII ibrido uomo/maiale (sequenze FVIII di maiale in domini A1 e A3 aumentano livelli di espressione migliorando la velocità di secrezione) in un sistema len.virale so8o il controllo del promotore EF-­‐1α in cellule BHK • Livelli di espressione: 9 pg/cellula/giorno cioè circa 7.3 mg in 2.5 l raccolto dal giorno 3 al giorno 7 di coltura • Purificazione mediante cromatografia a scambio ca.onico su SulfoPropyl-­‐Sepharose: 4.9 mg di fa8ore VIII con elevata purezza Fa8ore VIII ricombinante
Espressione del Fa8ore IX in cellule CHO Fa8ore IX (415 aa) espresso in CHO a 180 µg/ml (forma aava solo 1.5 µg/ml). I livelli di espressione aumentano se viene co-­‐
espressa la furina (proteasi che rimuove un pep.de segnale necessario per la γ-­‐
carbossilazione). Approvato con il nome BeneFIX nel 1998. Fa8ore VIIa ricombinante
Il fa8ore VII è espresso in cellule BHK come proteina a singola catena. L’aavazione (proteolisi R152-­‐I153) è spontanea. Purificazione mediante cromatografia a scambio ionico, cromatografia di affinità su an.corpo monoclonale contro il dominio Gla e altre due cromatografie a scambio ionico. Il fa8ore VIIa è indicato nei pazien. con emofilia A o B che hanno sviluppato an.corpi inibitori contro i fa8ori VIII o IX. Nuovi approcci per aumentare l’emivita di
FVIII, FIX e FVIIa