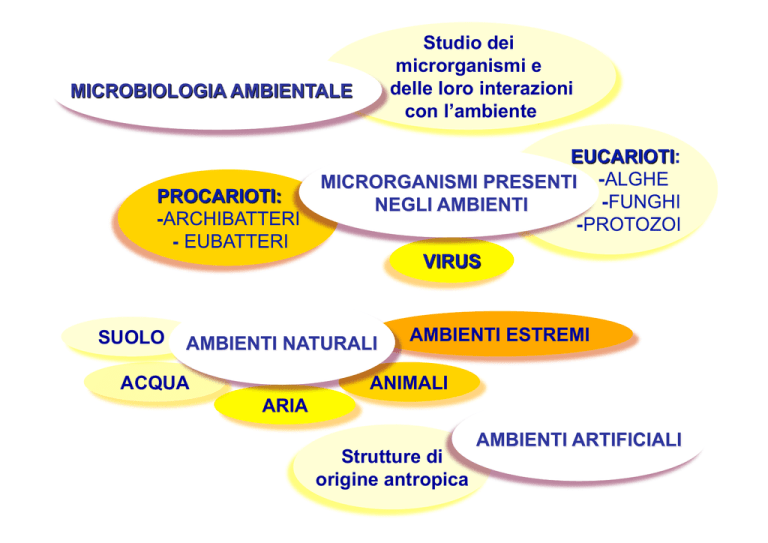
Studio dei
microrganismi e
delle loro interazioni
con l’ambiente
AMBIENTI ESTREMI
SUOLO
ACQUA
ANIMALI
ARIA
Strutture di
origine antropica
I microrganismi sono ovunque
• Nel suolo
• Ambienti acquatici
• Zone termali
• Nel ghiaccio
• In aree ad elevata salinità
• In acqua, i virus superano i batteri di 2-10:1
• Nelle profondità marine (origine della vita?)
I microrganismi vivono insieme
biofilms
• Nostoc commune
E con altri organismi
• Sulla superficie delle
radici delle piante
• Nei coralli
• Nei licheni
• Con erbivori e termiti
Ciclo degli elementi
Ciclo degli
elementi
Uso dei microrganismi
• Nelle tecnologie alimentari
• Biorisanamento
• Compostaggio
• Medicinali
• Insetticidi
I microrganismi possono essere modificati
• DNA ricombinante :
– Inserzione o modificazione di geni per la
produzione di proteine desiderate
ORIGINE DELLA
MICROBIOLOGIA AMBIENTALE
1800
Louis Pasteur
1800
Robert Koch
Mostrano una grande diversità
Hanno molteplici attività biochimiche che possono
provocare cambiamenti fisici e chimici nell’ambiente
Il comportamento dei microrganismi negli ambienti
naturali è diverso da quello mostrato in laboratorio
Gli ambienti naturali sono:
eterogenei
soggetti a continue fluttuazioni dei parametri chimicofisici
oligotrofici (=poveri di nutrienti)
Mineralizzazione:
tramite decomposizione di materiale organico o fungendo da
cibo per altri microrganismi chemioeterotrofi
Fonte di cibo per protozoi, nematodi e insetti
Modificazione di sostanze che in tal modo possono
essere usate da altri organismi
Cambiamento delle proporzioni tra forme solubili e gassose
dei materiali (Direttamente o modificando l’ambiente)
Produzione di composti che inibiscono l’attività microbica
o di piante e animali
Tra microrganismi
INTERAZIONI
Tra microrganismi e
macrorganismi
NEUTRALI
NEGATIVE
POSITIVE
NEUTRALISMO
COMMENSALISMO
0
0
0
+
SINERGISMO (cooperazione)
+
+
MUTUALISMO (simbiosi)
COMPETIZIONE
AMENSALISMO
+
0 / +
+
-
PREDAZIONE
+
-
PARASSITISMO
+
-
Esempio di competizione
• La stabilità della comunità microbica nell’ intestino
umano è attribuita alla competizione ed
antagonismo tra i suoi membri
– Competione per i nutrienti
– producono tossine per limitare la crescita di altri
microbi
Mutualismo con Eukarioti
• mychorrhizae: fungo
– Assistono la pianta
nell’assorbimento di elementi
minerali
– Mychorrizae prendono composti
organici dalla pianta
Mutualismo
• azotofissatori: fissano
azoto e lo rendono
disponibile per la
pianta
– Rhizobium,
microorganismo che si
trova nei noduli
radicali di molte
specie (leguminose)
Rhizobium in root
nodules
PARAMETRI
CHIMICO - FISICI
CARATTERISTICHE
MICROBICHE
Temperatura
Umidità
Salinità
Pressione idrostatica
pH
Concentrazione di O2
Radiazione solare
Nutrienti
Metabolismo
Morfologia:
- dimensioni
- capacità di adesione
alle superfici
Gli ambienti naturali sono MACROAMBIENTI
Ciascuno di essi è ETEROGENEO
Ogni macroambiente è formato da molti MICROAMBIENTI
Molti HABITAT
HABITAT
Insieme di proprietà fisiche, chimiche
e biologiche
che caratterizzano un ambiente
Distanza (mm)
Concentrazione di O2
all’interno di un granello
di suolo
Distanza (mm)
ESEMPIO DI GRADIENTE
PARTICELLA DI SUOLO
Regione
aerobica
Concentrazione
di O2
MICRORGANISMO
Regione
anaerobica con
solfuro
Concentrazion
e di solfuro
Microambiente specializzato per
MICRORGANISMI AEROBI ZOLFO
OSSIDANTI
Habitat microbici
• acquatici
– marini:
• le acque profonde sono habitat stabili
• Le aree di costa sono habitat altamente variabili
• Acque dolci:
– laghi
algae
• I processi di startificazione permettono il
rimescolamento satgionale degli habitat
• Aumento della concenrazione di O2 in profondità
paramecium
• Acqua corrente
– fiumi
• Generalmente habitat
aerobici per la corrente
che facilita la circolazione
di O2
• terrestri
– Microorganismi sono fondamentali nel suolo
• Composizione della comunità microbica dipende
dalle caratteristiche del suolo
• Suolo umido: condizioni anaerobiche dovute al
riempimento con acqua dei pori
Endospores
Negli ambienti naturali è raro trovare
singole popolazioni
E’ molto più frequente
trovare
COMUNITA’
MICROBICHE
CATENE
ALIMENTARI
SINTROFISMO
Composto organico
complesso
A
B
C
Composti inorganici
ECOSISTEMA
Complessità di interazioni
Comunità di microrganismi
e elementi abiotici
presenti in un dato
HABITAT
COMUNITA’
Insieme di popolazioni
interattive nello stesso
HABITAT
CONSORZIO
POPOLAZIONE
Insieme di cellule uguali che risiedono
nello stesso HABITAT (colonie)
INDIVIDUO
Sintesi di materiale organico da
CO2 (o composti a 1C) e composti
inorganici:
Decomposizione di materiale
organico accumulato:
→ PRINCIPALI PRODUTTORI
PRIMARI
AMBIENTE TERRESTRE
Piante
→ DECOMPOSITORI
→ CONSUMATORI
AMBIENTE ACQUATICO
Alghe
Batteri fototrofi
chemiolitotrofi
POSIZIONE DEI MICRORGANISMI NELLA PIRAMIDE
ECOLOGICA
Consumatori
terziari
CO2
Consumatori
secondari
CO2
Consumatori
primari
CO2
Flusso di
carbonio
Batteri e Funghi
Produttori primari
CO2 (Chemioeterotrofi)
(Fotoautotrofi,
Chemioautotrofi)
Acquisizione dei nutrienti nell’ecosistema
• 3 livelli principali:
– produtori
– consumatori
– decompositori
1. Produttori primari:
convertono CO2 in materia
organica
2. Consumatori
– eterotrofi
– utilizzano la materia
organica creata dai
produttori
3. Decompositori
– Eterotrofi
– utilizzano I resti dei
produttori primari e dei
consumatori
• detriti (materia organica
fresca o parzialmente
decomposta)
– Batteri e funghi sono attori
fondamentali nel processo
di decomposizione
CICLO
PRESENZA DI
COMPOSTI
GASSOSI
IMPORTANTI?
FORME PRINCIPALI E VALENZE
RIDOTTE
C
STATO DI
OSSIDAZIONE
INTERMEDIO
Si
CH4 (-4)
Si
NH4+, N
organico (-3)
N2
(0)
N 2O
(+1)
S
Si
H2S, gruppo SH
organico (-2)
S0
(0)
S2O32(+2)
Fe
Mn
No
“
N
Fe2+
Mn2+
OSSIDATE
CO (+2)
CO2 (+4)
NO2(+3)
SO32(+4)
NO3(+5)
SO42(+6)
Fe3+
Mn4+
FOTOSINTESI:
Alghe
Piante verdi
Cianobatteri
(CH2O)n
COMPOSTI ORGANICI
RESPIRAZIONE:
Piante
Animali
Microrganismi
Batteri chemiolitotrofi
Batteri
metano ossidanti
CO
CH4
Batteri
metanogeni
COMPOSTI
METILICI
(CO2)
Batteri
fototrofi
SEDIMENTAZIONE
COMPOSTI ORGANICI
(CH2O)n
AEROBIOSI
ANAEROBIOSI
RESPIRAZIONE
ANAEROBICA,
FERMENTAZIONE:
Microrganismi
anaerobi inclusi
batteri fototrofi
SUBSTRATI
TIPO CO2
Anidride carbonica _ CO2 (con elettroni
derivati da H2 o da alcuni alcol)
Formiato _ HCOOH
Monossido di carbonio _ CO
SUBSTRATI
METILICI
SUBSTRATO
ACETOCLASTICO
Metanolo _ CH3OH
Metilamina _ CH3NH3+
Dimetilamina _ (CH3)2NH2+
Trimetilamina _ (CH3)3NH+
Metilmercaptano _ CH3SH
Dimetilsolfuro _ (CH3)2S
Acetato _ CH3COOH
ossidato
ridotto
COENZIMA F420
METANOFURANO
COENZIMA M
(inibito da acido
bromoetansulfonico)
COENZIMA F430
METANOPTERINA342
HS-HTP (7-mercaptoeptanoiltreonina fosfato)
CO2
MF
O
MP
2H
MF-C-H
O
H 2O
Acido
bromoetansulfonico
CoM-SH
2H
HS-HTP
(CARBONIO
FORMILICO)
MP-C-H
F420 red
IDROGENASI
F420 ox
MP
CH2 (CARBONIO
2H METILENICO)
MP-CH3
H2
(CARBONIO
METILICO)
CoM-S-CH3
complesso METIL REDUTTASI- F430
CoM-S-S-HTP
CH4
(METANO)
GENERE
GRUPPO I:
Methanobacterium
Methanobrevibacter
MORFOLOGIA
REAZIONE
DI GRAM
H2 + CO2, formiato
29-61
H2 + CO2, formiato
27-31
+
H2 + CO2; riduce S0
33
Cocchi irregolari
-
H2 + CO2, formiato
29-34
Methanomicrobium
Bastoncelli corti
-
H2 + CO2, formiato
45-49
Methanogenium
Methanospirillum
Cocchi irregolari
Spirilli
-
H2 + CO2, formiato
H2 + CO2, formiato
51-61
46-50
Methanoplanus
Dischi appiattiti
con estremità
accuminate
-
H2 + CO2, formiato
38-47
Methanosphaera
Cocchi
+
Metanolo + H2
(entrambi necessari)
26
GRUPPO II:
Methanothermus
GRUPPO III:
Methanococcus
GRUPPO IV:
GRUPPO V:
Bastoncelli lunghi
+/-
Bastoncelli corti
+
Bastoncelli
SUBSTRATO PER LA
METANOGENESI
DNA
(mole % GC)
GENERE
GRUPPO VI:
MORFOLOGIA
REAZIONE
DI GRAM
SUBSTRATO PER LA
METANOGENESI
DNA
(mole % GC)
Methanosarcina
Larghi cocchi
Irregolari
Impacchettati
+
H2 + CO2, formiato,
metanolo, metilamina,
acetato
41-43
Methanolobus
Aggregati di
cocchi irregolari
Cocchi irregolari
-
Metanolo, metilamina
38-42
-
54-62
Methanococcoides
Methanohalophilus
Cocchi irregolari
-
H2 + CO2, alcol,
formiato
Metanolo, metilamina
Cocchi irregolari
-
41
Methanothrix
Filamenti di lunghi +
bastoncelli
Metanolo, metilamina,
metilsolfuri
Acetato
Methanoculleus
Methanosaeta
GRUPPO VII:
Methanopyrus
52-61
Filamenti di lunghi bastoncelli
Acetato
49
Catene di
bastoncelli
+
H2 + CO2; termofili
estremi, crescita a
110 °C
60
Cocchi irregolari
-
H2 + CO2, formiato,
alcol
48-52
GRUPPO VIII:
Methanocorpusculum
42
Methanobacterium
ceppo AZ
Methanospirillum
hungatii
Methanobrevibacter
ruminantium
Methanosarcina
barkeri
POLIMERI COMPLESSI:
cellulosa
altri polisaccaridi
proteine
BATTERI CELLULOSOLITICI
E IDROLITICI
MONOMERI:
zuccheri
aminoacidi
BATTERI FERMENTATIVI
H2 + CO2
ACETATO
BATTERI
ACETOGENI
ACETATO
BATTERI
METANOGENI
PROPIONATO, BUTIRRATO
BATTERI SINTROFICI
(Syntrophomonas, Syntrophobacter)
CHE OSSIDANO GLI ACIDI
GRASSI E PRODUCONO H2
H2
BATTERI
METANOGENI
BATTERI METANOGENI
CH4
+ CO2
ACETATO
RUMINANTI 200-400 litri/giorno
MINIERE DI CARBONE
RISAIE
PALUDI
FOSSE BIOLOGICHE
IMPIANTI DI TRATTAMENTO
DELLE ACQUE REFLUE
DISCARICHE
SUBSTRATI UTILIZZATI PER LA CRESCITA
Metano, CH4
Metanolo, CH3OH
Metilamina, CH3NH2
SUBSTRATI OSSIDATI, MA
NON UTILIZZATI PER LA
Dimetilamina, (CH3)2NH
CRESCITA (CO-METABOLISMO)
Trimetilamina, (CH3)3N
Tetrametilammonio, (CH3)4N+
Ammonio, NH4+
Trimetilamina N-ossido, (CH3)3NO
Etilene, H2C=CH2
+
Trimetilsulfonio, (CH3)3S
Clorometano, CH3Cl
Formiato, HCOO
Bromometano, CH3Br
Formamide, HCONH2
Idrocarburi a catena più
Monossido di carbonio, CO
lunga (etano, propano)
Dimetil etere, (CH3)2O
Dimetil carbonato, CH3OCOOCH3
METILOTROFI
OBBLIGATI
INCAPACI DI UTILIZZARE
COMPOSTI CON LEGAMI C-C
CAPACI DI UTILIZZARE
COMPOSTI CON LEGAMI C-C
FACOLTATIVI
Ciclo del ribulosio monofosfato (RuMP)
Ciclo della serina
Ciclo di Calvin
3-FORMALDEIDE
3 ESULOSIO-6-P
HCHO
CH2OH
H-C-OH
ESULOSIO-P
SINTASI
C=O
H-C-OH
3-RIBULOSIO-5-P
CH2OH
C=O
H-C-OH
H-C-OH
CH2–O-P
BIOSINTESI
CHO
H-C-OH
CH2O∼P
H-C-OH
CH2O∼P
ISOMERASI
CH2OH
ATP
C=O
HO-C-H
H-C-OH
H-C-OH
GLICERALDEIDE-3-P
CH2O∼P
3-FRUTTOSIO-6-P
3-FORMALDEIDE + ATP GLICERALDEIDE-3-P + ADP
IDROSSIPIRUVATO
SUBSTRATI a 1C
SERINA
HOCH2-CH-COOH
NH3
NH2
1 HCHO
METILENE
SERINA
TETRAIDROFOLATOTRANSIDROSSIMETILASI
FORMALDEIDE
RICICLO
H2N-CH2-COOH
GLICINA
O
NH3
NADH
NAD+
GLICERATO
FOSFOENOLPIRUVATO
HC-COOH
GLIOSSILATO
OH
1
O
Pi
O
HOOC-CH2-CH2-C-S-CoA
MALIL CoA
CO2
1
O
HOOC-C-CH2-COOH
OSSALACETATO
ATP
CH3-C-S-CoA
ACETIL CoA
BIOSINTESI
ATP
NADH
CoA
MALATO
NAD+
FORMALDEIDE + CO2 + CoA + 2NADH + 2H+ + 2ATP
ACETIL∼CoA + 2NAD+ + 2ADP + 2Pi +2H2O
METANOTROFI
CAPACI DI UTILIZZARE
METANO
AUTOTROFI
Calvin-Benson
Paracoccus denitrificans
Xanthobacter
% G+C 68-70
UTILIZZATORI
DI METANOLO
INCAPACI DI UTILIZZARE
METANO
Serina
Methylobacterium
Hyphomicrobium
% G+C 65-69
COMPOSTO
STATO DI OSSIDAZIONE
*N organico (R-NH2)
-3
*Ammoniaca (NH3)
-3
*Azoto gassoso (N2)
0
Ossido nitroso (N2O)
+1
Ossido di azoto (NO)
+2
*Nitrito (NO2-)
+3
Biossido di azoto (NO2)
+4
*Nitrato (NO3-)
+5
*COMPOSTI PIU’ DIFFUSI
IN NATURA:
NH3, NO3- si formano
nell’atmosfera per
processi chimici
NO3- uno dei più comuni accettori
alternativi di elettroni
NH3, NO2- i più comuni donatori di elettroni
Nitrato Riduzione
dissimilativa
NITRATO RIDUZIONE
ASSIMILATIVA
NO3Denitrificazione
Molti generi
Pseudomonas
denitrificans
N organico
NH3
Geobacter
Desulfovibrio
Clostridium
N2+N2O+NO
NITRIFICAZIONE
vera
Nitrobacter,
Nitrococcus
NO2-
N2fissazione
Molti generi
Azotobacter,Clostridium,
batteri fotosintetici
MINERALIZZAZIONE
O
AMMONIFICAZIONE
NH4+
Processo aerobio o anaerobio
anaerobio
aerobio
NITRIFICAZIONE
ossidazione dell’ammonio
Nitrosomonas,
Nitrosococcus
On the planetary scale the biogeochemical N cycle has
suffered major anthropogenic alterations in the last
decades shifting the priorities from boosting food
production to control large scale environmental
changes Half of the fixed nitrogen entering Earth
ecosystems is of mediated by humans, being produced
via the Haber-Bosch process and cultivation of nitrogen
fixing crops. Furthermore, reactive nitrogen is also
produced by fossil and bio-fuels combustion.
These inputs of reactive nitrogen might alter the
terrestrial and marine N cycles- whose fluxes have
been only recently partially clarified, as well as
interconnected biogeochemical cycles, such as those
related to carbon and phosphorus.
• In the absence of human perturbations, the
nitrogen cycle is the result of geological time-scale
abiotic processes including NH4+ production from
N2, combustion of N2 to nitrate, mineralization and
biologically driven metabolic reactions. The abiotic
production of fixed nitrogen, which is mainly due to
lightening discharge, is ten-fold lower than
microbial production. It has been postulated that
abiotic fixed nitrogen was limiting in the early
Earth, a condition that might have favored an early
appearance of microbial N2 fixation.
• In a simplified scenario the microbial driven nitrogen
cycle comprises three steps:
• i) the fixation of the highly inert atmospheric N2 to
ammonia (NH4+) trough one of the most energy
consuming reductive reactions mediated by nitrogenase;
• ii) the stepwise oxidation of ammonia to nitrite by
ammonia oxidizing bacteria and of nitrite to nitrate by
nitrite oxidizing bacteria.
• iii) the denitrification of nitrite and nitrate to gaseous
dinitrogen through anaerobic respiration in anoxic
environment - the so called complete denitrification - or
the detoxifying reduction of nitrite to NO in aerobic
environment (incomplete or nitrifier denitrification).
• Nevertheless, a complete picture of the microbial
nitrogen cycle must take into account other relevant
processes and the list of prokaryotic players in the
biogeochemical N fluxes is continuously increasing.
For example, nitrification can be carried out by widely
distributed Crenarchaea with a process different from
that performed by ammonia oxidizing bacteria.
• In recent years anaerobic ammonia oxidation
(ANAMMOX), the coupled oxidation of ammonia to the
reduction of nitrite has been disclosed and elucidated.
• Another specific contribution to the microbial cycle is
represented by ammonification, the respiratory
reduction of nitrate to ammonia mediated by several
obligate and facultative chemolitotrophic bacteria.
PERIPLASMA
HNO2 + 4H+
MEMBRANA
NH2OH
+ H 2O
AMO
HAO
2e-
4e-
Q
4e-
Cyt c
NH3 + O2 + 2H+
2OH-
Cyt c
2e-
Cyt aa3
AMMONIO
MONOOSSIGENASI
NH2OH + H2O
2H2O
2e-
2H+
AMO
CITOPLASMA
½ O2 + 2H+
H 2O
ADP + Pi
H+
ATP
H+
HAO IDROSSILAMINA
OSSIDOREDUTTASI
ATPasi
•
•
•
•
•
Nitrification, the stepwise oxidation of ammonia to nitrite (NO2-) via hydroxylamine
and the successive oxidation of NO2- to NO3- (nitrate) is a catabolic O2 dependent
process that evolved only after the oxygenation of the atmosphere and it is
considered as the last step of nitrogen cycle appeared on Earth. Such process,
enabling chemolithoautotrophic growth, is performed by different players of the
“nitrifying community” . The ammonia oxidizing bacteria (AOB) use ammonia as an
energy source for carbon assimilation by using two different enzymes,
i) the copper dependent ammonia monooxygenase (AMO) that converts NH4+ to
hydroxylamine
ii) hydroxylamine oxidoreductase (HAO) which transforms the latter compound to
nitrite with the collaboration of the ubiquinone pool and of the two cytochromes c554
and cM552
In spite of the long standing knowledge about the AOB and the widespread use of the
AMO and HAO coding genes as probes for nitrifier microbial communities surveys,
the genetic regulation of such process has been poorly understood.
Lack of knowledge about the denitrification process (“incomplete” or “nitrifier”
denitrification) carried out by many AOB such as Nitrosomonas europaea that
produces reactive nitrogen species and reduces nitrite availability for nitrite oxidizing
bacteria (NOB) catabolism.
PERIPLASMA
MEMBRANA
H2O + NO2-
CITOPLASMA
NO
2H+ + NO32e-
Cyt c
Biochimica dei
NITRITO OSSIDANTI
ancora non ben nota.
2e-
2H2O
2OH-
½ O2 + 2H+
Cyt aa3
H 2O
ADP + Pi
H+
ATP
H+
NO NITRITO OSSIDASI
ATPasi
• Nitrite oxidizers bacteria (NOB) catalyzes the second step of nitrification
and are so far restricted to four bacterial genera, Nitrobacter, Nitrospina,
Nitrococcus and Nitrospira. They belong to the Alpha-, Delta- and
Gammaproteobacteria and the deep-branching bacterial phylum
Nitrospirae .
• These microorganisms are able to catalyze the oxidation of nitrite in the
reaction NO2- + H2O → NO3- + 2H+ 2e- with the activity of nitrite nitrite
oxidoreductase (NXR) The NXR enzyme, a transmembrane associated
complex, is a heterodimer consisting of one α subunit and one β subunit,
encoded by encoded by NxrA and NxrB, respectively. The two genes are
duplicated in N. winogradskyi.
• NXR can catalyze also the reduction of nitrate to nitrite contributing to the
incomplete or nitrifier denitrification process..
• In the NOB metabolism nitrite functions as an electron donor for the
reduction of NAD and the generation of ATP by oxidative
phosphorylation.
Ampia distribuzione
nei suoli e nelle acque
Particolarmente numerosi in laghi, o corsi
d’acqua, dove si immetto norifiuti ed in genere dove c’è
estesa degradazione di materiale organico
Presenza di sistemi di membrane
intracellulari
Alcuni NITRIFICANTI
(AMMONIO OSSIDANTI) sono anche
METANO OSSIDANTI e
capaci di incorporare carbonio derivato
da CH4 in composti organici
Alcuni METANOTROFI sono anche
AMMONIO OSSIDANTI
Nitrificazione
avviene a pH
neutro o basico
Produzione di ACIDO NITRICO
Acidificazione dell’ambiente
A pH acido favorita la
formazione di ACIDO NITROSO
Blocco della nitrificazione
CLIMA
E’ la fonte principale di NO e N2O.
Recentemente misurati flussi significativi
di NO dal suolo all’atmosfera
E’ importante nel trattamento dei rifiuti
per rimuovere l’eccesso di nitrati e
favorire la rimozione di carbonio quando
l’aereazione è difficile
E’ importante nelle zone profonde
dei suoli e delle acque
NO è anche un segnale chimico in molte funzioni cellulari
Effettuata da
BATTERI
ETEROTROFI
ANAEROBI
FACOLTATIVI:
Pseudomonas spp.
Bacillus spp.
Thiobacillus denitrificans
Paracoccus denitrificans
Alcaligenes eutrophus
RIDUZIONE ASSIMILATIVA
(piante, funghi, batteri)
RIDUZIONE DISSIMILATIVA
(batteri)
NITRATO REDUTTASI nitrato (NO -)
3
ASSIMILATIVA:
inibita da NH3
nitrito (NO2-)
NITRITO REDUTTASI
ASSIMILATIVA:
inibita da NH3
(NH2OH) idrossilamina
NITRATO REDUTTASI
DISSIMILATIVA:
derepressa da anossia
(NH3) ammoniaca.
Riduzione dissimilativa ad
ammoniaca: alcuni batteri
NITRITO REDUTTASI
DISSIMILATIVA:
derepressa da anossia
(NO) ossido nitrico atmosfera
OSSIDO NITRICO REDUTTASI:
derepressa da anossia
(NH3) ammoniaca
(R-NH2) N organico
(N2O) ossido nitroso atmosfera
OSSIDO NITROSO REDUTTASI:
derepressa da anossia,
inibita da acetilene
(N2) azoto atmosfera
NO3- NO2-
NO
N2O
N2
NO2-
NO
N2O
N2
PERIPLASMA
Nos
Nir
Nor
Nar
NO3
-
NO2-
MEMBRANA
CITOPLASMA
Nar = Nitrato reduttasi
Nor = Ossido nitrico reduttasi
Km molto bassa e alta Vmax
Nir = Nitrito reduttasi
Nos = Ossido nitroso reduttasi
The denitrification process, the dissimilatory reduction of nitrate and nitrite to gaseous
nitrogen, proceeds stepwise following the reactions NO3- → NO2- → NO → N2O → N2 and
is an anaerobic or microaerophilic process performed by denitrifying (facultative)
heterotrophic soil and water bacteria using organic carbon source and nitrate as electron
acceptor.
Such process is one of the major source of nitric and nitrous oxide emissions to the
atmosphere and is one of main route of nitrogen resupply in the atmosphere. Denitrification
is performed by a set of nitrogen oxide reductase in a quite complex pathway involving
stepwisely genes encoding for nitrate respiration (nar genes), nitrite respiration (nir), NO
respiration (nor), and N2O respiration (nos). Such genes are assembled in cluster in several
long-time characterized denitrifying bacteria such as Pseudomonas aeruginosa, and
Paracoccus denitrificans.
From an evolutionary perspective it is interesting to analyze the emergence of the enzymes
in the pathway: whilst MO dependent membrane or periplasmic nitrate reductase (NAR)
were likely around during the Archaean, the copper dependent NOS was not, since the
unavailability of copper. Copper dependent NOS, present in all extant denitrifiers was
therefore: i) preceded by a non-copper enzyme that has been lost (or not yet identified) in
extant microorganism, ii) evolved from a non copper NOS, or iii) originated de novo
following the atmosphere oxygenation and was laterally transferred in many prokaryotes
thereby closing the denitrification process.
E’ stato dimostrato che
la NITRITO REDUTTASI
produce
principalmente NO
Sono stati ottenuti
mutanti difettivi
nella NITRITO
REDUTTASI (Nir-)
che sono capaci
di ridurre NO
a N2 O
E’ stata isolata e
caratterizzata
la REDUTTASI
DELL’OSSIDO NITRICO
NO è intermedio obbligato
nella respirazione dei NITRATI
Doppi mutanti
Nir-, Nor- sono vitali
Sono stati ottenuti mutanti
difettivi nella REDUTTASI
DELL’OSSIDO NITRICO (Nor-)
che accumulano NO
(LETALI CONDIZIONALI)
• Ammonification
• The ammonification process is the dissimilatory electrogenic
reduction of nitrate to ammonia via formate or H2 in oxygen
limited conditions.
• Such process is catalyzed by penthane cytochrome c nitrite
reductase complex (NrfABCD/NrfAH) and is present in many
facultative and obligate chemolithotrophic proteobacteria.
• Interestingly since this process does not require oxygen and
needs iron (eventually present in the Archaean) it is proposed
that such metabolic pathway evolved very early and was
responsible for fixed nitrogen resupply from abiotic formed
NO2- before the advent of N2 fixation.
Recentemente è stato scoperto un altro processo biologico di
Denitrificazione che comporta anche
l’ossidazione anaerobica dell’ammonio
NO3-
ANAMMOX
N organico
NH3
N2
NH4+
+N2O+NO
NO2-
ANAMMOX
NO2- + NH4 +
N2 + 2H2O
Il processo è stato scoperto studiando un impianto
pilota di depurazione con Denitrificazione
Un procedimento di arricchimento in terreno sintetico
contenente NO2- ed NH4 + ha consentito di ottenere
una comunità adesa (biofilm).
Sembra che uno dei componenti dominanti sia capace
di effettuare l’ossidazione anaerobica dell’ammonio.
Questo componente appartiene all’ordine delle
Planctomycetales
•
ANAMMOX
•
The recent discovery of anaerobic ammonia oxidation has been regarded
as one of main advancement in the comprehension of nitrogen cycle. The
microorganism with this metabolic pathway (anaerobic ammonia oxidizing
bacteria ANAOB) are able to couple nitrification (oxidation of ammonia) and
denitrification (until N2 production) in anaerobic environments and belongs
to the monophyletic group Brocadiales of the division Planctomycetales.
Although the exact enzymology and genetic inventory of such process are
still unsettled, much efforts has been devoted to clarify them, including the
sequencing of the ANAOB biofilm forming Kuenenia stuttgartiensis.
So far the ANMMOX process is thought to involve hydrazine (N2H4) and
hydroxylamine (NH2OH) as intermediates and that the bacteria oxidize
hydrazine to dinitrogen gas with a hydroxylamine-oxidoreductase- like
protein (HZO) that is a functional analog of HAO of nitrifying bacteria. The
importance of ANAMMOX in the global nitrogen cycle is striking and its
evolutionary origin intriguing. It is in fact proposed that ANAMMOX evolved
soon after the incomplete denitrification pathway (in absence of the copper
dependent NOS) and provided the first metabolic pathway to resupply the
atmospheric N2 pool and performed this role until the evolutionary origin of
the full denitrification pathway.
•
Ossidi di azoto atmosferici
Fertilizzanti industriali
Fissazione biologica
85%
Azoto fissazione è il fattore
principale che determina la
produttività nelle zone agricole
e forestali
60%
Terra
40%
Oceani
ALCUNI AZOTO FISSATORI LIBERI ANAEROBI
FOTOTROFI
LITOTROFI
ORGANOTROFI
Methanosarcina
BATTERI:
BATTERI:
Methanococcus
Chromatium
Clostridium spp.
(Archea)
Chlorobium
Desulfovibrio
Rhodospirillum
Desulfotomaculum
Rhodopseudomonas
Rhodomicrobium
Rhodobacter
Heliobacterium
AEROBI
BATTERI:
Azotobacter spp.
Klebsiella
Beijerinckia
Bacillus polymyxa
Mycobacterium flavum
Azospirillum lipoferum
Citrobacter freundii
METILOTROFI (alcuni)
CIANOBATTERI
(alcuni)
Alcaligenes
Thiobacillus
(alcune specie)
ALCUNI AZOTO-FISSATORI SIMBIONTI
PIANTE LEGUMINOSE
PIANTE
NON LEGUMINOSE
Soia, pisello, trifoglio, carrubo,
etc., associate a batteri
Alnus, Myrica, Ceanothus,
del genere Rhizobium o Comptonia, Casuarina; associate
Bradyrhizobium
ad attinomiceti del genere Frankia
LEGUMI (pisello, fagiolo,
soia, cece, arachide)
Rhizobium
Cibo e derivati
LEGUMI FORAGGERI
(erba medica, trifoglio)
Rhizobium
Fertilizzanti
LEGUMI DA PASCOLO
(trifoglio, veccia)
Rhizobium
Ripristino dei
pascoli
CESPUGLI LEGUMINOSI,
PIANTE FIORITE (lupino,
pisello odoroso, etc…)
Rhizobium
Orticoltura e
giardinaggio
Azolla
Anabaena
Fertilizzanti
ONTANO
Frankia
Riforestazione
Noduli
Eterocisti
Gomme
Guaine radicali
Membrane interne
Cambiamento di
conformazione
dell’enzima
Aumento dell’attività
respiratoria
Presenza di commensali
non fissatori
Eterocisti
ESEMPI DI GOMME
Derxia
Beijerinckia
Fe-proteina (64 KDa)
4 Fe
MoFe-proteina (220 KDa)
2 Mo + 28-32 Fe
Azotobacter chroococcum NITROGENASI ALTERNATIVE
MoFe-NITROGENASI
Va-NITROGENASI
Acetilene
Etilene
HC CH + 2H+ + 2eEtilene
Etano
H2C=CH2
H3C-CH3
H2C=CH2
FERREDOSSINA
RIDOTTA
FOTOSINTESI
Cianobatteri
RESPIRAZIONE
Aerobi
FERMENTAZIONE
Anaerobi
MECCANISMO D’AZIONE DELLA NITROGENASI
Ferredossina ossidata
Fe proteina ridotta
Ferredossina
2e-
ridotta
Fe proteina ossidata
4MgATP
4MgADP
Fe proteina ridotta•4MgATP
Fe proteina ossidata•4MgATP
2ePi
MoFe proteina ossidata
HN=NH
H2N-NH2
2NH3
2e-
MoFe proteina ridotta
2H
N2
HN=NH
H2N-NH2
RIDUZIONE
DELL’AZOTO
2NH3
ENZIMA
N2
2e-, 2H+
ENZIMA •H2N-NH2
ENZIMA •N
2e-, 2H+
2e-, 2H+
ENZIMA •HN=NH
N
VIA ASSIMILATIVA DELL’AMMONIO
IN ASSENZA DI AZOTO-FISSAZIONE
NH4+
NAD(P)H
Aminoacidi
α-chetoglutarato
GLUTAMICO
DEIDROGENASI
TRANSAMINASI
NAD(P)Glutamato
H2 O
α-chetoacidi
IN PRESENZA DI AZOTO-FISSAZIONE
NH3
ATP
ADP + Pi
glutamato
NADPFdOSSIDATA
Glutamato
NADPH
FdRIDOTTA
Glutamina
α-chetoacidi
O
R-C-COOH
NH2
α-chetoglutarato
R-CH-COOH
Aminoacidi
INIBIZIONE A
FEED-BACK
alta
[NH4+]
ADENIL-TRANSFERASI + PII
♦ Adenilazione
di residui di Tyr
♦ ♦♦
♦ ♦♦
INIBIZIONE DA
ADENILAZIONE
bassa
[NH4+]
ADENIL-TRANSFERASI + PII-U
Deadenilazione
di residui di Tyr
Nelle Rhizobiacee esistono
due forme di GS
GS I caratteristiche
simili a GS Klebsiella,
TERMOSTABILE
GS II 8 subunità, TERMOLABILE,
non regolata a livello
post-traduzionale
Forse GS II è importante
nell’interazione
batterio-pianta
Rhizobium
ATTINORRIZE: NODULI DI TIPO “A ONTANO”
INDOTTI DA Frankia





![5\) batteri [modalità compatibilità]](http://s1.studylibit.com/store/data/000928299_1-28a224c15810efb654d8d9e4b207aa31-300x300.png)





