Rivista Italiana di Genetica e Immunologia Pediatrica - Italian Journal of Genetic and Pediatric Immunology
Anno III numero 3 - luglio 2011 | direttore scientifico: Carmelo Salpietro - direttore responsabile: Giuseppe Micali
Terapia antibiotica nelle infezioni respiratorie
Maria Teresa Garozzo, Maria Papale, Valentina Costanzo Salvatore Leonardi e Mario La Rosa
Dipartimento di Pediatria UO Broncopneumologia, Allergologia e Fibrosi Cistica, Università degli Studi di Catania
Introduzione
Gli antibiotici sono i farmaci più comunemente prescritti in età pediatrica (1). Essi
vengono frequentemente impiegati nel trattamento delle infezioni respiratorie, molto
comuni nei bambini (2). In genere l’approccio terapeutico è su base empirica, in
relazione all’anamnesi del paziente, alla localizzazione dell’infezione e all’esistenza
di fattori di rischio, oltre che alle caratteristiche del farmaco. Recentemente è emersa
la preoccupazione per l’eccessivo impiego di antibiotici nel mondo che induce, oltre
ad uno spreco di risorse, alla selezione, alla crescita e alla diffusione di ceppi
resistenti. Inoltre si è registrata negli ultimi anni una riduzione nella prescrizione di
penicilline, poco costose e a spettro limitato, contro un incremento nella prescrizione
di macrolidi e antibiotici a largo spettro, quali le cefalosporine, più costosi e
responsabili dello sviluppo di nuove resistenze (1). I “nuovi ceppi” hanno colonizzato
le vie aeree, rendendo le infezioni respiratorie più difficili da trattare. È dunque
necessario che il clinico conosca le principali linee guida e raccomandazioni sul
trattamento delle infezioni respiratorie, in modo da evitare l’utilizzo inappropriato di
antibiotici, senza esporre il bambino alle complicanze della malattia (2). Inoltre la
conoscenza di alcuni dati relativi al farmaco (caratteristiche farmacocinetiche,
farmacodinamiche e tipo d’azione) e all’agente patogeno (profilo di resistenza locale)
aiuta il clinico nella scelta e nella gestione del trattamento (3). In questo capitolo
tratteremo le principali indicazioni terapeutiche nelle infezioni delle vie aeree
superiori ed inferiori, le principali caratteristiche farmacologiche degli antibiotici usati
e il profilo di resistenza dei patogeni sospetti.
Le infezioni respiratorie
Le infezioni respiratorie costituiscono un’importante causa di morbilità in tutte le
fasce d’età, specialmente in età pediatrica (4). Dai dati nazionali risulta inoltre che le
infezioni delle vie respiratorie siano responsabili dei 2/3 circa delle prescrizioni
farmaceutiche (5). Da un punto di vista topografico le infezioni delle vie respiratorie
vengono distinte in infezioni delle alte vie aeree e infezioni delle basse vie aeree.
Infezioni delle alte vie aeree
• Otite media acuta
L’otite media acuta (OMA) ha un gravoso impatto epidemiologico: si stima che il
75% dei bambini con età inferiore ai tre anni vada incontro ad almeno un episodio
(6) e che in Italia l’incidenza nei primi 5 anni di età sia di oltre 1 milione di casi annui
(7). Purtroppo non c’è consenso tra le opinioni scientifiche circa la condotta da
adottare in caso di otiti medie acute nel bambino (8) ed il numero di studi condotti è
esiguo, se confrontato con l’elevata incidenza della patologia (9). Inoltre non
disponiamo di linee giuda nazionali e, tra le regioni italiane, solo l’Emilia Romagna
ha sviluppato un “Pacchetto informativo sui farmaci” in merito al trattamento
dell’OMA in età pediatrica. Nonostante ciò dai dati di cui disponiamo risulta chiaro
che, a meno che il bambino non abbia meno di 6 mesi di età, otorrea o patologie
croniche severe, la strategia più conveniente in caso di OMA sia quella del “wait and
see”, ossia della vigile attesa. Una revisione sistematica Cochrane, che confrontava
l’efficacia del trattamento antibiotico rispetto al placebo, ha infatti dimostrato che
l’antibiotico non accelera la scomparsa del dolore (nel 65% dei bambini sia del
gruppo placebo che del gruppo controllo l’otalgia scompariva 24 h dopo il suo
esordio) e che l’insorgenza di complicanze (perforazione, mastoidite, otite media
ricorrente o con effusione) non è aumentata nei soggetti non trattati. Inoltre
l’astensione dall’impiego immediato di antibiotici riduce il rischio di vomito, rash
cutaneo e diarrea del 6%. Andrebbe quindi procrastinata la decisione di
somministrare una terapia antibiotica fino a 48-72 h, al termine delle quali, in caso di
peggioramento o persistenza dei sintomi, andrebbe somministrato l’antibiotico (10).
Nelle 48-72 h di attesa il pediatra deve prescrivere una terapia analgesica con
paracetamolo o ibuprofene, informando adeguatamente i genitori sulla patologia e
sulle ragioni di una strategia d’attesa (11). Non vi è alcuna indicazione all’impiego di
decongestionanti, antistaminici o mucolitici. È indubbio che una terapia antibiotica
precoce accorci il decorso della malattia e prevenga l’insorgenza di complicanze, ma
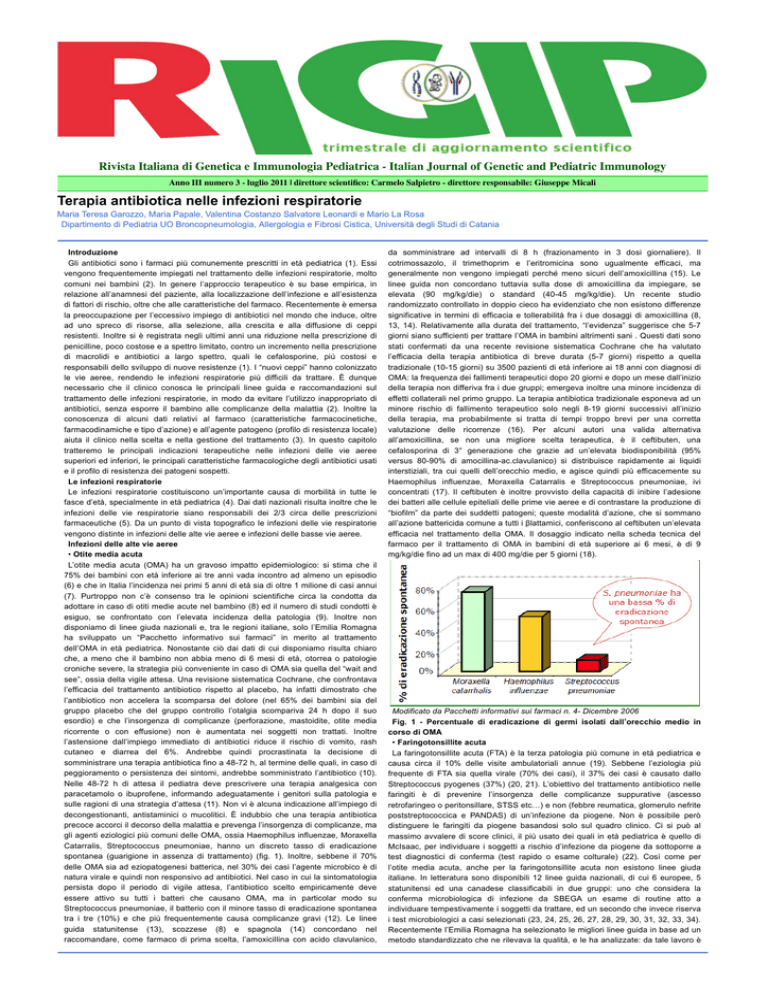
gli agenti eziologici più comuni delle OMA, ossia Haemophilus influenzae, Moraxella
Catarralis, Streptococcus pneumoniae, hanno un discreto tasso di eradicazione
spontanea (guarigione in assenza di trattamento) (fig. 1). Inoltre, sebbene il 70%
delle OMA sia ad eziopatogenesi batterica, nel 30% dei casi l’agente microbico è di
natura virale e quindi non responsivo ad antibiotici. Nel caso in cui la sintomatologia
persista dopo il periodo di vigile attesa, l’antibiotico scelto empiricamente deve
essere attivo su tutti i batteri che causano OMA, ma in particolar modo su
Streptococcus pneumoniae, il batterio con il minore tasso di eradicazione spontanea
tra i tre (10%) e che più frequentemente causa complicanze gravi (12). Le linee
guida statunitense (13), scozzese (8) e spagnola (14) concordano nel
raccomandare, come farmaco di prima scelta, l’amoxicillina con acido clavulanico,
da somministrare ad intervalli di 8 h (frazionamento in 3 dosi giornaliere). Il
cotrimossazolo, il trimethoprim e l’eritromicina sono ugualmente efficaci, ma
generalmente non vengono impiegati perché meno sicuri dell’amoxicillina (15). Le
linee guida non concordano tuttavia sulla dose di amoxicillina da impiegare, se
elevata (90 mg/kg/die) o standard (40-45 mg/kg/die). Un recente studio
randomizzato controllato in doppio cieco ha evidenziato che non esistono differenze
significative in termini di efficacia e tollerabilità fra i due dosaggi di amoxicillina (8,
13, 14). Relativamente alla durata del trattamento, “l’evidenza” suggerisce che 5-7
giorni siano sufficienti per trattare l’OMA in bambini altrimenti sani . Questi dati sono
stati confermati da una recente revisione sistematica Cochrane che ha valutato
l’efficacia della terapia antibiotica di breve durata (5-7 giorni) rispetto a quella
tradizionale (10-15 giorni) su 3500 pazienti di età inferiore ai 18 anni con diagnosi di
OMA: la frequenza dei fallimenti terapeutici dopo 20 giorni e dopo un mese dall’inizio
della terapia non differiva fra i due gruppi; emergeva inoltre una minore incidenza di
effetti collaterali nel primo gruppo. La terapia antibiotica tradizionale esponeva ad un
minore rischio di fallimento terapeutico solo negli 8-19 giorni successivi all’inizio
della terapia, ma probabilmente si tratta di tempi troppo brevi per una corretta
valutazione delle ricorrenze (16). Per alcuni autori una valida alternativa
all’amoxicillina, se non una migliore scelta terapeutica, è il ceftibuten, una
cefalosporina di 3° generazione che grazie ad un’elevata biodisponibilità (95%
versus 80-90% di amocillina-ac.clavulanico) si distribuisce rapidamente ai liquidi
interstiziali, tra cui quelli dell’orecchio medio, e agisce quindi più efficacemente su
Haemophilus influenzae, Moraxella Catarralis e Streptococcus pneumoniae, ivi
concentrati (17). Il ceftibuten è inoltre provvisto della capacità di inibire l’adesione
dei batteri alle cellule epiteliali delle prime vie aeree e di contrastare la produzione di
“biofilm” da parte dei suddetti patogeni; queste modalità d’azione, che si sommano
all’azione battericida comune a tutti i βlattamici, conferiscono al ceftibuten un’elevata
efficacia nel trattamento della OMA. Il dosaggio indicato nella scheda tecnica del
farmaco per il trattamento di OMA in bambini di età superiore ai 6 mesi, è di 9
mg/kg/die fino ad un max di 400 mg/die per 5 giorni (18).
Modificato da Pacchetti informativi sui farmaci n. 4- Dicembre 2006
Fig. 1 - Percentuale di eradicazione di germi isolati dall’orecchio medio in
corso di OMA
• Faringotonsillite acuta
La faringotonsillite acuta (FTA) è la terza patologia più comune in età pediatrica e
causa circa il 10% delle visite ambulatoriali annue (19). Sebbene l’eziologia più
frequente di FTA sia quella virale (70% dei casi), il 37% dei casi è causato dallo
Streptococcus pyogenes (37%) (20, 21). L’obiettivo del trattamento antibiotico nelle
faringiti è di prevenire l’insorgenza delle complicanze suppurative (ascesso
retrofaringeo o peritonsillare, STSS etc…) e non (febbre reumatica, glomerulo nefrite
poststreptococcica e PANDAS) di un’infezione da piogene. Non è possibile però
distinguere le faringiti da piogene basandosi solo sul quadro clinico. Ci si può al
massimo avvalere di score clinici, il più usato dei quali in età pediatrica è quello di
McIsaac, per individuare i soggetti a rischio d’infezione da piogene da sottoporre a
test diagnostici di conferma (test rapido o esame colturale) (22). Così come per
l’otite media acuta, anche per la faringotonsillite acuta non esistono linee giuda
italiane. In letteratura sono disponibili 12 linee guida nazionali, di cui 6 europee, 5
statunitensi ed una canadese classificabili in due gruppi: uno che considera la
conferma microbiologica di infezione da SBEGA un esame di routine atto a
individuare tempestivamente i soggetti da trattare, ed un secondo che invece riserva
i test microbiologici a casi selezionati (23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34).
Recentemente l’Emilia Romagna ha selezionato le migliori linee guida in base ad un
metodo standardizzato che ne rilevava la qualità, e le ha analizzate: da tale lavoro è
emerso che la terapia antibiotica in età pediatrica va riservata ai bambini con “mal di
gola” in cui il sospetto sia supportato da uno score clinico suggestivo (score di
McIsaac > 2) e da un test rapido positivo e/o da un esame colturale positivo (35). I
vantaggi del test rapido rispetto all’esame colturale sono numerosi: la rapidità di
inquadramento diagnostico, la qualificazione dell’ambulatorio del pediatra, la
riduzione dei disagi per la famiglia del paziente e il risparmio di risorse economiche. I
test rapidi presentano tuttavia una sensibilità inferiore all’esame colturale (95%
versus 100%). Lo score di McIsaac viene calcolato valutando i seguenti segni nel
bambino in esame: febbre (T > 38 °C), assenza di tosse, tumefazione dei linfonodi
cervicali anteriori, ipertrofia o essudazione delle tonsille, età < 15 anni. Per score < 2
non è consigliato alcun test di laboratorio quindi alcun trattamento antibiotico, per
score ≥ 2 è sempre consigliabile il ricorso a test diagnostici (test rapido o esame
colturale) prima di iniziare il trattamento antibiotico, per score ≥ 4 il ricorso ai test
diagnostici è facoltativo ed il trattamento antibiotico può essere effettuato in prima
istanza (22) (Fig. 2). Il fatto di procrastinare il trattamento antibiotico, in attesa della
conferma microbiologica, è ragionevole in quanto:
• per prevenire le complicanze dell’infezione piogena è sufficiente iniziare la terapia
antibiotica entro 9 giorni dall’esordio della sintomatologia (36) ;
• le faringotonsilliti streptococciche sono destinate a guarire da sole dopo 3-4 giorni
dall’esordio (37) ;
• la terapia antibiotica ha, sulla sintomatologia acuta, un beneficio relativo,
accorciando la durata dei sintomi di sole 16 h (38).
Sebbene tutte le linee guida concordino nel raccomandare la penicillina V (45
mg/kg/die in 3 somministrazioni giornaliere) come trattamento di prima scelta nelle
faringiti streptococciche, recenti RCT hanno confermato la più elevata efficacia
dell’amoxicillina (50 mg/kg/die in 2 somministrazioni giornaliere) sia in termini di
guarigione clinica che batteriologica (39, 40). Ad oggi tutte le linee guida concordano
nell’affermare che il trattamento della faringite streptococcica debba avere una
durata di almeno 10 giorni per eradicare il batterio. Un recente RCT che confrontava
il regime terapeutico classico (10 giorni, con penicillina V) con un regime terapeutico
breve (6 giorni con amoxicillina) ha però evidenziato una equivalenza in termini di
eradicazione, percentuale di ricadute ed effetti collaterali nei due trattamenti. Il
trattamento breve ha inoltre una maggiore percentuale di adesione alla terapia (41).
La compliance al trattamento antibiotico dipende infatti da diversi fattori: tollerabilità,
durata del trattamento, numero di somministrazioni giornaliere, palatabilità e via di
somministrazione (42). Nonostante i dati riportati sull’incremento dei fallimenti
terapeutici con penicilline, esse rimangono il trattamento di scelta nelle faringiti
streptococciche. Probabilmente una buona percentuale di fallimenti terapeutici è
ascrivibile alla mancata individuazione del portatore cronico (45). Nei pazienti
allergici alle penicilline è raccomandato l’uso di eritromicina (46). Secondo alcuni
autori il macrolide da impiegare nel trattamento delle faringiti streptococciche è
invece la claritromicina, in quanto si distribuisce più facilmente ai tessuti corporei,
quindi anche alle tonsille, grazie ad un migliore profilo farmacocinetico. Da uno
studio effettuato dal Gaslini di Genova e dal Dipartimento di malattie infettive di
Verona è emerso però che in Italia la resistenza di S.pyogenes ai macrolidi è del 38,
5%. Dato che le alternative terapeutiche nei soggetti allergici alle penicilline sono
esigue, l’uso dei macrolidi viene ancora raccomandato, se parsimonioso ed
associato alla sorveglianza della eritromicino-resistenza. Può essere utile in tal
senso determinare “in vitro” i fenotipi di S. pyogenes eritromicino-resistenti,
specialmente nelle zone in cui i macrolidi vengono più frequentemente prescritti (47).
Le cefalosporine andrebbero riservate ai casi in cui il macrolide non venga tollerato;
l’eritromicina infatti può indurre in età pediatrica effetti collaterali gastrointestinali
(46). L’impiego delle cefalosporine in caso di allergia alle penicilline può essere però
contestabile in quanto è possibile che si verifichi una reazione crociata alle
cefalosporine. Secondo alcuni autori le cefalosporine di terza generazione hanno
un’efficacia maggiore rispetto ad amoxicillina ed acido clavulanico nel trattamento
della faringite da SBEGA (48, 49). Inoltre, secondo tali autori, la compliance al
trattamento con cefalosporine di 3° generazione è maggiore che con amoxicillina ed
ac. clavulanico, in quanto le cefalosporine di 3° generazione hanno una migliore
palatabilità e tollerabilità e devono essere somministrate per un periodo di tempo più
breve (5-6 giorni versus 10 giorni di amoxicillina e acido clavulanico) (50, 51).
Tuttavia nessuna linea guida raccomanda le cefalosporine come terapia di prima
scelta della faringite da SBEGA, dato il più alto costo rispetto ad amoxicillina e
penicillina ed il rischio di diffondere ceppi resistenti. Il loro uso andrebbe quindi
limitato, oltre che ai casi di allergia alle penicilline (in cui rappresentano una valida
alternativa ai macrolidi), anche ai casi di faringiti ricorrenti: l’efficacia delle
cefalosporine in termini di eradicazione è infatti elevata. Per Hayes et al. tra le
cefalosporine sono indicate solo quelle di prima generazione (cefalexina o cfadroxil
in due somministrazioni giornaliere) : tali agenti antimicrobici hanno infatti uno
spettro più ristretto e sono meno costosi rispetto alle cefalosporine di seconda e
terza generazione (46).
Fig 2 - Condotta terapeutica in base allo score clinico di McIsaac
• Sinusite acuta
Con sinusite si intende la flogosi purulenta di uno o più seni paranasali da sovra
infezione batterica, che si instaura nel corso di un’infezione virale nasale e non si
risolve con la risoluzione del processo rinitico iniziale. Si stima che la prevalenza di
sinusiti nella popolazione pediatrica sia del 5-10%; probabilmente le percentuali
sono anche più alte se si considera che molte sinusiti passano inosservate perché la
rinite viene trattata tempestivamente con terapia antibiotica, prima che l’infezione
sinusale si manifesti (52). Il principio fondamentale nel trattamento delle sinusiti
acute in età pediatrica è la selezione dei pazienti che realmente necessitano di un
trattamento antibiotico. Gli antibiotici vengono infatti frequentemente impiegati,
senza alcuna efficacia, nelle sinusiti ad eziopatogenesi virale, che costituiscono la
gran parte delle sinusiti: l’eziologia è batterica solo nello 0, 5-2% dei casi (53). Il
pediatra deve sospettare che il comune “raffreddore” abbia provocato una
rinosinusite tramite criteri clinici ed anamnestici: rinorrea purulenta e tosse con
esacerbazione notturna da almeno 10 giorni; raffreddore che si associa a febbre,
rinorrea purulenta, edema o dolore periorbitario; raffreddore in risoluzione che
improvvisamente peggiora (con o senza febbre). Generalmente non vengono
impiegate né le metodiche di imaging né la puntura dei seni paranasali per la
diagnosi di sinusiti ad eziopatogenesi batterica, a meno che i pazienti non siano ad
alto rischio di complicanze. Numerose linee guida suggeriscono che l’associazione
di segni clinici sia il migliore indicatore di infezione batterica; tra queste citiamo
l’European Position Paper On Rhinosinusitis and Nasal Polips 2007 (EPOS) che
stabilisce come criteri diagnostici nei bambini: l’improvvisa insorgenza di due o più
sintomi caratteristici, di cui uno sia la rinorrea purulenta/ostruzione nasale o
l’anterior/posterior nasal drip, gli altri o il dolore frontale o la riduzione/perdita
dell’olfatto (54). Conseguentemente a quanto detto, il trattamento delle sinusiti
batteriche acute nella pratica clinica è empirico ed include i batteri che più
frequentemente sono coinvolti: Streptococcus Pneumonniae, Hemophilus
influenzae, Moraxella Catarralis. Il trattamento antibiotico delle sinusiti si avvale
quindi degli stessi antibiotici impiegati nel trattamento delle otiti medie acute, data la
comune eziopatogenesi delle due patologie infettive. Le più recenti raccomandazioni
di American Academy of Otolaryngology Head and Neck Surgery Foundation sono di
distinguere i pazienti in base alla gravità del quadro clinico: nei soggetti con forme
lievi (dolore moderato e T < 38, 3 °C) va applicata la strategia del “watchful waiting”,
nei soggetti con forme gravi (dolore da moderato a severo e T > 38, 3 °C) va iniziato
in prima istanza il trattamento antibiotico. La strategia del “watchful waiting” consiste
nel procrastinare il trattamento antibiotico di 4-5 giorni; il 60% delle sinusiti si
risolvono infatti spontaneamente e solo 1 su 8 bambini trattati con antibiotico trae
realmente beneficio da esso. Nel periodo d’attesa è consigliato l’impiego di farmaci
sintomatici quali analgesici, decongestionanti o soluzione salina in spray nasale, che
potrebbero favorire il drenaggio dei seni congesti. Nel caso in cui la sintomatologia
perduri oltre il periodo di attesa andrà iniziato il trattamento antibiotico. Nelle forme
gravi il trattamento antibiotico viene effettuato in prima istanza per evitare
l’insorgenza di complicanze e sequele della sinusite, quali meningiti, ascesso
cerebrale, cellulite e ascessi orbitari, che incorrono più frequentemente in tali forme
(55). Gli antibiotici maggiormente prescritti variano nelle diverse aree geografiche,
ma le linee guida concordano nel raccomandare, come farmaco di prima scelta,
l’amoxicillina a dosaggio standard (40 mg/Kg/die) nei soggetti a basso rischio, e a
dosaggio elevato (90/mg/kg/die) nei soggetti ad alto rischio. Si definiscono soggetti
ad alto rischio i bambini che frequentano abitualmente comunità chiuse e che siano
stati trattati, negli ultimi 3 mesi, con antibiotici. La durata del trattamento con
amoxicillina, ad entrambi i dosaggi, è di 10 giorni e la dose viene frazionata in 2
sommistrazioni giornaliere. La scelta dell’amoxicillina è giustificata dalla sua elevata
efficacia sullo Streptococcus pneumoniae, dall’azione battericida su Moraxella
catarralis ed Hemophilus influenzae, gli altri agenti patogeni delle sinusiti, da una
buona palatabilità e da un basso costo. In età pediatrica la riuscita del trattamento è
infatti condizionata tanto dall’efficacia dell’antibiotico quanto dalla compliance del
paziente. Nel caso di fallimento terapeutico con amoxicillina si ricorre all’uso dell’
amoxicillina clavulanata o di cefalosporine. Il fallimento terapeutico può essere
dovuto a vari fattori: un’eziologia virale, una diagnosi inesatta, una scarsa
compliance al trattamento, un dosaggio o frazionamento della dose inadeguato, la
persistenza dell’infezione. Quest’ultima condizione si verifica nel caso di ceppi di
H.influenzae produttori di β lattamasi sui quali l’amoxicillina è inattiva. Nei casi di
fallimento terapeutico in soggetti trattati con dosi standard di amoxicillina, viene
consigliata l’associazione di amoxicillina e amoxicillina clavulanata, che dà
protezione sugli hemophilus produttori di β lattamasi e limita gli effetti collaterali
gastrointestinali legati all’acido clavulanico. L’amoxicillina clavulanata ha tuttavia una
scarsa palatabilità, se comparata con gli altri antibiotici attivi sulle sinusiti. Nei
soggetti precedentemente trattati con alte dosi di amoxicillina si preferisce impiegare
le cefalosporine (cefdinir, cefpodoxime e cefuroxime). Tra queste, cefpodoxime,
cefalosporina di 3° generazione, ha una tollerabilità e un’efficacia equivalenti
all’amoxicillina, ma una scarsa palatabilità; il suo impiego è però vantaggioso per
quel che concerne il numero di somministrazioni giornaliere (1 o 2 volte al dì). Il
cefdinir ha, come il cefpodoxime, una buona efficacia e una buona tollerabilità e
viene somministrato due volte al dì, ma viene preferito in quanto provvisto di una
buona palatabilità. Infine il cefuroxime, cefalosporina di seconda generazione, è
attiva sia sui ceppi di S. peneumoniae penicillino sensibili che sugli organismi
produttori di βlattamasi; ha una buona efficacia, buona tollerabilità, ma brutta
palatabilità. Si tratta dell’unica cefalosporina che può essere impiegata in trattamenti
di breve durata (5 giorni). Le attuali linee guida pediatriche limitano l’uso di
azitromicina ai casi di allergia alle penicilline. Sebbene si tratti di farmaci largamente
prescritti in virtù di una breve durata del trattamento (da 3 a 5 giorni), del numero di
somministrazioni giornaliere (monosomministrazione) e di una palatabilità superiore
all’amoxicillina clavulanata, non rappresentano il trattamento ottimale per le sinusiti
acute, in quanto sono inattivi sia su H.influenzae che su PNSP. Antibiotico di
seconda scelta nei soggetti con sinusite acuta allergici alle penicilline è il
cefuroxime, purché l’allergia non sia severa (è possibile infatti che si verifichino
fenomeni di allergia crociata) (56). Infine l’uso dei fluorochinoloni non è ammesso
dall’American Academy of Pediatrics per il trattamento delle sinusiti; il loro uso
potrebbe però essere considerato in caso di fallimento terapeutico con i farmaci
suddetti, in quanto ha una buona eradicabilità (57).
Infezioni delle basse vie aeree
• Polmoniti
Le polmoniti acquisite in comunità (PAC) rappresentano ancora oggi una delle
principali cause di morte in età pediatrica, sebbene l’uso degli antibiotici ne abbia
notevolmente ridotto l’incidenza. L’UNICEF e la WHO stimano che, se tutti i bambini
con polmonite venissero trattati farmacologicamente, verrebbero evitati 600.000
decessi ogni anno nel mondo (58). Recenti linee-guida (59) suggeriscono che tutti i
pazienti affetti da PAC dovrebbero essere sottoposti a trattamento antibiotico, anche
in caso di sospetta infezione virale, poiché spesso nelle polmoniti virali è impossibile
escludere la presenza di coinfezione batterica. Generalmente quando viene iniziato
il trattamento antibiotico l’agente eziologico della PAC non è noto e la terapia è
quindi obbligatoriamente empirica. Tuttavia fattori relativi al paziente (età,
sintomatologia d’esordio e gravità) consentono al clinico di intraprendere un
trattamento antibiotico mirato (3).
Tra i fattori comunemente valutati nella scelta dell’antibiotico, l’età rimane il più
importante. In base ad un recente studio di Mcintosh (60), la popolazione pediatrica
può essere divisa in due fasce d’età: 0-5 anni e 6-15 anni. Le polmoniti in bambini
appartenenti alla prima fascia d’età vanno trattate con amoxicillina e acido
clavulanico perché particolarmente attivi sullo Streptococcus pneumoniae, l’agente
eziologico più comune in questi pazienti; è inoltre ben tollerata e poco costosa. Se
nelle prime 24-48 ore di terapia il quadro clinico non migliora, il βlattamico va
sostituito con un macrolide (azitromicina o eritromicina), nel sospetto di un’infezione
da Mycoplasma pneumoniae o Chlamydia pneumoniae. Una valida alternativa
all’amoxicillina clavulanata nei bambini dagli 0 ai 5 anni sono le cefalosporine di 3°
generazione (ceftriaxone, cefixima, cefpodoxima), equiparabili per efficacia
all’amoxicillina. In alcune aree geografiche, quali l’India, l’antibiotico di prima linea
nel trattamento delle PAC nei bambini di età compresa tra 0-5 anni è il
cotrimossazolo (5-7 mg/kg di trimethoprim + 25-35 mg/kg/die di sulfametossazolo). I
dati in letteratura sulla possibilità di utilizzo del cotrimossazolo in sostituzione
dell’amoxicillina sono discordanti: alcuni autori ritengono che l’efficacia
dell’amoxicillina sia superiore a quella del cotrimossazolo, un recente studio
multicentrico invece considera i due farmaci equivalenti (61).
Nei bambini con età superiore ai 5 anni l’antibiotico di scelta è invece il macrolide,
attivo su Mycoplasma pneumoniae e Chlamydia pneumoniae, gli agenti eziologici più
comuni in questo range d’età, e su Streptococcus pneumoniae, l’agente eziologico
più comune in tutte le fasce d’età (60). Non vi sono differenze significative tra
l’efficacia dell’azitromicina e quella dell’eritromicina (62). Secondo Berti et al. i
macrolidi non andrebbero impiegati nei casi di PAC in bambini di età superiore ai 5
anni, soprattutto se all’esordio presentano febbre e/o sintomi respiratori importanti
associati ad infiltrati polmonari all’Rx-torace. In questi casi la migliore scelta
terapeutica è l’amoxicillina clavulanata a dosaggio elevato (100 mg/Kg/die) ; la
maggior parte delle polmoniti con queste caratteristiche sono dovute allo
Pneumococco, contro il quale i macrolidi hanno un’efficacia pari al 50%. Inoltre, le
polmoniti da Mycoplasma nella grande maggioranza dei casi non esitano in
complicanze gravi se non trattate adeguatamente. L’amoxicillina clavulanata va
somministrata quindi per 24-48 h; in base alla defervescenza e al miglioramento
delle condizioni cliniche l’antibiotico può in seguito essere mantenuto o sostituito con
un macrolide (63, 64). Le PAC in bambini di età inferiore ai 3 mesi richiedono un
trattamento differente rispetto a quello della fascia 0-5 anni: nei primi 20 giorni di vita
infatti va impiegata l’associazione farmacologica di ampicillina ed aminoglicoside,
attiva su Streptococcus B ed Enterobatteri penicillino-resistenti che sono gli agenti
eziologici più comuni in questa fascia di età, mentre nei bambini di età compresa tra
i 20 gg e i 3 mesi va usato il macrolide o la cefalosporina di 3° generazione
(cefotaxime), entrambi attivi sulle infezioni da Chlamydia Trachomatis e
Staphilococcus aureus tipiche di questi pazienti (60).
La modalità d’esordio della PAC generalmente permette al pediatra di ipotizzare
l’eziologia della polmonite e quindi iniziare un trattamento antibiotico mirato. In caso
di esordio improvviso della sintomatologia con febbre e brivido, tosse produttiva,
tachipnea e compromissione dello stato generale, il clinico deve sospettare una
polmonite pneumococcica e prescrivere una terapia con amoxicillina (65). Il sintomo
che permette di differenziare la polmonite pneumococcica da altre patologie
respiratorie che esordiscono con tosse e dispnea, quali croup, bronchiolite e asma, è
la tachipnea. Molti bambini con tosse e febbre non associata a tachipnea non
necessitano quindi di trattamento antibiotico (61). Quando la polmonite esordisce
invece in modo lento e progressivo, con conservazione dello stato generale, va
sospettata una diversa eziologia. Generalmente i casi di febbre senza brivido
associata a faringodinia, tosse non produttiva e dolore toracico sono causati da M.
pneumoniae, mentre quelli di apiressia associata a tosse simil-pertussica e
congiuntivite, da C. pneumoniae. In entrambi i casi il trattamento raccomandato è
quello con macrolide. Quando la presentazione clinica della PAC è chiaramente
riconducibile ad un agente eziologico la scelta dell’antibiotico è quindi facilitata (65).
In base al quadro clinico e all’anamnesi per altre patologie respiratorie le PAC
vengono distinte in lievi e gravi. Le prime vanno trattate a domicilio con amoxicillina
clavulanata o macrolide, a seconda dell’età del bambino, da continuare per 7-10
giorni; la durata del trattamento è di 5 giorni nei casi in cui l’antibiotico utilizzato sia
l’azitromicina. Secondo alcuni autori questa condotta terapeutica rischia però di
essere inefficace e le forme lievi di PAC andrebbero trattate con l’associazione di β
lattamico e macrolide in quanto:
• i due antibiotici hanno sinergismo d’azione contro lo S. pneumoniae;
• viene fornita una copertura anche contro le infezioni provocate da M. pneumaniae
e C. pneumoniae;
• i macrolidi riducono, tramite l’inibizione della sintesi di mediatori, lo stato
infiammatorio polmonare (66).
Secondo quanto riportato nelle Evidence-based care giudeline for community
acquired pneumonia in children invece è sempre raccomandata la monoterapia, in
attesa di giudicare la risposta all’antibiotico di 1° linea (67).
Le polmoniti gravi richiedono l’ospedalizzazione del bambino ed il trattamento con
l’associazione di cefalosporina di 2° o 3° generazione somministrata per via
parenterale (i.m. o e.v.) e macrolide. I criteri per l’ospedalizzazione universalmente
riconosciuti sono: T corporea > 38, 5 °C, tachipnea (con FC > 50 atti/min, e > 70
atti/min nei neonati), dispnea grave, “grunting”, alitamento delle pinne nasali,
disidratazione e, nel neonato, inappetenza. Le linee guida consigliano l’associazione
dei due antibiotici perché fornisce una migliore copertura contro i ceppi resistenti e le
infezioni miste. La terapia parenterale (cefalosporina i.m. o e.v.) può essere
sostituita dall’enterale (amoxicillina clavulanata per os) dopo 24-48 h se lo stato
emodinamico è stabile, le condizioni cliniche sono migliorate e il bambino può
ingerire il farmaco. La sospensione del trattamento antibiotico può essere effettuata
dopo 10-15 giorni, dopo aver confermato radiologicamente la risoluzione
dell’addensamento polmonare (65). Non vi sono differenze significative tra l’efficacia
della penicillina per via parenterale e l’amoxicillina per os (63). L’esecuzione
dell’esame microbiologico dell’escreato permette di identificare l’agente eziologico
della PAC, iniziando una terapia mirata (vedi tab.1) da associare alla cefalosporina
di 3° generazione. La modalità d’uso degli antibiotici usati nelle PAC può essere
meglio compresa osservando la Tab. 2.
Tab.1 - Trattamento antibiotico specifico per ciascun agente eziologico delle
PAC
I criteri farmacologici che sottendono all’effetto degli antimicrobici sono stati meglio
compresi negli ultimi 10 anni. L’efficacia clinica di un antibiotico risulta correlata al
meccanismo d’azione e chemiosensibilità (farmacodinamica), alla quota
d’esposizione del paziente al farmaco (farmacocinetica) e al rapporto
farmacocinetica/farmacodinamica.
Farmacodinamica
• Meccanismo d’azione
Le due classi di antibiotici comunemente impiegate nel trattamento delle infezioni
respiratorie sono i βlattamici e i macrolidi. I βlattamici, di cui fanno parte le penicilline
e le cefalosporine, hanno un meccanismo d’azione battericida simile, caratterizzato
dall’inibizione della sintesi del peptidoglicano della parete batterica. Tutti i β lattamici
sono costituiti infatti da un anello tetratomico azetidonico (l’acido
6-aminopenicillanico nelle penicilline e 7-aminocefalosporanico nelle cefalosporine)
che rappresenta un analogo strutturale del dimero destro-alaninico, substrato delle
transpeptidasi batteriche (PLP: Proteine di Legame delle Penicilline). Il legame del β
lattamico all’enzima transpeptidasico comporta una denaturazione dell’enzima e un
arresto della sintesi del peptidoglicano e conseguentemente della crescita batterica
(Fig. 3). Questo meccanismo rappresenta l’effetto batteriostatico dell’antibiotico.
L’effetto battericida è secondario alla de-repressione genomica delle idrolasi
mureiniche che demoliscono la mureina della parete cellulare della cellula procariota
e ne determinano la lisi. I βlattamici βlattamasi sensibili, quali l’amoxicillina, vengono
generalmente somministrati in associazione con gli inibitori delle βlattamasi, quali
l’acido clavulanico che, pur essendo provvisti dell’anello βlattamico, mancano di
attività antibatterica intrinseca. Gli inibitori delle βlattamasi si legano alle βlattamasi,
enzimi responsabili dell’idrolisi del βlattamico, e le inattivano con meccanismo
“suicida”. Grazie a questo meccanismo l’acido clavulanico preserva l’attività
dell’amoxicillina contro Streptococcus pneumonae, le specie di Staphilococcus
aureus meticillino-sensibili, Hemophilus influenza e Moraxella catarralis (68). Tra i β
lattamici le cefalosporine di 3° generazione (es. ceftriaxone, cefixima, cefpodoxima),
comunemente impiegate nelle infezioni respiratorie, sono dotate di uno spettro
antibatterico più ampio rispetto alle penicilline, comprendente gli enterobatteri (es.
Klebsiella, Serratia, Enterobacter) ed i clostridi, dovuta ad una maggiore stabilità nei
confronti delle βlattamasi plasmidiche e ad una buona attività intrinseca. Questa
classe di cefalosporine comprende inoltre alcuni antibiotici, quali il ceftazidime ed il
cefoperazone, attivi anche sullo Pseudomonas Aeruginosa (69, 70). I macrolidi
(eritromicina, azitromicina ed altri) sono antibiotici ad attività batteriostatica che
talvolta possono espletare un’azione battericida; quest’ultima condizione si verifica in
caso di infezione da germi molto sensibili ai macrolidi quali streptococchi e
pneumococchi. Il loro meccanismo d’azione consiste nell’inibizione della sintesi
proteica batterica tramite la fissazione alla sub unità ribosomiale 50s contenente la
peptidiltrasferasi, enzima che catalizza la formazione del legame tra gli aminoacidi e
la catena polipeptidica in formazione (Fig. 4). I macrolidi agiscono quindi solo sulle
cellule in attiva moltiplicazione. Il loro spettro d’azione è medio e comprende, oltre a
patogeni intracellulari quali Mycoplasma pneumoniae e Chlamydia pneumoniae,
anche cocchi Gram + (stafilococchi, streptococchi, pneumococchi), bacilli Gram +
(Nocardia, Listeria) e alcuni batteri Gram – (Bordetella pertussis e Bordetella
catarralis) (69). Tra gli “antibiotici nuovi” sono compresi i fluorochinoloni, i Ketolidi e
gli Oxazilidinonici.
Mentre i βlattamici ed i macrodi vengono impiegati in tutte le infezioni respiratorie, i
chinoloni vengono impiegati solo nelle PAC resistenti ad altri antibiotici. Tra i
chinoloni si distinguono i derivati dell’acido nalidixico, o chinoloni di prima
generazione, e i fluorochinoloni, che comprendono i chinoloni di seconda e terza
generazione. I chinoloni di prima generazione (acido oxolinico, pipemico ed altri)
hanno uno spettro antibatterico ristretto, orientato prevalentemente verso gli
enterobatteri, ed una farmacocinetica che, per la rapida eliminazione e i tassi
tissutali specifici, ne consente l’impiego solo come antisettici urinari. I fluorochinoloni
di seconda generazione si caratterizzano per l’aggiunta di un atomo di fluoro al
carbonio 6 che conferisce alla molecola un’attività molto rinforzata ed estesa sui
Gram - ed una ridotta eliminazione urinaria (antibiotici sitemici). I fluorochinoloni di
terza generazione sono stati ottenuti per aggiunta di un sostituente eterociclico in
posizione 7 che ne amplia lo spettro d’azione ai Gram +. I fluorochinoloni di terza
generazione (levofluoxacina, moxifluoxacina) rappresentano quindi una valida
alternativa nella terapia delle PAC provocate da ceppi resistenti in quanto attivi nei
confronti di agenti tipici, quali lo pneumococco, e atipici quali le clamidie ed i
micoplasmi, oltre che su anaerobi e micobatteri. Si tratta di antibiotici battericidi che
si legano irreversibilmente alla sub unità A della DNA-girasi (topo isomerasi II),
enzima responsabile del superavvolgimento del DNA batterico, ostacolando la
replicazione e la sopravvivenza del batterio. I fluorochinoloni di terza generazione si
differenziano dai chinoloni di prima e seconda generazione in quanto esercitano
un’azione inibitoria anche sulla topoisomerasi IV, enzima omologo della DNA-girasi
con elevato potere decatenante (Fig. 5). Tale azione allargherebbe lo spettro
d’azione dei chinoloni ai batteri Gram +. Intorno agli anni ’90 è stato sintetizzato il
linezolid, un derivato morfolinico appartenente alla classe degli oxazolidinoni,
indicato nelle infezioni sistemiche provocate da ceppi resistenti ad altri antibiotici. Il
farmaco esercita un’azione batteriostatica legandosi alla sub unità ribosomiale 50s
ed è disponibile sia in preparazione per uso orale che per uso sistemico (Fig. 6).
Infine la telitromicina appartiene ad una nuova classe di antibiotici, i Ketolidi, derivati
chimicamente dai macrolidi quindi provvisti dello stesso meccanismo d’azione (Fig.
4), ma maggiormente efficaci rispetto ad essi nei confronti dei cocchi Gram +. La
nuova struttura chimica conferisce alla molecola una maggiore affinità di legame ai
ribosomi dei ceppi di pneumococchi MLSb (resistenti a Macrolidi, Lincosamidi,
Streptogramina B) (70). Sia il linezolid che la telitromicina vengono riservati al
trattamento delle PAC complicate.
Tab 2 - Modalità d’uso dei principali antibiotici nella terapia delle PAC
Il farmaco
• Minima concentrazione inibente (MIC) e minima concentrazione battericida
(MBC)
L’efficacia di un antibiotico può essere valutata tramite due parametri
farmacodinamici: la Minima Concentrazione Inibente (MIC) e la Minima
Concentrazione Battericida (MBC). La chemiosensibilità dei microrganismi
all’antibiotico viene stimata in vitro mediante la determinazione della MIC che
rappresenta la più bassa concentrazione di antibiotico capace di inibire
completamente la crescita batterica dopo 18-24 ore d’incubazione a 37°C. La
distinzione degli antibiotici in battericidi e batteriostatici sfrutta invece la
determinazione della MBC che rappresenta la più bassa concentrazione di
antibiotico capace di ridurre del 99, 9% la popolazione batterica iniziale dopo 24 ore
d’incubazione a 37°C. Si parla di antibiotico battericida quando la popolazione
batterica si riduce di 1.000 volte rispetto a quella dell’inoculo iniziale. Per gli
antibiotici battericidi, quali i βlattamici e i fluorochinoloni, le MIC e le MBC sono
sovrapponibili. Le MIC forniscono quindi una buona approssimazione dell’attività
battericida della molecola. In una stessa specie batterica non tutti i ceppi hanno però
la stessa sensibilità, per cui la valutazione della sensibilità di una specie batterica
nei confronti di un antibiotico deve basarsi su MIC50 e MIC90 che rappresentano
rispettivamente la sensibilità del 50% e del 90% della popolazione della specie
batterica in esame nei confronti di quell’antibiotico. Le MIC90 sono considerate il
parametro di riferimento più attendibile tra le due (71, 72).
Farmacocinetica
L’efficacia clinica di un antibiotico risulta correlata, oltre che al livello di
chemiosensibilità del microrganismo, anche alla quota di esposizione del paziente al
farmaco, determinata dalla sua concentrazione plasmatica massima (Cmax), area
sotto la curva nelle 24 ore (AUC24), concentrazione plasmatica minima (Cmin),
biodisponibilità ed emivita plasmatica di eliminazione, definiti parametri
farmacocinetici (71).
• Cmax, AUC24 e Cmin
La Cmax rappresenta il picco di concentrazione raggiunto a termine
dell’assorbimento del farmaco, che è in funzione della dose, della via di
somministrazione e della forma galenica. La penicillina G sodica o potassica
raggiunge i più elevati picchi sierici solo con perfusioni intermittenti e discontinue, le
cefalosporine di 3° generazione raggiungono invece sempre elevati picchi plasmatici
perché fortemente legate alle proteine plasmatiche. Per i macrolidi i picchi sierici
aumentano con assunzioni ripetute, raggiungendo nella fase di equilibrio livelli anche
doppi rispetto a quelli ottenuti con la prima assunzione. Dal confronto dei valori di
Tmax (tempo necessario per raggiungere la Cmax) nelle cefalosporine di 3°
generazione somministrate per via intramuscolare e in alcuni antibiotici orali risulta
una sostanziale somiglianza; perciò la somministrazione orale è preferibile. L’AUC24
indica l’entità di esposizione sistemica al farmaco, indirettamente proporzionale alla
clearance e la Cmin è la concentrazione minima raggiunta alla fine dell’intervallo di
dosaggio, prima della dose successiva del farmaco (69).
• Biodisponibilità
La biodisponibilità indica la quota percentuale di farmaco che viene assorbito e
raggiunge il circolo sistemico in forma immodificata dopo somministrazione per una
via diversa rispetto a quella endovenosa. La biodisponibilità orale dei βlattamici è
pressoché nulla in quanto si tratta di antibiotici fortemente idrosolubili, che non
possono cioè diffondere passivamente attraverso le membrane del tubo
gastroenterico, e labili nell’ambiente acido gastrico. La penicillina G viene infatti
impiegata solo per via parenterale. Tra i βlattamici fa però eccezione l’amoxicillina e
ac. Clavulanico in quanto, seppur fortemente idrofila, resiste all’ambiente acido
gastrico e viene assorbita dal tubo gastroenterico tramite specifici trasportatori.
Diversi autori hanno affermato infatti che le cinetiche di amoxicillina e acido
clavulanico somministrati per via orale e parenterale sono quasi sovrapponibili. I
fluorochinoloni ed il linezolid sono moderatamente lipofili ma presentano una
biodisponibilità orale > 80-90%, mentre i macrolodi sono fortemente lipofili, quindi
facilmente assorbibili (73).
• Emivita plasmatica d’eliminazione
L’emivita plasmatica di eliminazione di un farmaco equivale al tempo necessario
affinchè la sua concentrazione plasmatica raggiunga il t/2 ed è pari a 4/5 del t/2
stesso. Tale parametro è indirettamente correlato alla clearance del farmaco, quindi
alla sua modalità di eliminazione: gli antibiotici idrofili (βlattamici) vengono eliminati
per via renale tramite filtrazione glomerulare e secrezione attiva, mentre i lipofili
(fluorochinoloni e macrolidi) prevalentemente per via epatica tramite ossidoriduzione o coniugazione. Le penicilline hanno breve emivita plasmatica
d’eliminazione (< 1, 5 h), le cefalosporine di terza generazione un’emivita media o
lunga a seconda delle caratteristiche molecolari (il ceftriaxone ha un’emivita molto
lunga >7h), i macrolidi un’emivita variabile (2-3 h per l’eritromicina e 15-20 h per
l’azitromicina) (72, 73, 74).
Efficacia terapeutica: Farmacocinetica/Farmacodinamica (PK/PD)
L’efficacia terapeutica di un antibatterico è correlata al rapporto tra parametri
farmacocinetici e parametri farmacodinamici (PK/PD). Prima di tutto gli antibiotici
vanno distinti, sulla base della modalità d’azione antibatterica, in due classi: tempodipendenti e concentrazione-dipendenti. Gli antibiotici del primo gruppo, tra cui i
βlattamici ed i macrolidi, hanno in vivo un’azione correlata a t>MIC, cioè al tempo
durante il quale le concentrazioni si mantengono al di sopra della MIC del patogeno.
Affinché venga garantita l’efficacia terapeutica del farmaco, la concentrazione
plasmatica farmacologicamente attiva deve essere mantenuta per la maggior parte
dell’intervallo di dosaggio (50-70%) ; l’aumento della dose ha poco effetto quindi
sull’azione battericida, a condizione che la concentrazione sia già al di sopra della
soglia d’efficacia. Tale condizione viene raggiunta tramite un plurifrazionamento della
dose giornaliera che tenga conto anche dell’emivita plasmatica di eliminazione del
farmaco. Un altro parametro che bisogna necessariamente considerare nella scelta
dell’antibiotico più efficace è l’effetto post-antibiotico (PAE). Gran parte degli
antibiotici tempo-dipendenti sono privi di effetto post-antibiotico (PAE), cioè
l’inibizione della crescita batterica dopo la scomparsa dell’antibiotico è nulla. La
somministrazione di tali antibiotici richiede più che mai un oculato frazionamento
della dose. Alcuni antibiotici ad azione tempo-dipendente, quali l’azitromicina, si
distinguono dagli altri per un prolungato PAE nei confronti di molte specie batteriche;
per questi farmaci l’efficacia terapeutica si correla, più che al t>MIC ad AUC>MIC, al
rapporto tra l’esposizione plasmatica giornaliera all’antibiotico e la MIC. Secondo
alcuni autori per l’azitromicina, frequentemente impiegata nel trattamento delle
polmoniti atipiche, l’AUC/MIC da mantenere deve essere di 20-30 h. Per tale ragione
l’azitromicina viene utilizzata in monosomministrazione giornaliera piuttosto che in
plurisomministrazioni, diversamente gli altri antibiotici tempo-dipendenti (72, 76). Per
gli antibiotici concentrazione-dipendenti, tra cui i fluorochinoloni e gli aminoglicosidi,
invece, l’indicatore di efficacia è la Cmax>MIC, ovvero il rapporto tra la
concentrazione plasmatica massima e la MIC. All’aumentare della concentrazione
plasmatica di tali antibiotici aumenta progressivamente anche l’efficacia terapeutica;
la Cmax/MIC deve essere ≥10 per ottenere l’eradicazione dell’infezione e la
risoluzione del quadro clinico in almeno l’80% dei casi. I farmaci appartenenti a
questa classe possiedono inoltre un prolungato effetto post-antibiotico; per questa
ragione, e per l’intrinseca azione concentrazione-dipendente, vengono somministrati
una volta al dì. Si stima che i fluorochinoloni, impiegati come antibiotici di seconda
scelta nelle PAC, debbano avere un rapporto AUC/MIC > 25-35 h nelle infezioni
provocate da Gram + e > 125 h in quelle provocate dai Gram – per garantire una
sicura efficacia clinica. I parametri sopraelencati hanno non solo un’elevata valenza
clinica, ma anche una valenza epidemiologica, in quanto consentono di prevenire la
selezione di ceppi resistenti in corso di terapia antibiotica (72, 77, 78).
Agenti patogeni: resistenza locale
L’uso inappropriato di antibiotici nel trattamento delle patologie delle alte vie aeree,
nelle quali non è richiesto, determina lo sviluppo di ceppi batterici resistenti, oltre ad
esporre inutilmente il bambino alle reazioni avverse del trattamento farmacologico e
ad indurre uno spreco di risorse economiche (5). Gli agenti eziologici più comuni
nelle infezioni respiratorie batteriche sono: Streptococcus pneumoniae (PAC, OMA,
FTA), Hemophilus influenzae (PAC, OMA, FTA), Chlamydia pneumoniae (PAC),
Mycoplasma pneumoniae (PAC), Streptococcus piogenes (FTA) e Moraxella
catarralis (OMA, FTA).
Batteri tipici (oma, fta, sinusiti acute, pac)
• Streptococcus pneumoniae
Sono stati condotti numerosi studi sulla distribuzione della resistenza dello
Streptococcus pneumoniae, l’agente eziologico più comune delle PAC, agli antibiotici
di più largo uso (βlattamici e macrolidi). Gli pneumococchi sono germi altamente
sensibili alle penicilline, sia naturali (es. penicillina G) che semisintetiche (es.
aminopenicilline quali l’amoxicillina), con una MIC rispettivamente di 0, 01 µg/ml e 0,
03 µg/ml (69). La chemio-sensibilità degli pneumococchi ai βlattamici ha subìto però
nel corso degli anni un notevole cambiamento dovuto allo sviluppo di nuove
resistenze locali. La penicillina venne prodotta nel 1940 e fu il primo antibiotico
impiegato nelle patologie infettive, ma già nel 1970 comparvero ceppi di S.
pneumoniae penicillino-resistenti: modificazioni strutturali delle PBP (penicillin
binding proteins) del batterio impedivano l’inibizione da parte dell’antibiotico della
sintesi del peptidoglicano batterico (79). Per il trattamento delle infezioni
pneumococciche vennero quindi impiegati i macrolidi; l’uso frequente di questi
farmaci comportò però la comparsa di specie di S. pneumoniae resistenti anche ai
macrolidi. I più comuni meccanismi di resistenza ai macrolidi sono la metilazione
ribosomiale mediata dal gene erm (B) e la sintesi di pompe di efflusso mediata dal
gene mef (A). Nel PROTEKT study si stima che la penicilllino-resistenza sia oggi del
31%, l’eritromicino-resistenza del 36% e la cefaclor e cefuroxime-resistenza
rispettivamente del 43% e 44%. I ceppi di S. pneumoniae penicillino resistenti
possono essere distinti in ceppi a resistenza intermedia e ceppi a resistenza elevata
in base alla MIC. Il CLSI (Clinical and Laboratory Standards Institute) ha definito i
MIC breakpoint, cioè le concentrazioni –soglia (µg/ml) per esprimere la sensibilità e
la resistenza dei microrganismi alla penicillina: valori compresi tra 0, 12 e 1 µg/ml
indicano una resistenza intermedia, valori > 2 µg/ml una resistenza elevata. La
distribuzione della MIC varia notevolmente nelle diverse aree geografiche: la
percentuale di ceppi di S. pneumoniae a resistenza intermedia alle penicilline è del
15, 3% in Nord America, del 22, 2% in Sud America, 27, 4% in Sud Africa, 13% in
Europa, 16, 2% in Asia e 19, 7% in Arabia Saudita. I ceppi a resistenza elevata sono
invece il 20, 2% in Nord America, il 7, 9% in Sud America e Sud Africa, l’11, 2% in
Europa, il 44, 1% in Asia ed il 19, 7% in Arabia Saudita. Dai dati riportati l’Arabia
Saudita risulta quindi l’area geografica con la maggiore concentrazione di
pneumococchi penicillino-resistenti nel mondo (82, 83). Nei casi di infezioni
respiratorie provocate da ceppi di S. Pneumoniae penicillino-resistenti si deve
somministrare amoxicillina clavulanata ad alto dosaggio (80-90 mg/kg/die) ; in
questo modo si raggiungono tassi di antibiotico-sensibilità del 99% (84).
I MIC breackpoint impiegati per la distinzione di ceppi di S. pneumoniae macrolideresistenti sono invece 1 µg/ml per l’azitromicina e 0, 5 µg/ml per l’eritromicina. I
ceppi eritromicina- resistenti in Sud America, Europa, Sud Africa e Asia sono
rispettivamente 9, 5%, 29, 4%, 13, 6% e 4, 7%; i ceppi azitromicina-resistenti invece
29, 2% in Nord America e 22, 6% in Arabia Saudita. L’Europa è quindi il continente
con la maggiore resistenza pneumococcica all’eritromicina, il Nord America
all’azitromicina (82, 83). Nei casi di resistenza al macrolide deve essere impiegata
una cefalosporina di 3° generazione e, come seconda scelta, uno tra i “nuovi
antibiotici”:
fluorochinoloni
(levofloxacina,
moxifloxacina,
etc.),
Ketolidi
(telithromycina) e Oxazilodonici (linezolide). La resistenza ai “nuovi antibiotici” è
infatti rara (0, 12%).
• Streptococcus piogenes
Il meccanismo di resistenza di tale specie di streptococco alle penicilline è legato
alla selezione di ceppi produttori di βlattamasi (vedi Streptococcus pneumoniae).
Sebbene crescente, la resistenza di tali ceppi alle penicilline è ancora un fenomeno
contenuto. La resistenza dello S. piogenes ai macrolidi è invece preoccupante: da
un recente studio (nota bibliografica) è emerso che la sua incidenza in Italia sia del
38%. Dei ceppi di S.pyogenes eritromicino-resistenti il 63% ha un fenotipo M, il 26%
un fenotipo RI (Resistenza inducibile) e l’11, 5% un fenotipo RC (resistenza
costitutiva). I ceppi con il primo fenotipo possiedono pompe di efflusso che
conferiscono loro un basso grado di resistenza ad eritromicina, mantenendo la
sensibilità a clindamicina e macrolidi a 16 atomi di C (josamicina, spiramicina, etc) ;
quelli con il secondo fenotipo hanno una basso grado di resistenza all’eritromicina
ed una resistenza a clindamicina e macrolidi a 16 atomi di C inducibile con
l’esposizione a concentrazioni sub inibitorie di eritromicina; infine i ceppi con il terzo
fenotipo hanno un elevato livello di resistenza sia ai macrolidi che alla clindamicina.
Il meccanismo di resistenza nei ceppi con fenotipo RI e RC è rappresentato dalla
metilazione dell’rRNA batterico, sito bersaglio del farmaco. L’eritromicino- resistenza
di S.pneumoniae ha reso i macrolidi farmaci di seconda scelta nel trattamento delle
infezioni respiratorie con tale eziologia, ossia le faringotonsilliti acute.
• Hemophilus influenzae
Il trattamento antibiotico di scelta nelle infezioni da HP è rappresentato
dall’associazione di amoxicillina e acido clavulanico; recentemente infatti si sono
diffusi ceppi di Hemophilus produttori di βlattamasi (si stima che la hemophilusresistenza alla penicillina ed ampicillina vari dal 25 al 60%). Tale incidenza si è
accresciuta negli ultimi anni a seguito dell’utilizzo del vaccino eptavalente che ha
provocato una riduzione delle infezioni causate da Streptococcus pneumoniae, a
scapito di un aumento di quelle indotte da Hemophilus influenzae.
• Moraxella catarralis
Moraxella catarralis fa parte, insieme ad Hemophilus influenzae degli antibiotici
“forti produttori” di βlattamasi; è per tale ragione che la somministrazione
dell’associazione di amoxicillina ed acido clavulanico va preferita alla
somministrazione della sola amoxicillina.
Batteri atipici (pac)
• Mycoplasma pneumoniae
L’antibiotico di scelta nelle polmoniti provocate da Mycoplasma pneumoniae è il
macrolide; le tetracicline ed i fluorochinoloni, attivi su questa specie, non sono
raccomandati infatti in età pediatrica. Nelle ultime tre decadi sono stati riportati solo
casi sporadici di resistenza del Mycoplasma pneumoniae ai macrolidi, eccetto che in
Giappone. Nel mondo sono stati segnalati tre casi di eritromicino-resistenza in
Israele negli anni ’80, due casi negli Stati Uniti ed in Finlandia tra il 1995 ed il 1999 e
due casi in Francia nel 1999. Il Giappone differisce dalle altre aree geografiche in
quanto a partire dal 2000 sono stati isolati numerosi ceppi di Mycoplasma
pneumoniae macrolide-resistenti e nel 2004 è stata stimata una macrolideresistenza del M. pneumoniae del 15%. Lo sviluppo di resistenza sembra dovuto ad
una nuova sequenza nel gene dell’adesina P1, la più importante molecola
d’adesione del Mycoplasma pneumoniae che favorisce l’azione patogena del
batterio e stimola la risposta infiammatoria nell’ospite. La nuova sequenza è
caratterizzata da una mutazione puntiforme nel dominio V del 23s rRNA che
comporta la sostituzione dell’Alanina con la Guanina in posizione 2058 e 2059.
Sebbene i ceppi di micoplasmi macrolide-resistenti non abbiano ancora trovato larga
diffusione nel mondo, l’esperienza del Giappone impone un’attenta sorveglianza
epidemiologica (85).
• Chlamydia pneumoniae
Per quel che riguarda la resistenza di Chlamydia pneumoniae ai macrolidi, fino ad
oggi non si dispone di alcun dato epidemiologico. La resistenza delle clamidie agli
antibiotici è in generale rara e, mentre in letteratura è stata riportato qualche caso di
resistenza in vivo delle specie C. trachomatis e C. suis ai macrolidi, sulla resistenza
di C. pneumoniae sono stati effettuati soltanto studi in vitro. Da questi è risultato che
la C. pneumoniae non sviluppa resistenza con dosi elevate di antibiotico e risponde
anche a basse dosi di macrolidi (pari ad 1/8 della MIC). Tuttavia sono state
riscontrate in alcuni ceppi modificazioni geniche che potrebbero, nel tempo,
determinare lo sviluppo della resistenza ai macrolidi in Chlamydia pneumoniae. Per
tale ragione il trattamento prolungato con macrolidi, fattore scatenante lo sviluppo di
antibiotico-resistenza, andrebbe evitato quando possibile.
Bibliografia
1. Smart K, Lemay JF, Kellner JD. Antibiotic choices by paediatric residents and
recently graduated paediatricians for typical infectious disease problems in children.
Paediatr Child Health. 2006;11 (10) :647-53.
2. Sih TM, Bricks LF. Optimizing the management of the main acute infections in
pediatric ORL: tonsillitis, sinusitis, otitis media. Braz J Otorhinolaryngol. 2008;74 (5)
:755-62.
3. Cantón R, Unal S, Farrell DJ. Antibacterial resistance patterns in Streptococcus
pneumoniae isolated from elderly patients: PROTEKT years 1-5 (1999-2004). Int J
Antimicrob Agents. 2007; 30: 546-50.
4. Salari P. Spunti pratici in termini di antibioticoterapia delle infezioni delle vie
aeree superiori. Edit-symposia. Pediatria e neonatologia 2010;2:1-10.
5. Cazzato T, Pandolfini C, Campi R et al; ACP Puglia-Basilicata Working Group.
Drug prescribing in out-patient children in Southern Italy. Eur J Clin Pharmacol.
2001;57 (8) :611-6.
6. Rovers MM, Schilder AG, Zielhuis GA et al. Otitis media. Lancet.
2004;363:465-73.
7. Angeloni S. Atti del XX Congresso Nazionale in Antibioticoterapia in Età
Pediatrica, Milano, 2011.
8. Scottish Intercollegiate Guidelines Network. Diagnosis and management of
childhood otitis media in primary care. A national clinical guideline. Guideline n. 66.
SIGN 2003. Disponibile al sito: http://www.sign.ac.uk/pdf/sign66.
9. Browning GG.Childhood otalgia: acute otitis media. 1. Antibiotics not necessary
in most cases. BMJ 1990;300 (6730) :1005-6.
10. Glasziou PP, Del Mar CB, Sanders SL et al. Antibiotics for acute otitis media in
children. Cochrane Database Syst Rev. 2004; (1) :CD000219.
11. Bertin L, Pons G, d.Athis P et al. A randomized, double-blind, multicentre
controlled trial of ibuprofen versus acetaminophen and placebo for symptoms of
acute otitis media in children. Fundam Clin Pharmacol 1996;10:387-92.
12. Klein JO. Microbiologic efficacy of antibacterial drugs for acute otitis media.
Pediatr Infect Dis J. 1993;12 (12) :973-5.
13. American Academy of Pediatrics Subcommitee on Menagement of Acute Otitis
Media. Diagnosis and Menagement of acute otitis media. Pediatrics
2004;113:1451-65.
14. Agencia de Evaluacìon de Tecnologias Sanitarias de Andalucia. Manejo de la
otitis media aguda en la infancia. Guìa de pràctica clinica basada en la evidencia/
Pedro Martín MuñozJuan Ruiz-Canela Cáceres. Sevilla: Agencia de Evaluacìon de
Tecnologias Sanitarias deAndalucia2001.http://ww.juntadeandalucia.es/salud/orgdep
/AETSA/pdf/otitis¬_GUIA.pdf
15. Marcy M, Takata G, Shekelle P et al. Management of acute otitis media.
Rockville (MD) : Agency for Healthcare Research and Quality; 2001. Evidence
Report/Technology Assessment No.15. AHRQ Publication No. 01-E010. [cited 28
Nov
2002].
Available
from
url:http://hstat.nlm.nih.gov/hq/Hquest
/db/local.epc.er.erta15/screen/TocDisplay5./s/55230/action/Toc
16. Kozyrskyj A, Klassen TP, Moffatt M et al. Short-course antibiotics for acute otitis
media. Cochrane Database Syst Rev. 2010; (9) :CD001095.
17. Barr WH, Affrime M, Lin CC et al. Pharmacokinetics of ceftibuten in children.
Pediatr Infect Dis J. 1995;14 (7 Suppl) :S93-101.
18. Coticchia J, Zuliani G, Coleman C et al. Biofilm surface area in the pediatric
nasopharynx: Chronic rhinosinusitis vs obstructive sleep apnea. Arch Otolaryngol
Head Neck Surg. 2007;133 (2) :110-4.
19. Caramia G, Ruffini E, Carlucci A. Principali infezioni ambulatoriali in età
pediatrica: approccio razionale alla terapia antibiotica (II parte).
20. Shaikh N, Leonard E, Martin JM. Prevalence of Streptococcal Pharyngitis and
Streptococcal Carriage in children: a meta-analysis. Pediatrics 2010;126:e557-64.
21. American Academy of Pediatrics, Committee on Infectious Diseases. Red Book:
Report of the Committee on Infectious Diseases. 27th ed. Elk. Grove Village 2006.
22. McIsaac WJ, Goel V, To T et al. The validity of a sore throat score in family
practice. 2000;163 (7) :811-5.
23. Gerber MA. Group A Streptococcus. In: Nelson, Textbook of pediatrics 18th
edition, International editions 2007;182:1135-39.
24. Gerber MA, Baltimore RS, Eaton CB et al. Prevention of rheumatic fever and
diagnosis and treatment of acute Streptococcal pharyngitis: a scientific statement
from the American Heart Association endorsed by the American Academy of
Pediatrics Circulation 2009;119:1541-51.
25. Bisno AL, Gerber MA, Gwaltney JM. Jr. Practice guidelines for the diagnosis
and management of group A Streptococcal pharyngitis. Infectious Diseases Society
of America. Clin Infect Dis 2002; 35:113-25.
26. National Guideline Clearinghouse. Acute pharyngitis.http://www.guideline.gov.
Last accessed 26 th May, 2010.
27. Snow V, Mottur-Pilson C, Cooper RJ et al; American Academy of family
physicians; American College of Physicians-American Society of Internal Medicine;
Centers for disease control. Principles of appropriate antibiotic use pharyngitis in
adult. Ann Intern Med 2001;134:506-8.
28. British Columbia Ministry of Science Web site. Diagnosis and management of
sore throat. http.htlm.gov.bc.ca
29. Systemic antibiotic treatment in upper and lower respiratory tract infections:
official French guidelines. Agence Française de Sécurité Sanitaire des Produits de
Santé. Clin Microbiol Infect 2003; 9:1162-78.
30. Duodecim. Sore throat and tonsillitis. National Guideline Clearing-house. 2001.
http://www.guideline.gov. Last accessed 26 th May, 2010.
31. National Institute for Health and Clinical Excellence (NICE). Prescribing of
antibiotics for self limiting respiratory tract infections in adults and children in primary
care 2008. (Clinical guideline 69) London: NICE 2008. Available at www.nice.org.uk.
Last accessed 26th May, 2010.
32. Scottish Intercollegiate Guidelines Network. Management of sore throat.
http://www.sign.ac.uk. Last accessed 26 th May, 2010.
33. Starreveld JS, Zwart S, Boukes FS et al. Summary of the practice guideline
'Sore throat' (second revision) from the Dutch College of General Practitioners. Ned
Tijdschr Geneeskd 2008;152:431-5.
34. De Meyere M, Matthys J. Guideline acute sore throat. Huisart nu
1999;28:193-201.
35. Pacchetti Informativi sui Farmaci. 2006 n.4;6-9.
36. Catanzaro FJ et al. The role of Streptococcus in the pathogenesis of rheumatic
fever. Am J Med. 1954;17:749-56.
37. AAVV. L'otite moyenne aiguë chez l'enfant. L'évolution naturelle est le plus
souvent favorable en quelques jours. Rev Prescr 2003. 23 (237) : 194-208.
38. Del Mar CB, Glasziou PP, Spinks AB. Antibiotics for sore throat. Cochrane
Database Syst Rev 2006;4:CD000023.
39. Gopichand I, Williams GD, Medendorp SV. Randomized, single-blinded
comparative study of the efficacy of amoxicillin (40 mg/kg/day) versus standard-dose
penicillin V in the treatment of group A streptococcal pharyngitis in children. Clin
Pediatr (Phila). 1998;37 (6) :341-6.
40. Feder HM Jr, Gerber MA, Randolph MF et al. Once-daily therapy for
streptococcal pharyngitis with amoxicillin. Pediatrics. 1999;103 (1) :47-51.
41. Cohen R, Levy C, Doit C et al. Six-day amoxicillin vs. ten-day penicillin V
therapy for group A streptococcal tonsillopharyngitis. Pediatr Infect Dis J. 1996;15 (8)
:678-82.
42. Markello JR. Factors influencing pediatric compliance. Pediatr Infect Dis.
1985;4 (5) :579-83.
43. Pichichero ME, Green JL, Francis AB et al. Recurrent group A streptococcal
tonsillopharyngitis. Pediatr Infect Dis J. 1998;17 (9) :809-15.
44. Roos K, Håkansson EG, Holm S. Effect of recolonisation with "interfering" alpha
streptococci on recurrences of acute and secretory otitis media in children:
randomised placebo controlled trial. BMJ. 2001 Jan 27;322 (7280) :210-2.
45. McIsaac WJ, Kellner JD, Aufricht P et al. Empirical validation of guidelines for
the management of pharyngitis in children and adults. JAMA. 2004 7;291 (13)
:1587-95.
46. Bromberg K. Group A beta-hemolytic streptococcal pharyngitis. Am Fam
Physician. 2001 Apr 15;63 (8) :1486-7, 1493.
47. Bassetti M, Manno G, Collidà A et al. Erythromycin resistance in Streptococcus
pyogenes in Italy. Emerg Infect Dis. 2000;6 (2) :180-3.
48. Casey JR, Pichichero ME. Meta-analysis of cephalosporin versus penicillin
treatment of group A streptococcal tonsillopharyngitis in children. Pediatrics
2004;113:866–82.
49. Casey JR, Pichichero ME. The evidence base for cephalosporin superiority over
penicillin in streptococcal pharyngitis. Diagn Microbiol Infect Dis 2007;57:39-45.
50. Ortiz BG, Simnetal PS, Porrai MH. et al. Comparacion del olor, el cuerpo, el
sabor y la sensacion posterior a la ingestion que producen 15 antibioticos en
presentacion liquida para indicacion pediatrica Riv Mex Puer Ped 2:1-8, 1994.
51. Brumfitt W, Hamilton-Miller JM. Cefaclor into the millennium. J Chemother.
1999;11 (3) :163-78.
52. Cassano P, Gelardi M, Cassano M. Pneumologia Pediatrica 2002; 7:5-11.
53. Meltzer EO, Hamilos DL. Rhinosinusitis diagnosis and management for the
clinician: a synopsis of recent consensus guidelines. Mayo Clin Proc. 2011;86 (5)
:427-43.
54. Thomas M, Yawn BP, Price D et al; European Position Paper on Rhinosinusitis
and Nasal Polyps Group. EPOS Primary Care Guidelines: European Position Paper
on the Primary Care Diagnosis and Management of Rhinosinusitis and Nasal Polyps
2007 - a summary. Prim Care Respir J. 2008;17 (2) :79-89.
55. Blin P, Blazejewski S, Lignot S et al. Effectiveness of antibiotics for acute
sinusitis in real-life medical practice. Br J Clin Pharmacol. 2010;70 (3) :418-28.
56. Pichichero ME, Brixner DI. A review of recommended antibiotic therapies with
impact on outcomes in acute otitis media and acute bacterial sinusitis. Am J Manag
Care. 2006;12 (10 Suppl) :S292-302.
57. Karageorgopoulos DE, Giannopoulou KP, Grammatikos AP et al.
Fluoroquinolones compared with beta-lactam antibiotics for the treatment of acute
bacterial sinusitis: a meta-analysis of randomized controlled trials. CMAJ. 2008;178
(7) :845-54.
58. UNICEF. Pneumonia: The Forgotten Killer of Children. The United Nations
Children’s Fund (UNICEF) /World Health Organization (WHO), 2006. Available from:
URL: http://www.unicef.org/publications/files
/Pneumonia_The_Forgotten_Killer_of_Children.pdf. Accessed August 30, 2009.
59. Ruuskanen O, Lahti E, Jennings LC et al. Viral pneumonia. Lancet 2011; 377:
1264–75.
60. Polverino E, Torres Marti A. Community-acquired pneumonia. Minerva
Anestesiol 2011; 77: 196-11.
61. McIntosh K. Community-acquired pneumonia in children. N Engl J Med 2002;
346: 429-37.
62. India Clinical Epidemiology Network (IndiaCLEN) Task Force on Pneumonia.
Rational use of antibiotics for pneumonia. Indian Pediatr. 2010;47 (1) :11-8.
63. Berti I, Faraguna D. Pneumonia in children. N Engl J Med 2002; 346: 1916.
64. Kabra SK, Lodha R, Pandey RM. Antibiotics for community acquired pneumonia
in children. Cochrane Database Syst Rev 2010; 3: CD004874.
65. Juven T at al. Etiology of community acquired pneumonia in 254 hospitalized
children. Pediatr Infect Dis J 2000;19:293-8.
66. Scaricato da www.thoraxjnl.com
67. Van der Poll T, Opal S. Pathogenesis, treatment, and prevention of
pneumococcal pneumonia. Lancet 2009; 374: 1543–56.
68. Kost GJ. National guideline clearinghouse. URL: Www.guideline.gov/index.asp.
Clin Chem 2000; 46: 141-2.
69. Ribeiro CF, Ferrari GF, Fioretto JR. Antibiotic treatment schemes for very
severe community-acquired pneumonia in children: a randomized clinical study. Rev
Panam Salud Publica. 2011;29 (6) :444-50.
70. Rossi F, Cuomo V, Riccardi C. Farmacologia. Principi di base e applicazioni
terapeutiche. 2005.
71. Neuman M. Vademecum degli antibiotici ed agenti chemioterapici antinfettivi.
Quinta edizione. 1994.
72. Pea F, Bettoncelli G, Richeldi L et al. Valutazioni in merito alla appropriatezza
della prescrizione degli antibiotici iniettabili e proposta di ambiti e modalità di
intervento. Infezioni in Medicina, 2004;, Supplemento 3, vol. 12.
73. Esposito S, Eandi M, Novelli A et al. TAID: La Terapia Antibiotica Iniettiva
Domiciliare. Edizioni Internazionali Srl, Divisione EDIMES, Edizioni Medico
Scientifiche, Pavia; 129-143, 2001.
74. Avalox [Moxifloxacina]. Riassunto delle Caratteristiche del Prodotto aggiornato
a Maggio 2000.
75. Rocefin [Ceftriaxone]. Riassunto delle Caratteristiche del Prodotto aggiornato a
Giugno 2000.
76. Dagan R, Johnson C, McLinn S et al. Bacteriologic and clinical efficacy of
amoxicillin/clavulanate vs azithromycin in acute otitis media. Pediatr Infect Dis J
2000;19: 95-104.
77. Preston SL, Drusano GL, Berman AL et al. Pharmacodynamics of levofloxacin:
a new paradigm for early clinical trials. JAMA 1998;279: 125-129.
78. Forrest A, Nix DE, Ballow CH et al. Pharmacodynamics of
intravenousciprofloxacin in seriously ill patients. Antimicrob Agents Chemother 37:
1073-81, 1993. Craig W.A. Does the Dose Matter? Clin Infect Dis 33:S233-S237;
2001.
79. Scaglione S, Thomson RB, Mhor JF et al. MIC, PK/PD PER UN APPROCCIO
RAZIONALE ALLA TERAPIA ANTIBIOTICA. Documenta num. 15. 2005.
80. Fouda SI, Kadry AA, Shibl AM. Beta-lactam and macrolide resistance and
serotype distribution among Streptococcus pneumoniae isolates from Saudi Arabia.
J Chemother. 2004; 16: 517-23.
81. Jenkins SG, Farrell DJ, Patel M et al. Trends in anti-bacterial resistance among
Streptococcus pneumoniae isolated in the USA, 2000-2003: PROTEKT US years
1-3. J Infect. 2005; 51: 355-63.
82. Weinstein M, Klugman P, Jones R. Rationale for Revised Penicillin
Susceptibility Breakpoints versus Streptococcus pneumoniae: Coping with
Antimicrobial Susceptibility in an Era of Resistance. Clinical Infectious Diseases
2009; 48:1596–1600.
83. Pereyre S, Charron A, Renaudin H et al. First Report of Macrolide-Resistant
Strains and Description of a Novel Nucleotide Sequence Variation in the P1 Adhesin
Gene in Mycoplasma pneumoniae Clinical Strains Isolated in France over 12 Years.
J Clin Microbiol. 2007; 45 (11) :3534-9.
84. Riska PF, Kutlin A, Ajiboye P et al. Genetic and culture-based approaches for
detecting macrolide resistance in Chlamydia pneumonia. Antimicrob Agents
Chemother. 2004;48 (9) :3586-90.
Trimestrale di divulgazione scientifica dell'Associazione Pediatrica di Immunologia e Genetica
Legge 7 marzo 2001, n. 62 - Registro della Stampa Tribunale di Messina n. 3/09 - 11 maggio 2009
Direttore scientifico Carmelo Salpietro - Direttore responsabile Giuseppe Micali - Segreteria redazione Basilia Piraino - Piera Vicchio
Direzione-Redazione: UOC Genetica e Immunologia Pediatrica - AOU Policlicnico Messina
www.geneticapediatrica.it/rigip












