1
1.1
1.2
1.3
1.4
1.5
1.6
1.7
1.8
1.9
1.10
1.11
1.12
1.13
1.14
1.15
1.16
1.17
1.18
1.19
1.20
1.21
1.22
NEURONI E LORO
PROPRIETÀ
Anatomia e caratteristiche molecolari
Struttura del neurone
Struttura tridimensionale del neurone
e neuroistologia
Tipi di sinapsi
Citotipi neuronali
Citotipi gliali e non gliali
Biologia degli astrociti
Biologia della microglia
Biologia degli oligodendrociti
Fattori di crescita neuronale e fattori trofici
Le cellule staminali nel SNC: meccanismi intrinseci
ed estrinseci
Terapia con le cellule staminali
Barriera ematoencefalica
Infiammazione nel SNC
Trasporto assonale nel SNC e nel SNP
Mielinizzazione degli assoni del SNC e del SNP
Processo di mielinizzazione e formazione
della guaina di rivestimento degli assoni
Proprietà elettriche
Potenziale di riposo dei neuroni
Potenziale di membrana dei neuroni e canali
del sodio
Potenziali graduati nei neuroni
Meccanismi dei potenziali postsinaptici
eccitatori e inibitori
Potenziali di azione
Propagazione del potenziale di azione
1.23
1.24
1.25
1.26
1.27
1.28
1.29
1.30
1.31
1.32
1.33
1.34
1.35
1.36
1.37
1.38
1.39
Velocità di conduzione
Classificazione delle fibre nervose periferiche
in base alla dimensione e alla velocità
di conduzione
Elettromiografia e studi della velocità
di conduzione
Inibizione pre- e postsinaptica
Proprietà di sommazione spaziale e temporale
Modelli normali di eccitazione elettrica dei neuroni
corticali, origine e diffusione delle crisi epilettiche
Elettroencefalografia
Tipi di scariche elettriche nelle crisi epilettiche
generalizzate e siti d’azione dei farmaci
antiepilettici
Potenziali evocati visivi e uditivi
Proprietà di segnalazione e neurotrasmissione
Morfologia della sinapsi
Meccanismi di segnalazione molecolare nei neuroni
Rilascio dei neurotrasmettitori
Sintesi, rilascio e segnalazione di più
neurotrasmettitori da parte dei singoli neuroni
Trasduzione del segnale neuronale: regolazione
locale della forza dei potenziali sinaptici
in una sinapsi eccitatoria
Trasduzione del segnale neuronale: regolazione
delle segnalazioni nucleari
Regolazione neuronale mediata da glucocorticoidi
e apoptosi
Neurotrasmissione chimica
4
GENERALITÀ SUL SISTEMA NERVOSO
Dendriti
Spine dendritiche
(gemmule)
Reticolo endoplasmatico rugoso
(sostanza di Nissl)
Ribosomi
Mitocondrio
Nucleo
Assone
Nucleolo
Cono d’emergenza
dell’assone
Segmento iniziale dell’assone
Neurotubuli
Apparato di Golgi
Lisosoma
Corpo cellulare (soma)
Sinapsi asso-somatica
Processi gliali (astrocita)
Sinapsi asso-dendritica
ANATOMIA E CARATTERISTICHE MOLECOLARI
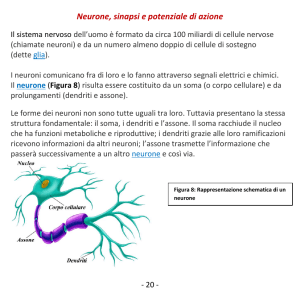
1.1 STRUTTURA DEL NEURONE
La struttura neuronale rispecchia le caratteristiche funzionali del singolo
neurone. L’informazione in arrivo è trasferita a un neurone principalmente attraverso terminazioni assonali a livello del corpo cellulare o
dei dendriti. Queste sinapsi sono isolate e protette dai prolungamenti
degli astrociti. Nella maggior parte dei casi i dendriti rappresentano,
nel loro insieme, la superficie maggiore della cellula nervosa. Alcune
protrusioni delle loro ramificazioni (spine dendritiche) sono i siti di
specifiche sinapsi asso-dendritiche. Ogni tipo di neurone presenta una
caratteristica modalità di ramificazione detta albero o arborizzazione
dendritica. Il corpo cellulare neuronale ha un diametro che va da pochi
micron (µm) fino a oltre 100 µm. Il citoplasma contiene un reticolo
endoplasmatico rugoso (RER) ampiamente rappresentato, che riflette la
notevole sintesi proteica necessaria a mantenere la vita e la funzionalità
del neurone. L’apparato di Golgi è coinvolto nell’accumulo di potenziali messaggeri, nel loro trasporto e nel loro rilascio. Numerosissimi
mitocondri sono necessari per l’enorme richiesta energetica neuronale
e in particolare per mantenere le pompe ioniche e i potenziali di membrana. Ogni neurone ha un unico assone (o, occasionalmente, nessuno), che si origina solitamente dal corpo cellulare o, più raramente,
da un dendrite (per es., nel caso di alcuni neuroni delle regioni cornu
ammoni - CA - dell’ippocampo). Il pirenoforo si assottiglia nell’assone
in corrispondenza del cono di emergenza, da cui origina il tratto iniziale dell’assone, che contiene i canali del Na+, il primo punto in cui si
formano i potenziali di azione. L’assone si estende per una lunghezza
variabile (fino a più di 1 m) dal pirenoforo. Un assone più spesso di
1 o 2 µm è isolato da una guaina mielinica, formata dall’oligodendroglia, nel sistema nervoso centrale (SNC), o dalle cellule di Schwann, nel
sistema nervoso periferico (SNP). Un assone può ramificarsi in più di
500.000 assoni terminali oppure può finire in una zona strettamente
circoscritta (come le proiezioni assoniche somatosensitive primarie per il
tatto finemente discriminativo) o può distribuirsi a molte diverse regioni
del cervello (come le proiezioni noradrenergiche del locus coeruleus).
Un neurone il cui assone termina a distanza dal proprio corpo cellulare e albero dendritico è detto macroneurone o neurone del I tipo di
Golgi; un neurone il cui assone termina localmente, vicino al proprio
pirenoforo e albero dendritico, è detto microneurone o neurone del II
tipo di Golgi, a circuito locale o interneurone. Non esiste un neurone
tipo, poiché ciascun tipo di neurone ha una propria specializzazione.
Tuttavia, il cosiddetto neurone tipo è rappresentato di solito dai neuroni piramidali e dai neuroni motori inferiori.
CORRELAZIONI CLINICHE
I neuroni necessitano di risorse metaboliche straordinarie per sostenere la propria
integrità funzionale, con particolare riferimento al mantenimento dei potenziali
di membrana per l’avvio e la propagazione dei potenziali di azione. I neuroni
necessitano del metabolismo aerobico per generare adenosina trifosfato (ATP) e
non hanno di fatto riserve di ATP, quindi hanno bisogno di un apporto continuo
di glucosio e ossigeno, di solito tra il 15 e il 20% delle risorse dell’organismo, che
rappresenterebbe un consumo di risorse sproporzionato. In situazioni di digiuno,
quando la disponibilità di glucosio è limitata, il cervello può passare gradualmente all’utilizzo di β-idrossibutirrato e acetoacetato come fonti di energia per
il metabolismo neuronale, ma questo processo non è istantaneo e non è in grado
di attenuare episodi acuti di ipoglicemia. Un episodio di ischemia anche di soli 5
minuti, dovuto a un attacco cardiaco o a un infarto, può causare un danno permanente in alcune popolazioni neuronali quali le cellule piramidali della regione
CA1 dell’ippocampo. Nei casi di ischemia prolungata può verificarsi una morte
neuronale estesa. Essendo i neuroni cellule postmitotiche, fatta eccezione per un
piccolo sottoinsieme di interneuroni, una volta morti, questi non vengono sostituiti. Un’altra conseguenza dello stato postmitotico della maggioranza dei neuroni è
che essi non danno origine alla formazione di tumori. I tumori cerebrali derivano
principalmente dalle cellule gliali, ependimali e meningee.
Neuroni e loro proprietà
Dendriti
Neuroni di Purkinje
A. Neurone motore inferiore del midollo
spinale. Sostanza di Nissl (reticolo
endoplasmatico rugoso) colorata in viola.
Il nucleo è chiaro eccetto il nucleolo.
Colorazione Cresil violetto.
5
Assone
Dendriti
Assone
Dendrite
B. Neuroni di Purkinje del cervelletto.
Grosse diramazioni dendritiche
dal corpo cellulare. Le neurofibrille
intraneuronali e i processi nervosi
di fondo (neuropilo) presentano
una colorazione più densa.
Impregnazione argentica.
C. Neurone del midollo spinale.
Dal corpo cellulare emergono
molti dendriti di grandi dimensioni,
mentre l’assone sottile si estende
dal neurone grande a ore 3.
Colorazione con inchiostro.
D. Neurone della formazione reticolare.
L’impregnazione con metalli pesanti
evidenzia il corpo cellulare (pirenoforo)
e tutti i processi di pochi selezionati
neuroni. Colorazione con metodo
di Golgi.
F. Ganglio mesenterico
superiore-celiaco. La fluorescenza
istochimica con acido gliossilico
evidenzia i corpi cellulari
noradrenergici.
G. Ganglio mesenterico
superiore-celiaco. La colorazione
istochimica evidenzia la presenza
dei recettori dell’interleuchina 2
in questi neuroni.
H. Ganglio mesenterico
superiore-celiaco. La colorazione
istochimica per l’acetilcolinesterasi
(AChE) evidenzia la presenza di questo
enzima che scinde l’acetilcolina
in colina e acetil-coenzima A.
Corpi cellulari
neuronali
Interfaccia
E. Corno ventrale del midollo spinale.
I pirenofori e l’ammasso di assoni
e dendriti sono osservabili nel neuropilo
del corno ventrale. L’interfaccia
tra la sostanza grigia e sostanza
bianca è ben evidente. Colorazione
con metodo di Cajal.
Parenchima
Astrociti
Pedicelli
perivascolari
Vascolatura
I. Neuroni del ganglio mesenterico
superiore-celiaco di ratto colorati
con fluorogold, il quale è trasportato
in direzione retrograda dal sito
di iniezione periferico fino al tessuto
nervoso grazie a fibre noradrenergiche
(NA) delle cellule gangliari NA.
J. Immunociti nella zona marginale
della milza. L’ibridizzazione
in situ dimostra la presenza
del gene del fattore di rilascio
della corticotropina (CRF; punti scuri)
in queste cellule non nervose. Il CRF
è un importante fattore di rilascio
secreto da neuroni nel sistema portale
ipotalamo-ipofisario. Il CRF si trova ed
è secreto anche da cellule immunitarie.
K. Astrociti nella sostanza grigia
del SNC i cui processi si estendono
nel neuropilo giungendo alla superficie
dei capillari sanguiferi dotati di barriera
ematoencefalica. Impregnazione
argentica.
L. Assoni provenienti da neuroni
postgangliari ortosimpatici
noradrenergici (NA) che innervano
i vasi e il parenchima (zona dei linfociti
T e zona marginale) della polpa bianca
della milza. Colorazione istochimica
dell’enzima tirosina idrossilasi (TH),
tappa limitante della reazione
enzimatica che ha come substrato la
tirosina per la sintesi di catecolamine.
Guaine
mieliniche
M. Gli stessi assoni NA della figura L.
Colorazione istochimica
a fluorescenza con acido gliossilico
per la norepinefrina.
N. Gli stessi assoni NA della figura M
in aggiunta a iniezione di inchiostro
gel (blu scuro) che mette in evidenza
la vascolarizzazione. L’inchiostro gel
viene anche fagocitato dai macrofagi
della zona marginale.
1.2 STRUTTURA TRIDIMENSIONALE
DEL NEURONE E NEUROISTOLOGIA
O. Fascicoli di assoni mielinizzati
di nervo periferico in sezione trasversa.
La colorazione con osmio evidenzia
gli assoni mielinici, ma non quelli
amielinici.
Nodi di
Ranvier
P. Assoni di nervo periferico in sezione
longitudinale. La colorazione con Oil
red O mostra assoni longitudinali
circondati da guaine mieliniche
(zone pallide), con un’evidente
giustapposizione di guaine a livello
dei nodi di Ranvier.
GENERALITÀ SUL SISTEMA NERVOSO
Processo
gliale
C. Sinapsi con cresta dendritica
B. Sinapsi con spine dendritiche
Assone
Dendrite
Assone
Dendrite o corpo
cellulare
A. Sinapsi semplice asso-dendritica
o asso-somatica
Dendrite
6
Spina
dendritica
(gemmula)
Assone
D. Sinapsi semplice più sinapsi
asso-assonica
Dendrite
Dendrite
E. Sinapsi combinata asso-assonica
e asso-dendritica
F. Bottoni (“boutons en passant”)
Dendrite o corpo cellulare
I. Sinapsi in serie
H. Sinapsi reciproca
G. Sinapsi dendro-dendritica
J. Glomerulo cerebellare
Sinapsi
dendrodendritica
Dendrite
Dendrite
Dendrite
K. Strato plessiforme interno
della retina
Cellula
gangliare
Dendriti delle cellule granulari
Capsula gliale
Assone
di una
cellula
di Golgi
Dendrite di
una cellula
di Golgi
Dendrite o corpo cellulare
Assone
di una cellula muscoide
1.3 TIPI DI SINAPSI
Una sinapsi è il luogo in cui un potenziale di azione in arrivo, attraverso
l’accoppiamento eccitazione-secrezione che coinvolge l’ingresso di ioni
Ca2+, stimola il rilascio di uno o più neurotrasmettitori nella fessura
sinaptica (di solito di 20 nm di ampiezza). Il neurotrasmettitore agisce
sui recettori della membrana neuronale bersaglio, alterando il potenziale di membrana rispetto al suo stato di riposo. Questi potenziali postsinaptici sono chiamati potenziali graduati. La maggior parte delle sinapsi
che portano informazioni verso un neurone bersaglio termina come
sinapsi asso-dendritica o asso-somatica. Sinapsi specializzate, come le
sinapsi reciproche, o complesse serie di interazioni sinaptiche permettono un controllo specifico dell’eccitabilità dei loro neuroni bersaglio. Le
sinapsi dendro-dendritiche aiutano a coordinare l’eccitazione di gruppi
di neuroni collegati (come i neuroni del nucleo frenico che causano la
contrazione del diaframma).
Assone di
una cellula
bipolare
Cellula
di Müller
(di sostegno)
Prolungamenti
di una cellula
amacrina
CORRELAZIONI CLINICHE
Le configurazioni delle sinapsi di popolazioni neuronali chiave in regioni particolari
del cervello e del SNP determinano l’influenza relativa dello stimolo. In corrispondenza della giunzione neuromuscolare, una quantità sufficiente di acetilcolina è di
solito rilasciata in seguito a un potenziale di azione nell’assone motore, al fine di
garantire che il potenziale di placca della cellula muscolare raggiunga la soglia critica
e inneschi un potenziale di azione. Al contrario, stimoli assonali per neuroni della
formazione reticolare e per molti altri tipi di neuroni richiedono una sommazione
spaziale o temporale per consentire al neurone bersaglio di raggiungere la soglia;
tale orchestrazione implica una regolazione multisinaptica coordinata. In alcuni
neuroni principali, quali i neuroni motori inferiori (MNI), lo stimolo proveniente
dai neuroni motori superiori (MNS) del tronco encefalico arriva principalmente
attraverso gli interneuroni del midollo spinale e necessita di una sommazione estesa
di potenziali eccitatori per attivare i MNI; al contrario lo stimolo monosinaptico
in arrivo dai MNS della corteccia motoria ad alcuni MNI, per esempio quelli che
regolano i movimenti fini delle dita, termina vicino al segmento iniziale/cono di
emergenza dell’assone e può così generare direttamente un potenziale di azione
nei MNI. Alcuni gruppi complessi di sinapsi tra diversi elementi neuronali, come
quelli che si riscontrano nel cervelletto e nella retina, permettono la modulazione
di neuroni chiave mediante connessioni sia in serie, sia in parallelo, fornendo la
modulazione laterale dell’eccitabilità neuronale limitrofa.
Neuroni e loro proprietà
7
Cellula bipolare del nervo
cranico VIII
Neurone unipolare
dei gangli sensitivi dei
nervi cranici V, VII, IX o X
Cellula multipolare
(piramidale) della corteccia
cerebrale motoria
Terminazioni associative, commessurali
e talamiche
Astrocita
Muscolo striato
(somatico)
Interneuroni
Vasi sanguigni
Cellule satelliti
Cellule di Schwann
Fibre mieliniche
Terminazioni nervose
libere (fibre amieliniche)
Terminazione incapsulata
Placca
motrice
Motoneurone somatico
multipolare dei nuclei
dei nervi cranici
III, IV, V, VI,
VII, IX, X, XI o XII
Neurone multipolare
dei centri motori
encefalici inferiori
Oligodendrocita
Fibra corticospinale (piramidale)
Terminazione
asso-dendritica
Terminazione
asso-somatica
Terminazione
asso-assonica
Neurone motore
somatico multipolare
del corno anteriore
del midollo spinale
Sostanza di Nissl
Astrocita
Fibra collaterale
Interneurone di Renshaw
(retrogrado)
Fibra motrice somatica mielinica
di un nervo spinale
Terminazione specializzata
Interneurone
Astrocita
Neurone effettore
viscerale multipolare
(autonomo) del
midollo spinale
Fibra nervosa pregangliare
autonoma (simpatica
o parasimpatica)
Guaina mielinica
Neurone postgangliare
autonomo di un ganglio
simpatico o parasimpatico
Cellule satelliti
Fibra afferente mielinica
di un nervo spinale
Guaina mielinica
In rosso: motoneuroni,
neuroni autonomi
pregangliari
In blu: neurone sensitivo
In viola: interneurone
In grigio: cellule gliali
e neurilemmali, mielina
Nota: le cellule
cerebellari non sono
qui raffigurate
Fibra nervosa amielinica
Cellule di Schwann
Guaina mielinica
Guaina mielinica
Cellule di Schwann
Placca terminale motrice
ricoperta da una cellula
di Schwann
Muscolatura
striata (volontaria)
Fuso muscolare
Neurone sensitivo
unipolare del ganglio di
una radice spinale dorsale
Cellule satelliti
Terminazioni sulla
muscolatura
cardiaca o
sulle cellule
nodali
Varicosità
a bottoni e
terminazioni
sulla muscolatura
liscia e sulle
cellule ghiandolari
1.4 CITOTIPI NEURONALI
Gli interneuroni locali e i grandi neuroni di proiezione dimostrano
dimensioni, arborizzazioni dendritiche e proiezioni assonali che sono
caratteristiche per tipo di neurone. Nel SNC (delimitato dalle linee
tratteggiate), le cellule gliali (astrociti, microglia, oligodendroglia) supportano, proteggono e mantengono i neuroni. Le cellule di Schwann e
le cellule satelliti svolgono queste funzioni nel SNP.
I neuroni sensitivi primari (blu) trasformano l’energia o gli stimoli
in arrivo in segnali elettrici che vengono trasferiti al SNC. Il flusso
neuronale in uscita dal SNC è di tipo efferente (rosso) e si dirige o
direttamente alle fibre muscolari scheletriche, attraverso le giunzioni
neuromuscolari, oppure, appartenendo al sistema nervoso autonomo, il
neurone autonomico pregangliare (rosso) contatta i neuroni dei gangli
simpatici, i quali innervano il muscolo cardiaco, la muscolatura liscia,
le ghiandole, le cellule a funzione metabolica o le cellule del sistema
immunitario (effettori). Neuroni diversi dai neuroni sensitivi primari,
come i MNI o i neuroni autonomici pregangliari si trovano nel SNC
costituito da encefalo (racchiuso tra linee tratteggiate in alto) e midollo
spinale (racchiuso tra linee tratteggiate in basso). La rappresentazione
di neuroni e glia non è in scala.
Fibre amieliniche
Terminazioni
nervose libere
Terminazione
incapsulata
Fuso muscolare
CORRELAZIONI CLINICHE
Forma e struttura forniscono la prova del ruolo di quel particolare tipo di neurone.
I neuroni sensitivi dei gangli delle radici dorsali del midollo spinale non hanno di
fatto alcuna sinapsi sul pirenoforo; il recettore sensoriale è contiguo al segmento
periferico dell’assone per consentire l’attivazione diretta del segmento iniziale al
raggiungimento di uno stimolo soglia. Questa configurazione non dà alcuna possibilità di controllo centrifugo (da parte del SNC) dell’impulso sensoriale iniziale
periferico (SNP); tuttavia, il controllo e l’analisi di tale impulso avvengono successivamente nel SNC. I neuroni di Purkinje nel cervelletto hanno enormi alberi
dendritici su un singolo piano; l’attivazione avviene mediante centinaia di fibre
parallele e l’eccitabilità di fondo (background) è influenzata dal controllo delle fibre
rampicanti. Questo tipo di disposizione consente la modulazione in rete del segnale
delle cellule di Purkinje, grazie a neuroni dei nuclei intrinseci del cervelletto, diretta
verso i MNS, un meccanismo di controllo che permette adattamenti fini e continui
di attività motorie coordinate e uniformi. I piccoli interneuroni in molte regioni
hanno funzioni locali e specializzate grazie a connessioni a circuito locale, mentre i
grandi neuroni isodendritici della formazione reticolare ricevono un impulso non
locale, polimodale e diffuso, che è importante in fase di risveglio (arousal) per l’attivazione generale della corteccia cerebrale e il passaggio allo stato di coscienza. Un
danno a questi neuroni chiave può generare il coma. I MNI e i neuroni autonomici
pregangliari ricevono un’enorme convergenza di stimoli sui propri dendriti e corpi
cellulari dovendo coordinare vie effettrici comuni, attraverso le quali i tessuti effettori periferici ricevono segnali che determinano il comportamento.
8
GENERALITÀ SUL SISTEMA NERVOSO
Ventricolo
Cellula
microgliale
Ependima
Tanicita
Neurone
Oligodendrocita
Assone
Astrocita
Pedicelli astrocitari
Pericita
perivascolare
Pia madre
1.5 CITOTIPI GLIALI E NON GLIALI
Gli astrociti forniscono isolamento strutturale ai neuroni e alle loro
sinapsi, importano ioni (K+), offrono supporto nutritizionale ai neuroni
e intervengono nella loro crescita e attività di “signaling”.
L’oligodendroglia (oligodendrociti) è responsabile della mielinizzazione degli assoni nel SNC. Le cellule della microglia partecipano
alla fagocitosi, alle risposte infiammatorie, alla secrezione di citochine
Capillare
e di fattori di crescita e ad alcune reazioni immunitarie nel SNC. Le
cellule perivascolari concorrono a simili attività in vicinanza dei vasi
sanguigni. Le cellule di Schwann formano la guaina mielinica assonale
in periferia, contribuendo alla loro nutrizione, crescita e riparazione.
I linfociti T attivati, attraversando i microvasi, possono normalmente entrare nel SNC, garantendo l’immunosorveglianza per circa
24 ore dal loro ingresso.
Neuroni e loro proprietà
Domini poliedrici tridimensionali non sovrapposti
Processi “a cespuglio” che riempiono
lo spazio interno ai domini tridimensionali
9
Fisiologia degli astrociti
Sostegno metabolico dei neuroni
- Produzione di lattato per i neuroni
- Glicogenesi
Equilibrio ionico:
- Tamponamento di ioni K+
- Equilibrio del pH
Fattori di crescita neuronale
Formazione di tessuto cicatriziale gliale
100-200µm
Neurone
(non in scala)
Lattato
K+
Sinapsi
Isolamento
sinaptico
Giunzioni tipo gap tra astrociti adiacenti
che formano un sincizio funzionale
Equilibrio
ionico
Arteriola
K+
Cellula endoteliale
Pedicelli astrocitari:
- Avvolgimento di arteriole e capillari
- Trasporto di acqua tramite
acquaporina 4
- Rilascio di ’gliotrasmettitori‘
(glutammato, ATP, adenosina ecc.)
- Regolazione della formazione
di giunzioni tight dell’endotelio Pedicelli
- Regolazione della vasodilatazione
astrogliali
e dell’afflusso ematico
all’encefalo
Isolamento sinaptico
Cellula muscolare
liscia dei vasi
1.6 BIOLOGIA DEGLI ASTROCITI
Gli astrociti sono le cellule gliali più numerose nel SNC. Essi hanno
origine dal neuroectoderma e sono intimamente associati ai processi
neurali, alle sinapsi, ai vasi sanguigni e alla superficie piale ed ependimale
che riveste il SNC. Gli astrociti della sostanza grigia sono definiti astrociti protoplasmatici, mentre quelli della sostanza bianca sono conosciuti
come astrociti fibrosi. Il soma può avere un diametro variabile che va
da pochi µm a 10 o più µm. Gli astrociti sono disposti in domini poliedrici tridimensionali che non si sovrappongono tra di loro e presentano
dimensioni da lato a lato di 100-200 µm (fino a 400 µm negli ominidi).
Dal punto di vista strutturale, i processi degli astrociti si interdigitano, in
modo tale da formare un sincizio che protegge le sinapsi, collocandosi a
meno di 1 µm da queste strutture. I pedicelli astrocitari sono in contatto
Ricaptazione di
glutammato
e GABA
Processi a carico degli astrociti:
- Circondare e isolare le sinapsi
- Equilibrio ionico (tamponamento K+ e pH)
- Ricaptazione di glutammato e GABA dalla sinapsi
- Disattivazione del glutammato con trasformazione
in glutammina e riciclo della glutammina
con le cellule dell’endotelio vasale e le cellule muscolari lisce adiacenti.
I processi degli astrociti rivestono dall’interno l’intera superficie piale.
Dal punto di vista fisiologico, i processi degli astrociti incidono
sull’equilibrio ionico (sequestrano K+), trasportano acqua attraverso
i canali di acquaporina 4, assorbono e riciclano glutammato e GABA,
forniscono sostegno metabolico ai neuroni e, come astrociti reattivi,
possono concorrere alla formazione di una cicatrice gliale in seguito a
lesioni a carico del SNC. Gli astrociti possono, inoltre, rilasciare fattori
di crescita e molecole bioattive (denominate gliotrasmettitori), come
glutammato, ATP e adenosina. Durante lo sviluppo, alcuni astrociti
specializzati, chiamati glia radiale, forniscono un’impalcatura per le
ordinate migrazioni neuronali nel SNC.
10
GENERALITÀ SUL SISTEMA NERVOSO
Microglia a riposo
I processi della microglia
controllano continuamente
l’ambiente locale
I processi della microglia entrano spesso
(¾ una volta all’ora) in contatto con le sinapsi
per rilevare l’attività sinaptica
Neurone
(non in scala)
Risposta a lesione
o agenti patogeni
Danno cellulare, apoptosi
Agenti patogeni
ATP
delle cellule
danneggiate
PAMP
(LPS batterici,
RNA virale ecc.)
DAMP
Flusso di ioni
Recettori toll-like
(TLR)
NF-kB, MAPK
Il rimodellamento
e la rimozione delle sinapsi
("smantellamento delle sinapsi")
contribuiscono alla plasticità
sinaptica
K+
Canali
regolati
dai recettori
purinergici
Recettori NOD-like
(NLR)
Caspasi-1
Nucleo
Pro-IL-1b
Pro-IL-18
IL-1b
IL-18
ATTIVAZIONE
Microglia attivata
Forma ameboide
Meno processi, più corti e più spessi
Rilascio di molecole di segnalazione
Interleuchine,
citochine
Rilascio di:
- Specie reattive dell’ossigeno (%O2–)
- Specie reattive dell’azoto (NO)
- Citochine proinfiammatorie (IL-1`, IL-6, TNF)
- Metalloproteinasi di matrice
- Fattori neurotrofici (NGF, TGF-`,
neurotrofina-4/5, GDNF, FGF)
L’interazione
Linfocita
con i linfociti T può
T
Presentazione
determinare il fenotipo
dell’antigene
della microglia (M1, M2)
Fagocitosi di agenti patogeni
e detriti cellulari
1.7 BIOLOGIA DELLA MICROGLIA
Le cellule della microglia sono cellule mesenchimali residenti nel SNC,
ma che hanno origine dal sacco vitellino. Si tratta di una popolazione cellulare unica, con capacità di autorigenerazione. Le cellule della microglia
sorvegliano costantemente il microambiente locale, spostandosi avanti e
indietro a una velocità che può raggiungere 1,5 µm/min. I processi delle
cellule della microglia possono allungarsi o accorciarsi di 2-3 µm/min. I
territori sorvegliati da queste cellule hanno una larghezza di 15-30 µm e
sono minimamente sovrapposti gli uni agli altri. La microglia a riposo
ha diametro medio del soma di 5-6 µm, mentre la microglia attivata ha
aspetto ameboide, con soma di circa 10 µm di diametro.
Le cellule della microglia possono fagocitare detriti e cellule apoptotiche, rimodellare ed eliminare sinapsi del SNC adulto o in fase di
sviluppo, nonché reagire a lesioni o agenti patogeni. Queste cellule
presentano recettori per diversi tipi di stimoli, quali, per esempio, ATP
(indicatore di lesioni locali) o i recettori toll-like (TLR) che rispondono
a molecole rilasciate da cellule morenti (DAMP, Damage-Associated
Molecular Pattern) o patogeni (PAMP, Pathogen-Associated Molecular
Pattern), come LPS dei batteri gram-negativi o RNA a doppio filamento dei virus.
La microglia reattiva produce specie reattive dell’ossigeno (ROS),
specie reattive dell’azoto (RNS, come NO), citochine proinfiammatorie (IL-1β, IL-6, TNF-α), metalloproteasi di matrice (MMP) e fattori
neurotrofici (quali NGF, TGF-β, neurotrofina 4/5, GDNF, FGF). Queste
molecole di segnalazione prodotte dalla microglia attivata sono in grado
di influenzare negativamente la funzione di neuroni e astrociti.
Neuroni e loro proprietà
11
Maturazione degli oligodendrociti
L’attività funzionale dei neuroni attiva la mielinizzazione da parte delle cellule precursori degli oligodendrociti (OPC)
I segnali di richiesta di mielinizzazione
comprendono ATP, K+, glutammato, GABA
e molecole di adesione cellulare
NG2+ OPC
Fisiologia degli oligodendrociti
Segmenti adiacenti degli assoni vengono
mielinizzati da oligodendrociti differenti
Un solo oligodendrocita
mielinizza in media 30 assoni
Guaina mielinica
Il trasportatore monocarbossilato 1 (MCT1) trasferisce lattato,
piruvato e corpi chetonici dagli oligodendrociti
Mitocondrio
agli assoni attraverso la guaina mielinica
Nodo
di Ranvier
Canali del sodio
Strati fusi di membrana
cellulare formata da oligodendrociti,
avvolti attorno a un assone nel sistema
nervoso centrale
Masse piccolissime di citoplasma intrappolate
tra due strati fusi di membrana.
1.8 BIOLOGIA DEGLI OLIGODENDROCITI
Gli oligodendrociti sono cellule gliali che derivano dal neuroectoderma
e ricoprono l’importante ruolo di mielinizzare gli assoni centrali del
SNC. I fattori che possono innescare la mielinizzazione sono il diametro
degli assoni da rivestire e la presenza di molecole di segnalazione (quali
ATP, K+, glutammato, GABA e alcune molecole di adesione cellulare).
Ciascun oligodendrocita è in grado di mielinizzare singoli segmenti
internodali in media di 30 assoni (fino a un massimo di 60 assoni);
i segmenti internodali adiacenti sono mielinizzati da oligodendrociti
differenti. Nel SNC, questo schema di mielinizzazione lascia scoperti, a
intervalli regolari, i cosiddetti nodi di Ranvier, dotati di canali del sodio,
in corrispondenza dei quali si verificano i potenziali di azione durante
la propagazione dell’impulso nervoso lungo l’assone ricoperto dalla
guaina mielinica e le relative diramazioni (questo fenomeno è definito
conduzione saltatoria).
Gli oligodendrociti possono subire l’attacco di anticorpi diretti contro
specifiche proteine degli oligodendrociti in pazienti affetti da sclerosi
multipla, causando demielinizzazione e disfunzione assonale. Le cellule
precursori degli oligodendrociti (OPCs) possono replicarsi in seguito a
tali attacchi e remielinizzare i segmenti scoperti degli assoni. Le membrane degli oligodendrociti presentano il trasportatore monocarbossilato MCT1, in grado di trasferire il lattato, il piruvato e i corpi chetonici
all’assone. Le OPCs sono presenti nel SNC adulto ed esprimono NG2
e recettore α del PDGF.
12
GENERALITÀ SUL SISTEMA NERVOSO
I. Crescita (es., differenziazione neuronale, allungamento degli assoni)
Neurone
Fattori di crescita
Tessuto bersaglio
Allungamento degli assoni
II. Segnalazione autocrina e paracrina tra neuroni
Neurone
Segnalazione
autocrina
Segnalazione paracrina
La segnalazione inibisce l’apoptosi, stimola la sopravvivenza dei neuroni
e si occupa del mantenimento delle sinapsi
III. Segnalazione reciproca (es., giunzione neuro-muscolare)
Mantenimento
del neurone
(es., GDNF)
Neurone
Muscolo
Mantenimento
del muscolo
(es., agrina)
Fattore di crescita Origine
Recettore
Importante per:
NGF
Epidermide,
ippocampo?
TrkA, p75
Neuroni cutanei nocicettivi (piccoli neuroni del ganglio dorsale)
Neuroni del sistema nervoso simpatico
Neuroni colinergici del prosencefalo basale (non esclusivo fattore di crescita necessario)
BDNF
Sedi diverse
TrkB, p75
Plasticità sinaptica
Nel SNP, i topi con delezione del gene (KO) del BDNF mostrano perdita di neuroni del ganglio vestibolare
NT3
Organi tendinei TrkC, p75
del Golgi e fusi
neuromuscolari
Perdita di neuroni sensitivi propriocettivi nel ganglio della radice dorsale
Nessun motoneurone gamma; i topi muoiono alla nascita
NT4
Sedi diverse
TrkB, p75
Nessun fenotipo
GDNF
Muscolo
Grfa1, Ret
Perdita muscolare parziale
CNTF
Muscolo?
CNTFRa, gp130
Parziale perdita muscolare osservata nel KO di CNTFR_, mentre nessuna perdita in KO
di CNTF grazie all’azione di LIF
IGF-1
Muscolo
IGFR-1, IGFR-2
Perdita muscolare parziale
VEGF
Muscolo
Flk-1, Flt-1, Flt-4
Fatale in epoca embrionale perché necessario per l’angiogenesi
NGF, nerve growth factor; BDNF, brain derived neurotrophic factor; NT3 e NT4, neurotrophic 3 e 4; GDNF, glial cell-line derived neurotrophic factor;
CNTF, ciliary neurotrophic factor; IGF-1, insulin-like growth factor 1; VEGF, vascular endothelial growth factor; Trk, tyrosine kinase; KO, knock out; LIF, leukemia inhibitory factor
1.9 FATTORI DI CRESCITA NEURONALE
E FATTORI TROFICI
I fattori di crescita neuronale e i fattori trofici sono molecole di segnalazione prodotte da neuroni, glia e tessuti bersaglio (effettori, recettori; N.d.C), le quali possono incidere sulla differenziazione neuronale,
sulla crescita assonale, sull’istituzione di contatti per la segnalazione,
sul mantenimento dei contatti tra neuroni e loro destinazioni centrali e
periferiche, e altre funzioni. Questi fattori agiscono mediante recettori
specifici e possono stimolare la produzione di determinate molecole,
di cui un esempio è l’agrina che funge da ancoraggio dei recettori colinergici nicotinici in corrispondenza della giunzione neuromuscolare.
Nella tabella sopra sono elencati numerosi fattori di crescita identificati,
i relativi recettori e i loro ruoli potenziali.