Esercitazione chimica – Nomenclatura
29/03/11
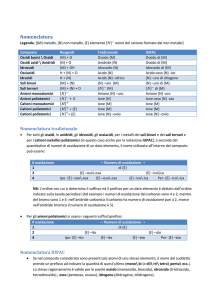
Un elemento viene espresso cosi:
A: n° di massa -> somma di neutroni e protoni contenuti nel nucleo
Z: n° atomico -> numero di protoni contenuti nel nucleo
y: carica della specie ionica
n: n° di atomi dell’elemento X presenti nella molecola
isotopo:
un elemento ha diversi isotopi quando un elemento esiste con differenti numeri di massa, ovvero si
presenta con diverso numero di neutroni. Es.:
8 protoni e 10 neutroni,
8 protoni e 8 neutroni.
Ioni
Cationi
Sono ioni a carica positiva, significa che all’atomo dell’elemento vengono sottratti degli elettroni. Questa
operazione è più semplice nei metalli, in quanto se si tolgono pochi elettroni, la configurazione di quelli
rimanenti tende ad essere la stessa del gas nobile precedente, completando cosi il guscio più esterno.
Cationi monoatomici
Nomenclatura:
IUPAC: ione + nome elemento + n° di ossidazione
Tradizionale: ione + nome elemento + (se esistono più di uno ione) –ico (n° ossidazione più elevato)
–oso (n° di ossidazione meno elevato)
Es.:
IUPAC
Nomenclatura tradizionale
Ione rame (II)
Ione rameico
Ione rame (I)
Ione rameoso
Ione ferro (III)
Ione ferrico
Ione ferro (II)
Ione ferroso
Ione sodio
Ione sodio
Ione calcio
Ione calcio
Ione zinco
Ione zinco
Cationi poliatomici
non metalli + H
Nomenclatura: ione + nome del non metallo + -onio
Es.:
ione ossonio
ione fosfonio
ione ammonio
Elemento + O
Nomenclatura: ione + nome dell’elemento + -ile
Es:
ione bismutile
ione fosfonio
ione ammonio
Anioni
Sono ioni a carica negativa, significa che all’atomo dell’elemento vengono aggiunti degli elettroni. Questa
operazione è più semplice nei non metalli, in quanto se si aggiungono pochi elettroni, la nuova
configurazione tende ad essere la stessa del gas nobile successivo, completando cosi il guscio più esterno.
Anioni monoatomici
Nomenclatura: ione + nome elemento + -uro
Es.:
ione cloruro
ione ioduro
Eccezioni:
ione ossiduro
ione bromuro
ione fluoruro
ione nitruro
Anioni poliatomici
Nomenclatura: ione + (mono-bi-tri..) + nome dell’elemento meno elettronegativo + nome dell’elemento più
elettronegativo + -ato + numero di ossidazione
Es.:
ione tetrafluoroborato (III)
ione esafluorosilicato (IV)
Osso anioni:
Sono formati da O + non metallo
Nomenclatura:
IUPAC: ione + n° atomi O (mono-di-tri) + osso + nome del non metallo + ato + n° di ossidazione
Tradizionale: ione + nome elemento + -ato
con 2 stati di ossidazione:
ione + nome elemento + –ato (molecola contenente più ossigeno)
ione + nome elemento + –ito (molecola contenente meno ossigeno)
con 4 stati di ossidazione:
ione + -ipo + nome elemento + -ito
(meno ossigeno)
ione + nome elemento + -ito
ione + nome elemento + -ato
ione + -per + nome elemento + -ato
(più ossigeno)
Nomenclatura IUPAC
Ione triossocarbonato (IV)
Ione tetraossosolfato (VI)
Ione triossosolfato (IV)
Ione triossonitrato (V)
Nomenclatura tradizionale
Ione carbonato
Ione solfato
ione solfito
Ione nitrato
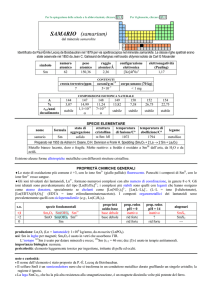
Composti
Metallo + non metallo
Nomenclatura:
IUPAC: non metallo + -uro + di + metallo + (se necessario) stato di ossidazione
Tradizionale:
Nome non metallo + -uro + di + nome metallo + -ico (stato ossidazione più elevato)
Nome non metallo + -uro + di + nome metallo + -oso (stato ossidazione più basso)
Formula: per primo il metallo
Es.:
Nomenclatura IUPAC
Nomenclatura tradizionale
Cloruro di ferro (II)
Cloruro ferroso
Cloruro di ferro (IV)
Cloruro ferrico
Cloruro di stagno (II)
Cloruro stagnoso
Cloruro di stagno (IV)
Cloruro stannico
Non metallo + non metallo
Nomenclatura: : Nome dell’elemento più elettronegativo + -uro + di + nome dell’elemento meno
elettronegativo
Formula: per primo l’elemento meno elettronegativo
La successione dell’elettronegatività dei non metalli:
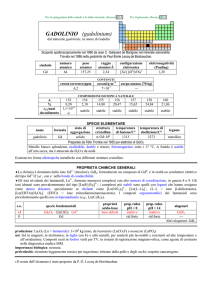
Ossidi: (elemento + O)
Nomenclatura:
IUPAC: mono – di –tri + ossido + nome elemento (tranne F che forma il fluoruro )
Tradizionale: vengono divisi in 3 categorie:
metallo + O : ossidi basici
non metallo + O : ossidi acidi o anidridi
semimetallo + O : ossidi anfoteri
Formula: prima l’elemento e poi O (tranne
)
Es.:
Nomenclatura IUPAC
Nomenclatura tradizionale
Diossido di azoto
Biossido di azoto
Diossido di carbonio
Anidride carbonica
Triossido di zolfo
Anidride solforica
Biossido di zolfo
Anidride solforosa
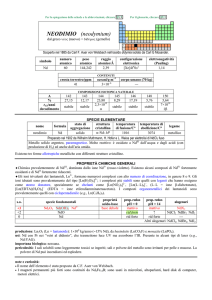
Acidi:
idracidi: (H + gruppo VI o gruppo VII o ione cianuro)
Nomenclatura:
IUPAC: non metallo + -uro + di idrogeno
Tradizionale: acido + non metallo + -idrico
Es.:
Nomenclatura IUPAC
Cloruro di idrogeno
Bromuro di idrogeno
Fluoruro di idrogeno
Solfuro di idrogeno
Cianuro di idrogeno
Nomenclatura tradizionale
Acido cloridrico
Acido brumidrico
Acido fluoridrico
Acido solfidrico
Acido cianidrico
Ossoacidi: (H + ossoanione)
Di solito si ricavano per reazione tra un ossido acido (anidride) e
Nomenclatura: acido + nome ossoanione + stato di ossidazione + di idrogeno
Idrossidi (idrati) :
+ cationi metallici
Sali:
catione metallico + anione
Nomenclatura: nome anione + di + nome catione
Formula: catione + anione
Sali acidi:
Si dicono Sali acidi le molecole di sale che contengono al loro interno una o più molecole di idrogeno (
Sali basici:
Si dicono Sali basici le molecole di sale che contengono al loro interno una o più molecole di idrossido (
Sali idrati:
Si dicono Sali idrati le molecole di sale che contengono al loro interno la molecola d’acqua (