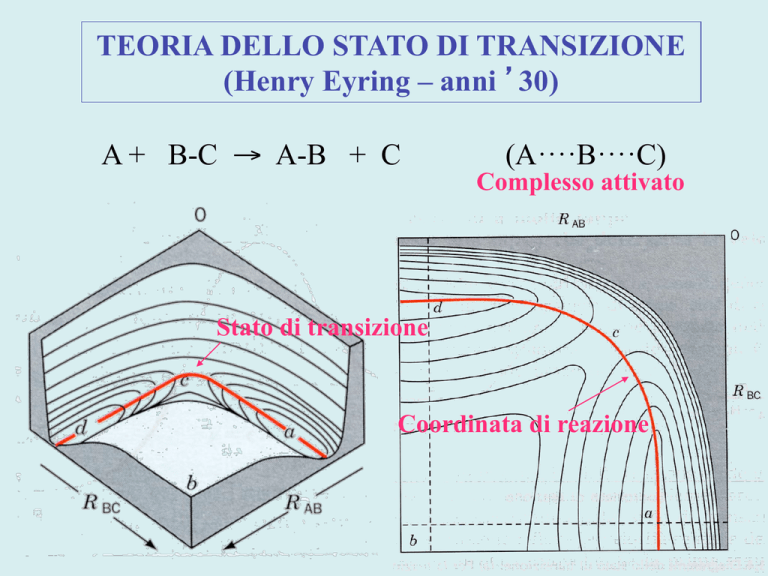
TEORIA DELLO STATO DI TRANSIZIONE
(Henry Eyring – anni 30)
A + B-C → A-B + C
(A····B····C)
Complesso attivato
Stato di transizione
Coordinata di reazione
H A − H B + HC → H A + H B − HC
K
k'
A + B ←→ X
→ P + Q
d [P ]
− ΔG / RT
[A][B]
= k'e
dt
Energia di attivazione
Aumento della velocità ≈
e
ΔΔG
RT
10 volte ≈ 5,7 KJ mole-1
1 milione di volte ≈ 34 KJ mole-1
Dipendenza dalla temperatura
Q10 ≈ 2
Dipendenza dal pH
CINETICA
ENZIMATICA
invertasi
saccarosio + H 2O → glu cos io + fruttosio
1902 – Adrian Brown dimostrò che quando la
concentrazione del saccarosio è molto più alta
di quella dell enzima, la velocità della reazione
diventa indipendente da quella del substrato:
la velocità è di ORDINE ZERO rispetto al saccarosio
k1
k2
E + S←
→ ES → P + E
k −1
d [P ]
v=
= k2 [ES ]
dt
Non può essere integrata a meno di
assunzioni semplificatrici
d [ES ]
= k1 [E ][S ]− k−1 [ES ]− k2 [ES ]
dt
ASSUNZIONE DI EQUILIBRIO
1913 – Leonor Michaelis e Maude Menten, lavorando
su una precedente ipotesi di Victor Henri, assunsero che
k-1>>k2, cioè che la prima tappa della reazione potesse
raggiungere l equilibrio.
k −1 [E ][S ]
KS =
=
[ES ]
k1
ASSUNZIONE DI STATO STAZIONARIO
(G.E Briggs e James B.S. Haldane)
FASI DI UNA REAZIONE
CATALIZZATA DA UN ENZIMA
(nelle condizioni fisiologiche,
per cui [S] >> [E]):
k1
k2
E+S←
→
ES
→
P+E
k−1
1) Fase pre-stazionaria
2) Fase stazionaria
(quando la reazione ha
raggiunto un equilibrio
dinamico)
d [ES ]
=0
dt
k1
k2
E + S←
→ ES → P + E
k1[E][S ] = (k−1 + k2 )[ES ]
k −1
[E]T = [E]+ [ES ]
k 1 ([E ]T − [ES ])[S ] = (k−1 + k2 )[ES ]
k −1 + k 2
KM =
k1
[
E ]T [S ]
[ES ] =
K M + [S ]
[
E ]T [S ]
[ES ] =
K M + [S ]
[
E ]T [S ]
v0 = k 2
K M + [S ]
[S ] = K M
S
1
=
S + Km 2
1
v0 = Vmax
2
d [P ]
v=
= k2 [ES ]
dt
v0 = Vmax
S
S + Km
Equazione di Michaelis - Menten
GRAFICO DEI DOPPI RECIPROCI
L equazione di Michaelis – Menten può essere trasformata in una equazione
lineare rispetto a 1/v0
Km 1
1
1
=
+
v0 Vmax Vmax [ S ]
La costante catalitica di un enzima (kcat) è il numero di cicli catalitici completati
nell unità di tempo. Viene anche chiamata numero di turnover di un enzima ed
è di fatto una frequenza.
kcat
Vmax
=
ETOT
Il rapporto kcat/Km (costante di specificità) è una misura dell efficienza catalitica
di un enzima:
S << K m
v0 ≈ Vmax
S
Km
v0 ≈ ETOT kcat
S
Km
v 0 ≈ ETOT
k cat
S
Km
LO STUDIO DELLA CINETICA ALLO STATO STAZIONARIO
NON DA MOLTE INFORMAZIONI SUL MECCANISMO DI REAZIONE
Allo stato stazionario possiamo solo misurare il flusso in uscita o in entrata,
i quali sono uguali tra loro. Possiamo comunque ottenere alcune informazioni
sul meccanismo di reazione variando le condizioni sperimentali (dipendenza dal pH)
INIBIZIONE
ENZIMATICA
INIBIZIONE COMPETITIVA
v0 = Vmax
[S ]
[S ]+ αK m
1 αK M 1
1
=
+
v0 vmax [S ] vmax
INIBIZIONE INCOMPETITIVA
[
S]
v0 = Vmax
α ' [S ]+ K m
1 KM 1
α'
=
+
v0 vmax [S ] vmax
INIBIZIONE MISTA
[
S]
v0 = Vmax
α ' [S ]+ αK m
1 αK M 1
α'
=
+
v0 vmax [S ] vmax
Vmax/α
αKM/α
INATTIVAZIONE DEGLI ENZIMI
REVERSIBILE
{
IRREVERSIBILE
{
• COMPETITIVA
• INCOMPETITIVA
• MISTA
• ASPECIFICA PER IL TIPO DI ENZIMA
• BASATA SUL MECCANISMO DI REAZIONE
DELL ENZIMA (inibitori suicidi)
E+I
EI ↔ E + P
→
X
La VIGABATRINA: un farmaco contro l epilessia.
• L acido γ-aminobutirrico (GABA) è uno dei principali neurotrasmettitori inibitori del
sistema nervoso centrale
COO -
COO -
CH2
CH2
CO2
CH2
CH2
3
+HN
C
H
H+
COO -
L-glutammato
3
+HN
C
H
H
glutammato
decarbossilasi
GABA
COO -
COO-
COO-
COO -
CH2
CH2
CH2
CH2
CH2
CH2
+
CH2
+HN
3
C
H
H
GABA
O
C
COO-
α-chetoglutarato
GABA
aminotrasferasi
O
+
C
H
Succinico semialdeide
CH2
3
+HN
C
H
COO -
L-glutammato
L epilessia può essere trattata aumentando la concentrazione di GABA
nel sistema nervoso centrale. Un metodo per ottenere questo risultato è
quello di inibire in modo specifico la GABA aminotrasferasi
3
+HN
COO -
COO-
CH2
CH2
CH2
CH2
C
H
H
GABA
+
3HN
C
H
H
C
CH2
4-amino-5-esanoato
VIGABATRINA
La VIGABATRINA, un analogo del GABA, è un efficiente inibitore
della GABA aminotrasferasi ed è attualmente utilizzata con successo
nel trattamento dell epilessia
MECCANISMO DI INIBIZIONE DELLA VIGABATRINA
Lys329
75%
R
H
H
NH
NH
Py
ENZIMA
INATTIVATO
25%
REAZIONI A DUE SUBSTRATI
Le reazioni a due substrati sono quasi sempre reazioni di trasferimento
A+BP+Q
A-X + B A + B-X
Il trasferimento può avvenire:
• tramite un singolo spostamento : REAZIONI SEQUENZIALI O
A SINGOLO SPOSTAMENTO
• tramite un doppio spostamento: REAZIONI PING - PONG O
A DOPPIO SPOSTAMENTO
REAZIONI A SINGOLO SPOSTAMENTO (o sequenziali)
In questo tipo di reazioni entrambi i substrati devono legarsi
all enzima affinché possa avvenire la reazione
1) Meccanismo casuale
2) Meccanismo ordinato
REAZIONI A DOPPIO SPOSTAMENTO (o ping-pong)
In questo tipo di reazioni un prodotto viene rilasciato prima che
entrambi i substrati si siano legati
Esempio:
Esperimenti di scambio isotopico o di cinetica
1) Saccarosio fosforilasi
glucosio-fruttosio + fosfato ⇔ glucosio-1-fosfato + fruttosio
Il meccanismo è a ping pong
2) Maltosio fosforilasi
glucosio-glucosio + fosfato ⇔ glucosio-1-fosfato + glucosio
Il meccanismo è sequenziale
REGOLAZIONE
ENZIMATICA
REGOLAZIONE DELL ATTIVITA
ENZIMATICA
• Coordinare i processi metabolici
• Rispondere a variazioni dell ambiente
• Crescere e differenziarsi
REGOLAZIONE DELL ATTIVITA
ENZIMATICA
• Controllo della disponibilità dell enzima
1.
Controllo genetico sulla produzione di enzimi (da
minuti a ore). Attivazione o terminazione di una
determinata via metabolica
2.
Degradazione proteica
REGOLAZIONE DELL ATTIVITA
ENZIMATICA
• Controllo dell attività enzimatica
• L attività enzimatica è regolata dalla concentrazione dei substrati
presenti e disponibili.
• La velocità della reazione enzimatica diminuisce quando diventa
cospicua la reazione contraria P S (una volta raggiunto l equilibrio
la velocità apparente della reazione diventa uguale a zero).
• Inibizione da prodotto, ma anche inibizione da substrato
REGOLAZIONE DELL ATTIVITA
ENZIMATICA
• Modificazioni dell enzima
• Modificazione covalente (molto rapida, secondi)
REGOLAZIONE DELL ATTIVITA
ENZIMATICA
1.
Regolazione allosterica. Diversi effettori.
Prontamente reversibile.
2.
Zimogeni. Accensione di un processo metabolico nel
luogo e nel momento giusto. Irreversibile.
Emofilia classica
REGOLAZIONE DELL ATTIVITA
ENZIMATICA
• Isozimi
• Proteine modulatrici
REGOLAZIONE DELL ATTIVITA
ENZIMATICA
• ALLOSTERIA
Modello di Monod-Wyman-Changeux (modello concertato)
Equilibrio tra due forme T0 R0
L=
T0
R0
Costanti di dissociazione KT >> KR, ossia
KR
KT
≈
0
L=
T0
R0
c=
KR
KT
Effetti eterotropici POSITIVI e NEGATIVI
REGOLAZIONE DELL ATTIVITA
ENZIMATICA
ESEMPIO : l aspartato transcarbamilasi
REGOLAZIONE DELL ATTIVITA
ENZIMATICA
ESEMPIO : l aspartato transcarbamilasi
L INIBIZIONE RETROATTIVA
(a FEEDBACK )
c6 r6
(2c3 + 3r2)
Stato T
Stato R
DETERMINAZIONE DELLE STRUTTURE T e R
• PALA si lega alla forma R
• CTP si lega alla forma T
MODELLO SEQUENZIALE DI
KOSHLAND
• Il legame del substrato e il cambiamento conformazionale
sono due fenomeni
distinti e sequenziali
• Trasmissione del segnale
allosterico attraverso
la comunicazione
all interfaccia delle subunità