SEZIONE SCIENTIFICA - Patologia in pillole
PATOLOGIA IN PILLOLE
Nr. 82
J. Barizzi, F. Quadri
Storia clinica
Uomo di 62 anni, forte fumatore, in
esiti di carcinoma renale a cellule
chiare operato nel 2007. Una radiografia polmonare effettuata nel contesto di persistenza di bronchite evidenzia un nodulo al lobo inferiore
sinistro di circa 1,2 cm. Viene eseguita una broncoscopia che, quale
reperto incidentale, rivela un’alterazione polipoide di 0.1 cm nel bronco
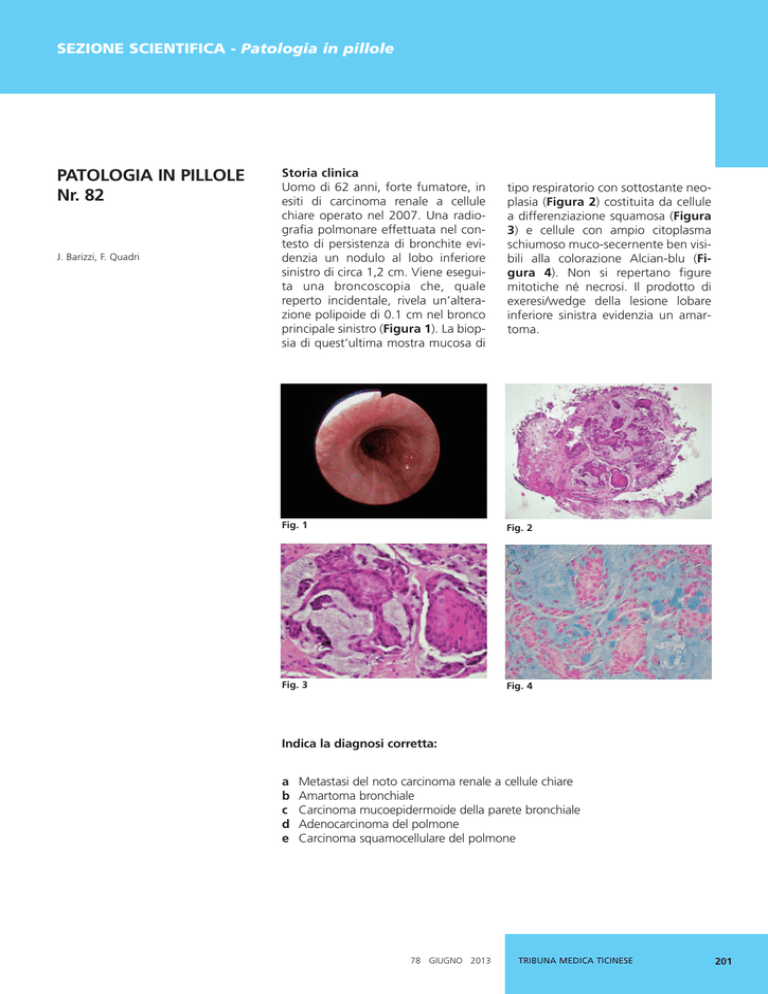
principale sinistro (Figura 1). La biopsia di quest’ultima mostra mucosa di
tipo respiratorio con sottostante neoplasia (Figura 2) costituita da cellule
a differenziazione squamosa (Figura
3) e cellule con ampio citoplasma
schiumoso muco-secernente ben visibili alla colorazione Alcian-blu (Figura 4). Non si repertano figure
mitotiche né necrosi. Il prodotto di
exeresi/wedge della lesione lobare
inferiore sinistra evidenzia un amartoma.
Fig. 1
Fig. 2
Fig. 3
Fig. 4
Indica la diagnosi corretta:
a
b
c
d
e
Metastasi del noto carcinoma renale a cellule chiare
Amartoma bronchiale
Carcinoma mucoepidermoide della parete bronchiale
Adenocarcinoma del polmone
Carcinoma squamocellulare del polmone
78 GIUGNO 2013
TRIBUNA MEDICA TICINESE
201
SEZIONE SCIENTIFICA - Patologia in pillole
Diagnosi
Carcinoma mucoepidermoide della parete bronchiale
Commento
Il carcinoma mucoepidermoide (MEC
= mucoepidermoid carcinoma) è la
neoplasia maligna più frequente
delle ghiandole salivari ma rappresenta meno dell'1% delle neoplasie
polmonari/bronchiali. In quest’ultimo e più raro contesto, essa insorge
in pazienti di tutte le età (3-78 anni)
e nel 50% dei casi si manifesta prima
dei 30 anni, con una lieve predilezione per gli uomini. Esiste una chiara
associazione con il consumo di
tabacco. La neoplasia è localizzata
nei grossi bronchi o, meno frequentemente, nella trachea e condiziona
una sintomatologia di tipo ostruttivo: tosse, emoptisi, dispnea, febbre e
polmonite.
Radiologicamente, se di dimensioni
significative, il MEC si presenta come
un nodulo endobronchiale ben delimitato e occasionalmente calcifico.
Macroscopicamente si può osservare
una lesione polipoide endobronchiale ricoperta da mucosa di tipo respiratorio intatta o ulcerata, con dimensioni variabili da pochi millimetri ad
alcuni centimetri. Al taglio, la neoplasia appare cistica o solida con una
quantità variabile di muco. L’origine
tumorale risiede nelle ghiandole
bronchiali localizzate nella sottomucosa bronchiale/tracheale.
In analogia con il MEC delle ghiandole salivari, anche il MEC del sistema
tracheobrochiale si differenzia in carcinoma di basso e di alto grado; il
MEC di basso grado, più frequente
nei pazienti giovani, è una lesione
principalmente polipoide o esofitica,
senza o con solo minima estensione
al parenchima polmonare. All'esame
istologico, esso è caratterizzo da aree
prevalentemente cistiche contenenti
muco e da nidi di cellule monomorfe
cubiche o colonnari con lievi atipie
202
TRIBUNA MEDICA TICINESE
citologiche. Le figure mitotiche sono
rare o assenti. Non si osservano focolai di necrosi. Le aree solide sono più
rare e costituite da cellule intermedie
o squamose non cheratinizzanti. Lo
stroma è mixoide o fibrotico, talvolta
calcifico. Il MEC di alto grado, più frequente nei pazienti anziani, può
spesso infiltrare il parenchima polmonare circostante. Esso è costituito
prevalentemente da aree solide con
cellule squamose o intermedie. Le
cellule muco-secernenti sono più
rare. Le atipie nucleo-citoplasmatiche
sono da moderate ad importanti e
l’attività mitotica è elevata. Si possono osservare fenomeni di infiltrazione
perineurale.
La diagnosi differenziale per i tumori
di basso grado comprende principalmente l'adenoma di ghiandole
mucose che tuttavia non presenta nè
cellule intermedie nè cellule a differenziazione squamosa. Per quanto
riguarda le neoplasie di alto grado
bisogna considerare il carcinoma
squamocellulare (assenza della componente ghiandolare), il carcinoma
adenosquamoso e le metastasi bronchiali di un carcinoma mucoepidermoide che prende origine in altra
sede, per esempio in una ghiandola
salivare, a sottolineare l’importanza
della correlazione clinico-patologica
prima di una valutazione conclusiva.
Il trattamento e la prognosi sono
strettamente legati al grado istologico. I MEC di basso grado hanno una
prognosi eccellente, in particolare nei
bambini; le metastasi linfonodali si
manifestano in meno del 5% dei
casi. La terapia consiste in una resezione a manicotto della mucosa
bronchiale/tracheale o in un trattamento laser. Al contrario i MEC di
alto grado sono più aggressivi e la
prognosi è legata allo stadio al
momento della diagnosi. Le metastasi epatiche, cerebrali, surrenaliche e
ossee non sono rare e la sopravvivenza è sovrapponibile a quella del carci-
78 GIUGNO 2013
noma non a piccole cellule del polmone. Il trattamento è chirurgico, se
possibile, eventualmente seguito da
una radioterapia adiuvante.
Studi recenti hanno evidenziato la
presenza di una traslocazione specifica in MEC delle ghiandole salivari
maggiori e minori ma anche in MEC
di altre localizzazioni (ad esempio
mammella e cervice uterina). La traslocazione t(11;19)(q21;p13) comporta la fusione dei geni MECT1 (MECtranslocated-1, anche chiamato
CRTC1) e MAML2 (master mind like
2) ed è presente nel 55-75% dei
MEC di basso grado e fino nel 46%
dei MEC di alto grado. La presenza di
traslocazione è stata generalmente
osservata in pazienti con sopravvivenza migliore anche se sono riportati MEC con traslocazione che hanno
progredito e causato il decesso dei
pazienti. Si ipotizza che altre alterazioni genetiche siano determinanti
per la progressione e l’aggressività
dei MEC. È stato comunque dimostrato che la traslocazione è pressoché specifica per il MEC in quanto è
stata osservata solo occasionalmente
in tumori delle ghiandole salivari di
altro tipo e segnatamente nel tumore
di Warthin. E’ quindi molto probabile
che la presenza di questa traslocazione, che può essere evidenziata con
un semplice esame di citogenetica
interfasica (FISH), possa in futuro
diventare un valido ausilio diagnostico e prognostico in casi selezionati.
Sulla base di questi risultati si ipotizza
infatti una nuova classificazione dei
MEC che prenda in considerazione
aspetti morfologici e molecolari e che
quindi permetta di migliorare la presa
a carico dei pazienti e di sviluppare
nuove strategie terapeutiche.
J. Barizzi, Istituto Cantonale di patologia
F. Quadri, Servizio di pneumologia,
Ospedale San Giovanni, Bellinzona
SEZIONE SCIENTIFICA - Patologia in pillole
Bibliografia
Jee KJ et al. Genomic profiles and CRTC1MAML2 fusion distinguish different subtypes o
mucoepidermoid carcinoma. Mod Pathol
2013, 26(2): 213-22.
McCord C. et al. Progress in salivary gland
pathology: new entities and selected molecular features. Diagnostic Histopathology 2012,
18:253
Tomashefski JF. Pulmonary Pathology, Neoplastic Lung Disease. Vol II. Third Edition. Springer.
Travis WD. Tumours of the Lung, Pleura,
Thymus and Heart. WHO Classification of
Tumours. Lyon, 2004, IARC Press.
1
78 GIUGNO 2013
TRIBUNA MEDICA TICINESE
30.04.13 08:58
203