1.1.1.1. ALLEGATO I
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
1
1.
DENOMINAZIONE DEL MEDICINALE
AZOPT 10 mg/ml collirio, sospensione.
2.
COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Brinzolamide 10 mg/ml
Per gli eccipienti, vedere 6.1.
3.
FORMA FARMACEUTICA
Collirio, sospensione
4.
INFORMAZIONI CLINICHE
4.1
Indicazioni terapeutiche
AZOPT è indicato per ridurre l’elevata pressione intraoculare nei casi di:
• ipertensione oculare
• glaucoma ad angolo aperto
come monoterapia nei pazienti in cui i beta-bloccanti si siano dimostrati inefficaci o nei pazienti in cui
i beta-bloccanti siano controindicati, o come terapia aggiuntiva ai beta-bloccanti
4.2
Posologia e modo di somministrazione
Quando usato in monoterapia o in terapia aggiuntiva, il dosaggio è di una goccia di AZOPT
nel sacco congiuntivale dell’occhio/i affetto/i due volte al giorno. Alcuni pazienti possono
avere una risposta migliore con la somministrazione di una goccia tre volte al giorno.
Dopo l’instillazione è raccomandata l’occlusione nasolacrimale o una leggera chiusura delle
palpebre. Ciò può ridurre l’assorbimento sistemico del medicinale somministrato per via
oculare e determinare una diminuzione degli effetti collaterali sistemici.
2
Quando AZOPT viene usato in sostituzione di un altro agente oftalmico antiglaucoma,
interrompere la somministrazione dell’altro agente ed iniziare la terapia con AZOPT il giorno
successivo.
Se viene usata più di una medicazione topica oftalmica, i medicinali devono essere
somministrati singolarmente a distanza di almeno 5 minuti.
Uso in pazienti anziani
Non è necessaria alcuna modifica del dosaggio nei pazienti anziani.
Uso pediatrico
L’efficacia e la sicurezza di AZOPT in pazienti minori di 18 anni non sono state stabilite e il
suo uso non è raccomandato in questi pazienti.
Uso in pazienti con insufficienza epatica o renale
AZOPT non è stato studiato in pazienti con insufficienza epatica, pertanto non deve essere
utilizzato da questi pazienti.
AZOPT non è stato studiato in pazienti con insufficienza renale grave (clearance della
creatinina < 30 ml/min) o in pazienti con acidosi ipercloremica. Poiché la brinzolamide ed il
suo metabolita principale sono escreti in modo predominante dal rene, AZOPT è
controindicato in questi pazienti (vedere anche 4.3).
4.3
Controindicazioni
•
Ipersensibilità alla brinzolamide o ad uno qualsiasi degli eccipienti.
•
Accertata ipersensibilità alle solfonamidi (vedere anche 4.4).
•
Insufficienza renale grave.
•
Acidosi ipercloremica (vedere 4.2).
4.4
Avvertenze speciali e opportune precauzioni d’impiego
3
AZOPT è una solfonamide e, sebbene somministrato per via topica, è assorbito a livello
sistemico. Quindi possono verificarsi con la somministrazione per via topica gli stessi tipi di
effetti indesiderati che sono attribuibili alle solfonamidi. Se si manifestano segni di reazioni
gravi o di ipersensibilità, sospendere l’uso di questo preparato.
Esiste la possibilità di un effetto additivo sugli effetti sistemici noti dell’inibizione
dell’anidrasi carbonica, nei pazienti che ricevono un inibitore dell’anidrasi carbonica per via
orale e AZOPT. La concomitante somministrazione di AZOPT e degli inibitori dell’anidrasi
carbonica orali non è stata studiata e non è raccomandata.
Esiste una esperienza limitata con AZOPT
pseudoesfogliativo o pigmentario.
nel trattamento di pazienti con glaucoma
Nella terapia aggiuntiva del glaucoma AZOPT è stato valutato principalmente con timololo.
Esistono quindi dati limitati sulla somministrazione di brinzolamide in associazione ad altri
agenti antiglaucomatosi.
AZOPT non è stato studiato in pazienti con glaucoma ad angolo chiuso.
Il possibile ruolo della brinzolamide sulle funzioni corneali endoteliali di pazienti con cornea
compromessa (particolarmente in pazienti con bassa conta cellulare endoteliale) non è stato
studiato.
Non sono stati studiati in modo specifico pazienti portatori di lenti a contatto e, in questi
pazienti, è raccomandato un attento monitoraggio durante l’uso di brinzolamide, poiché gli
inibitori dell’anidrasi carbonica possono alterare l’idratazione corneale e l’uso di lenti a
contatto potrebbe aumentare i rischi per la cornea. Similmente è raccomandato un attento
monitoraggio in altri casi di compromissione corneale come in pazienti affetti da diabete
mellito.
E’ stato riportato che il benzalconio cloruro, che è usato comunemente come conservante nei
prodotti oftalmici, può causare cheratopatia puntata e/o cheratopatia tossica ulcerativa. Poichè
AZOPT contiene benzalconio cloruro, è richiesto un attento monitoraggio in caso di uso
frequente o prolungato, in pazienti affetti da secchezza oculare, o compromissione corneale.
AZOPT non è stato studiato in pazienti portatori di lenti a contatto. AZOPT contiene come
conservante il benzalconio cloruro che può essere adsorbito dalle lenti a contatto morbide.
4
Perciò, portatori di lenti a contatto dovranno attendere 15 minuti dall’instillazione di AZOPT
prima di applicare le lenti a contatto. AZOPT non deve essere somministrato durante l’utilizzo
delle lenti a contatto.
La possibilità di un effetto rimbalzo dopo la sospensione del trattamento con AZOPT non è
stata studiata; l’effetto di riduzione della pressione intraoculare dovrebbe durare per 5-7
giorni.
Nei pazienti anziani gli inibitori orali dell’anidrasi carbonica possono ridurre la capacità di
eseguire operazioni che richiedono attenzione mentale e/o coordinazione fisica. AZOPT viene
assorbito a livello sistemico e quindi ciò potrebbe verificarsi con la somministrazione topica.
5
4.5
Interazioni con altri medicinali ed altre forme di interazione
Non stati condotti studi specifici sull’interazione di altri medicinali con AZOPT. Negli studi
clinici, l’uso concomitante di AZOPT e preparazioni oftalmiche a base di timololo non ha
evidenziato interazioni avverse. L’associazione tra AZOPT e miotici o agonisti adrenergici
non è stata valutata durante terapie aggiuntive antiglaucoma.
L’associazione tra AZOPT e agenti antiglaucoma diversi dagli agenti beta-bloccanti
adrenergici durante terapia aggiuntiva del glaucoma non è stata valutata.
AZOPT è un inibitore dell’anidrasi carbonica e sebbene somministrato topicamente viene assorbito a
livello sistemico. Disturbi dell’equilibrio acido/base sono stati riportati con l’uso orale di inibitori
dell’anidrasi carbonica. La possibilità di interazione deve essere considerata in pazienti in terapia con
AZOPT.
Gli isoenzimi del citocromo P-450 responsabili del metabolismo della brinzolamide includono
CYP3A4 (il principale), CYP2A6, CYP2C8 e CYP2C9. Gli inibitori di CYP3A4 come chetoconazolo,
itraconazolo, clotrimazolo, ritonavir e troleandomicina possono inibire il metabolismo della
brinzolamide attraverso CYP3A4. E’ necessario prestare attenzione se si usano contemporaneamente
CYP3A4 inibitori. Ad ogni modo, dato che l’eliminazione avviene principalmente per la via renale,
l’accumulo di brinzolamide è poco probabile. La brinzolamide non è un inibitore degli isoenzimi
citocromo P-450.
4.6
Gravidanza e allattamento
Gravidanza
Non sono stati condotti studi su donne in gravidanza. Studi negli animali hanno evidenziato tossicità
riproduttiva (vedi sezione 5.3). Il rischio potenziale per l’uomo è sconosciuto. AZOPT non deve essere
usato durante la gravidanza a meno che non sia chiaramente necessario.
Madri in allattamento
Non è noto se la brinzolamide sia escreta nel latte umano, comunque questa sostanza è escreta
nel latte di ratto. Si raccomanda vivamente di evitare l’uso di AZOPT durante l’allattamento.
4.7
Effetti sulla capacità di guidare veicoli e sull’uso di macchine
Un temporaneo offuscamento della visione o altri disturbi visivi possono influire sulla
capacità di guidare veicoli e sull’uso delle macchine (vedere anche 4.8 Effetti indesiderati). Se
si manifesta un offuscamento della visione dopo l’instillazione, il paziente dovrà attendere che
la visione torni chiara prima di guidare o usare macchinari.
6
4.8
Effetti indesiderati
Negli studi clinici che sono stati condotti su 1500 pazienti trattati con AZOPT come monoterapia o
terapia aggiuntiva al timololo maleato 0,5%, gli eventi avversi correlati al trattamento e i sintomi locali
più frequentemente riportati sono stati: alterazione del gusto (gusto amaro o inusuale) (5,3%) e
offuscamento temporaneo all’instillazione che dura da pochi secondi a pochi minuti (4,8%) (vedere
anche 4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchine)
Durante gli studi clinici con AZOPT sono state riportati i seguenti effetti indesiderati,
sicuramente, probabilmente o possibilmente correlati al trattamento terapeutico. La loro
incidenza è comune (meno del 10,0%) o non comune (meno dell’1,0%).
Effetti oculari
Comuni: visione offuscata, disagio oculare (bruciore o dolore puntorio transitori
all’instillazione), sensazione di corpo estraneo e iperemia oculare.
Non comuni: secchezza oculare, dolore oculare, secrezione oculare, prurito oculare, cheratiti,
blefariti, congiuntiviti, formazione di croste sul bordo palpebrale, sensazione di appiccicoso,
lacrimazione, stanchezza oculare, cheratopatie, follicoli congiuntivali e alterazione dell’acuità
visiva.
I seguenti effetti oculari sono stati osservati solamente negli studi con AZOPT in associazione con
timololo:
Non comuni: erosione corneale.
Effetti sistemici
AZOPT è una solfonamide inibitore dell’anidrasi carbonica con assorbimento sistemico.
Anche se non osservati in studi clinici sono possibili altri effetti indesiderati attribuibili a
questa classe di prodotti medicinali.
L’alterazione del gusto (sapore amaro o inusuale in bocca in seguito all’instillazione) è stato l’effetto
indesiderato più frequentemente riportato a livello sistemico associato all’uso di AZOPT durante gli
studi clinici; ciò é probabilmente dovuto al passaggio del collirio nel nasofaringe attraverso il canale
nasolacrimale. L’occlusione nasolacrimale o la leggera chiusura dell’occhio dopo l’instillazione può
aiutare a ridurre l’incidenza di questo effetto (vedere anche 4.2 Posologia e modo di
somministrazione).
1.2.
Nel corpo
Non comuni: dolore al petto e alopecia.
1.3.
Effetti gastrointestinali
Comuni: alterazione del gusto (sapore amaro o inusuale).
7
Non comuni: bocca asciutta, nausea, e dispepsia.
1.4.
Reazioni di ipersensibilità
Non comuni: dermatiti.
1.5.
Effetti sul sistema nervoso
Comuni: mal di testa
Non comuni: parestesia, caratterizzata da formicolio e intorpidimento delle estremità,
depressione, e vertigini.
Effetti respiratori
Non comuni: riniti, dispnea, faringiti, bronchiti, epistassi e emottisi.
Effetti gastrointestinali, sul sistema nervoso, ematologici, renali e metabolici sono
generalmente associati agli inibitori sistemici dell’anidrasi carbonica. Lo stesso tipo di effetti
indesiderati attribuibili agli inibitori orali dell’anidrasi carbonica sono possibili con la
somministrazione topica.
4.9
Sovradosaggio
Non sono stati riportati casi di sovradosaggio.
Il trattamento dovrà essere sintomatico e di supporto. Potrebbero manifestarsi sbilanciamento
elettrolitico, sviluppo di uno stato di acidosi e possibili effetti a livello del sistema nervoso. Dovranno
essere tenuti sotto controllo i livelli di elettroliti nel siero (in modo particolare il potassio) ed i livelli di
pH del sangue.
5.
PROPRIETÀ FARMACOLOGICHE
5.1
Proprietà farmacodinamiche
Categoria farmacoterapeutica: Preparati antiglaucoma e miotici, inibitori dell’anidrasi
carbonica
8
1.5.1.
Codice ATC:S01EC
L’anidrasi carbonica è un enzima presente in molti tessuti del corpo, incluso l’occhio.
L’anidrasi carbonica catalizza la reazione reversibile che coinvolge l’idratazione del
diossido di carbonio e la deidratazione dell’acido carbonico. L’inibizione dell’anidrasi
carbonica a livello dei processi ciliari dell’occhio diminuisce la secrezione dell’umore
acqueo, presumibilmente per un rallentamento della formazione di ioni bicarbonato
con conseguente riduzione del trasporto di sodio e fluido. Il risultato è una riduzione
della pressione intraoculare (PIO), uno dei maggiori fattori di rischio nella patogenesi
del danno al nervo ottico e nella perdita di campo visivo nel glaucoma. Brinzolamide,
un inibitore dell’anidrasi carbonica II (CA-II), l’isoenzima predominante nell’occhio,
con una IC50 in vitro di 3,2 nM ed una Ki di 0,13 nM verso la CA-II
5.2
Proprietà farmacocinetiche
In seguito a somministrazione topica oculare, la brinzolamide è assorbita nella circolazione sistemica.
A causa della sua alta affinità con l’anidrasi carbonica II, la brinzolamide si distribuisce
estensivamente nei globuli rossi e mostra una lunga emivita nel sangue intero (che significa
approssimativamente 24 settimane). Nell’uomo, si forma il metabolita N-desetil brinzolamide, che si
lega anch’esso all’anidrasi carbonica e si accumula nei globuli rossi. Questo metabolita si lega
principalmente all’anidrasi carbonica I in presenza di brinzolamide. Nel plasma, le concentrazioni sia
della brinzolamide che del’N-desetil brinzolamide sono basse e generalmente al di sotto dei limiti
dell’analisi quantitativa (<7,5 ng/ml). Il legame alle proteine plasmatiche non è elevato (circa 60%).
La brinzolamide è eliminata principalmente attraverso l’escrezione renale (approssimativamente al
60%). Circa il 20% della dose è stato ritrovato nelle urine come metabolita. La brinzolamide e
l’N-desetil-brinzolamide sono i componenti principali nelle urine, insieme a concentrazioni più basse
dei metaboliti N-desmetossipropil e O-desmetil.
In uno studio di farmacocinetica orale, volontari sani hanno ricevuto capsule da 1 mg di
brinzolamide due volte al giorno per 32 settimane ed è stata misurata l’attività dell’anidrasi
carbonica nei globuli rossi per valutare il grado di inibizione sistemica dell’anidrasi carbonica.
La saturazione da parte della brinzolamide dell’anidrasi carbonica II nei globuli rossi è stata
raggiunta entro quattro settimane (concentrazioni nei globuli rossi di approssimativamente
20 µM). L’N-desetil brinzolamide accumulata nei globuli rossi raggiungeva lo stato
stazionario entro 20-28 settimane, con concentrazioni comprese tra 6 e 30 µM. L’inibizione
dell’attività dell’anidrasi carbonica totale nei globuli rossi allo stato-stazionario era
approssimativamente del 70-75%.
Soggetti con insufficienza renale moderata (clearance della creatinina di 30-60 ml/minuto)
hanno ricevuto 1 mg di brinzolamide per via orale due volte al giorno fino a 54 settimane. La
concentrazione di farmaco nei globuli rossi alla quarta settimana di trattamento era compresa
9
tra circa 20 e 40 μM. Allo stato stazionario, le concentrazioni di brinzolamide e del suo
metabolita nei globuli rossi erano comprese rispettivamente tra 22,0 e 46,1 e tra 17,1 e 88,6
μM. La concentrazione di N-desetil-brinzolamide nei globuli rossi è aumentata e l’attività
dell’anidrasi carbonica totale nei globuli rossi è diminuita con la riduzione dell’eliminazione
della creatina, ma la concentrazione di brinzolamide nei globuli rossi e l’attività CA-II è
rimasta invariata. In soggetti col livello più elevato di disfunzione renale l’inibizione
dell’attività dell’anidrasi carbonica totale è stata più elevata, sebbene inferiore al 90% allo
stato stazionario.
In uno studio topico oculare le concentrazioni di brinzolamide nei globuli rossi allo stato
stazionario erano simili a quelle trovate nello studio orale, ma i livelli di N-desetil
brinzolamide erano più bassi. L’attività dell’anidrasi carbonica era circa 40-70% dei livelli
predose
5.3
Dati preclinici di sicurezza
Nei conigli la somministrazione topica oculare di brinzolamide da uno a sei mesi ha dato
come risultato un leggero aumento, statisticamente significativo, dello spessore corneale,
quando somministrato a concentrazioni di 1%,2% e 4%, quattro volte al giorno; questi
cambiamenti non sono stati osservati in altre specie. La somministrazione cronica di
brinzolamide ai ratti ad un dosaggio di 8 mg/kg/giorno (fino a 250 volte la dose oftalmica
raccomandata nell’uomo) ha comportato modifiche associate agli effetti farmacologici
dell’inibizione dell’anidrasi carbonica (i.e. modificazioni del volume delle urine e degli
elettroliti, leggere differenze negli elettroliti del siero).
E’ stato osservato un aumento statisticamente significativo dei tumori della vescica nei topi
femmina a cui era stata somministrata brinzolamide 10 mg/kg/die (250 volte la dose oftalmica
raccomandata nell’uomo), oralmente, per 24 mesi. Nei topi femmina sono state osservate delle
variazioni di proliferazione dose-correlate nella vescica ai dosaggi di 1,3 e 10 mg/kg/die, nei
topi maschi ai dosaggi di 3 e 10 mg/kg/die. L’elevata incidenza di tumori alla vescica, che era
statisticamente significativa, era dovuta principalmente ad un aumento della incidenza di
tumori considerati unici nei topi.
Studi della tossicità sullo sviluppo evolutivo dei conigli con dosi orali di brinzolamide fino a 6
mg/kg/giorno (125 volte la dose oftalmica raccomandata nell’uomo) non hanno rivelato effetti sullo
sviluppo del feto nonostante una significativa tossicità materna. Studi simili nei ratti hanno mostrato
una ossificazione lievemente ridotta del cranio e dello sterno dei feti da madri cui è stata
somministrata brinzolamide nella dose di 18/mg/kg/giorno (375 volte la dose oftalmica raccomandata
nell’uomo), ma non a dosi di 6 mg/kg/giorno. Questi risultati si sono avuti a dosi che hanno causato
acidosi metabolica con una riduzione della crescita di peso corporeo nelle madri e nel peso dei feti.
Una riduzione nel peso del feto dose-dipendente è stata osservata in piccoli di madre che hanno
ricevuto brinzolamide oralmente con diminuzioni variabili da leggere (circa 5-6%) con 2 mg/kg/giorno
fino a circa il 14% con 18 mg/kg/giorno.
10
6.
INFORMAZIONI FARMACEUTICHE
6.1
Elenco degli eccipienti
Benzalconio cloruro, mannitolo, carbomer 974P, tyloxapol, disodio edeteato, cloruro di sodio,
acido cloridrico/idrossido di sodio (per aggiustare il pH) e acqua purificata.
6.2
Incompatibilità
Non pertinente.
6.3
Periodo di validità
2 anni
4 settimane dalla prima apertura.
6.4
Speciali precauzioni per la conservazione
Nessuna speciale precauzione per la conservazione.
6.5
Natura e contenuto della confezione
Flaconi di polietilene opaco a bassa densità con cappuccio a vite in polipropilene da 5 ml e 10
ml.
6.6
Istruzioni per l’impiego e la manipolazione
11
Agitare bene prima dell’uso. Per prevenire la contaminazione della punta del contagocce e
della sospensione, fare attenzione a non toccare la palpebra, le aree circostanti o altre superfici
con la punta del contagocce. Tenere il contenitore ben chiuso dopo l’uso.
12
7.
TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
Alcon Laboratories (UK) Ltd.
Boundary Way
Hemel Hempstead
Herts HP2 7UD
Regno Unito.
8.
NUMERO(I) DI
MEDICINALI
ISCRIZIONE
NEL
9.
DATA
DELLA
DELL’AUTORIZZAZIONE
10.
DATA DI REVISIONE DEL TESTO
PRIMA
REGISTRO
COMUNITARIO
DEI
AUTORIZZAZIONE/RINNOVO
13
ALLEGATO II
A. TITOLARE
DELL’AUTORIZZAZIONE
ALLA
PRODUZIONE RESPONSABILE DEL RILASCIO DEI
LOTTI
14
B. CONDIZIONI
DELL’AUTORIZZAZIONE
ALL’IMMISSIONE IN COMMERCIO
15
A.
TITOLARE
DELL’AUTORIZZAZIONE
RESPONSABILE DEL RILASCIO DEI LOTTI
ALLA
PRODUZIONE
Nome ed indirizzo del produttore responsabile del rilascio dei lotti
S.A. Alcon-Couvreur N.V.
Rijksweg 14
B-2870 Puurs, BelgioAutorizzazione alla produzione rilasciata il 7 agosto 1997 dal Ministerie
van Sociale Zaken, Volksgezondheid en Leefmilieu belga
B.
CONDIZIONI DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
CONDIZIONI O LIMITAZIONI DI FORNITURA E UTILIZZAZIONE IMPOSTE AL
TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
Medicinale soggetto a prescrizione medica.
16
ALLEGATO III
ETICHETTATURA E FOGLIO ILLUSTRATIVO
17
[NOTA: l'ombratura dei titoli, che serve ad agevolare la compilazione del modulo da parte
dei richiedenti; deve rimanere negli allegati durante la valutazione, ma non deve apparire
nella versione finale degli stampati per la confezione (campioni o esemplari del modello
vendita)
18
A. ETICHETTATURA
19
INFORMAZIONI DA APPORRE SULL'IMBALLAGGIO ESTERNO O, IN SUA
ASSENZA, SUL CONDIZIONAMENTO PRIMARIO
1.
DENOMINAZIONE DEL MEDICINALE
AZOPT 10 mg/ml collirio, sospensione
2.
INDICAZIONE DEL (DEI) PRINCIPIO(I) ATTIVO(I)
Brinzolamide 10 mg/ml
3.
ELENCO DEGLI ECCIPIENTI
Benzalconio cloruro, mannitolo, carbomer 974P, tyloxapol, disodio edetato, cloruro di sodio,
acido cloridrico/idrossido di sodio (per aggiustare il pH) e acqua purificata.
4.
FORMA FARMACEUTICA E CONTENUTO
Collirio, sospensione; 5 ml
5.
MODO E, OVE NECESSARIO, VIA(E) DI SOMMINISTRAZIONE
Per uso oculare. Leggere il foglio illustrativo prima dell’uso. Agitare bene prima dell’uso.
20
6
AVVERTENZA SPECIALE CHE PRESCRIVA DI TENERE IL MEDICINALE
FUORI DALLA PORTATA E DALLA VISTA DEI BAMBINI
Tenere fuori della portata e della vista dei bambini
7.
ALTRA(E) AVVERTENZA(E) SPECIALE(I), OVE NECESSARIO
8.
DATA DI SCADENZA
Scadenza:xx/xxxx
Eliminare quattro settimane dopo la prima apertura.
Apertura:
9.
PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
10.
OVE
NECESSARIO,
PRECAUZIONI
PARTICOLARI
PER
LO
SMALTIMENTO DEL MEDICINALE NON UTILIZZATO O DEI RIFIUTI
DERIVATI DA TALE MEDICINALE
21
11.
NOME E INDIRIZZO DEL TITOLARE
ALL’IMMISSIONE IN COMMERCIO
DELL'AUTORIZZAZIONE
Alcon Laboratories (UK) Ltd.
Boundary Way
Hemel Hempstead
Herts, HP2 7UD
Regno Unito.
12.
NUMERO(I) DI
MEDICINALI
ISCRIZIONE
NEL
REGISTRO
COMUNITARIO
DEI
EU/x/xx/xxx/xxx
13.
NUMERO DI LOTTO
Lotto No.:xxxxx
14.
CONDIZIONE GENERALE DI FORNITURA
Medicinale soggetto a prescrizione medica.
15.
ISTRUZIONI PER L’USO
22
INFORMAZIONI DA APPORRE SULL'IMBALLAGGIO ESTERNO O, IN SUA
ASSENZA, SUL CONDIZIONAMENTO PRIMARIO
1.
DENOMINAZIONE DEL MEDICINALE
AZOPT 10 mg/ml collirio, sospensione
2.
INDICAZIONE DEL (DEI) PRINCIPIO(I) ATTIVO(I)
Brinzolamide 10 mg/ml
3.
ELENCO DEGLI ECCIPIENTI
Benzalconio cloruro, mannitolo, carbomer 974P, tyloxapol, disodio edetato, cloruro di sodio,
acido cloridrico/idrossido di sodio (per aggiustare il pH) e acqua purificata.
4.
FORMA FARMACEUTICA E CONTENUTO
Collirio, sospensione; 10 ml.
5.
MODO E, OVE NECESSARIO, VIA(E) DI SOMMINISTRAZIONE
Per uso oculare. Leggere il foglio illustrativo prima dell’uso. Agitare bene prima dell’uso.
23
6
AVVERTENZA SPECIALE CHE PRESCRIVA DI TENERE IL MEDICINALE
FUORI DALLA PORTATA E DALLA VISTA DEI BAMBINI
Tenere fuori della portata e della vista dei bambini
7.
ALTRA(E) AVVERTENZA(E) SPECIALE(I), OVE NECESSARIO
8.
DATA DI SCADENZA
Scadenza:xx/xxxx
Eliminare quattro settimane dopo la prima apertura.
Apertura:
9.
PRECAUZIONI PARTICOLARI PER LA CONSERVAZIONE
10.
OVE
NECESSARIO,
PRECAUZIONI
PARTICOLARI
PER
LO
SMALTIMENTO DEL MEDICINALE NON UTILIZZATO O DEI RIFIUTI
DERIVATI DA TALE MEDICINALE
24
11.
NOME E INDIRIZZO DEL TITOLARE
ALL’IMMISSIONE IN COMMERCIO
DELL'AUTORIZZAZIONE
Alcon Laboratories (UK) Ltd.
Boundary Way
Hemel Hempstead
Herts, HP2 7UD
Regno Unito.
12.
NUMERO(I) DI
MEDICINALI
ISCRIZIONE
NEL
REGISTRO
COMUNITARIO
DEI
EU/x/xx/xxx/xxx
13.
NUMERO DI LOTTO
Lotto No.:xxxxx
14.
CONDIZIONE GENERALE DI FORNITURA
Medicinale soggetto a prescrizione medica.
15.
ISTRUZIONI PER L’USO
25
26
INFORMAZIONI MINIME DA APPORRE SUI CONFEZIONAMENTI PRIMARI DI
PICCOLE DIMENSIONI
1.
DENOMINAZIONE DEL MEDICINALE E, SE NECESSARIO, DOSAGGIO E/O
VIA(E) DI SOMMINISTRAZIONE
AZOPT 10 mg/ml collirio, sospensione
Brinzolamide 10 mg/ml. Uso oftalmico
2.
MODO DI SOMMINISTRAZIONE
Leggere il foglio illustrativo prima dell’uso.
Eliminare 4 settimane dopo la prima apertura.
Apertura:
3.
DATA DI SCADENZA
Scadenza: xx/xxxx
4.
NUMERO DI LOTTO
Lotto No.: xxxxx
5.
5
CONTENUTO IN PESO, VOLUME O UNITÀ
ml
27
INFORMAZIONI MINIME DA APPORRE SUI CONFEZIONAMENTI PRIMARI DI
PICCOLE DIMENSIONI
1.
DENOMINAZIONE DEL MEDICINALE E, SE NECESSARIO, DOSAGGIO E/O
VIA(E) DI SOMMINISTRAZIONE
AZOPT 10 mg/ml collirio, sospensione
Brinzolamide 10 mg/ml. Uso oftalmico
2.
MODO DI SOMMINISTRAZIONE
Leggere il foglio illustrativo prima dell’uso.
Eliminare 4 settimane dopo la prima apertura.
Apertura:
3.
DATA DI SCADENZA
Scadenza: xx/xxxx
4.
NUMERO DI LOTTO
Lotto No.: xxxxx
5.
CONTENUTO IN PESO, VOLUME O UNITÀ
10 ml
28
INFORMAZIONI MINIME DA APPORRE SUI CONFEZIONAMENTI PRIMARI DI
PICCOLE DIMENSIONI
1.
DENOMINAZIONE DEL MEDICINALE E, SE NECESSARIO, DOSAGGIO E/O
VIA(E) DI SOMMINISTRAZIONE
AZOPT 10 mg/ml collirio, sospensione
Brinzolamide 10 mg/ml. Uso oftalmico
2.
MODO DI SOMMINISTRAZIONE
Leggere il foglio illustrativo prima dell’uso.
Eliminare 4 settimane dopo la prima apertura.
Apertura:
3.
DATA DI SCADENZA
Scadenza: xx/xxxx
4.
NUMERO DI LOTTO
Lotto No.: xxxxx
5.
CONTENUTO IN PESO, VOLUME O UNITÀ
10 ml
29
30
B. FOGLIO ILLUSTRATIVO
31
FOGLIO ILLUSTRATIVO
AZOPT 10 mg/ml collirio, sospensione
Brinzolamide
Legga attentamente e per intero questo foglio prima di iniziare ad usare il medicinale.
Questo medicinale è stato prescritto per lei personalmente. Non lo dia mai ad altri.
Per altri individui questo medicinale potrebbe essere pericoloso, anche se i loro sintomi sono
uguali ai suoi.
Conservi questo foglio. Potrebbe aver bisogno di leggerlo di nuovo. Se ha dei dubbi, si
rivolga al
suo medico o al suo farmacista.
Il principio attivo è brinzolamide 10 mg/ml.
Gli eccipienti sono: benzalconio cloruro, carbomer 974P, disodio edetato, mannitolo, acqua
purificata, cloruro di sodio e tyloxapol.
Piccole quantità di acido cloridrico o sodio idrossido sono talvolta aggiunte per mantenere i normali
livelli di acidità (pH).
Il titolare dell’immissione in commercio di AZOPT è Alcon Laboratories (UK) Ltd.,
Boundary Way, Hemel Hempstead, Herts. HP2 7UD, Regno Unito.
Il produttore di AZOPT é S.A. Alcon –Couvreur N.V., Rijksweg 14, B-2870 Puurs, Belgio.
1. COSA FA AZOPT
32
AZOPT collirio viene usato per il trattamento della pressione elevata nell’occhio. Tale stato
pressorio può portare al glaucoma.
Alta pressione nell’occhio. Gli occhi contengono un liquido limpido acquoso che nutre l’interno
dell’occhio. Normalmente parte del liquido fuoriesce dall’occhio e dell’altro viene prodotto
all’interno. Se l’occhio si riempie più velocemente di quanto si svuoti, la pressione cresce all’interno
dell’occhio. Se aumenta troppo può danneggiare la vista.
AZOPT appartiene al gruppo di farmaci anti-glaucomatosi denominati inibitori
dell’anidrasi carbonica. Funziona diminuendo la produzione di liquido, con conseguente
abbassamento della pressione oculare. Può essere usato da solo o in aggiunta ad altri farmaci,
meglio noti come beta-bloccanti, che abbassano la pressione nell’occhio.
AZOPT è un collirio lattiginoso (in sospensione) confezionato in un flacone di plastica con tappo a
vite da 5 ml o 10 ml (droptainer).
2.
PRIMA DI USARE AZOPT
Non usi Azopt …
•
se ha problemi renali
•
in caso di allergia alla brinzolamide o ad uno degli eccipienti
•
se è allergico a medicinali chiamati sulfamidici. AZOPT potrebbe causare la stessa
reazione
•
se ha una condizione chiamata acidosi ipercloremica (troppa acidità nel sangue)
Consulti il suo medico
Usi AZOPT con attenzione …
•
se ha problemi di fegato. Consulti il suo medico.
•
se lei ha secchezza oculare o problemi alla cornea. Consulti il suo medico.
•
se porta lenti a contatto morbide. Non usi il collirio mentre porta le lenti. Aspetti 15
minuti dopo aver usato il collirio prima di rimettere le lenti. Un conservante contenuto in
AZOPT (benzalconio cloruro) può avere degli effetti sulle lenti morbide.
AZOPT non deve essere usato da pazienti inferiori ai 18 anni d’età.
33
Gravidanza/allattamento
In caso di gravidanza accertata o presunta consulti il suo medico prima di usare AZOPT.
Se sta allattando al seno, non usi AZOPT; potrebbe passare nel latte materno.
In caso di guida o utilizzo di macchinari
Potrebbe avere un offuscamento della vista per un certo periodo dopo l’uso di AZOPT.
Alcune persone hanno provato sonnolenza o capogiro dopo aver assunto AZOPT. Non
guidate o usate macchinari fino alla scomparsa di tali sintomi.
AZOPT e altri farmaci
Se sta assumendo un altro inibitore dell’anidrasi carbonica (acetazolamide o dorzolamide,
vedere sezione 1 COSA FA AZOPT), consulti il suo medico.
Informi il suo medico o farmacista se sta prendendo (o ha preso recentemente) qualsiasi altro farmaco.
Ricordi di menzionare anche i farmaci da banco che ha comprato senza ricetta medica.
3.
COME USARE AZOPT
Il dosaggio normale è …
Adulti: 1 goccia nell’occhio(i), due volte al giorno - mattina e sera.
Utilizzi questo dosaggio a meno che il suo medico non le prescriva un dosaggio differente.
Usi AZOPT in entrambi gli occhi solo su prescrizione del suo medico. Utilizzi il farmaco per
il periodo di tempo che le consiglia il suo medico.
AZOPT può essere usato solamente come collirio.
2.
GIRI LA PAGINA PER ULTERIORI INFORMAZIONI
34
3. COME USARE AZOPT (continuazione)
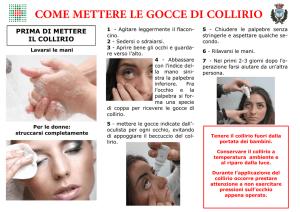
1
2
3
Quanto usarne
< vedere l’altro lato
•
Prenda AZOPT e uno specchio
•
Si lavi le mani
•
Agiti il flacone e sviti il tappo
•
Prenda in mano il flacone, tra il pollice e il medio, e lo tenga rivolto verso il basso
•
Pieghi indietro la testa. Abbassi la palpebra inferiore con un dito pulito, così da formare
una “tasca” tra la palpebra e l’occhio. Faccia cadere una goccia di collirio nell’occhio
(figura 1)
•
Tenga la punta del flacone vicino all’occhio. Può essere utile guardarsi allo specchio
•
Non tocchi l’occhio o la palpebra, le aree circostanti o altre superfici con la punta del
flacone. Potrebbe infettare il collirio
•
Una leggera pressione sulla base del flacone produrrà la fuoriuscita di una goccia di
AZOPT alla volta.
• Non comprimere il flacone: è stato appositamente studiato affinchè una leggera pressione
sul fondo sia sufficiente (figura 2)
•
Dopo aver usato AZOPT, prema con il dito l’angolo dell’occhio, vicino al naso (figura 3).
Questo impedisce che AZOPT si distribuisca nel resto del corpo
•
Se deve mettere il collirio in entrambi gli occhi, ripeta i passaggi per l’altro occhio
•
Rimetta il cappuccio immediatamente dopo l’uso
35
Se una goccia manca l’occhio, riprovi.
Se ha instillato troppo collirio, lavi subito l’occhio con acqua tiepida. Non usi il collirio fino
all’ora della dose successiva.
Se dimentica di usare AZOPT, lo usi normalmente non appena si ricorda e poi torni ai suoi
normali tempi di instillazione. Non usi una doppia dose per compensare.
Se usa contemporaneamente anche un altro collirio, lasci passare almeno 5 minuti tra
l’instillazione di AZOPT e dell’altro collirio.
4. POSSIBILI EFFETTI COLLATERALI
Durante l’uso di AZOPT alcune persone potrebbero avere degli effetti collaterali. Possono
risultare fastidiosi, ma la maggior parte di essi é di breve durata.
Normalmente può continuare a mettere il collirio, a meno che gli effetti collaterali non siano di
notevole entità. Se è preoccupato, si rivolga al suo medico o farmacista.
Effetti collaterali frequenti
potrebbero comparire con una frequenza fino a 6 persone su 100.
Effetti a livello dell’occhio: offuscamento temporaneo della vista; bruciore o fastidio subito
dopo l’instillazione; sensazione di un corpo estraneo nell’occhio; rossore.
Effetti sistemici: sensazione di amaro in bocca; mal di testa.
Se riscontra effetti collaterali non menzionati nel foglietto, consulti il suo medico o il suo
farmacista.
5.
CONSERVAZIONE DI AZOPT
36
Il flacone deve essere eliminato quattro settimane dopo la prima apertura, per prevenire
infezioni.
Scriva nello spazio sottostante e nello spazio sull’etichetta del flacone e sulla scatola la data di
apertura del flacone.
Apertura:
Tenere questo collirio in un posto sicuro fuori della portata e della vista dei bambini.
Non usare questo farmaco dopo la data di scadenza (indicata come “Scadenza”) sul flacone e
sulla scatola.
Se ha domande o dubbi su qualsiasi cosa, si rivolga al suo medico o farmacista.
Il foglio illustrativo è stato modificato l’ultima volta in data xxxxxx.
37
Ulteriori informazioni
Per ulteriori informazioni sul prodotto, si prega di contattare l’ufficio Alcon locale.
België/Belgique/Belgien
Luxembourg/Luxemburg
S.A. Alcon-Couvreur N.V.
S.A. Alcon-Couvreur N.V.
Rijksweg 14
Rijksweg 14
B-2870 Puurs
B-2870 Puurs
Tél: + 32 (0)3 890 27 11
Tél: + 32 (0)3 890 27 11
Danmark
Nederland
Alcon Danmark ApS
Alcon Nederland B.V.
Dampfærgevej 28
Avelingen-West 5
DK-2100 København Ø
NL-4202 MS Gorinchem
Tlf: + 45 35 460 460
Tel: + 31 (0) 183 654321
Deutschland
Österreich
Alcon Pharma GmbH
Alcon Ophthalmika GmbH
Blankreutestrasse 1
Mariahilferstr. 121b
D-79108 Freiburg
A-1060 Wien
Tel: + 49 (0)761 1304-0
Tel: + 43 (0)1 596 69 70
Ελλάδα
Portugal
Άλκον Λαμποράτορις Ελλάς ΑΕΒΕ
Alcon Portugal
Κηφισίας 18
Produtos e Equipamentos Oftalmolόgicos,
Lda
GR-151 25 Μαρούσι
Τηλ: + 30 (0) 1 68 00 811
Rua Castilho, 201-1.°
P-1070-051 Lisboa
Tel: + 351 21 381 29 65
38
España
Suomi/Finland
Alcon Cusi, S.A.
Alcon Finland OY
c/Camil Fabra, 58
PL 13
E-08320 El Masnou-Barcelona
FIN-01641 Vantaa
Tel: 34 93 497 7000
Puh/Tln: + 358 (0)9 8520 2260
France
Sverige
Laboratoires Alcon S.A.
Alcon Sverige AB
Immeuble ‘Les Colonnades’
Box 12233
4, Rue Henri Sainte-Claire Deville
S-102 26 Stockholm
F-92563 Rueil-Malmaison Cedex
Tln: + 46 (0)8 634 40 00
Tél: + 33 (0)1 47 10 47 10
Ireland
United Kingdom
Alcon Laboratories (UK) Ltd
Alcon Laboratories (UK) Ltd
Pentagon Park
Pentagon Park
Boundary Way
Boundary Way
Hemel Hempstead
Hemel Hempstead
Herts., HP2 7UD-UK
Herts., HP2 7UD-UK
Tel: + 44 (0)1442 34 1234
Tel: + 44 (0) 1442 341234
Italia
Alcon Italia S.p.A.
Via Roma 108
I-20060 Cassina de’ Pecchi (MI)
Tel: + 39 02 954181
39
40