CASO CLINICO
Atrio sinistro gigante in una paziente con scompenso
cardiaco riacutizzato
Andrea Sonaglioni, Michele Lombardo, Massimo Baravelli, Andrea Rossi, Graziana Trotta,
Edoardo Gronda
U.O. di Cardiologia, Ospedale San Giuseppe Multimedica, Milano
A 71-year-old woman was admitted to our institution with symptoms and signs of acute congestive heart failure. The patient had a long history of rheumatic heart disease and, in 1974, she had undergone mitral valve
replacement with a single tilting-disk mechanical valve. Transthoracic echocardiography showed a giant left
atrium, measuring 18.5 cm longitudinally and 17 cm transversely from the apical four-chamber view with a
volume of 1706 ml/m2 body surface area, associated with intense spontaneous echocontrast. Massive tricuspid regurgitation and severe pulmonary hypertension were diagnosed. It could be hypothesized that the
giant left atrium may have contributed to the development of acute decompensated heart failure resulting
in a significant reduction of left ventricular preload.
Key words. Giant left atrium; Heart failure; Spontaneous echocontrast.
G Ital Cardiol 2013;14(4):286-288
CASO CLINICO
Una donna di 71 anni (altezza 150 cm, peso corporeo 50 kg,
superficie corporea 1.43 m2) veniva ricoverata presso la nostra
Unità Operativa di Cardiologia per scompenso cardiaco congestizio acuto, secondario a cardiopatia valvolare mitralica postreumatica. La paziente presentava all’ecocardiogramma transtoracico un atrio sinistro gigante, insufficienza tricuspidale massiva e ipertensione polmonare severa.
Nel 1974 la paziente, a seguito del riscontro di steno-insufficienza mitralica severa, aveva eseguito un intervento di sostituzione valvolare mitralica con protesi meccanica a singolo
disco oscillante. All’epoca dell’operazione, la malattia era già
in uno stadio avanzato, complicata da ipertensione polmonare
severa e da una significativa insufficienza tricuspidale funzionale secondaria. Nel 1999 alla paziente veniva impiantato un
pacemaker bicamerale per una fibrillazione atriale a lenta risposta ventricolare. Nel corso degli ultimi anni, la paziente aveva progressivamente manifestato un quadro di scompenso cardiaco ingravescente, in classe funzionale NYHA III. La paziente
era in terapia domiciliare orale con digossina, spironolattone,
furosemide a dosi crescenti e metolazone.
All’ingresso si riscontrava un quadro di scompenso cardiaco acuto con segni clinici di congestione sistemica (turgore venoso giugulare, pressione venosa centrale 20 cmH2O, edemi
declivi colonnari) e polmonare (dispnea ingravescente, ortopnea), associati a sindrome da bassa gittata (oliguria, sudorazione, ipoperfusione periferica, pressione arteriosa <90/70
mmHg). La creatininemia risultava nella norma.
© 2013 Il Pensiero Scientifico Editore
Ricevuto 28.09.2012; nuova stesura 29.10.2012; accettato 16.11.2012.
Gli autori dichiarano nessun conflitto di interessi.
Per la corrispondenza:
Dr. Andrea Sonaglioni Viale dei Partigiani 116, 20092 Cinisello
Balsamo (MI)
e-mail: [email protected]
286
G ITAL CARDIOL | VOL 14 | APRILE 2013
L’ECG mostrava fibrillazione atriale con frequenza di risposta ventricolare compresa tra 70 e 90 b/min, sporadici battiti
ectopici ventricolari, normale durata del complesso QRS (97 ms)
con deviazione assiale destra (asse medio del QRS sul piano
frontale +130°). È verosimile che i valori di frequenza cardiaca
della paziente siano stati influenzati in parte dalla terapia cronica con digossina, in parte dalla storia di fibrillazione atriale
con frequenza di risposta ventricolare tendenzialmente lenta,
che aveva richiesto l’impianto del pacemaker.
L’ecocardiogramma transtoracico all’ingresso mostrava ridotte dimensioni del ventricolo sinistro (volume telediastolico indicizzato 28 ml/m2; volume telesistolico indicizzato 12.6
ml/m2) con gettata sistolica 15.4 ml/m2 e frazione di eiezione 55%. La protesi meccanica mitralica era normofunzionante, con regolare escursione del disco, con gradiente medio transmitralico di 6 mmHg e con lieve rigurgito intraprotesico. L’atrio sinistro si presentava inusualmente ingrandito
(diametro longitudinale 18.5 cm e diametro trasversale 17
cm, misurati in sezione 4 camere apicale; diametro anteroposteriore 15.8 cm, misurato in sezione parasternale asse
lungo; volume, ottenuto con il metodo Simpson monoplano
in sezione 4 camere apicale, pari a 2441 ml e indicizzato
1706 ml/m2) (Figura 1), con intenso ecocontrasto spontaneo
(Figura 2). Il volume dell’atrio destro, ottenuto anch’esso con
il metodo Simpson monoplano in sezione 4 camere apicale,
misurava 143 ml/m2; il diametro del tratto di afflusso del ventricolo destro 45 mm. L’insufficienza tricuspidale era severa e
la pressione sistolica arteriosa polmonare, stimata indirettamente dalla velocità di rigurgito tricuspidale campionata con
il Doppler continuo in sezione 4 camere apicale, era di 80
mmHg.
La radiografia del torace rivelava un rapporto cardiotoracico pari a 1.
L’esofagogramma (Figura 3) documentava un’evidente dislocazione verso destra dell’esofago ad opera dell’atriomegalia
sinistra, in assenza di disfagia.
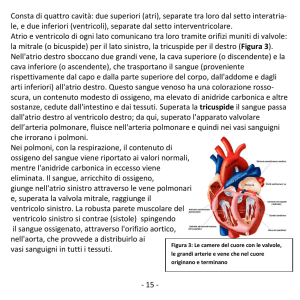
ATRIO SINISTRO GIGANTE
Figura 1. Ecocardiogramma transtoracico, sezione 4 camere apicale. Dimensioni dell’atrio sinistro
marcatamente sproporzionate rispetto al ventricolo sinistro e alle altre camere cardiache; volume
dell’atrio sinistro, misurato con il metodo Simpson monoplano dei dischi, pari a 2441 ml (1706
ml/m2 di superficie corporea).
Figura 2. Ecocardiogramma transtoracico, sezione sottocostale 4 camere. Intenso ecocontrasto spontaneo all’interno della cavità atriale sinistra.
Si manifestavano incremento della diuresi, progressiva riduzione degli edemi declivi e della pressione venosa centrale
(14 cmH2O), con attenuazione della sintomatologia dispnoica e
con il mantenimento di una pressione arteriosa sistolica >100
mmHg e di una frequenza cardiaca da fibrillazione atriale normofrequente (circa 70 b/min). Inoltre, si ottenevano i seguenti
parametri ecocardiografici: volume telediastolico ventricolare
sinistro indicizzato 30 ml/m2, volume telesistolico ventricolare sinistro indicizzato 12 ml/m2; gettata sistolica (18 ml/m2) e frazione di eiezione (60%) risultavano pertanto aumentati; si documentava infine una riduzione della pressione sistolica arteriosa polmonare a 50 mmHg.
Durante la degenza, inoltre, la paziente veniva sottoposta
a visita di consulenza cardiochirurgica che, in considerazione
delle rilevanti comorbilità, dell’elevato profilo di rischio operatorio e, soprattutto, dell’assenza di una sintomatologia di compressione esofagea, escludeva ulteriori procedure.
Alla dimissione, il quadro emodinamico si presentava stabile, con miglioramento delle condizioni cliniche della paziente,
che veniva dimessa in classe funzionale NYHA II, in terapia orale con furosemide 125 mg bid, spironolattone 50 mg/die e digossina 0.125 mg/die.
DISCUSSIONE
Figura 3. Esofagogramma, proiezione postero-anteriore. Marcata dislocazione dell’esofago verso destra, senza evidenza di compressione.
La paziente veniva trattata con idratazione per via venosa e
con infusione di dopamina 3 γ/kg/min, dobutamina 4 γ/kg/min
e furosemide 250 mg/die; inoltre si somministravano spironolattone 100 mg/die e digossina 0.25 mg/die per via venosa.
L’atrio sinistro è definito “gigante” quando il diametro misura dai 6 ai 10 cm1,2; frequentemente esso costituisce il risultato
finale di un severo e prolungato sovraccarico sia di pressione
che di volume, nel contesto di una valvulopatia mitralica severa3.
È ipotizzabile che l’eccessiva dilatazione atriale sinistra sia
dovuta non soltanto alla storia di valvulopatia mitralica, ma anche ad un primario coinvolgimento delle pareti dell’atrio sinistro
da parte della malattia reumatica4.
La prevalenza della malattia reumatica si è considerevolmente ridotta negli ultimi 30 anni. Pertanto, un atrio sinistro
gigante è una condizione raramente riscontrata oggi5.
In letteratura sono stati segnalati altri casi di atrio sinistro gigante2,6. In particolare, il report più eclatante7 mostra il caso di
una paziente con diametri ecocardiografici (18.8 x 14 cm) sovrapponibili a quelli da noi riscontrati (18.5 x 17 cm). Pertanto,
possiamo ragionevolmente ritenere che l’atriomegalia sinistra
della nostra paziente sia tra le maggiori mai segnalate.
G ITAL CARDIOL | VOL 14 | APRILE 2013
287
A SONAGLIONI ET AL
I pazienti con atrio sinistro gigante molto spesso giungono
all’osservazione con complicanze emodinamiche e/o respiratorie, talora con l’evidenza ecocardiografica di ecocontrasto spontaneo e/o formazione di trombo8 e/o con disfagia9. L’ecocontrasto spontaneo, marker di aumentato rischio tromboembolico10,11, è un riscontro comune nei pazienti con cardiopatia valvolare mitralica che si sottopongono ad esame ecocardiografico transesofageo. Tuttavia, nel nostro caso, l’ecocontrasto
spontaneo risultava già evidente all’ecocardiogramma transtoracico. Esso è dovuto sia alla stasi ematica in atrio sinistro che
alla fibrillazione atriale cronica. Malgrado questo riscontro, la
terapia anticoagulante era risultata efficace nel prevenire episodi tromboembolici.
I pazienti con atrio sinistro gigante possono presentare sintomi di compressione esofagea che richiedono l’atriotomia sinistra chirurgica12,13. Nel nostro caso, tuttavia, non erano presenti sintomi clinici di compressione esofagea e l’intervento chirurgico non è stato ritenuto necessario.
Sul piano fisiopatologico, è ipotizzabile che l’atriomegalia
sinistra fosse già presente al momento dell’intervento chirurgico di sostituzione valvolare mitralica e che, incrementandosi,
abbia successivamente contribuito al mantenimento di una significativa ipertensione venosa e arteriolare polmonare, con insufficienza tricuspidale secondaria e quadro clinico di scompenso cardiaco congestizio cronico.
Infine, la condizione acuta di bassa portata circolatoria riscontrata all’ingresso, in presenza di una normale funzione della protesi meccanica mitralica e di una conservata performance sistolica ventricolare sinistra, può essere stata, almeno in parte, determinata, oltre che dall’insufficienza tricuspidale severa,
dall’ingente quantità di sangue sequestrata nell’atrio sinistro
gigante e sottratta alla circolazione anterograda: due fattori responsabili di un’abnorme riduzione del precarico ventricolare
sinistro, con conseguente spostamento della curva di FrankStarling verso sinistra e riduzione critica della portata cardiaca.
È inoltre ipotizzabile che la terapia diuretica, progressivamente incrementata prima del ricovero, in presenza di un abnorme sequestro di volume circolante sia in atrio sinistro che
nel distretto venoso e interstiziale periferico, abbia contribuito
a determinare l’instaurarsi della sindrome da bassa gittata riscontrata all’ingresso.
Infatti, dopo infusione di liquidi e terapia con agenti inotropi, si è verificato un progressivo ripristino della perfusione
periferica e renale, con ripresa della diuresi e mantenimento di
un’adeguata pressione arteriosa sistolica.
RIASSUNTO
Una paziente di 71 anni, giunta alla nostra osservazione per la riacutizzazione di uno scompenso cardiaco congestizio, secondario a
cardiopatia valvolare mitralica post-reumatica, portatrice di protesi meccanica mitralica dal 1974 e affetta da fibrillazione atriale cronica, presentava all’ecocardiogramma transtoracico un atrio sinistro gigante (diametro longitudinale 18.5 cm, diametro trasversale 17 cm, volume 1706 ml/m2 di superficie corporea) con ecocontrasto spontaneo e insufficienza tricuspidale severa. Vengono discusse le implicazioni eziopatogenetiche che un così massivo aumento di volume dell’atrio sinistro (uno dei più imponenti tra quelli mai segnalati in letteratura) può aver determinato a carico della
funzione cardiaca.
Parole chiave. Atrio sinistro gigante; Ecocontrasto spontaneo;
Scompenso cardiaco.
BIBLIOGRAFIA
1. Kothari AA, Kothari KA. A giant left
atrium. J Postgrad Med 2005;51:49-50.
2. Ates M, Sensoz Y, Abay G, Akcar M. Giant left atrium with rheumatic mitral stenosis. Tex Heart Inst J 2006;33:389-91.
3. Hurst JW. Memories of patients with a giant left atrium. Circulation 2001;104:2630-1.
4. Popescu BA, Lupescu I, Georgescu SA,
Ginghina C. Giant left atrium with calcified
walls and thrombus in a patient with an old,
normally functioning ball-in-cage mitral valve
prosthesis. Circulation 2010;122:e579-e580.
5. Fattouch K, Sampognaro R, Coppola G,
et al. Giant left atrium: a condition that is
rarely seen today. J Cardiovasc Med 2008;
9:967-8.
288
G ITAL CARDIOL | VOL 14 | APRILE 2013
6. Sinatra R, Pulitani I, Antonazzo A, Melina G. A novel technique for giant left atrium
reduction. Eur J Cardiothorac Surg 2001;
20:412-4.
7. Ozkan A, Tuncer A, Ozkan M. Giant left
atrium. J Am Coll Cardiol 2012;60:e13.
8. Kawazoe K, Beppu S, Takahara Y, et al.
Surgical treatment of giant left atrium combined with mitral valvular disease. Plication
procedure for reduction of compression to
the left ventricle, bronchus, and pulmonary
parenchyma. J Thorac Cardiovasc Surg 1983;
85:885-92.
9. Gould LA, Betzu R, Yang DC, Patel D.
Giant left atrium - a case report. Angiology
1991;42:52-4.
10. Lee TM, Chou NK, Su SF, et al. Left atrial spontaneous echo contrast in asymptomatic patients with a mechanical valve
prosthesis. Ann Thorac Surg 1996;62:
1790-5.
11. Kranidis A, Koulouris S, Anthopoulos L.
Clinical implications of left atrial spontaneous echo contrast in mitral valve disease.
J Heart Valve Dis 1993;2:267-72.
12. Tonguç E, Kestelli M, Ozsoyler I, Yilik L,
Yilmaz A, Ozbek C, et al. Limit of indication
for plication of giant left atrium. Asian Cardiovasc Thorac Ann 2001;9:24-6.
13. Apostolakis E, Shuhaiber JH. The surgical management of giant left atrium. Eur J
Cardiothorac Surg 2008;33:182-90.