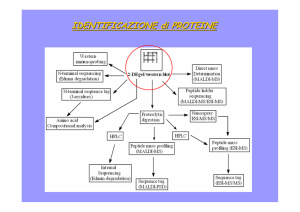
Spettrometria di massa
La spettrometria di massa e’ una tecnica che consente di misurare il peso di atomi o
molecole. La determinazione della massa, o del peso molecolare e’ sempre utile
per individuare l’identita’ di una sostanza.
Per effettuare questa analisi bisogna impartire una carica elettrica alla molecola di
interesse, cioe’ l’analita, e successivamente misurare come le traiettorie degli ioni
risultanti rispondano nel vuoto a varie combinazioni di campi elettrici e magnetici.
Per piccole specie molecolari, la ionizzazione e’ facilmente ottenibile bombardando
l’analita con un fascio di elettroni.
Negli ultimi anni, gli sforzi di molti ricercatori hanno portato alla scoperta di nuove
tecniche di ionizzazione in grado di caricare elettricamente molecole estremamente
grandi, altrimenti impossibili da ionizzare con metodi tradizionali senza ottenere una
totale distruzione del campione
John Fenn, Premio Nobel per la chimica 2002
Bio-MS lezione 1
1
Spettrometria di massa
Per effettuare un’analisi mediante spettrometria di massa bisogna
impartire una carica elettrica alla molecola di interesse, cioe’ l’analita,
e successivamente misurare come le traiettorie dello ione risultante
rispondono nel vuoto a varie combinazioni di campi elettrici e
magnetici.
Le traiettorie degli ioni
dipendono dal loro
rapporto massa/carica
Bio-MS lezione 1
m/z
2
Lo spettrometro di massa: un prisma molecolare
• Generazione di ioni
• Separazione delle componenti
• Rilevamento delle componenti
separate
Bio-MS lezione 1
3
Componenti di uno spettrometro di massa
Camera di
ionizzazione
Analizzatore
Rivelatore
Bio-MS lezione 1
EI, MALDI, ESI
Analizzatore a tempo di
volo(TOF), quadrupolo (Q)
Fotomoltiplicatore,
elettromoltiplicatore
4
Ionizzazione
Condizione necessaria all’analisi spettrometrica e’ la generazione di
specie cariche in fase gassosa. Tale processo e’ detto ionizzazione.
Il processo richiede energia
Costruito il primo
spettrometro di massa
ESI
1907
1966
CI
EI
1900
Bio-MS lezione 1
MALDI
1984 1985
1925
1950
1975
2000
5
Metodi di ionizzazione (1)
Protonazione
Proteine, peptidi, ammine
M + H+ à [M+H]+
NH3+
Deprotonazione
Oligonucleotidi, acidi carbossilici
O
M - H+ à [M-H]OBio-MS lezione 1
6
Metodi di ionizzazione (2)
OH
Addizione cationica
Carboidrati
M + Na+ à [M+Na]+
Na+ OH
Espulsione di elettroni
+.
Piccole molecole organiche
M
- eà
Bio-MS lezione 1
M+.
CH3
7
Come scegliere la modalità di ionizzazione?
Individuare la modalità di ionizzazione più appropriata per l’analisi di un determinato
composto è una procedura che si basa essenzialmente su tre fattori
• Osservazione delle proprietà chimiche della molecola (e.g. proprietà acidobase, presenza di gruppi funzionali, volatilità, etc.)
• Esperienza (confronto con molecole analizzate con successo nel passato o con
dati di letteratura).
• Verifica pratica (confronto sperimentale tra due o più tecniche di ionizzazione
ritenute potenzialmente le più efficaci nella ionizzazione dell’analita in questione).
Bio-MS lezione 1
8
Principali tecniche di ionizzazione
Ionizzazione “hard”
• EI (electron impact)
Ionizzazioni “soft”
• MALDI (matrix-assisted laser desorption ionisation)
• ESI (electrospray ionization)
• APCI (atmospheric pressure chemical ionization)
Bio-MS lezione 1
9
EI: Ionizzazione per impatto elettronico
• Funziona su specie volatili,
gia’ presenti allo stato
gassoso all’atto della
ionizzazione
Filamento di
tungsteno
M
Repulsore
M
M+.
M
M+.
M+.
M
M+.
All’analizzatore
• Genera ioni ad alta energia, i
quali spesso frammentano
molto velocemente in seguito
alla ionizzazione
• Adatta alla ionizzazione di
piccole molecole ( < 400 Da)
Fascio di elettroni
ad alta energia
Bio-MS lezione 1
10
EI: Ionizzazione per impatto elettronico
• EI produce ioni ad alta energia.
• L’elevata energia interna causa una facile frammentazione dello ione
molecolare.
Intensita’
• I frammenti sono rivelati dallo spettrometro di massa. Essi sono
comunque utili per caratterizzazione strutturale (identificazione).
Bio-MS lezione 1
m/z
11
Spettri EI
Gli spettri di massa generati da ionizzazione EI sono altamente
riproducibili. E’ stato quindi possibile generare banche dati di
spettri EI ottenuti sperimentalmente da decine di migliaia di
composti organici.
L’identificazione di un composto incognito in un campione, quindi,
molto spesso si riduce ad una semplice ricerca in banca dati
dello spettro EI ottenuto sperimentalmente.
Bio-MS lezione 1
12
MALDI: Matrix-Assisted Laser Desorption Ionization
• La tecnica e’ basata su un’analisi in fase solida, anche se il
campione di partenza e’ in genere in soluzione.
• L’energia necessaria alla ionizzazione del campione e’ fornita
sotto forma di radiazione elettromagnetica.
• La radiazione e’ inviata in pacchetti ad alta intensita’ tramite un
impulso laser
Bio-MS lezione 1
13
MALDI: Matrix-Assisted Laser Desorption Ionization
HO
Matrice
COOH
OH
DHB
Acido 2,5-diidrossi benzoico
COOH
CN
H
CHCA
Acido α-cian-4- idrossicinnamico
Campione (proteina,peptide, acido nucleico, zucchero)
Laser ad azoto, emissione a 337 nm (UV)
Bio-MS lezione 1
14
MALDI- preparazione del campione
Soluzione di matrice
Soluzione campione
Miscelare (la matrice e’ in forte eccesso)
Depositare sulla piastra metallica (1 µL)
Piastra metallica
Piastra metallica per la deposizione
del campione e l’analisi
Lasciare cristallizzare
Bio-MS lezione 1
Piastra metallica
15
MALDI: Matrix-Assisted Laser Desorption Ionization
+ 20 kV
Impulso laser
+
+
Piastra metallica
Bio-MS lezione 1
+
+
+
+
All’analizzatore
+
+
+
+
+
Matrice
+
Proteina
16
MALDI: Matrix-Assisted Laser Desorption Ionization
- 20 kV
Impulso laser
Piastra metallica
Bio-MS lezione 1
-
-
All’analizzatore
-
-
Matrice
-
DNA/RNA
17
MALDI: meccanismo di ionizzazione
Il processo di ionizzazione MALDI sembra non essere basato su un
singolo meccanismo. A seconda delle condizioni sperimentali,
possono avvenire differenti processi di ionizzazione.
• La esistenza di ioni pre-esistenti nei cristalli di matrice è stata
dimostrata sperimentalmente. La sublimazione della matrice con
conseguente liberazione in fase gassosa degli ioni pre-formati è una
delle vie di ionizzazione del MALDI.
• Il trasferimento di protoni dalla matrice all’analita negli istanti
immediatamente successivi al desorbimento è ritenuto un altro
meccanismo responsabile della ionizzazione di analiti basici.
• Nel caso di sostanze capaci di assorbire la luce UV, è anche
possibile la fotoionizzazione diretta del campione, con la formazione
di ioni radicalici (generalmente non di interesse nel caso delle
biomolecole).
Bio-MS lezione 1
18
MALDI: Matrix-Assisted Laser Desorption Ionization
• Genera per lo piu’ specie monocarica
• Buona tolleranza a contaminanti e sali
• Capace di ionizzare proteine (> 300 kDa)
100
% Intensity
20900
10451
6966
0
10700
Bio-MS lezione 1
m/z
20000
24000
19
MALDI: Matrix-Assisted Laser Desorption Ionization
• Genera per lo piu’ specie monocarica
• Buona tolleranza a contaminanti e Sali
• Capace di ionizzare proteine (> 300 kDa)
[M+H]+
20900
100
% Intensity
[M+2H]2+
10451
[M+3H]3+
6966
0
10700
Bio-MS lezione 1
m/z
20000
24000
20
Elettrospray - ESI
• La tecnica e’ basata sulla nebulizzazione di una soluzione
contenente il campione da analizzare.
• L’energia di ionizzazione e’ fornita da un campo elettrico generato
tra l’ago di introduzione del campione e lo spettrometro di massa.
www.newobjective.com
Bio-MS lezione 1
21
Elettrospray - ESI
Nessun campo elettrico
tra l’ago e lo spettrometro
-
+
+
+
-
- +
-
+
+
-
+ +
+
-
+
-
+
+ +
Menisco
-
+
Ionizzazione
assente
MS
inlet
+
Alimentatore
Bio-MS lezione 1
22
Elettrospray - ESI
Campo elettrico insufficiente
Polo positivo
+
Polo negativo
+ 500 V
+ 50 V
+
+
+
+
+
+ + - ++ + + + +
+
- + - + + +
- + +
+
+
+ - + + + +
- +
+
Ionizzazione assente
-
-
+
-
+
Bio-MS lezione 1
-
Alimentatore
MS
inlet
-
Modalita’ ionizzazione positiva
23
Elettrospray - ESI
Campo elettrico sufficiente
Ionizzazione
Polo positivo
+
Polo negativo
+ 1000-5000 V
+
+
+
+
+
+
+
+ +
+ + + + +
+
+
+
- + + - +
+
+ +
+
+
-
+ 50 V
+
++
++
-
++
++
++
++
+
+
+
+
+
+
+
+ +
+
+
+
+
+
-
+ +
+
+
+
+
+
+
+
+
MS
inlet
+
+
+
Bio-MS lezione 1
Alimentatore
-
Si chiude un vero e proprio
circuito elettrico
24
L’elettrospray genera ioni multicarica
Goccia generata
da elettrospray
+
La goccia evapora lungo il tragitto che
porta allo spettrometro.
+
+
+
+
+
+
+
+
+
+
+
+
+
La proteina ionizzata entra
nello spettrometro di massa
+
+
+
+
+
+
+
+
+ +
+ + +
+
La ionizzazione mediante elettrospray di una soluzione
contenente una singola proteina generera’ un segnale multiplo
allo spettrometro di massa, dovuto al fenomeno della formazione
di ioni multicarica.
Bio-MS lezione 1
25
Ioni multicarica
+
+
Massa
8000
Carica
0
8002
+
+ +
+ +
8003
8004
3
4
2
m/z
+
+
4001
2667
2001
100
M
3+
M
4+
Intensita’
relativa (%)
Bio-MS lezione 1
0
M2+
m/z
5000
26
ESI di una proteina intatta
220
200
180
996.48
909.86
872.01
1046.40
951.19
805.03
Intensity, counts
160
140
775.27
1101.28
120
1162.39
100
80
60
747.63
1230.61
1307.49
40
1394.65
1494.14
20
1609.01
0
500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 1700 1800 1900 2000
m/z
Bio-MS lezione 1
27
ESI : interleuchina-6
220
200
+25
180
La proteina ha un peso molecolare di
circa 21 kDa. La ionizzazione ESI
impartisce da 10 a 30 cariche alla
molecola
996.48
909.86
+20
872.01
1046.40
951.19
805.03
Intensity, counts
160
140
775.27
M+n
1230.61 =
1101.28
n
120
1162.39
100
80
60
747.63
1230.61
1307.49
40
1162.39 =
M+n+1
+15
n+1
1394.65
1494.14
20
1609.01
0
500 600 700 800 900 1000 1100 1200 1300 1400 1500 1600 1700 1800 1900 2000
m/z
Bio-MS lezione 1
28
MALDI & ESI: interleuchina 6
20900
% Intensity
100
10451
Mw=20899
0
10700
100
% intensity
996.48
909.86
872.01
951.19 1046.40
805.03
775.27
MALDI
24000
20000
m/z
Mw=20904
1101.28
1162.39
1230.61
747.63
ESI
1307.49
1394.65
0
600
Bio-MS lezione 1
700
800
900
1000 1100
1200 1300 1400 1500 1600 1700 1800 1900 2000
m/z
29
ESI: sommario
Pro
• Capace di generare complessi
molecolari ionizzati in fase gassosa
(very soft)
• Facilmente interfacciabile con LC
• Interfacciabile con analizzatori
capaci di effettuare MS/MS
• Nessuna interferenza da parte di
matrici
Bio-MS lezione 1
Contro
• Suscettibile alla presenza di sali
• Miscele complesse possono
ridurre la sensibilita’ dell’analisi
• La presenza di ioni multicarica
puo’ confondere, specialmente nel
caso di miscele complesse
• Il campione da analizzare deve
essere puro (ma abbiamo spesso
LC come introduzione del
campione)
30
MALDI: sommario
Pro
• Capace di ionizzare biopolimeri
fino a 1 MDa (1,000,000)
• Piu’ tolleranza nei confronti di sali
ed impurezze rispetto
all’elettrospray
• Spettro facile da interpretare.
Bio-MS lezione 1
Contro
• Ioni background sotto i 700 m/z
escludono l’applicabilita’ del MALDI
a piccole molecole (ma…)
• Condizioni acide possono causare
degradazione del campione
(raramente osservate in analisi di
peptidi).
31
Componenti di uno spettrometro di massa
Camera di
ionizzazione
Analizzatore
Rivelatore
Bio-MS lezione 2
La biomolecola da analizzare viene ionizzata (i)
mediante irraggiamento laser della biomolecola stessa
dispersa in una matrice cristallina (MALDI); (ii)
direttamente da una soluzione, nebulizzandola in
presenza di un campo elettrico (ESI).
Gli ioni vengono separati in base al loro rapporto m/z.
La separazione puo’ avvenire attraverso filtri di massa
(quadrupoli), facendo viaggiare gli ioni in un tubo di
volo (TOF), o confinandoli in trappole ioniche (IT,
FTICR).
Gli ioni vengono inviati dall’analizzatore al detector,
che amplifica la corrente ionica diversi ordini di
grandezza, generando impulsi che compongono lo
spettro di massa finale.
32
Esempio di rivelatore: moltiplicatore di elettroni
Uno ione
dall’analizzatore
Serie di dinodi
106 elettroni
L’urto di un singolo ione proveniente dall’analizzatore causa una
cascata di elettroni. L’impulso elettrico viene successivamente
digitalizzato
Bio-MS lezione 2
33
Analizzatori: tipologie
• Tempo di volo (TOF)
• Quadrupolo (Q, triplo quadrupolo TQ)
• Trappola ionica (IT, trappola lineare LT)
• Fourier Transform Ion Cyclotron Resonance (FTICR)
• Orpitrap
Bio-MS lezione 2
34
Analizzatore a tempo di volo
+ +
Ek= ½ mv2
Ionizzazione
Campione
Eel=ezU
Rivelatore
Pusher, 10-20 kV
+
Campo elettrico
Bio-MS lezione 2
Assenza di campo elettrico
35
Analizzatore a tempo di volo
• In un analizzatore a tempo di volo (TOF), gli ioni vengono
separati all’interno di uno spazio di 1-2 metri compreso tra la
sorgente di ionizzazione ed il rivelatore, detto tubo di volo.
• Ioni aventi una massa elevata viaggiano nel tubo di volo
con velocita’ ridotta, arrivando con ritardo al rivelatore rispetto
a ioni piu’ piccoli.
Bio-MS lezione 2
36
Quadrupolo
Al rivelatore
+ (U + (Vcos ωt))
Dalla sorgente
Bio-MS lezione 2
- (U + (Vcos ωt))
37
Quadrupolo
A dati potenziali U e V solo ioni ad un preciso m/z
attraverseranno il filtro a quadrupolo
m/z 100
Dalla sorgente
m/z 500
Dalla sorgente
m/z 1500
Dalla sorgente
Bio-MS lezione 2
Al rivelatore
38
Quadrupolo
• E’ l’analizzatore di massa piu’ comune. (molto utilizzato in
strumenti da banco GC-MS relativamente economici).
• Separa gli ioni nello spazio a seconda del loro rapporto m/z.
• Usando il voltaggio appropriato, e’ possibile fare si’ che solo ioni
con un determinato m/z attraversino il quadrupolo e raggiungano il
rivelatore.
• Il quadrupolo può essere usato come filtro ionico: possiamo
settare i potenziali in modo da fare passare solo ioni aventi un
determinato m/z ad un secondo analizzatore di massa o ad una
camera di collisione (vedi MS/MS)
Bio-MS lezione 2
39
Spettrometro MALDI-TOF
Ionizzazione MALDI
TOF
Rivelatore
Laser
Segnale
amplificato
Intensita’
Piastra metallica
Bio-MS lezione 2
Tempo (m/z)
40
ESI-QqTOF analizzatore ibrido
pusher
ESI
Quadrupolo
rivelatore
Quadrupolo
100
Intensita’
0
Bio-MS lezione 2
m/z
1000
41
Spettrometria di massa in tandem
• La ionizzazione per EI produce frammentazione degli ioni molecolari.
Tali frammenti sono essenziali per ricavare informazioni strutturali
sulle molecole analizzate.
• Al contrario, le tecniche di ionizzazione soft (MALDI, ESI, APCI) non
producono frammentazione molecolare.
• Per ottenere informazioni strutturali sulle biomolecole ionizzate,
risulta quindi necessario effettuare MS/MS (spettrometria di massa in
tandem).
Bio-MS lezione 2
42
Spettrometria di massa in tandem (MS/MS)
La spettrometria di massa in tandem consiste nell’effettuare una doppia
analisi di massa su un determinato campione. Per fare cio’, e’ possibile
utilizzare due analizzatori in serie, o utilizzare lo stesso analizzatore a
tempi diversi.
MS1: spettro MS da 0 a 1000 m/z
Selezione del picco
650.4
850.1
401.3
0
m/z
Bio-MS lezione 2
100
Intensita’
Intensita’
100
MS2: MS/MS su m/z 850.1
1000
0
198.6
678.8
466.7
80.4
850.1
m/z
1000
43
MS/MS su QqTOF
pusher
Da ESI
Relative
intensity (%)
0
Q1: Camera
di collisione
Q0:
selezione
100
Rivelatore
Full scan
MS
m/z
1000
100
Relative
intensity (%)
0
Bio-MS lezione 2
MS/MS
su
m/z
1000
44
Free carnitine
PKU
MSUD
Homocystinuria
Citrullinemia
GA-I
CPT-I/II
VLCAD
SCAD
ASA
PMA/MMA
MS/MS su triplo quadrupolo (QQQ)
Q1
Q2
frammentazione
Q3
frammenti
• Permette esperimenti di MS/MS.
• In modalita’ SRM (selected reaction monitoring) fornisce
sensibilita’ elevatissime.
• SRM = uno ione di interesse viene selezionato in continuo in
Q1 (il filtro lascia sempre passare solo quello specifico ione),
frammentato in Q2, ed uno o piu’ frammenti specifici vengono
filtrati da Q3 e mandati al detector.
Bio-MS lezione 2
46
HPLC-ESI-MS
Fase
mobile
Colonna HPLC
ESI
Spettrometro
di
Campione
Bio-MS lezione 3
massa
47
LC-MS/MS: SRM
Q1
504
SIM 504
SRM
504 à 380,
504à 140
Bio-MS lezione 3
Q2
Q3
140, 380
Nel cromatogramma
superiore, è riportato il
segnale registrato dallo
spettrometro in modalità
SIM (m/z 504)
Nel cromatogramma
inferiore, lo stesso
campione è analizzato in
modalità SRM. L’analisi è
più selettiva (viene rilevato
solo il picco di interesse),
ed aumenta notevolmente
il rapporto segnale/rumore,
pur diminuendo l’intensità
assoluta del segnale.
48