Gli enzimi
Gli enzimi sono le proteine1 che catalizzano2
le reazioni chimiche che avvengono
nei sistemi biologici
1
2
con l’eccezione dei ribozimi (RNA catalitici)
un catalizzatore è una sostanza che promuove
una reazione chimica senza subire alcuna
modificazione permanente
Serina Proteasi
Le serina proteasi (o proteasi a serina) sono una classe
di proteasi che basano il loro meccanismo di catalizzazione
della rottura di un legame peptidico sulla presenza di un
residuo di serina.
Questa classe comprende (oltre ad enzimi digestivi) enzimi
che partecipano a processi come lo sviluppo, la coagulazione
e l’infiammazione.
Chimotripsina, tripsina ed elastasi hanno strutture
molto simili e catalizzano la stessa reazione, ma con
specificità diversa per le catene laterali dei residui aa.
accanto al legame peptidico che viene scisso.
Un estere o un'ammide si legano al gruppo -OH della
serina liberando alcol o ammina. In presenza di acqua si
ha la rottura del legame con la serina liberando acido
carbossilico.
La specificità non è tuttavia ben spiegata
Tripsina (bovina)
His57
Ser195
Asp102
Serina Proteasi – la triade catalitica
Serina 1Proteasi
Complesso ES
Attacco nucleofilo (Ser)
Intermedio
tetraedrico
Catalisi
acida (His)
2
Intermedio
acil-enzima
3
4
Intermedio
tetraedrico
(inverso
tappa 2)
(inverso
tappa 1)
E attivo + P
carbonilico
Serina Proteasi
Stabilizzazione dello stato di transizione
(distorsione del legame peptidico suscettibile e
formazione dell’intermedio tetraedrico)
Cinetica enzimatica
[E] limitante [S] in eccesso
Tutti gli enzimi possono essere analizzati per quantificare
sia la loro velocità di reazione che la loro efficienza
La relazione tra queste due grandezze è
descritta dall’equazione di Michaelis-Menten
From Wikipedia, the free encyclopedia
Leonor Michaelis (January 16, 1875 – October 8, 1949) was a German
biochemist and physician famous for his work with Maud Menten in enzyme
kinetics and Michaelis-Menten kinetics.
Born in Berlin (Germany), he studied medicine in Freiburg, where he
graduated in 1897.
In 1914 he published a paper suggesting that Emil Abderhalden's notorious
pregnancy tests could not be reproduced, a paper which fatally
compromised Michaelis' position as an academic in Germany (….)
Besides his role in the formulation of the Michaelis-Menten equation (1913)
he discovered Janus green as a supravital stain for mitochondria and the
Michaelis-Gutmann body in urinary tract infections (1902) and found that
thioglycolic acid could dissolve keratin, making him the father of the
permanent wave.
From Wikipedia, the free encyclopedia
Maud Leonora Menten (March 20, 1879 – July 26, 1960) was a Canadian
medical scientist who made significant contributions to enzyme kinetics
and histochemistry. Her name is associated with the famous MichaelisMenten equation in biochemistry.
She was among the first women in Canada to earn a medical doctorate.
She completed her thesis work at University of Chicago. At that time
women were not allowed to do research in Canada, so she decided to do
research in other countries such as the United States and Germany.
In 1912 she moved to Berlin where she worked with Leonor Michaelis,
obtaining a Ph.D. in 1916. (…) Her most famous work (…) resulted in the
Michaelis-Menten equations.
Menten also invented the azo-dye coupling reaction for alkaline
phosphatase, which is still used in histochemistry. She characterised
bacterial toxins from B. paratyphosus, S. scarlatinae and Salmonella ssp.)
and conducted the first electrophoretic separation of proteins in 1944. She
worked on the properties of hemoglobin, regulation of blood sugar level,
and kidney function. She was also an accomplished musician and painter.
Leonor Michaelis e Maud Menten (1913)
La cinetica di Michaelis-Menten descrive l'andamento della velocità di
una reazione catalizzata da enzimi, al variare della concentrazione di
substrato. (Questo modello è valido per enzimi non allosterici.)
ES è un intermedio di reazione il cui basso valore di energia di
attivazione permette di fare avvenire una specifica reazione
catalizzata.
Quando ES assume un valore di concentrazione che si mantiene
costante nel tempo, si dice che è stato raggiunto lo stato stazionario
(steady state).
Quando [S] è tale che tutto E si trova in ES la seconda
tappa limita la velocità complessiva della reazione, che
diviene insensibile ad un aumento ulteriore di [S]
L’equazione di Michaelis-Menten
KM è uguale alla concentrazione di substrato a cui la
Velocità di reazione è pari alla metà di quella massima
(mol/L)
La costante di Michaelis-Menten è una grandezza
caratteristica di ciascun enzima.
KM indica l'affinità tra un enzima e il suo substrato:
< valore di KM < [S] per cui V = Vmax/2
(alta affinità dell'enzima per il substrato).
Viceversa
> valore di KM > [S] per cui V = Vmax/2
(minore affinità dell'enzima per il substrato).
Quando tutto l’enzima (cioè l’enzima totale, Etot) partecipa alla
reazione, ovvero la concentrazione del complesso Enzima-Substrato
[ES] diventa [E] tot, la velocità della reazione catalizzata corrisponderà
alla velocità massima Vmax.
Si può allora definire una nuova costante :
Kcat = Vmax / [ETOT]
Kcat = Vmax / [ETOT]
La costante catalitica Kcat indica la velocità del processo
catalitico (il numero di molecole trasformate in un secondo)
ed è detta anche numero di turnover
Kcat = rappresenta una misura diretta
della formazione del prodotto in condizioni
ottimali (s-1)
Kcat/KM = è una costante di velocità di
secondo ordine ((mol/L) s-1) e fornisce una
misura dell’efficienza e della specificità di
un enzima
Per unità di enzima (EU) si intende:
la quantità di enzima che trasforma 1 μmole di
substrato in 1 minuto primo a temperatura definita (di
norma 37 C).
Ogni enzima ha valori delle costanti caratteristici
La SOD1 ha la più alta Kcat/KM di ogni altro enzima conosciuto (~7 x 109 M-1 s-1)
La determinazione sperimentale di VMax (e quindi di KM) è
necessariamente imprecisa.
Tuttavia, l'equazione di Michaelis-Menten può essere
espressa nella forma
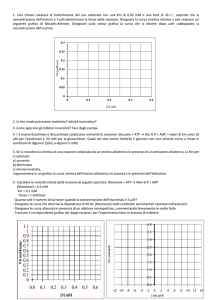
Grafico dei doppi reciproci (o di Lineweaver-Burk)
Rappresentazione grafica dell'andamento
funzione di 1/[S] retta con
-1/KM intercetta sull'asse delle ascisse
1/Vmax intercetta sull'asse delle ordinate
KM/Vmax = coefficiente angolare
di
1/V
in
Anche la rappresentazione di Lineweaver-Burk causa
imprecisioni nella determinazione di KM e VMAX,
però è molto utile per descrivere
il tipo di inibizione di un enzima
Gli inibitori enzimatici sono molecole che si legano ad un
enzima e causano la diminuzione della sua attività. Molti
inibitori sono studiati come farmaci.
Proteasi di HIV con ritonavir
Gli inibitori sono classificati come
reversibili e irreversibili.
Gli inibitori reversibili si legano non covalentemente a
E o a ES (attraverso legami ionici o idrogeno o per
interazioni idrofobiche)
Gli inibitori irreversibili modificano covalentemente
aminoacidi presenti nel sito attivo di E
Gli inibitori sono anche classificati come
•
•
•
•
Competitivi
Non-competitivi
Incompetitivi
Misti
Inibizione competitiva
Gli inibitori competitivi legano E nello stesso sito del
substrato e hanno la stessa intercetta sull’asse y
dell’enzima non inibito (Vmax non cambia) ma la
pendenza è diversa e la intercetta sull’asse x cambia
rispetto all’enzima non inibito (KM cambia).
Inibizione non competitiva e incompetitiva
Inibizione incompetitiva
Gli inibitori non competitivi legano E in un sito diverso
da quello del substrato e hanno la stessa affinità per E
ed ES.
KM non cambia ma Vmax diminuisce
Gli inibitori incompetitivi legano solo ES
Il complesso EIS è enzimaticamente inattivo
Vmax e KM sono minori.
Gli inibitori misti legano sia E che ES ma con affinità differente
Vmax diminuisce e KM aumenta
La regolazione dell’attività enzimatica
Le vie metaboliche sono costituite da serie di reazioni catalizzate
A
E1
B
E2
C
E3
D
La velocità di una via metabolica è spesso regolata da una
“tappa di comando” che accende/spegne la via stessa
La velocità della “tappa di comando”
è regolata in diverse maniere:
LENTAMENTE (ore o giorni)
1. Controllo genetico della concentrazione dell’enzima.
VELOCEMENTE (secondi o minuti)
1. Controllo allosterico (da substrati, coenzimi, prodotti
– anche di reazioni successive)
2. Modificazione covalente (ad es. fosforilazione)
3. Cicli del substrato (variazione della velocità di due
reazioni opposte catalizzate da due enzimi diversi)
Controllo (epi)genetico della concentrazione di un enzima.
• A livello trascrizionale :
struttura della cromatina,
attivazione/disattivazione di un promotore
• A livello del processamento dell’mRNA
splicing alternativo, stabilità
• A livello della traduzione
localizzazione dell’mRNA, conservazione in
RNP
Controllo post-traduzionale della concentrazione di un enzima
Ripiegamento tridimensionale corretto
Assemblaggio delle subunità peptidiche
Formazione di legami S-S fra gruppi laterali di cisteine
Rimozione di aminoacidi:
o sequenze segnale di indirizzamento
o metionina iniziale
o sequenze presenti nei precursori
Aggiunta di carboidrati e successiva elaborazione
Aggiunta di code lipidiche
Aggiunta di cofattori
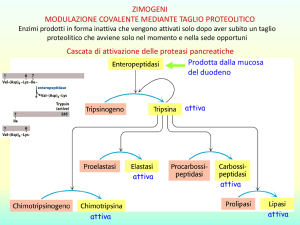
Modificazioni covalenti
Modificazioni post-traduzionali
L’attività di molti enzimi è regolata da modificazioni
post-traduzionali, che modificano l’affinità dell’enzima
per il suo substrato
- Glicosilazione;
- Acetilazione (ad es. degli istoni);
- Miristilazione (attacco di un ac. miristico, in genere in N-term);
- fosforilazione/defosforilazione di residui -OH di Tyr, Ser o Thr
(mediata da chinasi e fosfatasi)
- Acilazione (a livello del C-term a livello del ER e del Golgi).
- Gipilazione (attacco di Glicosil Fosfatidil Inositolo, GPI).
- Formazione di ponti di solfuro (disolfuro isomerasi)
- Metilazione (ad es. istoni, importante per il silenziamento geni)
- Idrossilazione (per la formazione di ponti H fra proteine;
es. proline nel collageno)
Modificazioni covalenti comuni delle proteine
Modification
Donor molecule
Example of
modified protein
Protein function
Phosphorylation
ATP
Glycogen
phosphorylase
Glucose homeostasis;
energy transduction
Acetylation
Acetyl CoA
Histones
DNA packing;
transcription
Myristoylation
Myristoyl CoA
Src
Signal transduction
ADP-ribosylation
NAD
RNA polymerase
Transcription
Farnesylation
Farnesyl
pyrophosphate
Ras
Signal transduction
γ-Carboxylation
HCO3-
Thrombin
Blood clotting
Sulfation
3′-Phosphoadenosine5′-phosphosulfate
Fibrinogen
Blood-clot formation
Ubiquitination
Ubiquitin
Cyclin
Control of cell cycle
Controllo allosterico (da substrati, coenzimi, prodotti)
Regolazione mediante retroinibizione da
prodotto (feedback inhibition )
A
E1
B
E2
C
E3
D
La concentrazione di un prodotto
(finale/intermedio) della via metabolica regola
l’attività di un E “a monte”
Se [D] è alta, E1 viene inibito da D stesso
Enzimi allosterici
(L’equazione di Michaelis-Menten non è valida)
La regolazione allosterica (o allosteria) è la regolazione di
un enzima o di una proteina (multimerica) mediata da una
molecola detta effettore allosterico, che svolge tale
funzione legandosi presso il sito allosterico. Un enzima
dotato di siti allosterici è detto enzima allosterico.
Il termine allosteria deriva dal greco allos, cioè "altro", e stereos,
"struttura, solido", in riferimento alla separazione del sito allosterico di
una proteina dal suo sito attivo.
Quando l'effettore di una proteina è diverso dal suo
substrato si parla di allosteria eterotropica, quando
coincide si parla di allosteria omotropica.
Un modulatore allosterico omotropico è tipicamente un
attivatore, un modulatore allosterico eterotropico può
essere un attivatore o un inibitore
I modulatori allosterici inducono cambiamenti
conformazionali (anche a lunga distanza) nella
proteina legata.
L'ossigeno è sia il substrato che l'effettore dell’Hb. Il sito allosterico è
il sito attivo di una subunità contigua. Il legarsi dell'ossigeno ad una
subunità induce un cambio conformazionale in quella subunità, che
forza i restanti siti attivi accrescendo la loro affinità per ossigeno.
Stato T
Bassa affinità per O2
(deossiemoglobina)
Stato R
Alta affinità per O2
(ossieomoglobina)
Il BPG diminuisce l’affinità
della Hb per l’O2 e quindi
favorisce la forma deossiNei capillari, il BPG
favorisce il rilascio di O2
Il BPG è un modulatore
allosterico eterotropico
dell’Hb.
Il cambiamento conformazionale indotto dal modulatore
allosterico causa una variazione di affinità dell’enzima per
il substrato o della proteina per il ligando.
La Fosfofruttochinasi controlla la via glicolitica
(nel muscolo scheletrico)
1.
• PFK è un tetramero con
due stati conformazionali (T e
R) in equilibrio tra loro
• L’ATP è sia substrato che
inibitore (2 siti di legame
diversi)
• AMP, ADP e fruttosio-2,6bifosfato sono attivatori
La regolazione allosterica viene talvolta sfruttata in
farmacologia.
Ad es. gli ansiolitici benzodiazepine (ad es : Valium, Xanax, Librium e
Ativan) potenziano l’attività del neurotrasmettitore acido gammaaminobutirrico (GABA) legando il suo recettore GABAR in un sito
diverso dal GABA e attivandolo (il GABAR è un canale inibitorio,
quando è attivato diminuisce l’attività neuronale).