PROGRAMMA DI SCIENZE NATURALI
Classe I C anno scolastico 2015/16
Libro di testo: CRIPPA “SCIENZE NATURALI 1” A .MONDADORI
SCIENZE TERRA
L’AMBIENTE CELESTE: L’universo intorno a noi
Le costellazioni: stelle solo apparentemente vicino; Stelle occidue e circumpolari: chi tramonta e chi
no; Lo zodiaco: il percorso apparente del Sole; Come si studia il cosmo? Gli strumenti dell’astronomi ; Le
distanze astronomiche: un viaggio nello spazio e nel tempo; Le stelle:la loro classificazione e il diagramma
H-R; Le stelle producono una enorme quantità di energia ; L’evoluzione delle stelle; Le galassie: la Via
Lattea e le altre galassie.
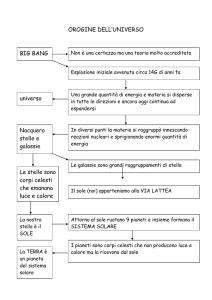
L’origine dell’Universo e il big bang; La radiazione cosmica di fondo; Materia oscura, energia
oscura e futuro dell’universo ; L'origine del Sistema Solare; I corpi del Sistema solare: pianeti gioviani e
terrestri satelliti, asteroidi comete, meteore, meteoriti e pianeti nani; Il Sole: la sorgente di energia; Il moto
dei pianeti attorno al Sole: le leggi di Keplero e la legge della forza gravitazionale universale
LA TERRA E LA LUNA
La forma e le dimensioni della Terra; Le coordinate geografiche; Il moto di rotazione terrestre: prove
e conseguenze; Il moto di rivoluzione terrestre attorno al Sole: prove e conseguenze; L’alternanza delle
stagioni; Le zone astronomiche; I moti millenari della Terra; Il tempo civile e i fusi orari; La Luna: il
paesaggio lunare e i suoi movimenti; Fasi Lunari.
CHIMICA
Introduzione alla chimica
Le origini della chimica: La Chimica odierna: tecnologia, ambiente e salute, Il metodo scientifico :
definizione del problema; Osservazione del fenomeno; Il ruolo dell'ipotesi nel metodo scientifico; Verifica
dell'ipotesi; Teorie e modelli teorici; La chimica studia la materia e le sue trasformazioni; Le proprietà della
materia; le trasformazioni della materia;
Le unità di misura
Il Sistema Internazionale di Unità è basato delle unità di misura; Le grandezze possono essere
intensive o estensive; La massa, il peso, la pressione, il volume, la densità assoluta; La Chimica e l'energia:
Energia cinetica e potenziale; La temperatura indica lo stato termico di un corpo: la scala Celsius, Kelvin e
Fahrenheit; Il calore: energia in trasferimento.
Gli strumenti e metodi della chimica
Gli strumenti di laboratorio e come si compila una relazione tecnico-scientifica.
Le trasformazioni fisiche e chimiche della materia
Lo stato di aggregazione di ogni sostanza dipende dalle condizioni ambientali;Gli stati di
aggregazione: descrizione microscopica; I passaggi di stato; La fusione e l'ebollizione; Le miscele:
eterogenee e omogenee; Un’unica fase o più fasi coesistenti ?; Gli stati di aggregazione delle miscele;
Proprietà comuni a tutte le miscele; Le tecniche di separazione delle miscele; La separazione delle miscele
eterogenee solido-liquido (soluzioni); La separazione delle miscele eterogenee solido-liquido (emulsioni); La
separazione delle miscele eterogenee solido-liquido; La distillazione delle miscele omogenee allo stato
liquido (soluzione); La cromatografia; Le sostanze pure; Proprietà delle sostanze pure; Entrano in gioco le
trasformazioni chimiche:composti ed elementi; Un composto non è una miscela; Gli elementi:nomi e
simboli; L’aspetto quantitativo delle reazioni.
L’aspetto quantitativo delle reazioni.
Le leggi ponderali:l’importanza delle quantità; La legge di Lavoisier o legge della conservazione
della massa; La legge di Proust o legge delle proporzioni definite e costanti; La legge di Dalton o legge delle
proporzioni multiple; La teoria atomica di Dalton interpreta le leggi ponderali; La scoperta delle molecole ;
Teoria atomica ed esperimenti di Gay-Lussac: un’insanabile contraddizione ; La teoria atomico - molecolare
di Avogardo; La definizione di molecola; Massa assoluta e massa relativa: due modi per “pesare” gli atomi;
La misurazione delle masse assolute; L’unità delle masse atomiche; La massa molecolare relativa; La mole:il
contatore delle quantità di sostanza; La definizione di mole ; Il numero di Avogardo; La massa molare; Le
formule:il linguaggio della chimica; Come si determina la formula di un composito?; Dalla composizione
percentuale alla formula molecolare di un composito
Attività di Laboratorio di Chimica: Illustrazione della vetreria
Roma, 1 giugno 2016
Alunni
Docente