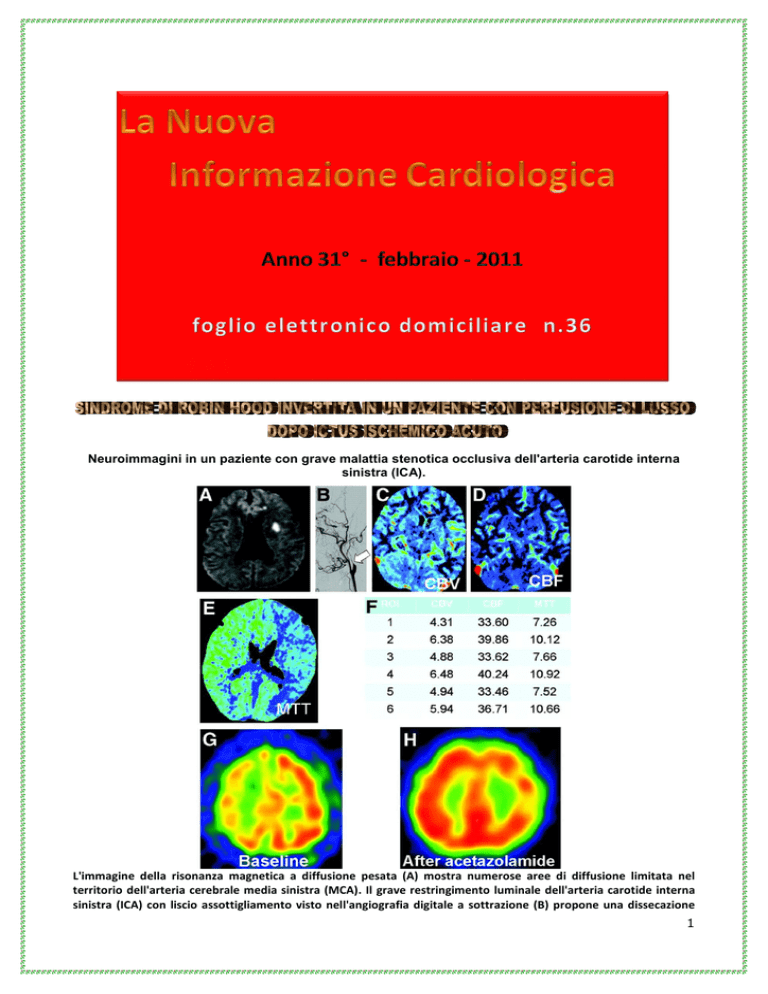
Neuroimmagini in un paziente con grave malattia stenotica occlusiva dell'arteria carotide interna
sinistra (ICA).
L'immagine della risonanza magnetica a diffusione pesata (A) mostra numerose aree di diffusione limitata nel
territorio dell'arteria cerebrale media sinistra (MCA). Il grave restringimento luminale dell'arteria carotide interna
sinistra (ICA) con liscio assottigliamento visto nell'angiografia digitale a sottrazione (B) propone una dissecazione
1
arteriosa. Aumento del volume ematico cerebrale (CBV) e del flusso ematico cerebrale (CBF) nel territorio
dell'arteria cerebrale media di sinistra (MCA) nonostante un elevato tempo medio di transito (MTT) sono
evidenziati sulle immagini tomografiche computerizzate di perfusione (da C a F). L'immagine tomografica
computerizzata da emissione di fotone singolo di technetium-99–hexamethylpropyleneamine oxime, in condizioni
basali (G) mostra aumento significativo di perfusione nel territorio dell'arteria cerebrale media sinistra nonostante
numerosi infarti ischemici e grave malattia di ICA (perfusione di lusso). L'immagine tomografica dopo la prova con
acetazolamide (Diamox) (H) mostra una paradossale riduzione di perfusione nel territorio dell'arteria cerebrale
media sinistra provocata dalla sindrome di Robin Hood invertita.
COMMENTO
Un uomo di 49 anni, fumatore cronico (40 sigarette al
giorno numerosi episodi transitori di debolezza del lato
precipitati dall'esercizio, e duravano da 5 a 10 minuti.
palpitazione, cefalea, o trauma, o storia familiare
dislipidemia, ictus, o cardiopatia ischemica.
giorno per 20 anni) presentava da 1
destro. Gli episodi erano stereotipici,
Egli negava qualche dolore toracico,
d'ipertensione, e diabete mellito,
All'arrivo, il paziente era normalmente cosciente e bene orientato; polso (65 bpm) e pressione
arteriosa (145/90 mm Hg) erano regolari. Durante l'esame, furono rilevate difficoltà nella
ricerca di qualche parola e lieve debolezza del lato destro (potenza, grado 4 della scala del
National Institute of Health Stroke). La risonanza magnetica dell'encefalo (Figura 1A) rivelava
numerose aree di diffusione limitata nel territorio dell'arteria cerebrale media sinistra (MCA).
L'assenza di placche aterosclerotiche importanti e l'assottigliamento liscio con grave
restringimento luminale dell'arteria carotide interna (ICA) faceva sospettare fermamente una
possibile dissecazione arteriosa, benché non fosse stato rilevato il classico reperto
ultrasonografico nel duplex carotideo. I reperti erano confermati nell'angiografia digitale
(Figura 1B).
L'ultrasonografia Doppler Transcranica mostrava riempimento crociato anteriore dell'arteria
cerebrale media sinistra (MCA) via un'arteria comunicante anteriore palese. Durante
prolungato monitoraggio non erano rilevati segnali di microemboli spontanei.
La reattività vasomotoria (1) era valutata con la registrazione simultanea di entrambe le MCA
mentre la respirazione era trattenuta volontariamente per 30 secondi. Normale accelerazione
del flusso si verificava nell'arteria cerebrale media destra durante la sospensione del respiro,
ma nello stesso tempo l'arteria cerebrale media sinistra dimostrava paradossale riduzione delle
velocità di flusso risultante dal fenomeno del furto intracranico (Figura 2). La così detta
sindrome di Robin Hood invertita. (2)
Figura 2
2
Figura 2. Monitoraggio continuo con Doppler transcranico di entrambe le arterie cerebrali
medie durante la sospensione volontaria della respirazione per 30 secondi. Durante
sospensione del respiro la velocità media del flusso aumentava in modo significativo
nell'arteria cerebrale media destra (RMCA) (da 40 a 58 cm/s). Nello stesso periodo, l'arteria
cerebrale media di sinistra (LMCA) mostrava una riduzione paradossale di velocità media di
flusso (da 44 a 38 cm/s). Sotto, tendenza complessiva delle velocità di flusso nelle due MCAs.
La perfusione metabolica e la riserva vasodilatatoria cerebrale erano valutate con l'immagine
tomografica computerizzata da emissione di fotone singolo di technetium-99–
hexamethylpropyleneamine oxime, in condizioni basali e dopo la prova dell'acetazolamide.(3)
L'incremento significativo della perfusione (Figura 1G) nella regione dell'arteria cerebrale
media sinistra nonostante i numerosi infarti ischemici e la grave steno-occlusione dell'arteria
carotide interna faceva pensare a una "perfusione di lusso". Tuttavia, una riduzione paradossa
della perfusione metabolica nel territorio dell'arteria cerebrale media sinistra (Figura 1H) si
verificava dopo la prova vasodilatatoria con acetazolamide, compatibile con sindrome di Robin
Hood invertita rilevata con l'ultrasonografia Doppler transcranica.
Durante la prova dell'acetazolamide, la potenza negli arti di destra del paziente peggiorò
transitoriamente (al grado 3 del Medical Research Council, durata 10 minuti).
In aggiunta alla somministrazione di aspirina e statine, il paziente rimase in posizione inclinata
"testa in giù" e ricevette abbondanti liquidi intravenosi per facilitare la perfusione cerebrale.(4)
Egli ha continuato a presentare fluttuazioni dei sintomi neurologici durante la prima settimana,
specialmente al risveglio. Durante il sonno si verificavano verosimilmente parecchie volte cicli
viziosi di transitoria ipoventilazione – ipercapnia - furto intracranico, che spiegava le sue
fluttuazioni diurne. La guarigione fu lenta ma soddisfacente e fu dimesso dopo 3 settimane
(Scala Rankin punteggio, 0). Nonostante la persistente e grave malattia steno-occlusiva
dell'arteria carotide interna, il paziente è rimasto asintomatico nei 4 mesi di follow-up. Alla
rivalutazione a 3 mesi con ultrasonografia Doppler transcranica, la reattività vasomotoria è
risultata essere normale (e non più presente sindrome di Robin Hood invertita, ).
In conclusione, è stato presentato un paziente con infarti acuti ischemici nel territorio
dell'arteria cerebrale media causati da dissecazione spontanea della carotide interna. La
perfusione di lusso è una non comune alterazione dell'imaging cerebrale, osservata
abitualmente dopo 3 - 7 giorni dall'infarto, e rappresenta il fallimento dell'autoregolazione
cerebrovascolare. La sindrome di Robin Hood invertita potrebbe aggravare la lesione dei
tessuti e dovrebbe essere ipotizzata se compaiono fluttuazioni neurologiche precocemente
dopo l'ictus.
Bibliografia
1. Markus HS, Harrison MJ. Estimation of cerebrovascular reactivity using transcranial Doppler, including
the use of breath-holding as the vasodilatory stimulus. Stroke. 1992;23:668–673.
2. Alexandrov AV, Sharma VK, Lao AY, Tsivgoulis G, Malkoff MD, Alexandrov AW. Reversed Robin Hood
syndrome in acute ischemic stroke patients. Stroke. 2007;38:3045–3048.
3. Hirano T, Minematsu K, Hasegawa Y, Tanaka Y, Hayashida K, Yamaguchi T. Acetazolamide reactivity
on 123I-IMP single photon emission computed tomography in patients with major cerebral artery occlusive
disease: correlation with positron emission tomography parameters. J Cereb Blood Flow Metab.
1994;14:763–770.
4. Wojner-Alexander AW, Garami Z, Chernyshev OY, Alexandrov AV. Heads down: flat positioning
improves blood flow velocity in acute ischemic stroke. Neurology. 2005;64:1354–1357.
P.R.
3
Indice:
Imaging: Sindrome di Robin Hood invertita in un paziente con perfusione di lusso dopo ictus ischemico acuto,
pag. 1-3; Editoriale: Infarto Miocardico nel corso d'Intervento Coronarico Percutaneo, pag. 4-10; Leading
article: Eziopatogenesi della Fibrillazione atriale: dalle teorie elettro-anatomiche alle nuove teorie genetiche.
pag. 10-24 ; Focus:, Gli antiagreganti piastrinici pag. 25-28; Medicina e morale: Propaganda bioetica: Il
premio Nobel a Edwards, pag. 28-31
EDITORIALE
L'indicazione a intervento coronarico percutaneo (PCI) dipende dalle strategie d'intervento e
dai criteri diagnostici seguiti negli ospedali. Ogni anno dal 5 al 30% dei pazienti sottoposti a
PCI subiscono un infarto miocardico periprocedurale. (1,2) Nelle stime più elevate, l'incidenza di
tali eventi è simile alla frequenza annuale dell'infarto miocardico spontaneo transmurale. (3)
Pertanto, molti cardiologi e internisti facilmente vedono pazienti con malattia coronarica che
hanno subìto un infarto miocardico periprocedurale il cui significato clinico e il trattamento
rimangono ancora argomento di considerevole controversia e incertezza.
Gli argomenti che depongono per l'importanza clinica dell'infarto periprocedurale, sono:
1. I pazienti con elevati biomarkers dopo PCI mostrano i segni di un infarto focale sulle
imging cardiache
2. Molti studi hanno dimostrato esservi
periprocedurale e cattivi esiti clinici
una
correlazione
tra
infarto
miocardico
3. Esiste una correlazione positiva tra l'ampiezza dell'aumento dei biomarkers e la
probabililità di esiti clinici negativi
4. Studi hanno dimostrato che interventi pre-PCI, quali la terapia con statine, riducono la
frequenza di infarti miocardici periprocedurali e migliorano gli esiti a lungo termine.
Gli argomenti che invece depongnono contro un significato clinico dell'infarto periprocedurale,
sono:
1. Praticamente tutti i dati che correlano l'infarto periprocedurale con gli esiti clinici
negativi sono derivati da studi clicini retrospettivi che hanno dimostrato le associazioni
ma non relazioni casuali.
2. Studi clinici retrospettivi sono
per tutte le possibili varianti
angiografiche, e procedurali,
periprocedurale che degli esiti
generalmente limitati poiché non possono essere corretti
confondenti rispetto alla caratteristiche basali, cliniche,
che possono determinare la probabilità sia dell'infarto
clinici negativi
3. La maggior parte degli studi non hanno utilizzato metodi di dosaggio ad elevata
sensibilità della troponina cardiaca; quando furono usati questi metodi, non si applicò il
valore di taglio del 99°percentile raccomandato come limite superiore del range normale
4. Nella maggior parte dei casi, l'infarto miocardico periprocedurale risulta in una necrosi
minima e quindi non altera sostanzialmente la funzione cardiaca – uno dei fattori più
importanti degli esiti clinici nella malattia coronarica. (4-6)
4
Definizioni e Fattori Predittivi di Mionecrosi Insorta con la PCIIl documento più recente di consenso delle linee guida concernenti gli interventi coronarici
percutanei (PCI), nella definizione generale d'infarto miocardico classifica specificamente che i
livelli dei biomarkers cardiaci sono indicativi di un infarto miocardico periprocedurale nel caso
in cui siano più di 3 volte sopra il limite di riferimento superiore. Si raccomanda inoltre la
misura della troponina cardiaca come il biomarker preferito. (7) Considerata la disponibilità di
metodi di determinazione della troponina cardiaca a elevata sensibilità, la linea guida stabilisce
la soglia per una diagnosi d'infarto miocardico periprocedurale con livelli molto bassi di
mionecrosi.
I fattori predittivi di infarto miocardico periprocedurale possono essere in senso lato suddivisi
come fattori di rischio relati al paziente, al tipo di lesione, e alla procedura. (1) I principali fattori
di rishio, in termini di frequenza e pericolosità, sono: ♦ le lesioni complesse (come ad esempio,
presenza di trombi, stenosi di un innesto di vena safena, o una lesione di tipo C), ♦ le
procedure complesse (come ad esempio, trattamento di lesioni multiple o impiego di
aterectomia rotazionale), ♦ le complicazioni associate (come ad esempio, chiusura improvvisa
di un vaso, occlusione di un ramo collaterale, embolizzazione distale, o no-reflow). (1,8) Invece,
fattori relati al paziente, come ad esempio età avanzata, diabete mellito, insufficienza renale,
malattia multivasale, e disfunzione ventricolare sinistra, costituiscono le determinanti
importanti degli esiti clinici dopo PCI. (1,8) La comparsa di sintomi ischemici durante la
procedura, in particolare dolore precordiale al termine della procedura o segni
elettrocardiografici d'ischemia, definisce il sottogruppo di pazienti con la probabilità più elevata
di avere infarto miocardico periprocedurale. (9)
Cause della Mionecrosi in relazione alla procedura di PCIGli estesi infarti miocardici periprocedurali sono in genere dovuti a complicazioni già evidenti
durante l'angiografia; tuttavia, non è questo che si verifica generalmente nella grande
maggioranza di pazienti con elevati livelli di biomarker dopo PCI. (6,10)
La risonanza magnetica cardiaca (MRI) ha confermato due sedi distinte della mionecrosi
procedurale: adiacente alla sede dell'intervento, in cui la lesione è assai probabilmente dovuta
all'occlusione di un ramo collaterale epicardico, e a valle della sede dell'intervento, dove è
assai probabilmente dovuta alla compromissione della circolazione microvascolare (fig. 1) (11).
La lesione miocardica acuta si verifica con uguale frequenza nelle due sedi ed è evidenziata con
la MRI nel 25% di pazienti dopo PCI, con una estensione media dell'infarto che coinvolge circa
il 5% della massa ventricolare sinistra. (2) L'estensione degli infarti distali è risultata essere
correlata direttamente al volume di placca che è stato ridotto (e quindi embolizzato) mediante
PCI, poiché più frammenti sono spinti nel flusso distale, mentre non è così nella lesioni di tipo
prossimale. Inoltre, la composizione della placca influenza l'estensione della mionecrosi
periprocedurale. PCI in placche con grosso centro necrotico provoca un maggior grado di
mionecrosi, mentre placche fibrose sono relativamente neutre a questo riguardo. (12)
Embolizzazione di materiale della placa è stata stata rilevata sulla ultrasonografia Doppler
intracoronarica durante PCI. Benché embolie si verifichino in ogni fase dell'intervento, esse
sono molto più spiccate durante l'impianto di stent. (13) Anche se il numero di microemboli è
correlato positivamente con la gravità della disfunzione miocardica microvascolare e della
mionecrosi, tuttavia la portata della microembolizzazione è simile nei pazienti con e in quelli
senza infarto miocardico periprocedurale. (13) Tale rilievo suggerisce che altri fattori diversi dal
carico della microembolizzazione della placca, elencati nella fig. 1, influenzano la probabilità
dell'infarto miocardico periprocedurale, come ad esempio la liberazione dalla placca di fattori
vasoattivi, l'attivazione piastrinica, e la pre-esistente vulnerabilità del miocardio. (1)
Fig. 1 Meccanismi Coinvolti nell'Infarto Miocardico Periprocedurale . (1,11)
5
Focus sulla Mionecrosi Post-procedurale
Molti studi hanno valutato il significato clinico di elevazioni di biomarkers cardiaci dopo PCI. (1)
La conclusione generale dalle analisi retrospettive fu che un'elevazione di CK-MB maggiore di 5
volte il limite superiore normale era indipendentemente associata con un aumentato rischio di
eventi cardiaci avversi durante il ricovero ospedaliero. Invece, la relazione tra il livello di CKMB e la sopravvivenza a lungo termine è risultata meno consistente con risultati contrastanti
tra gli studi. (1) Anche gli studi che hanno valutato la relazione esistente tra il livello postprocedurale della troponina cardiaca e la mortalità a distanza ha dato risultati contrastanti,
dovuti a eterogeneità dei criteri d'inclusione, variabilità in sensibilità e specificità dei metodi di
misurazione dei biomarkers, differenti ampiezze dei campioni, e differenze nella durata del
follow-up. Due recenti meta-analisi hanno concluso che un elevato livello di troponina cardiaca
dopo PCI fornisce un'informazione prognostica. (14,15) Tuttavia, l'accuratezza di tale conclusione
è pur sempre condizionata dalla scelta dei valori di taglio normali della troponina cardiaca. (7)
Focus sul Rischio Pre-procedurale
In una recente analisi, impiegando l'attuale valore di taglio raccomandato, corrispondente al
99° percentile del livello normale della troponina T cardiaca, è stato rilevato che circa un terzo
dei pazienti sottoposti a PCI non urgente presentavano evidente mionecrosi pre-procedurale.
6
(6)
Questi pazienti presentavano un maggiore carico aterosclerotico e una malattia più instabile
di quelli senza alcuna evidenza di mionecrosi pre-procedurale. Un altro terzo di pazienti
subirono un infarto miocardico periprocedurale dopo PCI quando fu utilizzata la troponin T
cardiaca per individuare la mionecrosi, rispetto a solo 1 su 15 pazienti quando fu utilizzata la
CK-MB. (6) Il livello di biomarker cardiaco pre-procedurale fu un potente fattore predittivo
indipendente di mortalità a breve e a lungo termine a differenza del biomarker postprocedurale, perché la maggior parte di mionecrosi periprocedurale sono di estensione molto
piccoli, specialmente nei pazienti con stabile malattia coronarica. (6) L'associazione che può
verificarsi tra mionecrosi post-procedurale ed esito clinico dopo PCI bene riuscita, riflette, in
genere, il rischio pre-procedurale congiunto alle caratteristiche cliniche e angiografiche del
paziente. Il rischio pre-procedurale può essere stimato misurando i livelli di base della
troponina cardiaca con i metodi a elevata sensibilità.
Significato prognostico degli eventi periprocedurali verso quelli spontanei
Nelle prove cliniche l'infarto miocardico periprocedurale sopra descritto è stato spesso
equiparato all'infarto miocardico spontaneo, (16) ma questo comporta una certa confusione
vista, le diverse definizioni usate in passato di infarto miocardio periprocedurale. L'attuale
definizione universale d'infarto miocardico affronta tale argomento introducendo invece una
categoria specifica (tipo 4a) per l'infarto miocardico periprocedurale per distinguerlo da quello
spontaneo (infarto miocardico tipi 1 e 2).(7)
In 7773 pazienti reclutati nell'ACUITY (Acute Catheterization and Urgent Intervention Triage
Strategy trial) (10), con sindromi coronariche acute senza elevazione del segmento ST, con
rischio moderato o elevato, che furono sottoposti a PCI, l'infarto miocardico periprocedurale e
quello spontaneo si svilupparono durante il follow-up rispettivamente nel 6.0% e nel 2.6%
della coorte. Nei pazienti infartuati confrontati con quelli senza infarto miocardico, la mortalità
non aggiustata a 1 anno risultò essere più elevata significativamente. Dopo aggiustamento per
le differenze delle condizioni di base e delle caratteristiche procedurali tra i due gruppi, l'infarto
miocardico spontaneo risultò un potente fattore predittivo indipendente di un aumentato
rischio di morte, mentre l'infarto miocardico periprocedurale non fu associato con un
aumentato rischio di morte.
Nel loro insieme gli studi contemporanei dimostrano che l'infarto miocardico spontaneo è un
potente fattore predittivo di mortalità. L'infarto miocardico periprocedurale è un evidenziatore
del carico aterosclerotico e della complessità procedurale, ma in gran parte dei casi, non
comporta importante significato prognostico indipendente nella malattia coronarica stabilizzata
o in sindromi coronariche acute senza elevazione del segmento ST. Gli estesi infarti miocardici
periprocedurali possono influenzare la prognosi, ma raramente si verificano in assenza di
complicazioni procedurali o in pazienti con livelli normali troponina cardiaca in condizioni di
base.
Implicazioni Pratiche
I livelli della troponina cardiaca devono essere abitualmente dosati prima che venga eseguito
l'intervento coronarico percutaneo (PCI). Nello schema a blocchi (17) della Figura 2 sono
descritti i consigli per la prevenzione e il trattamento dell'infarto miocardico periprocedurale.
Figura 2
(17)
7
8
(ACS = sindromi coronnariche acute, CK-MB = frazione MB della creatinchinasi, GP =
glicoproteine)
Un livello normale di troponina cardiaca pre-procedurale aiuterà nella stratificazione del rischio
individuando pazienti in cui PCI può essere eseguito con rischio molto basso e la dimissione
dall'ospedale può essere programmata in tempi brevi. Un'elevazione pre-PCI di troponina
cardiaca identifica pazienti a rischio elevato con lesioni complesse o trombotiche che possono
beneficiare di terapie con potenti farmaci antipiastrinici e con statine iniziate prima della
procedura per migliorare l'esito clinico. (1) Dopo PCI, la troponina cardiaca dovrebbe essere
dosata abitualmente in pazienti che hanno subito procedure complesse, che hanno avuto
risultati angiografici non ottimali, o che hanno complicazioni procedurali, ed anche in quelli che
presentano segni o sintomi d'ischemia miocardica, allo scopo di quantificare l'estensione della
lesione miocardica. D'altra parte, una strategia ragionevole consente di evitare la misura
abituale post-procedurale della troponina cardiaca nei pazienti con PCI bene riuscita e senza
complicazioni poiché in questi casi è improbabile che si possano ottenere informazioni rilevanti
addizionali che siano indipendenti dal rischio pre.procedurale e dagli esiti della procedura. Il
ruolo del monitoraggio post-procedurale di biomarkers per la stratificazione del rischio nella
prevenzione secondaria della malattia coronarica o come una misura di qualità deve ancora
essere stabilita.
La cura di pazienti che subiscono un'importante mionecrosi periprocedurale, con incremento
acuto pre-procedurale di troponina cardiaca, dovrebbe basarsi, in generale, sulle linee guida
per il trattamento delle sindromi coronariche acute. Pazienti le cui condizioni si aggravano in
modo inaspettato subito dopo PCI (quelli con dolore precordiale ricorrente e incessante, specie
se in combinazione con slivellamento del tratto ST o con evidenza ecocardiografica d'ischemia
o versamento pericardico) dovrebbero sottoporsi a ripetere l'angiografia coronarica. Lo scopo è
quello d'identificare complicazione procedurale che si presti a ulteriore intervento, quali
trombosi acute di stent, dissezione coronarica, o perforazione, per limitare la mionecrosi e
alleviare i sintomi. Ẻ raro in realtà che venga richiesto l'intervento cardiochirurgico.
Bibliografia
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
Herrmann J. Peri-procedural myocardial injury: 2005 update. Eur Heart J 2005;26:2493-2519
Porto I, Selvanayagam JB, Van Gaal WJ, et al. Plaque volume and occurrence and location of
periprocedural myocardial necrosis after percutaneous coronary intervention: insights from
delayed-enhancement magnetic resonance imaging, Thrombolysis in Myocardial Infarction
myocardial perfusion grade analysis, and intravascular ultrasound. Circulation 2006;114:662-669
Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart disease and stroke statistics -- 2010 update: a
report from the American Heart Association. Circulation 2010;121:e46-e215
Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart disease and stroke statistics -- 2010 update: a
report from the American Heart Association. Circulation 2010;121:e46-e215
Cutlip DE, Kuntz RE. Does creatinine kinase-MB elevation after percutaneous coronary
intervention predict outcomes in 2005? Cardiac enzyme elevation after successful percutaneous
coronary intervention is not an independent predictor of adverse outcomes. Circulation
2005;112:916-922
Prasad A, Rihal CS, Lennon RJ, Singh M, Jaffe AS, Holmes DR. Significance of periprocedural
myonecrosis on outcomes after percutaneous coronary intervention: an analysis of
preintervention and postintervention troponin T levels in 5487 patients. Circ Cardiovasc Interv
2008;1:10-19
Thygesen K, Alpert JS, White HD. Universal definition of myocardial infarction. Eur Heart J
2007;28:2525-2538
Mandadi VR, DeVoe MC, Ambrose JA, et al. Predictors of troponin elevation after percutaneous
coronary intervention. Am J Cardiol 2004;93:747-750
Cai Q, Skelding KA, Armstrong AT, Desai D, Wood GC, Blankenship JC. Predictors of
periprocedural creatine kinase-myocardial band elevation complicating elective percutaneous
coronary intervention. Am J Cardiol 2007;99:616-620
Prasad A, Gersh BJ, Bertrand ME, et al. Prognostic significance of periprocedural versus
spontaneously occurring myocardial infarction after percutaneous coronary intervention in
patients with acute coronary syndromes: an analysis from the ACUITY (Acute Catheterization and
Urgent Intervention Triage Strategy) trial. J Am Coll Cardiol 2009;54:477-486
9
11. Srinivasan M, Rihal C, Holmes DR, Prasad A. Adjunctive thrombectomy and distal protection in
primary percutaneous coronary intervention: impact on microvascular perfusion and outcomes.
Circulation 2009;119:1311-1319
12. Srinivasan M, Rihal C, Holmes DR, Prasad A. Adjunctive thrombectomy and distal protection in
primary percutaneous coronary intervention: impact on microvascular perfusion and outcomes.
Circulation 2009;119:1311-1319
13. Bahrmann P, Werner GS, Heusch G, et al. Detection of coronary microembolization by Doppler
ultrasound in patients with stable angina pectoris undergoing elective percutaneous coronary
interventions. Circulation 2007;115:600-608
14. Nienhuis MB, Ottervanger JP, Bilo HJ, Dikkeschei BD, Zijlstra F. Prognostic value of troponin after
elective percutaneous coronary intervention: a meta-analysis. Catheter Cardiovasc Interv
2008;71:318-324
15. Testa L, Van Gaal WJ, Biondi Zoccai GG, et al. Myocardial infarction after percutaneous coronary
intervention: a meta-analysis of troponin elevation applying the new universal definition. QJM
2009;102:369-378
16. Bhatt DL, Lincoff AM, Gibson CM, et al. Intravenous platelet blockade with cangrelor during PCI.
N Engl J Med 2009;361:2330-2341
17. Prasad A, and Herrmann J. Myocardial Infarction Due to Percutaneous Coronary Intervention. N
Engl J Med 2011; 364:453-464
Prof. Paolo Rossi, primario cardiologo, Novara.
[email protected]
(1) Facoltà
di Ingegneria dei Sistemi, Politecnico di Milano.
Cardiologico, AOU Maggiore della Carità, Novara.
(2) Dipartimento
Eziopatogenesi della Fibrillazione atriale: dalle teorie elettro-anatomiche
alle nuove teorie genetiche.
10
Introduzione
La fibrillazione atriale (FA) è considerata la più comune tra le aritmie cardiache incontrate nella
pratica clinica oltre che una delle cause primarie di mortalità, morbilità e ospedalizzazione; per
questo motivo lo studio della sua fisiopatologia ha assunto negli ultimi due decenni sempre
maggiore importanza. L’analisi di dati sperimentali sulla popolazione ha messo in luce
l’esistenza di una significativa componente ereditaria per questa aritmia: varianti sia in geni
che codificano i canali ionici, sia in geni correlati all’integrità strutturale dell’atrio, al processo
infiammatorio e alla trasmissione neuro-ormonale, sono state infatti identificate come
potenziali fattori di rischio per la FA.
Il ruolo sempre crescente riconosciuto ai geni codificanti i canali ionici sta recentemente
supportando la classificazione di FA come una canalopatia, ovvero una patologia causata da
disfunzioni a livello dei canali ionici: mutazioni a carico dei geni che codificano i canali ionici
potrebbero quindi influire su questo disturbo del ritmo cardiaco.
Obbiettivo di questa review è quello di fornire una rassegna dei principali risultati sperimentali
che negli ultimi anni hanno evidenziato l’esistenza di un legame tra fattori genetici e
fibrillazione atriale.
La fibrillazione atriale e le sue basi elettrofisiologiche
La FA è un’aritmia sopraventricolare caratterizzata da una contrazione e da un’attivazione
atriale caotica e disordinata.
Partendo come fenomeno parossistico, caratterizzato da una durata maggiore 30 secondi e da
una rapida interruzione spontanea, la FA può evolvere in aritmia persistente e permanente. La
FA è classificata come persistente se dura più di 7 giorni e richiede, per la sua interruzione,
una terapia farmacologia o una cardioversione elettrica. Infine, una FA completamente
refrattaria alla cardioversione è definita permanente. È dimostrato che la FA genera FA: questa
aritmia, una volta iniziata, altera l’elettrofisiologia dell’atrio in maniera da favorire il
mantenimento di se stessa. In altri termini, una FA che nasce come parossistica, se non
trattata, genererà un rimodellamento elettrico e strutturale che favorirà il passaggio a FA
persistente prima e permanente poi.
Dal punto di vista dell’eziologia si distinguono FA associate ad altre patologie cardiache, tra le
quali disturbi ipertensivi, cardiomiopatie, patologie valvolari o patologie cardiovascolari
aterosclerotiche, e “lone FA” ovvero FA che si sviluppano in assenza di fattori di rischio noti.
Una classificazione molto recente di FA è quella su base genetica che distingue la FA familiare
o “monogenic disorder” e la FA non familiare o “multifactorial FA”. La prima è caratterizzata
dalla presenza di un carattere ereditario mendeliano e si presenta in più membri della stessa
famiglia; solitamente si manifesta sotto forma di lone FA. La seconda si presenta tipicamente
in associazione a disturbi cardiaci secondari, anche se fattori genetici, non genetici e ambientali
contribuiscono anch’essi allo sviluppo della patologia. Quest’ultima è quella più comunemente
incontrata nella pratica clinica.
I principali meccanismi coinvolti nello sviluppo e nel mantenimento della FA, rappresentati
nella Figura 1, sono : ● la presenza di un automatismo anormale, ● il presentarsi di EAD (Early
After Depolarization) o ● DAD (Delayed After Depolarization) e ● la presenza di microcircuiti di
rientro. [1]
Figura 1. Potenziali di azione miocardici che descrivono i meccanismi coinvolti nella
patogenesi della fibrillazione atriale
11
Figura 1 – Principali meccanismi coinvolti nella FA. a, automatismo normale (1) e anormale (2).
b, depolarizzazioni precoci (3) rispetto al normale pdA (1) causate dall’aumento di una
corrente depolarizzante (2). c, circuito di rientro. (1)
È dimostrato che le alterazioni delle correnti ioniche di transmembrana sono la chiave
determinante per spiegare questi meccanismi responsabili dell’aritmia.
Il primo meccanismo che conduce ad una FA è la formazione di impulsi anomali che derivano
da foci ectopici, ovvero diversi dal nodo Seno-Atriale (SA), che con la loro attività generano
l’aritmia. Questi foci ectopici possono essere concentrati in un’unica sorgente focale a
conduzione fibrillatoria o essere foci multipli che scaricano rapidamente e in maniera non
sincrona e caotica. Questo è solitamente il meccanismo di trigger della FA, che contribuisce a
creare il substrato per l’insorgere di depolarizzazioni tardive e di circuiti di rientro.
Il secondo meccanismo è legato alle postdepolarizzazioni precoci (EAD = Early After
Depolarizations) e alle postdepolarizzazioni tardive (DAD = Delayed After Depolarization) [2]. Le
postdepolarizzazioni sono oscillazioni del potenziale di membrana che dipendono dal potenziale
d’azione precedente, ed è questa loro caratteristica che le differenzia dai fenomeni di
automatismo. Quando queste postdepolarizzazioni sono abbastanza ampie da raggiungere la
soglia, possono provocare l’insorgere di potenziali d’azione ectopici prematuri, che inducono
aritmie definite “triggerate”. Le DAD sono causate da anormalità nella regolazione del Ca2+. In
questo meccanismo sono coinvolte le correnti indotte dagli exchangers di Na/Ca che scambiano
tre ioni Na+ con uno ione Ca2+ (una carica positiva si muove nella direzione di trasporto del
sodio ad ogni ciclo), e producono così una corrente depolarizzante che potrebbe in quantità
elevate causare DADs.
Le EAD sono legate a un eccessivo prolungamento del potenziale d’azione (PdA) e sono quindi
causate da anomalie nei canali ionici responsabili della ripolarizzazione, quali la riduzione delle
correnti del K+ o l’aumento di quelle del Na+.
Il terzo meccanismo è determinato dalla presenza di microcircuiti di rientro.
Le condizioni necessarie per lo sviluppo dei circuiti di rientro possono essere anatomiche o
elettrofisiologiche. Secondo la teoria delle vie anatomicamente definite, affinchè si crei il
fenomeno del rientro devono esistere due vie distinte di conduzione, collegate tra di loro: se
12
una delle due vie è soggetta a un blocco di conduzione (che può essere causato da una
inomogeneità spaziale del tempo di refrattarietà o da un rimodellamento strutturale dell’atrio),
l’impulso viene condotto attraverso l’altra via, ma esiste il rischio che esso percorra la via
precedentemente bloccata in direzione retrograda, dando così il via a una conduzione circolare.
Il rientro può anche essere funzionale, in altre parole avvenire in assenza di substrati
anatomici, solo per la presenza di fibre contigue con differenti proprietà elettrofisiologiche. La
dispersione dei periodi di eccitabilità e/o refrattarietà, così come le distribuzioni anisotropiche
delle resistenze elettriche fra le cellule, consente l’inizio e il mantenimento del rientro
funzionale.
La teoria oggi più accreditata per spiegare la genesi della FA è quella dei multipli microcircuiti
di rientro circolari: particolare influenza per lo sviluppo di questa teoria ha avuto il lavoro di
Moe et al. [3], che ha enfatizzato il ruolo delle multiple wavelets (ondine, microcircuiti) rientranti
nel mantenimento della FA. La teoria di Moe, secondo la quale la stabilità della FA è
determinata dal numero di microcircuiti presenti nell’atrio, è stata successivamente dimostrata
sperimentalmente da Allessie et al.[4], sottolineando il concetto di lunghezza d’onda del rientro.
La lunghezza d’onda è la distanza percorsa dall’impulso elettrico in un periodo di refrattarietà,
ed è descritta come il prodotto tra periodo di refrattarietà e velocità di conduzione. Se la
lunghezza di un ipotetico circuito di rientro è più piccola della lunghezza d’onda, l’impulso
attraverserà il circuito e tornerà al punto di partenza in un tempo minore del periodo di
refrattarietà, smorzando così il fenomeno. Per questo motivo la lunghezza del circuito deve
essere almeno pari alla lunghezza d’onda perché il fenomeno del rientro possa sostenersi.
Quindi una lunghezza d’onda minore, diminuisce la dimensione del singolo circuito e aumenta
così il numero dei possibili microcircuiti: questo rende la FA più stabile.
Una volta generata attraverso i meccanismi precedentemente descritti, la FA provoca una serie
di cambiamenti secondari nelle proprietà elettriche e strutturali degli atri che sembrano essere
un fattore chiave per il mantenimento della FA stessa[5]. In particolare, una volta iniziata, la FA
si autoalimenta attraverso il fenomeno del rimodellamento elettrico (Figura 2).
Figura 2 – Rimodellamento elettrico atriale in corso di FA. [1]
Figura 2. Il rapido aumento del ritmo atriale causa un progressivo accumulo di Ca2+, che
minaccia la vitalità della cellula e induce una comune risposta difensiva nella cellula stessa, che
reagisce per diminuire l’accumulo di Ca2+ al suo interno.
Questo meccanismo difensivo porta, a breve termine, a una inattivazione della corrente del
Ca2+ ICa(L) che dipende dal potenziale di membrana e dalla [Ca2+]i. A lungo termine, lo stesso
meccanismo provoca una diminuzione del livello di espressione del mRNA che codifica la
subunità α del canale L del Ca2+, che conseguentemente porta ad una riduzione permanente
della corrente ICa(L). Poiché la corrente ICa(L) ha un ruolo fondamentale nel mantenimento del
plateau, una sua diminuzione porta ad una diminuzione del PdA e del periodo di refrattarietà e
13
questo può promuovere la formazione e il mantenimento di FA dovute a multipli circuiti di
rientro.
La fibrillazione atriale come “disturbo genetico”.
La FA è sempre stata trattata tradizionalmente come un disturbo sporadico e non genetico;
tuttavia, studi recenti hanno messo in evidenza la presenza di una base genetica per questa
aritmia.
Studi sulla popolazione, infatti, hanno dimostrato che esiste una componente ereditaria nella
patogenesi della FA. Fondamentale a questo proposito è stato il “Framingham Heart Study”,
uno studio prospettico condotto nel 2004 [6] su 2243 soggetti, che ha dimostrato come la
presenza di FA nei genitori aumenti in maniera significativa la probabilità di sviluppare l’aritmia
nei discendenti. Questa evidenza ereditaria può essere spiegata se si ipotizza l’esistenza di un
legame tra la patogenesi della FA e la presenza di alterazioni genetiche a essa correlate.
È stato dimostrato che in alcuni casi una mutazione genetica può essere sufficiente da sola a
causare la patologia. Tuttavia tali difetti monogenetici spiegano una porzione relativamente
piccola dei casi di FA e, in particolare, dei casi di FA familiare o asintomatica. Il primo studio [7]
svolto in questa direzione ha permesso di associare ad una FA un locus genetico appartenente
al cromosoma 10 (10q22-24), attraverso l’analisi di tre famiglie spagnole in cui la FA
segregava come un tratto autosomico dominante. Il gene responsabile non è ancora noto, ma
esistono possibili geni candidati contenuti nella regione individuata. In altri casi, la variabilità
genetica interindividuale è stata analizzata attraverso l’analisi dei cosiddetti polimorfismi a
singolo nucleotide (SNPs): alcune varianti sono state associate alla probabilità di sviluppare
FA; anche se, in generale, esse non sono sufficienti, da sole, a spiegare la patologia, possono
modificare la suscettibilità alla FA o ai fattori che ne predispongono lo sviluppo. Alla luce di
queste evidenze sperimentali, la direzione che si sta seguendo mira all’identificazione dei geni
che potrebbero giocare un ruolo nella patogenesi dell’aritmia. Questo potrebbe dare una nuova
visione dello sviluppo della malattia, oltre che aiutare a migliorare le opzioni terapeutiche, che
per ora si limitano a trattamenti antiaritmici non mirati al singolo paziente o a tecniche di
ablazione delle vene polmonari. I geni che sono stati ad oggi associati alla patogenesi dell’FA
codificano sia i canali ionici responsabili del PdA, sia altre proteine legate alla struttura
dell’atrio o ai meccanismi cellulari dei monoliti (vedi Tab.1). Tra questi ultimi rivestono una
particolare importanza il gene GJA5 e il gene SLN. Il primo codifica la connessina40, proteina
fondamentale responsabile dell’attivazione elettrica coordinata dell’atrio; il secondo inibisce
l’attività del reticolo sacroplasmatico, fondamentale per la genesi di un PdA fisiologico.
Tabella 1. La fibrillazione atriale come “Canalopatia".
Geni che sono stati fino a oggi associati alla patogenesi della FA:
Gene
Corrente
Tipo di variante
Meccanismo
presunto
(a) Geni codificanti i canali ionici di membrana associati alla FA
KQCN1
IKs
Mutazione S140G
Gain of function
(diminuisce APD)
Mutazione R14C
Gain of function
con tensione atriale
KCNE1
IKs
SNP S38G
Aumenta
APD:
causa
EADs
o
promuove rientri
KCNE2
IKs (?)
Mutazione R27C
Gain of function
(diminuisce APD)
KCNE4
IKs (?)
SNP E145D
Non nota
14
KCNH2
IKr
Mutazione N588K
Gain of function
(diminuisce APD)
KCNJ2
IKr
Mutazione V93I
Gain of function
(diminuisce APD)
KCNA5
IKur
Mutazione E375X
Aumenta
APD:
causa
EADs
o
promuove rientri
KCNN3
IKCa2.3
SNP rs13376333
Non nota
SCN5A
INa
SNP H558R
Loss of function
(diminuisce
la
conduzione)
Mutazione D1257N
Non nota
Mutazioni
Loss of function
(diminuisce APD)
CACNA1C CACNB2
ICaL
(b) Geni non codificanti i canali ionici di membrana associati alla FA
ACE
SNP
(I/D
nell’introne 16)
Aumenta il livello
di ACE causando
rimodellamento
strutturale
MMP2
SNP (genotipo DD)
Aumenta il livello
di ACE causando
rimodellamento
strutturale
NOS3
SNP -130C
T
Rimodellamento
strutturale atriale
SNP G894T
Cambia l’attività di
altri geni come ACE
IL-10
SNP -592
C
Segnali
infiammatori
GJA5
Mutazioni
somatiche
Diminuisce
Cx40
causando
alterazioni
nell’accoppiamento
elettrico
aritmogenico
SLN
SNP -65G
C
Inibisce l’ingresso
di Ca nel reticolo
sarcoplasmatico
ANKB
Mutazione E1425G
Causa DADs
ZFHX3
SNP rs2106261
Non nota
NPPA
Mutazione
frameshift
(eliminazione
Diminuisce APD
di
15
due basi)
Inoltre, un recente studio di associazione, Benjamin et al. [8] hanno messo in evidenza
un’associazione tra FA e una variante nella sequenza genica del fattore di trascrizione ZFHX3:
il meccanismo che collega questo gene all’aritmia non è ancora noto. Un altro recente studio [9]
ha poi identificato come fattore di rischio una mutazione “frameshift” nel gene NPPA,
codificante il peptide natriuretico atriale (ANP): l’elevata concentrazione di ANP chimerico,
osservata nei soggetti portatori della mutazione, causa un accorciamento del potenziale
d’azione atriale, creando un possibile substrato per l’aritmia.
Per “Canalopatia” (patologia dei canali) si intende una patologia associata ad alterate funzioni
dei canali ionici: le mutazioni a carico dei geni che codificano i canali ionici cardiaci possono
predisporre alla FA alterando l’attivazione dei canali stessi e di conseguenza le proprietà di
generazione e propagazione dello stimolo attraverso l’atrio. Le correnti ioniche, infatti, giocano
un ruolo chiave nella generazione del potenziale d’azione, contribuendo alla depolarizzazione o
alla ripolarizzazione della membrana cellulare, come mostrato in figura 3 [2].
Figura 3
Figura 3– Rappresentazione schematica del pdA umano e delle correnti che contribuiscono ad
ogni sua fase (correnti depolarizzanti = freccia verso il basso, correnti ripolarizzanti = freccia
verso l’altro). (2)
La cellula cardiaca è caratterizzata a riposo da un potenziale intracellulare negativo. Quando
viene attivata, la cellula subisce una depolarizzazione rapida a causa di un rapido aumento
della conduttanza della membrana al Na+, che genera un’ampia corrente del Na+. La cellula
attraversa poi una serie di fasi tra cui una fase di plateau e una successiva ripolarizzazione
legate alle correnti del K+, che la riporta al potenziale di riposo. La ripolarizzazione è ritardata
nella fase di plateau generata da un flusso depolarizzante di ioni Ca2+ attraverso il canale L del
Ca2+. Un modello dettagliato che spiega approfonditamente le varie fasi del potenziale d’azione
atriale in particolare è stato sviluppato approfonditamente da Courtemanche et al. (10).
I canali del K+
La maggior parte delle mutazioni scoperte sono a carico di geni che codificano i canali del K+ in
quanto
essi
risultano
fondamentali
per
tutte
le
fasi
del
PdA.
C:\content\vol299\issue5604\images\large\se0131162002.jpegIl primo gene ad essere stato
associato alla FA familiare è stato KCNQ1, che codifica la subunità α del canale cardiaco della
corrente IKs (KCNQ1/KCNE1), oltre che di altri canali del K+ (KCNQ1/KCNE2 e KCNQ1/KCNE3).
Evidenze sperimentali hanno infatti dimostrato come il canale KCNQ1 del K+ possa essere
modulato funzionalmente dal gruppo di proteine della famiglia KCNE. Ad essa appartengono 4
16
proteine transmembrana, codificate da 4 geni (KCNE1- KCNE4), che si associano alla subunità
α, per formare il complesso dei canali ionici del K+.
Lo studio di linkage di Chen (11) su una famiglia cinese di 4 generazioni con FA autosomica
dominante ereditaria aveva identificato la regione critica nel locus 11p15 contenente il gene
KCNQ1: le analisi della sequenza di questo gene rivelarono una mutazione missense (che
comporta, cioè, la sostituzione di un aminoacido nella sequenza proteica) del tipo S140G
(sostituzione di S con G in posizione 140 ) in tutti i membri della famiglia affetti (Figura 4).
Figura 4
Figura 4 – Associazione tra la mutazione S140G e la AF. a, ECG di un soggetto affetto della
famiglia b, sequenza amminoacidi delle basi nel gene KCNQ1 che evidenzia la mutazione
missense presente nei membri affetti e assente in quelli sani. (11)
Questa mutazione era assente nei membri sani della famiglia (tranne che per un'eccezione) e
in 188 individui sani di controllo: questo faceva supporre che la mutazione S140G non fosse un
polimorfismo benigno. Per dimostrarlo la mutazione in esame è stata espressa in cellule COS-7
con lo scopo di verificare le funzioni di canale attraverso metodi di patch clamp su tutta la
cellula, confrontandole con quelle del fenotipo sano. Sia la mutazione che il genotipo standard
sono stati co-espressi con KCNE1, KCNE2 e KCNE3.
L’analisi funzionale ha messo in luce che l’espressione di S140G da sola non produce
sostanzialmente aumento di corrente, ma quando questa è co-espressa con KCNE1 la densità
di corrente cresce notevolmente per tutti i valori del potenziale di membrana (a +20mV è
aumentata di un fattore 3 rispetto al fenotipo sano) (Figura 5).
Figura 5
17
Figura 5 - La mutazione S140G altera la corrente attraverso il canale KCNQ1/KCNE1. Effetti
sulla densità di corrente se a, S140G è espressa da sola b, KCNQ1 a fenotipo standard è coespresso con KCNE1 c, S140G-KCNQ1 è co-espresso con KCNE1. d, e, densità di corrente rispetto
al potenziale di test nelle diverse condizioni. (11)La co-espressione di KCNQ1 e KCNE2 produce
poi un aumento di 6 volte della densità di corrente nel genotipo S140G rispetto a quello
sano(effetto gain-of-function). mentre non vi sono differenze nella densità di corrente con
KCNE3. L’aumento della IKs porta ad una diminuzione del periodo di refrattarietà, ed a una fase
di ripolarizzazione più breve e quindi, complessivamente a una minore durata del PdA (ADP):
entrambe queste alterazioni creano un buon substrato per la FA.
È stato tuttavia osservato che la mutazione S140G individuata non si presentava in altre 6
famiglie affette da FA e in 19 pazienti con lone FA considerati successivamente. Questo può
essere spiegato dal fatto che la FA è, dal punto di vista genetico, una patologia “eterogenea”.
Per questo motivo la possibilità di usare IKs –bloccanti come terapia per la FA è subordinata alla
necessità di ulteriori studi sul ruolo dei canali del K+ nella patogenesi di questo disturbo di
conduzione.
La corrente lenta del K+ (IKs) svolge quindi un ruolo fondamentale nella patogenesi della FA.
Questo ha spinto i ricercatori ad indagare sul ruolo delle proteine KCNE, ad essa associate.
KCNE1 (o minK): Proteina ausiliaria che si complessa con canali del potassio voltaggiodipendenti come KCNQ1/KVLQT1 per la corrente IKs e KCNH2/HERG per la corrente IKr,
modulandone l’attività.
Attraverso uno studio mirato (12), è stata individuata un’associazione tra la FA e una variante
dello SNP (A/G) alla posizione 112 del gene KCNE1, risultante in una sostituzione tra glicina e
serina alla posizione 38 del peptide da esso codificato (minK). Nello studio, sono stati analizzati
i genomi di 108 pazienti affetti da FA e 108 soggetti sani. I risultati hanno mostrato
un’associazione tra l’allele 38G e la FA: il gruppo di pazienti affetti da FA risultava
caratterizzato da una maggior frequenza dell’allele 38G rispetto al gruppo di controllo (76,4%
vs 63,0%).
Il principale limite di questo primo studio, in altre parole la mancanza di una validazione
sperimentale sulla funzione di questo polimorfismo nella patogenesi della FA, è stato in parte
superato in uno studio successivo (13) il cui scopo era di dimostrare che l’allele 38G altera IKs
e/o IKr se co-espresso rispettivamente con le subunità α KCNQ1 e HERG. Per fare ciò è stata
condotta un’analisi differenziale su cellule ovariche di criceto (CHO) che esprimevano la
proteina minK con e senza la mutazione 38G; le due colture sono state esaminate con la
concomitante espressione di KCNQ1 e separatamente di HERG. Infine, i risultati ottenuti da
questi esperimenti sono stati inseriti in un modello matematico basato su quello atriale di
18
Courtemanche- Ramirez- Nattel, per studiare gli effetti delle variazioni di densità di IKs sulla
durata del PdA.
Nella Figura 6 sono rappresentate le correnti dalle cellule CHO che esprimono KCNQ1 con
minK38G e minK38S (genotipo non mutato). Le correnti sembrano simili in forma, ma sia la
densità che il picco di corrente sono minori (circa la metà) per le cellule con l’allele 38G.
Figura 6
Figura 6 - Correnti KCNQ1 con a, minK38G e b, minK38S. c, densità di corrente nei due casi e d,
picco di corrente. (13)
Nella Figura 7 sono rappresentate le correnti dalle cellule CHO che esprimono HERG con 38G e
38S: non ci sono differenze evidenti e si può concludere che lo SNP in esame non altera la IKr.
Figura 7
Figura 7 - Correnti HERG con a, minK38G e b, minK38S. c, picco di corrente e d, τ di
disattivazione in entrambi i casi. Da Ehrlich et al.,2004, (13)
I dati sperimentali sono stati poi inseriti nel modello matematico e la simulazione ha
evidenziato come lo SNP 38G tenda ad allungare ADP causando EADs sotto particolari
condizioni (stimolazione a 0,2 Hz ).
19
Si può concludere che il polimorfismo 38G ha effetti significativi sulla densità di IKs se coespresso con KCNQ1, mentre non ha effetti sulle proprietà di IKs. L’effetto che questa variante
ha sulla IKs è di tipo loss-of-function.
KCNE2: il gene KCNE2 codifica la subunità β del canale KCNQ1/KCNE2 responsabile della
corrente di background del K+. È stato svolto uno studio (14) su 28 famiglie cinesi non correlate,
nel quale sono stati scelti come geni candidati gli 8 canali fondamentali del K+. In due famiglie
è stata identificata una nuova mutazione missense R27C del gene KCNE2. La mutazione è
stata rilevata in 2 dei 5 membri della prima famiglia e in 2 dei 4 della seconda, mentre è
risultata assente in 462 cinesi sani e in 744 individui sani appartenenti a popolazioni europee.
Dopo essere stata identificata, si è cercato di determinare il ruolo che questa mutazione svolge
nella patogenesi della FA andando a indagare gli effetti che ha sulle correnti del K+ (Figura 8).
Figura 8
Figura 8 - La mutazione R27C altera la corrente attraverso il canale KCNQ1/KCNE2. Effetti sulla
densità di corrente se a, KCNQ1 è espressa da sola b, KCNQ1 è co-espresso con R27C-KCNE2 c,
KCNQ1 è co-espresso con KCNE2 a fenotipo standard. d, e, densità di corrente rispetto al
potenziale di test (
R27C,
WT). (14)
Si è così dimostrato che la densità della corrente associata al canale KCNQ1/KCNE2 aumenta
significativamente quando la mutazione R27C è co-espressa con KCNQ1 in cellule COS-7.
L’aumento della corrente ripolarizzante nella fase di iperpolarizzazione può stabilizzare il
potenziale di riposo e accorciare ADP, mentre l’amplificazione della corrente depolarizzante
durante la depolarizzazione può abbreviare la fase di ripolarizzazione del PdA: entrambi questi
effetti creano un substrato ideale per l’inizio di una FA.
La mutazione R27C del gene KCNE2 ha, quindi, un effetto gain-of-function sul canale
KCNQ1/KCNE2. Questo la rende simile alla mutazione S140G del gene KCNQ1, anche se
esistono delle differenze nel fenotipo, in quanto gli individui affetti da FA causata dalla
mutazione al gene KCNE2 presentano un fenotipo meno grave (FA parossistiche e non
permanenti, sviluppate ad età più avanzate).
KCNE4: recentemente [15] è stato identificato uno SNP nel gene KCNE4 (G/T in posizione 1057)
avente un allele che causa una sostituzione di tipo E145D. Questo sembra essere associato alla
lone FA (l’allele D aumenta la probabilità di FA). Lo studio di associazione è stato svolto su una
casistica di 142 pazienti con FA e 238 soggetti sani di controllo. La percentuale di allele D è
risultata di 34% nel gruppo con FA contro il 27% nel gruppo sano.
Per verificare l’ipotesi che questo SNP esercita un effetto gain-of-function sul canale
sono state utilizzate cellule ovariche di criceto (CHO) sia del tipo KCNE4 145D sia
145E, entrambe in presenza di KCNQ1. Su queste cellule sono stati svolti esperimenti
clamp volti a determinare l’effetto che la proteina KCNE4 ha su KCNQ1, in base
espresso.
KCNQ1,
del tipo
di patch
all’allele
Si è osservato che la co-espressione di KCNQ1 con KCNE4 non mutato inibisce la corrente
KCNQ1 e ne elimina la parte terminale: a 60 mV la densità di corrente risulta di
20
(24.0±2.9pA/pF) nelle cellule con KCNQ1, contro il (7.3±1.1pA/pF) in quelle con KCNQ1 e
KCNE4 145E (figura 9).
Figura 9
Figura 9 Densità di corrente KCNQ1, KCNQ1+KCNE4(145E) e KCNQ1+KCNE4(145D). (15)
Questo dimostra che la subunità KCNE4 normalmente ha un’azione inibitoria per la corrente
KCNQ1. Al contrario, la co-espressione di KCNQ1 con KCNE4 145D aumenta la densità di
corrente a (42.9±3.7pA/pF) (Figura 10).
Figura 10
Figura 10 - Frequenza dei genotipi HH, HR e RR nella popolazione malata e sana. (22)
In conclusione, KCNE4 diminuisce drasticamente la corrente associata al gene KCNQ1 nel
range di potenziali fisiologici. Al contrario la versione mutata di KCNE4 (145D) aumenta questa
corrente esercitando un effetto gain-of-function e questo potrebbe risultare il collegamento tra
questo SNP e la lone FA.
Fino ad ora sono stati considerati i geni responsabili della corrente IKs, tuttavia esistono altre
correnti del K+, che giocano un ruolo fondamentale nel PdA e per questo i geni che codificano
le relative proteine di canale si sono rivelati ottimi candidati per la ricerca delle basi genetiche
della FA.
In particolare, il gene KCNH2, che codifica il canale ionico di IKr, è stato per la prima volta
collegato alla FA in uno studio [16] che dimostrava un’associazione tra una mutazione di questo
gene e una sindrome del QT corto (SQTS) correlata ad FA parossistiche. La mutazione,
identificata in tre famiglie, consiste in una mutazione missense che risulta in una sostituzione
21
dell’aminoacido in posizione 588 della proteina (da N ad K). È stato dimostrato che questa
mutazione ha un effetto gain-of-function sulla IKr e questo provoca un accorciamento del PdA,
creando un ottimo substrato per lo sviluppo di aritmie.
Lo stesso gene è stato oggetto di un altro studio [17] volto a dimostrare l’esistenza di un legame
diretto tra KCNH2 e FA. E’ stato svolto uno studio di associazione a due stadi nel quale sono
stati considerati 1207 pazienti affetti da FA e 2475 soggetti di controllo. Durante la prima fase
di screening sono stati isolati 40 SNPs; di questi 5 sono rimasti significativi all’FA anche nella
seconda fase di validazione. Tra questi si è preso in considerazione lo SNP K897T, dimostrando
che l’allele comune K897 predispone alla FA, mentre quello raro T897 protegge da essa.
Probabilmente l’allele K897 favorisce una dispersione della ripolarizzazione atriale e una
maggior durata del PdA e questo crea un substrato per la genesi dell’aritmia.
Altre analisi del genoma umano hanno rivelato un possibile fattore di rischio nel gene KCNA5
che codifica Kv1.5, il canale che genera la corrente IKur, corrente fondamentale per la
ripolarizzazione atriale. Lo studio di associazione [18] è stato condotto su 154 pazienti europei
non correlati con lone FA e 540 soggetti di controllo proprio sul gene candidato KCNA5. La
variante genetica rappresenta una mutazione nonsense nel che provoca l’inserimento di una
tripletta di stop prematura al residuo 375 (E375X). A causa di questa tripletta, la mutazione
tronca la codifica del canale Kv1.5 alterandone struttura e funzione; non viene, infatti,
misurata alcuna corrente ultrarapida del K+; quindi, la mutazione del gene KCNA5 genera un
effetto loss-of-function sul canale Kv1.5. Questo ha come conseguenza un aumento della ADP
nei miociti: se misurato al 60% della ripolarizzazione, l’ADP aumenta significativamente da
44±9 a 79±15 ms. Si è poi dimostrato che questa mancanza nel canale Kv1.5 aumenta il
rischio di sviluppare EAD (incidenza dell’80%) e attività triggerata irregolare (incidenza del
50%) nelle cellule atriali.
In conclusione, la scoperta della mutazione loss-of-function della proteina Kv1.5 ha per prima
identificato l’aumento dell’ADP come possibile fattore determinante lo sviluppo di FA.
Recentemente [19] è stata identificata un’associazione tra la FA e il gene KCNN3, codificante la
corrente del potassio IKCa2.3, coinvolta nella ripolarizzazione atriale. Questo gene è espresso nel
tessuto nervoso e cardiaco: mentre nei neuroni il coinvolgimento della IKCa2.3 nella
ripolarizzazione è chiaro, il suo ruolo nel tessuto cardiaco è ancora da definire con certerzza. È
stato dimostrato come il blocco farmacologico dei canali KCNN comporta l’accorciamento del
PdA, riduce il periodo di refrattarietà dei cardiomiociti atriali e promuove così i fenomeni di
rientro. Per questo si è ipotizzato che variazioni genetiche in entrambe le subunità del canale
KCNN (KCNN2 e KCNN3) potrebbero modulare la corrente IKCa2.3. Studi di associazione hanno
messo tuttavia in evidenza solo uno SNP del gene KCNN3 significativamente associato alla FA.
Per questo il meccanismo con cui questa variazione da sola può aumentare il rischio di FA deve
ancora essere chiarito e studi futuri potrebbero mirare a definire l’utilità di KCNN3 come
potenziale target diretto o indiretto per il tratta mento farmacologico dell’aritmia.
I canali del Na
Un altro canale molto studiato in relazione alla FA è quello del Na+. Nell’uomo, il canale del Na+
(SCN5A) è responsabile del rapido picco di depolarizzazione del PdA cardiaco ed è molto usato
come target molecolare per i farmaci antiaritmici. Mutazioni di questo gene sono state
precedentemente associate ad altre patologie cardiache come la sindrome del QT lungo e la
sindrome di Brugada [20]In particolare, è stato scoperto che il 39% dei pazienti affetti da
sindrome di Brugada presentava FA e per questo il gene SCN5A è stato scelto come gene
candidato per la lone FA.
In totale, sono stati identificati 39 SNPs contenuti in questo gene, ma tra questi la variante
genetica più comune è la sostituzione di A con G al nucleotide 1673, risultante in un
cambiamento di aminoacidi del tipo H558R (21). È stato dimostrato che il genotipo RR
omozigote per questo polimorfismo, presente in un terzo della popolazione, altera il canale del
Na+ riducendo la corrente depolarizzante.
Per verificare questa associazione è stato svolto uno studio indipendente (22) su 157 pazienti di
origine caucasica non correlati con lone FA e 314 pazienti di controllo senza evidenza clinica di
FA. È stata osservata una significativa differenza nella frequenza dei tre genotipi di H558R
22
(HH, HR e RR) tra pazienti e soggetti di controllo : il 50% dei pazienti presentava genotipo
caratterizzato da almeno un R rispetto al 37% dei soggetti di controllo (Figura 10).
È stata così dimostrata un’associazione tra lo SNP H338R del gene SCN5A e la lone FA, che ha
portato a concludere che i farmaci Na+ bloccanti, comunemente usati per trattare la FA,
potrebbero anche peggiorare le condizioni di pazienti portatori dell’allele R producendo
un’ulteriore riduzione della corrente INa. Infatti, fisiologicamente la presenza dell’allele R porta
ad una diminuzione della densità di INa e questo può creare un substrato elettrofisiologico per
l’aritmia. La diminuzione di INa provoca una diminuzione della velocità di conduzione nell’atrio e
questo promuove i microcircuiti di rientro diminuendo la lunghezza d’onda (alterazioni di canali
del K portano allo stesso risultato riducendo il periodo di refrattarietà).
I canali del Ca2+
L’ultimo canale da prendere in considerazione e quello del Ca2+ di tipo L. Questo canale è una
proteina complessa formata almeno da 3 subunità: α1 (codificata dal gene CACNA1C), β
(codificata da CACNB2b) responsabile della regolazione del Ca2+ nel reticolo sacroplasmatico e
α2δ (codificata da CACNA2D1).
In realtà questi geni non sono stati associati direttamente alla FA, anche se un collegamento
dovrebbe esistere visto che la regolazione del Ca2+ ha un ruolo chiave; tuttavia esiste uno
studio (23) che li associa ad una patologia caratterizzata da sovraslivellamento del segmento
QT, SQTS e morte cardiaca improvvisa. Questo studio ha identificato 3 diverse mutazioni
missense in questi geni in 3 famiglie affette da sindrome di Brugada.
La prima famiglia esibiva una mutazione C1442T, che provoca una sostituzione di serina con
leucina alla posizione 481 (S481L) del gene CACNB2b, non presente in 400 soggetti di
controllo.
La seconda famiglia esibiva una mutazione A1468G, che provoca una sostituzione di glicina con
arginina (G490R) alla posizione 490 del gene CACNA1C, non presente in 640 soggetti di
controllo.
La terza famiglia esibiva una mutazione C116T, che provoca una sostituzione di alanina con
valina alla posizione 39 (A39V) del gene CACNA1C, non presente in 404 soggetti di controllo.
Per determinare il contributo delle mutazioni al fenotipo patologico, sono state espresse in
cellule CHO e confrontate con il loro genotipo standard. In tutti e 3 i casi la presenza della
mutazione diminuiva la corrente ICaL e per questo si è concluso che queste mutazioni avessero
un effetto loss-of-function su questo canale.
Conclusione
Il ruolo dei fattori genetici nella patogenesi della FA è ormai riconosciuto. Si è dimostrato che i
difetti ereditari nei geni che codificano principalmente i canali ionici ma anche altre proteine
che esercitano un ruolo chiave nel tessuto cardiaco inducono alterazioni delle proprietà di
conduzione nell’atrio e predispongono alla FA.
Tuttavia, nell’ultimo periodo alla teoria di FA come channelopathy si sta affiancando la teoria
nota come del “second hit” (24), secondo la quale ci sarebbe un legame diretto tra fattori
genetici e condizioni acquisite (per esempio lo stretch atriale) nella patogenesi della FA. In
particolare, questa teoria afferma che la predisposizione genetica individuale (il primo “hit”)
richiede un secondo fattore chiave, come la dilatazione atriale (il secondo “hit”), perché la FA si
manifesti. Questa teoria, che fornisce una nuova prospettiva per lo studio delle basi ereditarie
della FA, ha ancora molti limiti sperimentali e deve essere ulteriormente approfondita.
In conclusione, l’identificazione di mutazioni collegate alla patologia in famiglie con FA fornisce
un importante punto di partenza per capire la chiave molecolare e cellulare che si cela dietro
alla più comune forma di aritmia cardiaca. Tuttavia, una miglior conoscenza della genomica
funzionale delle cellule cardiache e dei fattori acquisiti correlati all’aritmia, oltre che
dell’interazione tra i due, potrebbe portare a nuovi approcci per la diagnosi, la prevenzione e il
trattamento della FA. Un traguardo futuro sarebbe quello di creare trattamenti mirati al singolo
paziente, ma questo implica la conoscenza approfondita delle cause che scatenano l’aritmia e
che contribuiscono al suo mantenimento.
23
BIBLIOGRAFIA
[1] Stanley Nattel, New ideas about atrial fibrillation 50 years on. Nature, 2002; 415:219-226.
[2] A. Andalib et al., Atrial fibrillation: evidence for genetically determined disease. Curr Opin Cardiol
2008; 23:176-183.
[3] G.K Moe, J.A. Abildskov, Atrial fibrillation is a self-sustaining arrhytmia independent of focal
discharge. Am Heart, 1959;58: 59-70
[4] P.L. Rensma, M.A. Allessie et al., Lenght of excitation wave and susceptibility to reentrant atrial
arrhytmias in normal conscious dogs. Circ. Res, 1988; 62:395-410.
[5] M.C. Wijffels et al., Atrial fibrillation begets atrial fibrillation. A study in awake chronically
instrumental goats. Circulation, 1995; 92:1954-1995.
[6] C.S. Fox et al., Parental Atrial Fibrillation as a Risk Factor for Atrial Fibrillation in Offspring. JAMA
2004; 291:2851-2855.
[7] R. Brugada et al., Identification of a genetic locus for familiar atrial fibrillation. The New England
Journal of Medicine 1997; 336:905-911.
[8] E.J. Benjamin et al., Variants in ZFHX3 are associated with atrial fibrillation in individuals of European
ancestry. Nat Genet 2009; 41:879-881.
[9] D.M. Hodgson-Zingman et al., Atrial Natriuretic Peptide Frameshift Mutation in Familial Atrial
Fibrillation, N Engl J Med. 2008; 359(2): 158–165.
[10] M. Courtemanche et al., Ionic mechanisms underlying human atrial action potential properties:
insights from a mathematical model. Am J Physiol Heart Circ Physiol 1998; 275:H301-H321.
[11] Y.H.Chen et al. KCNQ1 gain-of-function mutation in familial atrial fibrillation. Science 2003;
299:251-254.
[12] L.P. Lai et al. Association of the human minK 38G allele with atrial fibrillation: evidence of possible
genetic control on the pathogenesis of atrial fibrillation. Am Heart J 2002; 144:485-490.
[13] J.R. Ehrlich et al. Atrial fibrillation associated minK-38G polymorphism modulates delayed rectifier
current and membrane localization. Eur Heart J, 2005; 67:520-528.
[14] Y. Yang et al. Identification of a KCNE2 gain-of-function mutation in patients with familial atrial
fibrillation. Am J Human Genetic 2004; 75:899-905.
[15] K.J. Ma et al. Modulation of KCNQ1 current by atrial fibrillation-associated KCNE4 (145E/D) gene
polymorphism. CMJ 2007; 120:150-154.
[16] K. Hong et al. Short QT sindrome and atrial fibrillation caused by mutation in KCNH2.
J
Cardiovascular Electrophysiol 2005; 16:394-396.
[17] M. Sinner et al. The non-synonymous coding IKr-channel variant KCNH2-K897T is associated with
atrial fibrillation: results from a systematic candidate gene-based analysis of HERG. Eur Heart J 2008;
29:907-914.
[18] T. Olson et al. Kv1.5 channelopathy due to KCNA5 loss-of-function mutation causes human atrial
fibrillation. Human Molecular Genetics 2006; 15:2185-2191.
[19] P.T. Ellinor et al., Common Variants in KCNN3 are Associated with Lone Atrial Fibrillation. Nat Genet
2010; 42(3): 240–244.
[20] Z.S. Zhang et al., Sodium channel kinetic changes that produce Brugada syndrome or progressive
cardiac conduction system disease. Heart and Circulatory Physiology 2006; 292:399-407.
[21] J.C. Makielski et al. A ubiquitous splice variant and a common polymorphism affect heterologous
expression of recombinant human SCN5A heart sodium channels. Circ. Res 2003;93:821–828.
[22] L.Y. Chen et al. A common polymorphism in SCN5A is associated with lone atrial fibrillation. Clin
Pharmacol Ther 2007; 81:35-41.
[23] C. Antezelevitch et al. Loss-of-function mutation in the cardiac calcium channel underlie a new
clinical entity characterized by ST segment elevation, short QT intervals and sudden cardiac death.
Circulation 2007; 115:442-449.
[24] R. Otway et al., Stretch-sensitive KCNQ1 mutation. A link between genetic and environmental
factors in the pathogenesis of atrial fibrillation? J AM Coll Cardiol 2007; 49:578-586.
24
Gli antiagreganti piastrinici
Brilinta: l’FDA ha richiesto analisi supplementari dei dati dello studio PLATO
La FDA (Food and Drug Administration) ha rinviato la decisione in merito all'approvazione negli
Stati Uniti di Ticagrelor, un nuovo antiaggregante piastrinico di AstraZeneca (Brilinta).
La FDA ha richiesto alla società produttrice di Ticagrelor ulteriori analisi dei dati dello studio
PLATO. Sono state riscontrate anomalie nei risultati dello studio PLATO, soprattutto da quelli
provenienti dai Centri del Nord America (Stati Uniti e Canada), in cui è emerso un trend
statisticamente significativo verso risultati peggiori con Ticagrelor rispetto a Clopidogrel
(Plavix) tra i 1.814 pazienti arruolati.
Lo studio PLATO, che ha coinvolto 18.624 pazienti in 43 Paesi, rappresenta lo studio più
importante riguardante Ticagrelor.
I risultati complessivi hanno mostrato che Ticagrelor associato ad Acido Acetilsalicilico
(Aspirina) produce una maggiore riduzione dell'endpoint primario composito di morte per cause
vascolari, infarto miocardico, o ictus del 16%, rispetto all’associazione Clopidogrel e Acido
Acetilsalicilico, nell'arco di 12 mesi (9.8% gruppo Ticagrelor vs 11.7% gruppo Clopidogrel;
p<0.001).
Tuttavia, l'outcome dei 1.814 pazienti di Stati Uniti e Canada che hanno assunto Ticagrelor è
risultato peggiore rispetto a quello dei pazienti trattati con Clopidogrel (11.9% nel gruppo
Ticagrelor vs 9.6% nel gruppo Clopidogrel; differenza non-significativa).
Una delle possibili spiegazioni è che nell'America del Nord vengono impiegate dosi più elevate
di Acido Acetilsalicilico (325 mg/die) rispetto a quelle utilizzate, in generale, nello studio
PLATO.
Alla base ci potrebbe anche essere una minore aderenza al protocollo, un numero maggiore di
impianti di stent a rilascio di farmaco, una più breve permanenza in ospedale. Tuttavia,
secondo Victor L Serebruany della Johns Hopkins University a Towson negli Stati Uniti,
potrebbero esserci altre importanti questioni. In primo luogo, AstraZeneca non ha monitorato
direttamente i siti PLATO negli Stati Uniti, Russia e Georgia; in questi Centri Ticagrelor ha
presentato un profilo meno favorevole rispetto a Clopidogrel.
Inoltre, in circa un terzo dei Paesi in cui lo studio PLATO è stato condotto Ticagrelor non ha
mostrato vantaggi nei confronti di Clopidogrel. Due soli Paesi europei, Polonia e Ungheria, che
assieme rappresentano il 21% del totale dei pazienti arruolati nello studio PLATO, hanno
apportato quasi la metà dei benefici di Ticagrelor, riscontrati nell’intero studio. I risultati
ottenuti in Brasile e in India hanno favorito in modo pesante Ticagrelor. Inoltre, sempre
secondo Serebruany, ci sarebbero incongruenze riguardo ai dati di mortalità. Nello studio
PLATO, il tasso globale di mortalità per qualsiasi causa nel gruppo Clopidogrel è stato pari a
5.9%, che è superiore a quello di mortalità dello studio CURE ( 5.7% ), condotto 10 anni
prima. Questo risultato è alto rispetto ad analoghi studi contemporanei come TRITON-TIMI 38.
Il tasso di mortalità osservato con Clopidogrel nello studio PLATO negli Stati Uniti è stato del
3.2%, che è identico a quello osservato con Clopidogrel nel TRITON-TIMI 38, e il tasso di
mortalità con Ticagrelor in Nord America è stato pari a 3.84% nello studio PLATO, simile a
quello osservato in tutti e tre i bracci dello studio ACUITY a 1 anno (range 3.6-3.9%).
Fonte: TheHeart.org, 2010
Plavix: la FDA ha imposto un Black Box nella scheda tecnica dell'antiaggregante piastrinico
Diversi pazienti che assumono Plavix sono a rischio di infarto miocardico, ictus e di morte
cardiovascolare
Il 2-14% della popolazione non è in grado di trasformare in modo efficiente il principio attivo di
Plavix (Clopidogrel), un profarmaco, nella forma attiva. Queste persone sono definite scarsi
metabolizzatori.
L'effetto antiaggregante piastrinico di Plavix negli scarsi metabolizzatori è ridotto o assente,
pertanto questi pazienti sono a maggior rischio di formazione di trombi. Che cosa fare?
1) individuazione dei pazienti scarsi metabolizzatori mediante analisi genotipica
25
2) variazione del dosaggio di Plavix (non esistono regimi validati)
3) sostituzione di Plavix con un altro antiaggregante piastrinico
Antiaggregazione piastrinica: ridotta efficacia di Plavix nei pazienti scarsi metabolizza tori
L’FDA (Food and Drug Administration) ha aggiunto un Boxed Warning alla scheda tecnica di
Plavix, un farmaco antiaggregante piastrinico.
Il Boxed warning riguarda i pazienti che non metabolizzano in modo efficiente il Clopidogrel
(principio attivo di Plavix), e pertanto non possono trarre beneficio in modo completo dalla
terapia antiaggregante.
Plavix trova impiego nel ridurre il rischio di infarto del miocardio, angina instabile, ictus e
mortalità cardiovascolare nei pazienti con malattia cardiovascolare.
Il Clopidogrel è metabolizzato a livello epatico, particolarmente dal sistema CYP2C19, e
convertito nella sua forma attiva.
I pazienti che sono scarsi metabolizzatori del farmaco non convertono in modo efficace il
Clopidogrel nella sua forma attiva. In questi pazienti Plavix esercita un minor effetto
sull’aggregazione delle piastrine, e pertanto è meno efficace nel prevenire l’infarto miocardico,
l’ictus e la morte per cause cardiovascolari.
Si stima che il 2-14% della popolazione sia uno scarso metabolizzatore.
I medici devono essere consapevoli che un sottogruppo di pazienti sono scarsi metabolizzatori
del Clopidogrel con gravi conseguenze riguardo all’efficacia del farmaco. Pertanto debbono
prendere in considerazione la possibilità di impiegare altri antiaggreganti piastrinici, o in
alternativa modificare il dosaggio di Plavix.
I pazienti non devono sospendere l’assunzione di Plavix senza prima aver informato il proprio
medico curante.
Nel maggio 2009, la FDA aveva aggiunto alla scheda tecnica di Plavix informazioni riguardo
agli scarsi metabolizza tori del Clopidogrel. Tuttavia, la FDA, sulla base di ulteriori dati, ha
ritenuto opportuno inserire un Boxed Warning con l’obiettivo di sottolineare la ridotta efficacia
di Plavix in questi pazienti, raccomandando ai medici di prendere in considerazione l’uso di altri
farmaci antiaggreganti piastrinici o cambiamenti del dosaggio di Plavix per gli scarsi
metabolizzatori.
Farmacocinetica
Il sistema enzimatico a livello epatico CYP2C19 è il principale responsabile della formazione del
metabolita attivo del Clopidogrel.
I test di farmacocinetica e di aggregazione piastrinica del metabolita attivo hanno mostrato che
i livelli di farmaco e gli effetti antiaggreganti differiscono in base al genotipo del sistema
enzimatico CYP2C19. I seguenti rappresentano i differenti alleli di CYP2C19 che compongono il
genotipo del paziente:
a) L’allele CYP2C19*1 è responsabile del metabolismo pienamente funzionale di Clopidogrel;
b) Gli alleli CYP2C19*2 e *3 non esercitano metabolismo funzionale di Clopidogrel. Questi due
alleli sono responsabili per la maggior del metabolismo funzionale ridotto nei pazienti con
discendenza caucasica (85%) e asiatica (99%), classificati come scarsi metabolizzatori;
c) Gli alleli CYP2C19*4,*5, *7, e 8* e altri alleli possono essere associati a un metabolismo
assente o ridotto di Clopidogrel, ma sono meno frequenti rispetto agli alleli CYP2C19*2 e *3.
d) Un paziente con perdita di funzionalità in due alleli sono da considerarsi scarsi
metabolizzatori.
Uno studio in crossover ha valutato la farmacocinetica e le risposte antiaggreganti di Plavix in
40 soggetti sani. Dieci soggetti per ciascuno dei 4 gruppi di metabolizzatori CYP2C19
(ultrarapidi, estesi, intermedi, scarsi) sono stati assegnati in modo casuale a due regimi di
trattamento: una dose di carico orale di 300 mg seguita da 75 mg/die, oppure una dose di
carico di 600 mg seguita da 150 mg/die, ciascuno per un totale di 5 giorni. Dopo un periodo di
wash-out, i soggetti sono passati al trattamento alternativo. Una ridotta esposizione al
metabolita attivo e un aumento dell’aggregazione piastrinica sono stati osservati negli scarsi
metabolizzatori, rispetto ad altri gruppi. Quando gli scarsi metabolizzatori hanno ricevuto la
26
dose di carico di 600 mg, seguita da 150 mg/die, l’esposizione al metabolita attivo e la risposta
antiaggregante sono risultati maggiori rispetto al regime 300 mg/75 mg.
Un appropriato dosaggio non è stato stabilito per i pazienti scarsi metabolizzatori. Fonte: FDA,
2010
Unione Europea: approvato il nuovo antiaggregante piastrinico Brilique nei pazienti con
sindrome coronarica acuta
La Commissione europea ha approvato Brilique (Ticagrelor), un nuovo antiaggregante
piastrinico per la prevenzione di eventi aterotrombotici in pazienti adulti con sindrome
coronarica acuta.
L’autorizzazione alla commercializzazione si basa sui dati del Programma clinico di Ticagrelor,
tra cui i risultati dello studio PLATO (A Study of PLATelet Inhibition and Patient Outcomes), che
ha mostrato la superiorità di Ticagrelor rispetto a Clopidogrel (Plavix), indicando che il
trattamento di 54 pazienti con sindrome coronarica acuta con Ticagrelor, anziché Clopidogrel,
per 1 anno impedisce 1 evento aterotrombotico, e il trattamento di 91 pazienti impedisce 1
morte cardiovascolare, senza alcun aumento complessivo di emorragia maggiore o di
emorragia ad esito fatale nel corso di 1 anno di trattamento (11.6% per Ticagrelor vs 11.2%
per Clopidogrel; p=0.43).
Gli effetti indesiderati più comunemente riportati con Ticagrelor sono: sanguinamento e
dispnea. Con Ticagrelor il sanguinamento grave non è comune, mentre sono comuni ecchimosi
ed epistassi. La dispnea spesso si risolve durante trattamento con l’antiaggregante piastrinico,
e raramente, nello studio PLATO, i pazienti hanno dovuto interrompere l’assunzione del
farmaco. Altri effetti indesiderati non-comunemente riportati comprendono: mal di testa,
vertigini, dolore addominale, diarrea, rash, prurito e disturbi di stomaco.
Ticagrelor è un antagonista ad azione diretta del recettore P2Y12, con legame reversibile, che
viene somministrato per bocca.
Brilique, co-somministrato con Acido Acetilsalicilico (ASA, Aspirina), trova indicazione nella
prevenzione degli eventi aterotrombotici in pazienti adulti con sindromi coronariche acute
(angina instabile, infarto NSTEMI, o infarto STEMI), tra cui pazienti in terapia medica e quelli
che sono sottoposti a intervento coronarico percutaneo (PCI) o bypass coronarico (CABG).
Fonte: AstraZeneca, 2010
Dispnea associata a trattamento con Ticagrelor nei pazienti con malattia coronarica stabile
Lo studio ONSET/OFFSET (A Multi-Centre Randomised, Double-Blind, Double-Dummy Parallel
Group Study of the Onset and Offset of Antiplatelet Effects of AZD6140 Compared With
Clopidogrel and Placebo With Aspirin as Background Therapy in Patients With Stable Coronary
Artery Disease) ha valutato in modo prospettico la funzione cardiaca e polmonare in pazienti
con coronaropatia stabile trattati con Ticagrelor (Brilinta), Clopidogrel (Plavix) o placebo.
Ticagrelor riduce gli eventi cardiovascolari in maniera più efficace rispetto a Clopidogrel in
pazienti con sindromi coronariche acute, ma in alcuni pazienti trattati con Ticagrelor si
manifesta dispnea e non è chiaro se ciò sia associato a cambiamenti nella funzione cardiaca o
polmonare.
In totale, 123 pazienti con malattia coronarica stabile in trattamento con Acido Acetilsalicilico
(Aspirina) sono stati assegnati in maniera casuale a ricevere Ticagrelor (180 mg di carico, poi
90 mg 2 volte al giorno; n=57), Clopidogrel (600 mg di carico, poi 75 mg al giorno; n=54)
oppure placebo (n=12) per 6 settimane.
Dopo trattamento, la dispnea si è manifestata, rispettivamente, nel 38.6%, 9.3% e 8.3% dei
pazienti dei gruppi Ticagrelor, Clopidogrel e placebo, (p<0.001). Nella maggior parte dei casi, il
disturbo è risultato lieve o moderato, ed è durato meno di 24 ore, ma 3 pazienti hanno
interrotto il trattamento con Ticagrelor proprio a causa della dispnea.
Nel gruppo Ticagrelor, 8 dei 22 pazienti ha manifestato dispnea entro 24 ore dalla
somministrazione del farmaco e 17 su 22 entro una settimana. In tutti i gruppi di trattamento
e nei pazienti con dispnea trattati con Ticagrelor non sono stati osservati cambiamenti
significativi rispetto al basale nei parametri di funzione cardiaca o polmonare.
27
In conclusione, la dispnea è comunemente associata alla terapia a base di Ticagrelor, ma in
questo studio non è risultata associata ad alcun cambiamento negativo nella funzione cardiaca
o polmonare.
Storey RF et al, J Am Coll Cardiol 2010; 56: 185-93
Medicina e Morale
a cura di
Paolo Rossi
Propaganda bioetica: Il premio Nobel a Edwards
Francesco D'Agostino
EDITORIALE Medicina e Morale 2010/5 613-616
La discussione sul premio Nobel attribuito a Robert Edwards sembra oramai spenta. Ottima
ragione per tornare a ragionarci sopra, con freddezza e distacco. È stato davvero “meritato”
questo premio? Non si può rispondere a questa domanda, se non ci si pone preliminarmente e
seriamente la questione di sapere cosa significhi “meritare” e soprattutto perché al “merito”
debba (o possa) conseguire un “premio” (dai più semplici, come la lode che il maestro rivolge
all’alunno, ai più prestigiosi, come il Nobel).
Quando Nobel decise di utilizzare il suo patrimonio per istituire i premi che sarebbero stati
designati con il suo nome, si viveva in un mondo ben più semplice dell’attuale e non esistevano
dubbi sul concetto di “merito”. Era opinione assolutamente condivisa che fosse da ritenere
“meritevole” un comportamento individuale, in quanto capace di incidere sul benessere sociale.
A Nobel (e non solo a lui!) appariva del tutto auto-evidente che non si potesse acquisire un
merito per nascita (non c’è merito nell’appartenere a una famiglia nobile) o per l’operato altrui
(come ad es., nella tradizione cristiana, in cui attraverso preghiere o suffragi si possono
alleviare le sofferenze delle anime del purgatorio, non certo però perché esse se lo meritino,
ma per la misericordia di nostro Signore). Analogamente non si conquista merito attraverso la
buona sorte (il vincitore di una lotteria viene invidiato, ma non lodato), né per predisposizione
naturale (la mera bellezza del corpo, una memoria di ferro o una vista da lince destano sì
ammirazione, ma non propriamente una lode). “Meritevole” poteva, agli occhi di Nobel come a
quelli dei suoi contemporanei, essere ritenuta solo un’attività volontaria, responsabile,
intenzionale, quale quella di uno scienziato, di un letterato o di un operatore di pace; un’azione
capace di implementare il bene umano. Fiducioso nell’oggettività universale del bene, e nella
più assoluta indifferenza per l’identità particolare dei meritevoli (identità etnica, sessuale,
religiosa, politica, di censo, ecc.), Nobel riteneva che non dovesse essere troppo arduo
individuare anno dopo anno i benemeriti dell’umanità. Confermare le loro benemerenze con
una elargizione di danaro (tuttora rilevante, anche se non raggiunge le cifre, a volte
impressionanti, di alcune lotterie) il premio doveva, nella mente di Nobel, veicolare un
significato prezioso: doveva manifestare la riconoscenza del genere umano verso i suoi
benefattori e nello stesso tempo attivare nei singoli individui la preziosa propensione
all’imitazione, nell’unico ambito in cui tutti possono confrontarsi con tutti, l’ambito appunto
dell’impegno orientato fattivamente e pubblicamente al bene sociale. Questo spiega perché a
norma di regolamento il premio Nobel non possa essere assegnato a chi sia defunto: anche la
figura di chi è morto può avere un valore esemplare, ma è ben più esemplare l’attività di un
vivo rispetto a quella di chi non sia più in vita. E spiega altresì perché non avrebbe senso
ipotizzare un Nobel che premiasse la dimensione preziosa, ma privata, della “bontà” o
addirittura della “santità”: non perché non sarebbe auspicabile che tutti, e soprattutto i
28
giovani, si impegnassero nell’imitazione di uomini buoni e santi, ma perché bontà e santità non
producono necessariamente un benessere sociale (valutabile con parametri quantitativi), ma
solo un benessere spirituale (percepibile, ma non quantificabile). Il Premio Nobel per la
Letteratura non rientra perfettamente in questo schema (come non ci rientrano, in genere, i
premi letterari), così come non ci rientra quello per la Pace; ma è per questo che tali tipologie
di premio sono le più influenzate da equilibrismi linguistici, politici e nazionali, che col merito
hanno non sempre a che vedere, come dimostra il fatto che il conferimento di questi premi è
tradizionalmente il più discusso.
Questo paradigma ha cominciato a scricchiolare da tempo, per vari ordini di ragioni. In primo
luogo perché si è cominciato a revocare in dubbio il paradigma (vagamente utilitaristico)
sotteso al regolamento del premio, l’idea cioè che il merito scientifico andasse riconosciuto a
partire dalla sua capacità di essere produttivo di benessere sociale. È oggi opinione
comunemente condivisa che una conoscenza scientifica, purché acquisita in modo
epistemologicamente corretto, sia dotata, ancorché “inutile”, di pari dignità gnoseologica di
qualsiasi altra acquisizione di sapere. Di conseguenza, Alfred Nobel, identificando la figura dello
scienziato, come sapiente e quella dello scienziato, come benefattore del genere umano,
avrebbe dato prova di un comprensibile, ma discutibile pregiudizio ideologico.
L’istituzione degli Ig-Prizes, i premi che dal 1991, anno per anno, sono conferiti a ricerche
rigorose e corrette, ma anche assolutamente irrilevanti, è stata senza dubbio motivata da un
intento deliziosamente satirico (secondo tipiche modalità anglosassoni) ed ha consentito la
creazione di uno dei siti più spassosi dell’intera rete, ma ha avuto anche la funzione (di certo
non intenzionale) di mostrare definitivamente a tutti come lo spirito e il metodo della ricerca
scientifica possano trovare concretizzazioni impeccabili sul piano puramente conoscitivo,
indipendentemente dalle ricadute operative delle ricerche stesse: non a caso per ottenere un
Ig-Prize è necessario che le ricerche first make people laugh and then make them think. Il
secondo fattore che ha cominciato a far scricchiolare l’imponente e ammirevole impalcatura
costruita da Alfred Nobel è più sottile del precedente, ma anche più tagliente. Esso va
ricondotto all’erosione interna cui è sottoposto, in una cultura relativistica come quella
contemporanea, il concetto stesso di benessere sociale, come concetto universale ed univoco.
La stessa categoria del bene tende oggi ad essere rigettata, come pre-moderna e
inguaribilmente metafisica, o viene rimodulata secondo una logica di estremo soggettivismo: è
bene ciò che i soggetti, nella loro insindacabile autodeterminazione, qualificano come tale. La
scala dei meriti, che Nobel riteneva potesse essere oggettivamente stabilita, viene a trovarsi
oggi pericolosamente soggetta a qualsiasi oscillazione possa conseguire alle determinazioni
potestative delle persone. Il diffondersi dell’individualismo assiologico, e la sua pretesa di
retroagire sul piano dell’epistemologia pura, se è dilagante, non ha però mancato di suscitare
reazioni appropriate, alcune delle quali non sarebbe esagerato definire epocali. La nascita e il
rapido diffondersi della bioetica ne è la prova migliore. La bioetica non è nata per sindacare la
dimensione epistemologica del sapere scientifico, ma il suo orientamento al bene umano.
Purtroppo, quando cade in mani ai relativisti, la bioetica diventa inevitabilmente un potente
strumento ideologico di legittimazione di qualsivoglia pratica scientifica. Quando invece resta
fedele alla sua vocazione prima e originaria, la bioetica assume nei confronti della scienza un
doveroso atteggiamento di rispetto, qualificato però da uno sguardo critico nei confronti del
nuovo, immenso potere di manipolazione della vita che caratterizza le moderne scienze
biomediche. Stiamo così lentamente arrivando al cuore della nostra questione.
Le conoscenze che Edwards ha fatto acquisire all’umanità con le sue ricerche e che tante
lucrose ricadute hanno avuto nell’ambito della medicina della riproduzione non sono
eticamente neutrali: esse veicolano l’idea che il processo riproduttivo umano possa
legittimamente trovare il suo luogo nel contesto necessariamente freddo e pubblico di un
laboratorio e non in quello, altrettanto necessariamente caldo e privato della casa (o comunque
di qualsiasi luogo una coppia individui e delimiti come un proprio luogo di intimità relazionale).
Sappiamo bene come su questa questione si abbiano, e non solo tra i bioeticisti, ma più in
generale nell’opinione pubblica, opinioni più diverse, che vanno dal rifiuto più drastico
all’accettazione più entusiastica. Quello che non è possibile revocare in dubbio è però proprio la
problematicità come questione bioetica della procreazione medicalmente assistita (non certo
della medicina della sterilità!). È evidente che, dando il Nobel a Edwards, gli svedesi hanno
legittimato i meriti scientifici dello scienziato, ma ancor più ne hanno avvalorato l’orizzonte
29
bioetico. Sono cioè intervenuti in un contesto, come quello inerente ai “valori”, che vive di
scontri dialettici, che non sono però qualificabili o risolubili attraverso meccanismi premiali. Si
obietterà: ma Edwards è realmente un benefattore, almeno agli occhi delle innumerevoli
coppie che hanno avuto un figlio solo grazie alla fecondazione in provetta. È innegabile che da
queste coppie egli venga ritenuto davvero tale. Ma è altresì innegabile che questa metodologia
ha un prezzo non irrilevante, che va dallo “spreco”degli embrioni (espressione brutta, ma
insostituibile) alla costituzione delle banche degli embrioni congelati, fino all’inevitabile dilagare
delle diagnosi pre-impiantatorie e delle conseguenti, altrettanto inevitabili pratiche di selezione
eugenetica (e non solo eugenetica). Di questi problemi e del loro spessore bioetico, sembra
che né Edwards, né coloro che lo esaltano, pur conoscendoli benissimo, vogliano assumere
coscienza. Un obiettore alle tesi che sto argomentando potrebbe continuare ad insistere,
riconoscendo che i problemi ai quali ho fatto cenno esistono realmente, ma che sono problemi
esclusivamente confessionali, tali cioè da turbare esclusivamente i cattolici: chi fosse sensibile
ad essi dovrebbe semplicemente impegnarsi a non utilizzare mai pratiche di procreazione
assistita, ma non proibirle a chi di questi problemi non avvertisse la rilevanza.
Con tutto il rispetto per chi si riconosce in questo argomento, penso che esso non sia altro che
un sofisma, specioso come tutti i sofismi e, come tutti i sofismi, inaccettabile. Sul piano
fattuale, la questione della procreazione assistita non ha in sé e per sé carattere confessionale,
ma filosofico-antropologico, cioè bioetico.
L’antropologia cristiana possiede naturalmente un’alta legittimazione per valutare queste
pratiche in prospettiva teologico-spirituale, ma deve riconoscerne primariamente lo spessore
pre-confessionale (esattamente come, nel matrimonio, il valore spirituale del matrimoniosacramento presuppone, e non sostituisce, il valore del c.d. “matrimonio naturale”). La ragione
ultima del fatto che con tanta monotonia si cerca di legittimare la procreazione assistita come
pratica laica e di respingere come cattolici coloro che ne avvertono tutta la problematicità non
può che essere ricondotta ad un espediente dialettico, nemmeno troppo difficile da
smascherare, quello di arruolare nei ranghi di una bioetica libertaria tutti coloro che non si
riconoscano nella tradizione cattolica o comunque cristiana, quasi che l’universo culturale
contemporaneo possa davvero ridursi a uno schema binario che divide gli uomini in due
categorie: moderni/pre-moderni, liberali e tolleranti/illiberali e intolleranti, dotati di spirito
critico e problematico/dotati di spirito dogmatico e ottuso, rispettosi dei nuovi diritti e in
particolare di quelli delle donne, ostili ai diritti e in particolare a quelli delle donne: non c’è
bisogno di sottolineare che i “laici” vengono naturalmente arruolati nella prima categoria, i
cattolici nella seconda. La povertà di questo sofisma è smentita dal fatto stesso che, se ci
decidiamo a chiamare bioetica personalista quella che mantiene una rigorosa attenzione alla
promozione e alla tutela del bene della vita, come bene oggettivo, vediamo come assieme ai
cattolici per essa si battano bioeticisti non credenti, o credenti in confessioni non cristiane, tutti
però accomunati dalla convinzione che sia inaccettabile dare credito morale al soggettivismo,
quel soggettivismo insaziabile (come è stato efficacemente definito), che caratterizza tanta
parte dell’orizzonte etico contemporaneo.
Ridurre il Premio Nobel per la medicina a strumento di propaganda bioetica non può che colpire
coloro che, per ragioni anche generazionali (come il sottoscritto), hanno sempre visto in questo
premio la prova del carattere cosmopolitico della scienza. E non può, per converso, che
rallegrare coloro che si battono contro la neutralità e l’universalità della scienza (secondo lo
slogan sessantottino: scienza è ciò che è utile al Pentagono!) e che quindi, coerentemente con
questa premessa, ritengono più che ragionevole un uso strumentale della scienza, per
implementare visioni e modelli antropologici di carattere libertario. Se questa è oggi la posta in
gioco, ha poco senso riflettere sui meriti specifici di Edwards come medico e come scienziato:
non a lui è stato dato il premio e ai suoi meriti, ma all’ideologia di cui lui (consapevolmente o
no, non importa) è oggi il massimo testimonial. È doveroso per chi non condivide questa
ideologia, ma soprattutto per chi la ritiene scientificamente pericolosa, biasimare la decisione
di conferirgli il Nobel.
30
LA NUOVA INFORMAZIONE CARDIOLOGICA (NIC)
è inviata gratuitamente secondo una mailing list predisposta; si può essere cancellati
o essere iscritti per riceverla, inviando la richiesta a:
[email protected]
L’archivio dei numeri precedenti si trova nel sito:
http://www.foliacardiologica.it
Direttore Responsabile: Prof. Paolo Rossi - [email protected]
Direttore Scientifico: Dott. Eraldo Occhetta – [email protected]
Segretario Scientifico: Dott. Gabriele Dell’Era - [email protected]
31












