PROPRIETA’ DELLE SOLUZIONI
ACQUOSE
Prof.ssa Patrizia Gallucci
• L'acqua è un composto chimicamente semplice, formato da
due atomi di idrogeno e uno di ossigeno (H2O), che riveste
fondamentale importanza in biologia: costituisce il principale
componente in peso (40-98%) degli organismi, ed è il mezzo in
cui si svolge la maggior parte dei processi biochimici.
• Le particolari caratteristiche chimico-fisiche dell'acqua sono
una conseguenza dei legami a idrogeno che si instaurano tra
le molecole d'acqua . I legami a idrogeno tendono a far
"aderire" più tenacemente le molecole d'acqua tra loro e
questo influenza altre proprietà, come la tensione superficiale
e la capacità termica.
• La natura polare della molecola d'acqua spiega l'elevato
potere solvente nei riguardi di composti ionici e di molecole
polari piccole o grandi.
La presenza di un soluto nell’acqua modifica le
seguenti proprietà:
•
•
•
•
Pressione di vapore
Punto di ebollizione
Punto di congelamento
Pressione osmotica
Queste proprietà sono dette colligative ( unite
insieme)
Queste proprietà dipendono tutte dal fatto che
la concentrazione dell’acqua è più bassa nelle
soluzioni che nell’acqua pura.
L’effetto della concentrazione del soluto sulle
proprietà colligative dell’acqua non dipende
dalle proprietà chimiche del soluto, ma solo
dal numero delle particelle (molecole o ioni)
presenti in una certa quantità di acqua.
INNALZAMENTO EBULLIOSCOPICO
Consiste nell’aumento della temperatura
di ebollizione di una soluzione rispetto al
solvente puro.
Δteb = Keb · m (molalità)
Se il soluto dissocia o ionizza si ha
Δteb =i· Keb · m (molalità)
dove i è il numero di ioni prodotti.
ABBASSAMENTO CRIOSCOPICO
Consiste nella diminuzione della temperatura
di fusione di una soluzione rispetto al
solvente puro.
Δtcr = Kcr · m (molalità)
Se il soluto dissocia o ionizza si ha
Δtcr =i· Kcr · m (molalità)
dove i è il numero di ioni prodotti.
Abbassamento crioscopico
Solo acqua
Con soluto
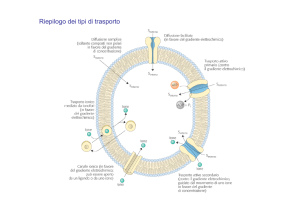
PRESSIONE OSMOTICA
Se ci sono due soluzioni a concentrazione diversa,
separate de un membrana permeabile, le molecole
del soluto diffonderanno dalla soluzione più
concentrata a quella meno concentrata; mentre le
molecole del solvente migreranno dalla soluzione
meno concentrata a quella più concentrata fino ad
avere la stessa concentrazione(diffusione passiva su
gradiente di concentrazione).
Se invece le due soluzioni sono separate da una
membrana semipermeabile, le sole molecole di
acqua diffonderanno verso la soluzione più
concentrata (osmosi) producendo una pressione
osmotica.
Questa pressione Π è espressa come pressione da
applicare per bloccare il movimento dell’acqua :
Π = i·c (mol/litro)·RT
https://www.youtube.com/w
atch?v=w3_8FSrqc-I
IMPORTANTE:
1)UN COMPOSTO COME NaCl CHE TENDE A
DISSOCIARSI HA UN EFFETTO DOPPIO SULLA
PRESSIONE OSMOTICA DI UN UGUALE QUANTITA’
DI MOLI DI GLUCOSIO, CHE INVECE NON DISSOCIA.
2)TUTTE LE SOSTANZE CHE SI SOLUBILIZZANO IN
ACQUA ,COMPRESE LE PROTEINE GLOBULARI,
SONO ATTIVE OSMOTICAMENTE.
OSMOSI INVERSA NELLA
DEPURAZIONE DELLE ACQUE
Rispetto all’OSMOSI (movimenti dell’acqua
attraverso una membrana semipermeabile
dovuti alla differenza di pressione
osmotica) le soluzioni possono essere:
• ISOTONICHE
• IPERTONICHE
• IPOTONICHE
EFFETTI
DELL’OSMOSI
SULLA CELLULA
VISCOSITA’ E TENSIONE SUPERFICIALE
Sono due proprietà dei liquidi, compresa l’acqua , che il
soluto modifica.
La VISCOSITA’ è la resistenza di un liquido allo
scorrimento.
La TENSIONE SUPERFICIALE è la forza esercitata
dalle molecole, poste all’interfaccia del liquido
con un corpo (solido o liquido) di altra natura,
sulle molecole più interne.
TENSIONE SUPERFICIALE
• Le soluzioni acquose di macromolecole,
es.polisaccaridi, sono molto viscose (soluzioni
colloidali).
• I tensioattivi (tra cui i saponi) sciolti in acqua
abbassano la tensione superficiale all’interfaccia
acqua/aria o acqua /olio.
Vengono usati come detergenti, stabilizzatori di
sospensioni ed emulsioni, disinfettanti.
La schiuma si
è prodotta
perché si è
abbassata la
tensione
superficiale
dell’acqua.