M. Marengo
RICHIAMI DI FISICA ATOMICA
Servizio di Fisica Sanitaria
Ospedale Policlinico S.Orsola - Malpighi, Bologna
[email protected]
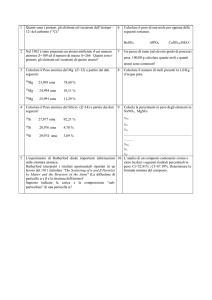
Il nucleo e le particelle atomiche
protone
nucleo
neutrone
.
elettrone
1
Massa ed energia
La massa di un protone risulta uguale a 1.67 . 10-24 grammi ; si preferisce
usare una scala speciale per le masse dei nucleoni e degli atomi, basata
per definizione sulla massa dell’atomo di carbonio. Si definisce unità di
massa atomica
1 uma = 1/12 (massa dell’atomo di 12C) = 1.66 . 10-24 grammi
si attribuisce cioè per definizione una massa pari a 12 all’atomo del 12C. In
tal modo si ha che la massa di un protone risulta pari a 1.00728 uma e la
massa del neutrone è di 1.00866 uma.
La massa “a riposo” di una nucleone può essere misurata, grazie alla
equivalenza fra energia e massa, in unità di misura dell’energia ; poiché 1
uma corrisponde a 931.5 MeV, per un protone essa risulta di 938.256 MeV,
mentre per un neutrone è di 939.550 MeV.
Il protone ha una carica positiva unitaria, che corrisponde a 1.602 . 10-19 C.
L’elettronVolt
elettrone
+
Differenza di potenziale di 1 Volt
L’energia cinetica acquisita da un elettrone che si muove tra due punti fra i quali si
ha una differenza di potenziale di 1 V, è pari a 1 elettronVolt. 1 eV risulta uguale a
1.6 . 10-19 Joule.
Multipli molto usati dell’ eV, sono
1 keV = 1000 eV
1 MeV= 1.106 eV
2
Numero di Avogadro
• il Numero di Avogadro esprime il numero di atomi o molecole che ci sono in 1 mole
di sostanza
• si indica di solito come N0 (a volte come NA) e vale 6.02x1023
• una mole è la quantità di materia data dal peso molecolare espresso in grammi
• quindi una quantità pari al peso atomico espresso in grammi di diversi elementi
contiene lo stesso numero di atomi
• p.es. se consideriamo il Carbonio-12, una mole è data da 12 grammi di 12C
• se consideriamo l’Idrogeno, che ha peso atomico 1, un grammo di Idrogeno
contiene lo stesso numero di atomi di 12 grammi di Carbonio
Stime delle dimensioni del nucleo
Considerando un materiale allo stato liquido o solido, per il quale possiamo
immaginare che gli atomi siano fra di loro contigui, si può dire che l’ordine
di grandezza delle dimensioni atomiche deve risultare prossimo a
1
N0
1/ 3
che equivale a considerare un ordine di grandezza di 1 g/cm3 per la
densità della materia ; in tale modo un centimetro cubo di materia viene a
contenere N0 atomi e da ciò viene il risultato. Poiché il numero di Avogadro
vale N0 = 6.02 . 1023 , la stima fornisce un ordine di grandezza di 10-8 cm
per le dimensioni di un atomo.
3
Schematizzazione del modello nucleare di Thomson
+
+
+
+
+
+
+
+
+
+
+
e-
+
+
+ e+
+
+
+ e
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
e+
+
+
e++
+
+
+
+
+
+
+
e- +
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
+
• il nucleo sarebbe costituito di una materia uniforme positiva
• in esso sono dispersi (come l’uvetta in un panettone …) gli elettroni negativi
• questo modello ha alcuni pregi; p.es. spiega la stabilità degli atomi
Schematizzazione del modello nucleare di Rutherford
• si ha un nucleo positivo attorno al quale ruotano, come pianeti attorno al sole,
gli elettroni negativi
• dal punto di vista della fisica classica, non può funzionare: gli elettroni, in moto
nel campo elettrico del nucleo, dovrebbero perdere progressivamente energia e
precipitare sul nucleo.
4
Ernest Rutherford
Nuova Zelanda 1871 – Cambridge 1937
• individuò i tre principali tipi di radiazioni α, β, γ
• dimostrò che le particelle alfa sono nuclei di Elio
• formulò la teoria dell’atomo con nucleo denso e elettroni orbitanti
• premio Nobel per la Chimica nel 1908 per le sue ricerche ed il modello atomico
• nel 1919 ottenne la prima reazione nucleare, bombardando Azoto con particelle alfa
Schema dell’esperimento di Geiger e Marsden
Obbiettivo
scorrevole su rotaia
Sottile lamina di diffusore
Collimatore
Sorgente di Polonio
Fascio di particelle positive
Schermo fosforescente di misura
5
Interpretazione dell’esperimento di Geiger e Marsden - I
+e- e+
e+- +ee- e-
+e- e+
e+- +e- e+e +
+e- e+
e+- +e- e+e +
+ +
+
+e- e+
e+- +e- e+e +
+e- e+
e+- +e- e+e +
+e- e+
e+- +e- e+e +
• i nuclei di Thomson sono elettricamente neutri
• solo a brevissima distanza una particella incidente può “sentire” effetti
dovuti al campo elettrico non perfettamente equilibrato
• si dovrebbero avere pochissime deflessioni a grande angolo delle particelle
incidenti
Interpretazione dell’esperimento di Geiger e Marsden - II
+
• i nuclei di non sono neutri, ma positivi; l’atomo risulta neutro solo a distanza e
mediamente, grazie al moto degli elettroni orbitali
• una particella incidente positiva di massa abbastanza grande penetra nella “nube”
di elettroni senza esserne disturbata
• a brevissima distanza una particella incidente positiva è esposta alla azione del
campo elettrico del nucleo e viene deflessa
• il modello giustifica e permette di prevedere la frequenza di deflessioni a grande
angolo delle particelle incidenti
6
Il modello nucleare di Bohr
• poiché i dati a sostegno del modello di Rutherford erano inconfutabili, anche se
esso non era spiegabile con la fisica classica, si cercò di capire perché ciò può
accadere e quali eccezioni esistevano ai principi classici
• Niels Bohr giunse a formulare un modello nel quale si ammetteva che
esistessero particolari orbite per le quali si aveva stabilità a dispetto dei principi
classici
• furono sviluppate una serie di regole numeriche che permettevano di stabilire in
quali condizioni ciò avveniva; queste sono dette “regole quantiche”, poiché
prevedono che l’energia possa variare (su scala atomica) non in modo continuo,
ma solo per quantità discrete
• questi ed altri sviluppi della fisica, hanno portato a costruire la meccanica
quantistica
Niels Bohr
(1885 – 1962)
• studiò con Thomson e Rutherford
• dal 1913 al 1915 sviluppò la teoria del modello atomico quantistico
• premio Nobel per la Fisica nel 1922 per il suo modello atomico
• dal 1920 direttore dell’Istituo di Fisica di Copenaghen, che divenne un centro
internazionale presso cui studiarono alcuni dei più importanti fisici del ‘900
• in seguito all’occupazione della Daniamarca nel 1940 fuggì in Svezia e poi negli
USA, contribuendo al progetto Manhattan
• dopo la guerra tornò in Danimarca e riprese la direzione del suo istituto
7
Schema del modello atomico di Bohr
LI
LII
LIII
K
• il nucleo è denso e vi sono concentrate le cariche positive
• gli elettroni orbitano attorno al nucleo, a distanza relativamente grande
• gli elettroni possono trovarsi solo su determinate orbite
• gli orbitali permessi devono soddisfare determinate regole quantistiche
• fra un orbitale e l’altro si ha una differenza di energia
• gli elettroni degli orbitali più interni sono più legati al nucleo rispetto a quelli esterni
Simbologia dei nuclidi
Numero di massa
(numero totale dei nucleoni)
Simbolo chimico
A
ZXy
Numero atomico
(numero dei protoni)
8
Nuclei isotopi
• hanno lo stesso numero atomico Z , diverso numero di massa A
• sono quindi diverse possibili “varianti” dello stesso elemento chimico
• hanno pertanto le stesse proprietà chimiche, ma diverse proprietà fisiche
• per esempio, alcuni isotopi di un elemento possono essere radioattivi
• a parità di Z alcune combinazioni del rapporto Z/A sono stabili ed altre no
• in natura diversi elementi si presentano come una miscela di vari isotopi
stabili
Esempio
• l'elemento chimico Z = 8, Ossigeno, è presente in natura con 3 isotopi stabili
16O (circa 99.76 %)
17O (meno di 0.04 %)
18O (circa 0.2 %)
• artificialmente si possono produrre alcuni isotopi radioattivi
15O (tempo di dimezzamento circa 2 minuti)
Isotopi naturali dell’Ossigeno
16Ossigeno
17Ossigeno
18Ossigeno
9
Isotopi dell’Idrogeno
1H
2H
- Idrogeno
3H
- Deuterio
- Trizio
Nuclei isobari
• hanno lo stesso numero di massa A, ma diverso numero atomico Z
• appartengono quindi a diversi elementi chimici
• hanno diverse proprietà sia chimiche che fisiche
• a parità di A vi sono valori del rapporto Z/A stabili ed altre no, ovvero ci
può essere un nuclide con Z diverso più stabile di quello considerato
OSSIGENO-15
0.0
0.0
7
15N
8
15O
(T1/2 = 122.24 secondi)
ΕC1, β1+
(stabile)
10
Numero dei neutroni in funzione del numero dei
protoni per i nuclidi stabili
• gli elementi leggeri
hanno numeri di neutroni
e protoni uguali (o molto
vicini)
• all’aumentare di A si ha
un eccesso di neutroni
• ciò si interpreta con la
necessità di avere più
neutroni al fine di
permettere la stabilità del
nucleo, controllando la
repulsione fra i protoni
Numero di neutroni N
140
120
100
80
60
40
20
0
0
20
40
60
80
100
Numero atomico Z
Difetto di massa
La differenza
∆ ( A, Z ) = [Z ⋅ m p + ( A − Z ) ⋅ mn ] − m A,Z
si chiama difetto di massa e può essere interpretata come l’energia di
legame del nucleo, cioè l’energia che deve essere fornita al nucleo per
liberare i nucleoni componenti (ovvero ancora, il “guadagno” di energia
che rende allettante per i nucleoni lo stare insieme).
Se si divide il difetto di massa per il numero di nucleoni A si ottiene
l’energia di legame media per nucleone, che ricordando che 1 uma
corrisponde a 931.5 MeV, può essere espressa in MeV. Risulta che, in
media fra tutti i nuclei stabili
∆ ( A, Z )
≈ 8 MeV
A
11
∆ ( A, Z ) = [Z ⋅ m p + ( A − Z ) ⋅ mn ] − m A,Z
Esempio:
(ricordare 1 uma = 931.48 MeV)
16O
massa nucleare tabulata = 15.995 uma
Z=8
A = 16
N=A-Z=8
mp= 938.256 MeV
mn = 939.550 MeV
ma,z = 15.995 x 931.48 = 14899.02 MeV
Z x mp= 7506.05 MeV
(A-Z) x mn = 7516.40 MeV
∆(A,Z) = [7506.05 + 7516.40] - 14899.02 = 127.59 MeV
energia media di legame = ∆(A,Z) / A = 123.43 / 16 = 7.7 MeV
Energia di legame per nucleone
10
Energia di legame (MeV)
9
8
7
6
5
4
3
2
1
0
0
50
100
150
200
Numero atomico A
• l’energia media di legame per nucleone risulta di circa 8 MeV
• per estrarre un nucleone occorre quindi disporre di questa elevata energia
12
Dimensioni del nucleo
Le dimensioni del nucleo atomico possono essere stimate sulla base di
esperimenti di deflessione di particelle, come quelli di Rutherford e
risultano dell’ordine di 10-13 cm
Rapporto raggio atomo / raggio nucleo = 105
Esempio sugli ordini di grandezza:
se il nucleo di un atomo fosse una palla di 1 metro di raggio posta al
centro di Piazza Maggiore a Bologna, gli elettroni si troverebbero ad
orbitare per Firenze !!!
102 cm
studente
101 cm
coniglietto
100 cm
coccinella
10-1 cm
pulce
10-2 cm
ameba
10-3 cm
globulo rosso
10-4 cm
batteri
10-5 cm
virus
10-6 cm
molecola gigante
10-7 cm
molecola grande
10-8 cm
atomo
13
FINE PRESENTAZIONE
14