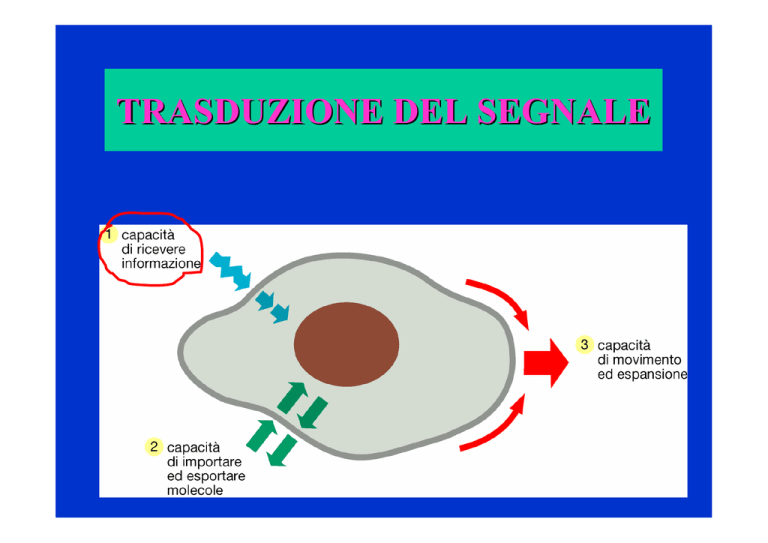
TRASDUZIONE DEL SEGNALE
TRASDUZIONE DEL SEGNALE
• Specificità (specificità riconoscimento)
• Amplificazione e diversificazione della
risposta (cascata enzimatica)
• Integrazione tra segnali
• Spegnimento del segnale
Schema generale di un sistema di segnalazione
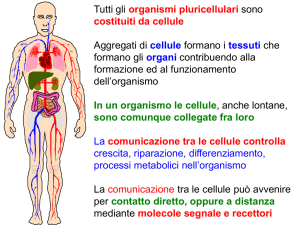
• Le molecole segnale sono di
natura chimica e dimensioni
diverse: proteine, nucleotidi,
amminoacidi, steroidi,
retinoidi, gas.
• I recettori possono essere di
membrana o intracellulari
• Il recettore deve avere un’alta
affinità e specificità per il
segnale; Kd 10-8-10 M
• Il recettore deve inattivarsi
rapidamente
• Il segnale all’interno della
cellula deve amplificarsi e
diversificarsi
Cellule diverse
rispondono allo
stesso segnale in
modo differente
Bevan, P. J Cell Sci 2001;114:1429-1430
Integrazione del segnale
•Ciascuna
Ciascuna cellula ha un set
di recettori per rispondere
ad un corrispondente set di
segnali.
•La
La combinazione di questi
segnali determina il destino
della cellula
TIPI DI SEGNALAZIONE
Segnale: Ormoni steroidei e tiroidei
Vit D; acido retinoico
Diversificazione
HRE: elemento di
risposta ormonale,
Amplificazione e spegnimento
Recettore per gli ormoni steroidei
Inibitori recettore degli
estrogeni
Segnale: NO
NO Sintasi
Attivazione della
Guanilico ciclasi
NO Sintasi
Adenilato (guanilato) Ciclasi
• I percorsi di
trasduzione del segnale
devono essere
attivati/disattivati con
estrema precisione.
• Sono necessari
interruttori molecolari.
• I due stati
conformazionali sono
riconosciuti da proteine
bersaglio
completamente
differenti.
• Le variazioni
conformazionali sono
indotte da variazioni
della fosforilazione
della proteina o di un
nucleotide (GTP, ATP).
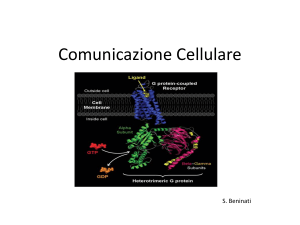
Recettore 7TM
• Recettore accoppiati alle
proteine G (GPCR) 7 a
eliche transmembrana
• Trasducono segnali di vario
tipo: proteine, AA, lipidi,
luce, odori,
• Recettori più numerosi
negli eucarioti (1-5% dei
geni totali)
• Modelli: recettore βadrenergico e la rodopsina
• Sono bersaglio di agenti
terapeutici e droghe
Recettore 7TM
Agonisti ed antagonisti del recettore β
adrenergico
Recettore e G-protein
Proteina G eterotrimerica
• Interruttori molecolari in
moltissimi processi biologici:
trasduzione, traffico
vescicolare, sintesi proteica
• Sono legate alla membrana da
ancore lipidiche
• Attività intrinseca GTPasica
molto bassa stimolata da altre
proteine, ad esempio il bersaglio
• L’idrolisi GTP induce cambio
conformazionale irreversibile
fino alla sostituzione del
nucleotide.
• Sensibili allo stato energetico
della cellula
Proteina G eterotrimerica
• La subunità α lega il nucleotide e si lega a GPCR in
presenza di βγ.
• Le subunità βγ si legano ad α GDP, ma non ad α GTP
• Le subunità βγ garantiscono che il recettore
catalizzi la sostituzione GDP con GTP e non
viceversa
Gs
Adenilico ciclasi
Fosfodiesterasi inibita da caffeina
e teofillina
PKA
La PKA fosforila specifiche
ser/thr in proteine bersaglio
attivandole.
Adrenalina- glucagone
AMPLIFICAZIONE
CRE: cAMP response element
Spegnimento del segnale
Spegnimento del segnale
•Adattamento: una
prolungata esposizione
allo stimolo diminuisce la
risposta della cellula.
•Endocitosi del recettore.
•Fosfodiesterasi
•Attivazione della ser/thr
fosfoproteine fosfatasi
Inibizione delle G-protein
G inibitorie (rec α-adrenergici, somatostatina)
Altri secondi messaggeri attivati da Gprotein
Gq: rec α-adrenergici, vasopressina, acetil colina
IP3 apre il canale
per il Ca.
[Ca 2+] aumenta
100 volte.
Il Ca rientra con
la CaATPasi
Ca 2+
Calmodulina
Calmodulina
• Recettore intracellulare
ubiquitario del Ca2+.
• Lega 4 ioni Ca che inducono un
cambio conformazionale.
• Una volta attivata si lega a
proteine bersaglio subendo un
ulteriore cambio
conformazionale.
•
•
•
•
CaM-chinasi
Troponina
PKC
Subunità della
glicogenofosforilasi chinasi
muscolare
PKC
• L’aumento del Ca2+ citosolico fa traslocare
la PKC dal citosol alla membrana.
• DAG e fosfolipidi negativi attivano la PKC
• PKC fosforila Ser/Thr in proteine bersaglio.
• Alcuni cancerogeni lipidici (esteri del
forbolo) attivano la PKC in assenza di
segnale.
Segnali olfattivi
Segnali gustativi
Molecole gustative
Stereospecificità
Bastoncelli e visione
Recettori legati ad enzimi
•rispondono a fattori di crescita, mediatori locali (10-9-10-11M)
che promuovono crescita e differenziamento → risposta lenta
•Possono determinare anche risposte rapide (modificazioni del
citosol, e/o metaboliche)
•Anomalie nella segnalazione attraverso questi recettori
possono avere un ruolo nella trasformazione tumorale
Recettori legati ad enzimi
• I recettori sono proteine transmembrana monopasso.
• Sono dimeri/oligomeri oppure dimerizzano in presenza del segnale.
• Il dominio citoplasmatico ha una attività tirosinchinasi intrinseca o è
associato ad una tirosinchinasi.
• La fosforilazione del recettore fornisce siti di riconoscimento per
proteine adattatrici che propagano il segnale
Metabolismo e
trasporto glucosio
crescita cellulare e
differenziazione
Metabolismo energetico
crescita cellulare e
differenziazione
Recettore
Insulina
Attivazione del recettore dell’insulina
•Il recettore autofosforila 3 tirosine
•Una tirosina è un sito di ancoraggio per IRS-1 che
viene fosforilato formando multipli siti di docking
•Le tirosine fosforilate sono riconosciute da proteine
che contengono il dominio SH2.
Dominio SH2: Protein chinasi Src
•La chinasi Src riconosce
il bersaglio attraverso il
dominio SH2 e SH3.
•cSrc normale, protooncogene, regolata
V-src oncogene sempre
attiva
Oncogeni
• I virus che inducono tumori trasportano oncogeni,
simili a geni (proto-oncogeni) presenti nelle cellule
animali bersaglio.
• Il virus del sarcoma di Rous ha v-src, omologo a csrc
• Entrambe codificano per una tirosin chinasi: c-scr
controllata, v-src incontrollata.
• Altri oncogeni: v-Ras, v-erbB, v-fos, v-jun.
• Gli oncogeni non sono necessariamente di origine
virale, ma piuttosto derivano da proto-oncogeni
mutati
• Perché una cellula subisca una trasformazione
maligna sono necessari più di un evento oncogenico
IRS-1 e PIP3
•PIP3 chinasi
attiva anche una
PLC
•PIP3 inattivato
da PTEN
•Mutazioni in
PTEN in molti
tumori
Akt o PKB
IRS-1 e GRB-2/SOS
GRB-2/SOS: proteina adattatrice
che accoppia il recettore attivato
alla proteina G Ras
Proteina G monomerica Ras
• Legata alla membrana da
ancora lipidiche
• Lo scambio GDP/GTP è
determinato dal legame con
una proteina attivatrice
GEF (Sos)
• Attività intrinseca
GTPasica molto bassa
stimolata da proteine GAP
• Attiva una cascata di
Ser/Thr fosforilazione
• Mutazioni in Ras in molti
tumori
Raf
Mek
Erk