Ippologia, Anno 10, n. 1, Marzo 1999
MIELOENCEFALOPATIA EQUINA
DA HERPESVIRUS*
MARK T. DONALDSON, VMD,
CORINNE R. SWEENEY, DVM,
University of Pennsylvania
Riassunto
Mieloencefalopatia è il termine più adatto per descrivere la malattia del sistema nervoso degli equini causata dall’herpesvirus equino 1 (EHV-1), poiché la sindrome clinica deriva da un danno ischemico del sistema nervoso centrale
secondario a vasculite (piuttosto che ad un’infezione virale diretta dei neuroni). La malattia determina tipicamente l’insorgenza acuta di una paresi degli arti posteriori. Possono essere interessati anche gli anteriori ed i nervi cranici. Nella
patogenesi della mieloencefalopatia equina da herpesvirus sono coinvolte sia l’infezione virale dell’endotelio del sistema
nervoso centrale che la risposta immunitaria a questa infezione. Anche se possono essere colpiti cavalli di qualsiasi età
o sesso, i dati disponibili indicano che le fattrici gravide o in lattazione possono essere più sensibili oppure manifestare
la malattia in modo più grave. La diagnosi si può basare sulle caratteristiche lesioni istopatologiche e sulle indagini
immunoistochimiche. L’herpesvirus equino 1 può essere isolato da tamponi nasali, sangue intero e, occasionalmente,
sistema nervoso centrale. Il trattamento consiste nella somministrazione di corticosteroidi, farmaci antiinfiammatori
non steroidei e dimetilsulfossido e nella terapia delle complicazioni derivanti dal decubito o dall’atonia vescicale. La prognosi dipende dalla gravità dei segni clinici. Nel presente lavoro vengono illustrati, l’anamnesi, i segni clinici, l’epizootologia, la fisiopatologia, le lesioni macro- e microscopiche, la diagnosi, il trattamento e la prognosi della malattia.
Vengono anche prese in considerazione le misure da adottare per il controllo della diffusione della mieloencefalopatia
equina da herpesvirus durante le epizoozie e le tecniche utilizzabili in futuro per lo studio delle caratteristiche epizootologiche della malattia.
Summary
Myeloencephalopathy is the most suitable term for describing disease of the equine neurologic system caused by equine herpesvirus 1 because the clinical syndrome result from ischemic damage to the central nervous system secondary to
vasculitis (rather than from direct viral infection of neurons). Equine herpes myeloencephalopathy typically causes an
acute onset of hindlimb paresis. The forelimbs and cranial nerves may also be affected. Both viral infection of the central
nervous system endothelium and immune response to this infection are involved in the pathogenesis of equine herpes
myeloencephalopathy. Although horses of any age or gender can be affected by equine herpes myeloencephalopathy, evidence suggests that pregnant or lactating mares may be more susceptible or more severely affected. A diagnosis can be
based on characteristic histopathologic lesions and immunohistochemistry. Equine herpesvirus 1 can be isolated from
nasal swabs, whole blood, and (occasionally) the central nervous system. Treatment involves corticosteroids, nonsteroidal antiinflammatory drugs, dimethyl sulfoxide, and management of complications of recumbency or bladder atony. The
prognosis is related to the severity of the clinical signs. This article discusses the history and clinical signs, epizootiology, pathophysiology, gross and histopathologic lesions, diagnosis, treatment, and prognosis of equine herpes myeloencephalopathy. Considerations is given to measures that should be taken to control the spread of equine herpes myeloencephalopathy during an outbreak as well as to techniques that may be used in future investigations into the epizootiology
of the disease.
* Da “The Compendium on Continuing Education for the Practicing Veterinarian” Vol. 19, N. 7, Luglio 1997. Con l’autorizzazione dell’Editore.
5
6
Mieloencefalopatia equina da herpesvirus
Degli 8 herpesvirus noti negli equidi, l’herpesvirus equino (EHV)-1 e l’EHV-4 sono quelli che hanno ricevuto la
maggiore attenzione a causa delle perdite economiche
associate ad aborto, affezioni neonatali, paresi e malattie
respiratorie. La patogenicità di EHV-2 ed EHV-5 (citomegalovirus degli equini) non è stata stabilita, nonostante
l’ampia diffusione della presenza di questi virus nella
popolazione equina. EHV-3 determina la comparsa di
lesioni vescicolari (indicate col nome di esantema coitale)
nelle fattrici e negli stalloni. EHV-4 è più comunemente
associato alle affezioni respiratorie di EHV-1, mentre provoca raramente paresi2 ed aborto.3
La maggior parte dei cavalli contrae l’infezione da
EHV-1 ed EHV-4 durante i primi anni di vita. Come per
gli altri herpesvirus, si possono avere delle infezioni latenti. 1,4 EHV-6 ed EHV-8 infettano l’asino e sono causa,
rispettivamente, di esantema coitale e rinite.1 Anche EHV7 infetta l’asino, ma non è stato associato ad episodi noti
di malattia.1
Le affezioni del sistema nervoso degli equini causate da
EHV-1 sono state descritte in molti modi, come mieloencefalite necrotizzante5 e meningoencefalomielite.6 È però
preferibile il termine di mieloencefalopatia, poiché la sindrome clinica è dovuta al danno ischemico del sistema
nervoso centrale (SNC) secondario a vasculite piuttosto
che all’infezione virale diretta dei neuroni.7
In uno studio retrospettivo sulle malattie del SNC del
cavallo, la mieloencefalopatia da herpesvirus degli equini è
risultata al secondo posto in ordine di frequenza fra le
cause di encefalite e mielite.8 Saxegaard è stato il primo ad
isolare EHV-1 dal SNC di un cavallo colpito; successivamente, la mieloencefalopatia equina da herpesvirus è stata
segnalata in tutto il mondo.9-16 Nel presente lavoro vengono descritti i segni clinici, la fisiopatologia, la diagnosi, il
trattamento e la prevenzione della malattia.
ANAMNESI E SEGNI CLINICI
La malattia neurologica sostenuta da EHV-1 può colpire un solo animale, oppure più soggetti di un allevamento.
È necessario effettuare un’accurata raccolta dell’anamnesi
- i cavalli con mieloencefalopatia da herpesvirus equino
sono frequentemente venuti a contatto con animali della
stessa specie che mostravano i segni dell’infezione da
EHV-1 quali aborto, atassia e malattie respiratorie. Un
soggetto recentemente introdotto nell’allevamento può
essere la fonte dell’infezione. La gamma dei segni clinici
riscontrati negli allevamenti con infezione documentata da
EHV-1 comprende febbre, anoressia, scolo nasale, tosse,
edema del tratto distale degli arti e dello scroto, perdita
della libido, aborto, diarrea, colica e lesioni oculari.14,17-22
Anche se la febbre è un riscontro anamnestico comune nei
cavalli colpiti da mieloencefalopatia da herpesvirus equino, al momento dell’insorgenza della sindrome neurologica la maggior parte dei cavalli risulta afebbrile.16, 17, 23
I soggetti con mieloencefalopatia da herpesvirus equino
mostrano tipicamente l’insorgenza acuta di paresi ed atassia; gli arti pelvici sono colpiti più gravemente di quelli
toracici (Fig. 1). Questi deficit neurologici in genere si stabilizzano in 24-48 ore e migliorano lentamente nelle settimane o mesi successivi. I segni clinici vanno dalla lieve
FIGURA 1 - Un cavallo con paresi degli arti posteriori tipica della mieloencefalopatia equina da herpes virus. (Per cortese concessione di
Eleanor M. Green, DVM, College of Veterinary Medicine, University of
Tennessee).
atassia al decubito e morte. La maggior parte degli autori
descrive una paresi simmetrica, ma si possono osservare
anche deficit asimmetrici.23, 24 In una rassegna, sono stati
riscontrati deficit dei nervi cranici nel 17% dei casi. 25
Cecità, testa piegata, debolezza della lingua e nistagmo
sono stati associati ai segni tipici dell’atassia e della debolezza.19,25-28
Le lesioni oculari associate all’infezione da EHV-1 sono
rappresentate da scolo oculare sieroso, midriasi, ipopion,
uveite, corioretinite con distacco retinico ed emorragia,
neurite ottica e cecità.14,17-20, 26, 27
È comune l’atonia vescicale, mentre la rottura dell’organo viene segnalata raramente.28 Gli animali colpiti possono
presentare uno stillicidio di urina e la palpazione addominale per via rettale può permettere di apprezzare una
vescica distesa. Si riscontrano anche paresi dello sfintere
anale, ritenzione fecale, deficit sensoriali perineali e diminuzione del tono muscolare coccigeo. 29,30
EPIZOOTOLOGIA
EHV-1 ed EHV-4 sono ubiquitari nella popolazione
equina e la maggior parte dei cavalli contrae l’infezione
durante il primo anno di vita.1 Dopo l’infezione iniziale,
l’herpesvirus può restare in uno stato di dormienza o inat-
Ippologia, Anno 10, n. 1, Marzo 1999
tività (latenza). Queste infezioni latenti consentono al
virus di persistere anche all’interno di allevamenti che non
hanno scambi con l’esterno. I risultati di una recente indagine su animali abbattuti hanno indicato che il virus infettante era presente nel 60% dei cavalli e che il DNA dell’herpesvirus poteva essere rilevato mediante reazione a
catena della polimerasi (PCR) nell’87,5% dei cavalli.3
Anche se possono essere colpiti animali di qualsiasi età
o sesso, le segnalazioni di episodi nelle aziende da riproduzione e le infezioni sperimentali suggeriscono che le fattrici gravide o in lattazione siano più sensibili o vengano
colpite in modo più grave.14, 15, 24 I risultati degli studi
retrospettivi indicano un aumento dell’incidenza della
malattia durante i mesi invernali e primaverili.25 Il quadro
neurologico attribuito ad EHV-1 è stato segnalato su scala
mondiale.9-16 La morbilità è variabile, ma la mortalità è
solitamente bassa. La mieloencefalopatia da herpesvirus
degli equini si può presentare sotto forma di casi sporadici
oppure colpire la maggior parte dei soggetti di un allevamento. Oltre ai cavalli, la forma neurologica dell’infezione
da EHV-1 si può riscontrare in lama, alpaca e zebre.26, 31, 32
FISIOPATOLOGIA
Dopo aver infettato l’epitelio respiratorio o intestinale,
EHV-1 può causare una viremia celluloassociata. I leucociti infetti, molto probabilmente rappresentati da linfociti T,
trasmettono quindi il virus all’endotelio del SNC o al
feto;3,33 i segni della paresi compaiono dopo circa 7 giorni
dall’infezione sperimentale. 34 Come altri herpesvirus,
EHV-1 può sfuggire al sistema immunitario dell’ospite e
dare origine ad un’infezione latente. Le sedi sospette di
latenza sono rappresentate dal ganglio del trigemino e dal
tessuto linfoide.4, 35-37
Per cercare di identificare un ceppo di EHV-1 associato
alla mieloencefalopatia da herpesvirus equino è stata utilizzata la tecnica del fingerprinting del DNA mediante
restrizione con endonucleasi. Il confronto dei ceppi del
virus isolati da cavalli colpiti dalla sindrome neurologica o
da quella abortigena non hanno evidenziato differenze che
giustifichino la classificazione di un ceppo separato; tuttavia, esistevano marcate analogie fra due ceppi isolati da
epizoozie di mieloencefalopatia da herpesvirus equino
geograficamente separate.38-40 Utilizzando l’analisi enzimatica con restrizione estesa, Studdert et al. hanno differenziato i ceppi di EHV-1 isolati da cavalli colpiti da aborto o
malattia neurologica nella stessa epizoozia.41
Alcuni herpesvirus equini sembrano possedere un tropismo per l’endotelio del SNC. Il virus è stato rilevato
mediante immunofluorescenza nell’endotelio capillare del
sistema nervoso centrale associato a trombosi ed alterazioni ischemiche secondarie.7 Utilizzando un ceppo di EHV1 isolato da un cavallo con mieloencefalopatia da herpesvirus equino, Patel et al. hanno dimostrato l’epiteliotropismo e l’endoteliotropismo di questo stesso ceppo nella
mucosa nasale, nel piccolo intestino, nei polmoni e nel
SNC di puledri infettati sperimentalmente. I segni clinici
erano rappresentati da paresi degli arti posteriori e diarrea.21 Per dimostrare un analogo endoteliotropismo in
un’epizoozia naturale di mieloencefalopatia equina in
Inghilterra è stata utilizzata la colorazione all’immunope-
7
Lesioni da herpesvirus negli equini
•
•
•
•
•
•
Vasculite del sistema nervoso centrale
• Emorragia
• Trombosi
• Degenerazione neuronale ischemica
secondaria
Ganglioneurite del trigemino
Petecchie della mucosa nasale
Emorragia del midollo spinale e cistite
Vasculite dell’endometrio, del tratto respiratorio
e dell’uvea
Cistite
rossidasi indiretta.42 In un’epizoozia della malattia è stato
implicato un vaccino a virus vivo modificato non più
disponibile, suggerendo ulteriormente il tropismo di alcuni ceppi di EHV-1 per il SNC.43
L’interazione fra EHV-1 ed il sistema immunitario dell’ospite è importante per la patogenesi della mieloencefalopatia equina da herpesvirus. Anche se sperimentalmente
è stata dimostrata la presenza di immunocomplessi circolanti, si sospetta che questo riscontro abbia un’importanza
secondaria, poiché le lesioni erano evidenti solo nelle aree
associate all’infezione delle cellule endoteliali; non era presente una forma generalizzata da immunocomplessi. 7
Ulteriori prove del coinvolgimento del sistema immunitario nella patogenesi della mieloencefalopatia equina da
herpesvirus sono state fornite dall’identificazione di un
aumento delle concentrazioni del complemento senza consumo dello stesso in pony che hanno sviluppato la paresi
indotta da EHV-1 rispetto a pony che non avevano presentato la paresi dopo l’infezione da EHV-1.44 La presenza
di anticorpi anti-EHV-4 prima dell’infezione da EHV-1
può essere importante nel determinismo degli effetti della
seconda infezione. È stato ipotizzato che i complessi antigene-anticorpo che si formano fra l’antigene di EHV-1 e
gli anticorpi di EHV-4 siano inefficaci per l’inattivazione
del complemento.44
L’infezione di puledri specific-pathogen-free (EHV-free)
con un ceppo di EHV-1 noto per essere associato alla
paresi non è riuscita a determinare una malattia neurologica.45 Al contrario, la sindrome clinica della mieloencefalopatia equina da herpesvirus è stata riprodotta sperimentalmente mediante inoculazione sottocutanea o intranasale di
cavalli e pony con ceppi di EHV-1 associati a malattia neurologica.21, 27, 34, 44-48 Nella maggior parte dei casi, questi
animali erano stati esposti ad EHV-1.21, 27, 34,44-48 Questa
discrepanza nella risposta all’infezione sperimentale
rafforza ulteriormente la teoria secondo la quale la precedente esposizione agli herpesvirus equini potrebbe essere
importante per lo sviluppo della sindrome neurologica.
Il virus dell’herpes simplex dell’uomo è una delle cause
più comuni di encefalite virale sporadica nella specie
umana. Inoltre, è stata segnalata una disfunzione autonoma, (comprendente ritenzione urinaria, costipazione e
impotenza). Anche se di solito nell’arco di alcune settimane si ha una graduale risoluzione dei segni clinici, la debolezza degli arti inferiori può persistere per mesi.49
LESIONI MACRO- E MICROSCOPICHE
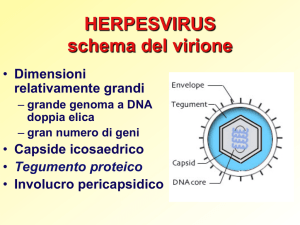
L’herpesvirus equino 1 provoca una caratteristica vasculite nel SNC, interessando principalmente le arterie e le
vene di piccolo calibro della sostanza bianca del midollo
spinale e la sostanza grigia e bianca dell’encefalo.27 La
vasculite porta ad emorragie, trombosi e degenerazione
neuronale ischemica secondaria.50 Si riscontra comunemente una ganglioneurite del trigemino. 5,6,27 Le lesioni
macroscopiche sono rappresentate da petecchie della
mucosa nasale ed emorragie del midollo spinale e cistite.14
La vasculite si osserva anche nell’endometrio, nel tratto
respiratorio e nell’uvea5, 6, 27, 50 (vedi lesioni da herpesvirus
equino).
DIAGNOSI
La completa valutazione clinica di un paziente con
sospetta mieloencefalopatia da herpesvirus equino deve
comprendere la palpazione della vescica per via rettale,
poiché la disfunzione urinaria può essere poco evidente.
La disuria è probabilmente causata da una combinazione
di disfunzioni da motoneurone inferiore e superiore che
esitano nella perdita del tono del muscolo detrusore e del
controllo volontario della minzione. Di conseguenza, i
cavalli colpiti manifestano un’incontinenza da eccessivo
riempimento vescicale o risultano incapaci di eliminare
l’urina. Questi animali possono compiere frequenti tentativi di urinare, senza però emettere urina o quasi. La palpazione addominale per via rettale evidenzia una distensione
vescicale moderata o grave.51
L’infezione da EHV-1 può esitare in lesioni oculari
quali ipopion, uveite, corioretinite ed emorragie retiniche.
Nei casi sospetti di mieloencefalopatia equina da herpesvirus è quindi necessario effettuare un esame completo
dell’occhio.
Nel liquor si riscontra una dissociazione albuminocitologica, cioè un aumento sproporzionato del contenuto di
proteine rispetto a quello di cellule nucleate. Nei cavalli
che presentano i deficit neurologici caratteristici e la dissociazione albuminocitologica, è giustificato il sospetto diagnostico di mieloencefalopatia da herpesvirus degli equini.
Se possibile, il liquor va prelevato dallo spazio lombosacrale; tuttavia, riscontri analoghi sono prevedibili anche in
caso di prelievo dallo spazio atlantooccipitale. Anche se
l’incremento dei livelli di proteine nel liquor può essere
impressionante (superiore a 600 mg/dl), la presenza di
livelli proteici normali non esclude la malattia. L’aumento
delle concentrazioni proteiche nel liquor non è necessariamente correlato alla gravità dei segni clinici o all’esito della
malattia.
In rari casi, nel liquido cefalorachidiano si possono
riscontrare solo lievi anomalie nelle fasi iniziali del decorso
della malattia. Se si sospetta la mieloencefalopatia equina
da herpesvirus, ma negli aspirati iniziali non si evidenzia
una dissociazione albuminocitologica del liquor, per dimostrare l’alterazione può essere utile effettuare successivamente nuovi prelievi. Il conteggio delle cellule nucleate è
spesso normale. Si possono riscontrare lievi aumenti della
loro concentrazione (inferiori a 15 cellule/µl), e l’esame
citologico permette di rilevare principalmente elementi
mononucleati. Altri comuni riscontri all’analisi del liquor
sono rappresentati da colorazione gialla, o xantocromia
(Fig. 2) causata dalla degradazione degli eritrociti nel
liquor.
Blythe et al. hanno studiato la presenza di anticorpi
anti-EHV-1 nel liquor, senza riscontrarne in cavalli vaccinati clinicamente normali; invece, in un soggetto con trauma del SNC era presente un titolo basso, probabilmente
causato da un’emorragia nel fluido spinale.52 Per determinare l’importanza del riscontro degli anticorpi anti-EHV
nel liquor ai fini della diagnosi della mieloencefalopatia
equina da herpesvirus saranno necessari ulteriori studi.
I risultati dell’immunoblot sul liquor per la diagnosi
della mieloencefalite protozoaria equina (EPM) in un
cavallo con mieloencefalopatia da herpesvirus vanno interpretati con cautela. Poiché in caso di infezione con EHV-1
l’integrità della barriera ematoencefalica può essere compromessa, si possono avere risultati falsi positivi per EPM
dovuti al passaggio nel liquor di anticorpi circolanti.53
Un aumento di 4 volte del titolo degli anticorpi siero-
neutralizzanti (SN) è considerato diagnostico per l’infezione da EHV-1.25 I titoli di questi anticorpi aumentano rapidamente nelle infezioni sperimentali (fra il 5° e l’8° giorno
dopo l’infezione) e in quelle naturali.16, 34
Nei puledri, i titoli anticorpali vanno valutati con cautela; anche i soggetti nei quali era stata accertata una viremia
FIGURA 2 - Liquor xantocromico prelevato da un cavallo con mieloencefalopatia equina da herpesvirus. (Per cortese concessione di Eleanor
M. Green, DVM, College of Veterinary Medicine, University of
Tennessee).
10
Mieloencefalopatia equina da herpesvirus
non sono riusciti ad effettuare la sieroconversione in un
episodio epizootico.18
I test sierologici appropriati sono la fissazione del complemento (CF), la determinazione degli anticorpi SN e il
metodo ELISA. 3, 10, 54, 55 Poiché i titoli SN anti-EHV-1
aumentano rapidamente durante l’infezione naturale, può
essere impossibile dimostrare un loro incremento di 4
volte se il prelievo del campione durante la fase acuta non
viene effettuato immediatamente.55 Dato che il titolo degli
anticorpi CF diminuisce rapidamente dopo l’infezione, un
valore di 1:16 o superiore suggerisce un’infezione recente.55 Le risposte degli anticorpi SN all’infezione naturale
sono maggiori di quelle determinate dalla vaccinazione. Il
riscontro di un unico titolo SN elevato (superiore a 1:256)
suggerisce quindi un’infezione naturale. Secondo l’esperienza degli autori, la determinazione dei titoli SN negli
animali in fase acuta e durante la convalescenza rappresenta il metodo diagnostico più facilmente disponibile, pratico ed economico.
Per circa 12 giorni dopo l’infezione, è possibile effettuare l’isolamento di EHV-1 dai tamponi rinofaringei e dagli
strisci allestiti con il buffy coat dei cavalli infettati.3 Per riuscire ad ottenere un virus vitale, è essenziale che i campioni vengano manipolati correttamente.1 I tamponi rinofaringei devono essere collocati in un appropriato terreno di
trasporto per virus, refrigerati o congelati e trasportati al
laboratorio il più presto possibile.1
Nei cavalli con infezione sperimentale, l’insorgenza
delle manifestazioni neurologiche si ha circa 7 giorni dopo
l’infezione.34 L’isolamento del virus da sangue intero è possibile per periodi più lunghi dai puledri.18 Durante gli episodi epizootici di mieloencefalopatia equina da herpesvirus, molti cavalli che non mostrano segni di malattia possono presentare prove sierologiche di infezione. Di conseguenza, tutti gli equini che potrebbero essere stati esposti
agli scoli nasali o alle secrezioni respiratorie in aereosol di
un cavallo infetto sono utili per dimostrare l’infezione da
EHV-1 in un allevamento.18
La PCR potrà presto costituire un metodo sensibile,
rapido ed economico per la diagnosi ante-mortem dell’infezione da EHV-1 ed EHV-4.56, 57 Anche se gli sforzi dei
ricercatori sono stati focalizzati sulla valutazione mediante
PCR delle secrezioni nasali della malattia respiratoria, l’esame del buffy coat o del liquor potrebbe essere utile per la
diagnosi della mieloencefalopatia equina da herpesvirus.
Presso l’ospedale degli autori è stata utilizzata la colorazione con immunoperossidasi del buffy coat e delle secrezioni nasali per la diagnosi rapida ante-mortem, ma si tratta di una tecnica non convalidata. In ambito sperimentale,
è stata anche dimostrata la viremia mediante immunofluorescenza su buffy coat.35
La diagnosi post-mortem può essere formulata in base
al riscontro di vasculite delle arterie e delle vene di piccolo
calibro, emorragie, trombosi e degenerazione neuronale
ischemica secondaria.3, 50 L’isolamento di EHV-1 dal SNC
è incostante, forse a causa degli elevati titoli anticorpali
presenti; di conseguenza, le tecniche immunoistochimiche
risultano molto utili.34
Per la diagnosi dell’infezione da EHV-1 sono stati
impiegati i metodi dell’immunofluorescenza e dell’immunoperossidasi.7,9,12,14,20,42,58 In una segnalazione, la tecnica
immunoperossidasica ha dato esito positivo per l’antigene
di EHV-1 nel SNC di due cavalli sottoposti ad esame
necroscopico; l’immunofluorescenza indiretta non è invece riuscita a dimostrare la presenza dell’antigene negli
stessi due cavalli.58 In un’altra segnalazione, EHV-1 è stato
isolato dal SNC di una fattrice di trottatore standarbred,
ma anche in questo caso l’immunofluorescenza indiretta è
risultata negativa.12 Anche la PCR è utile per la diagnosi
post-mortem, poiché può rilevare la presenza di piccole
quantità di DNA nei virus potenzialmente inattivati.4,35,37
Al momento attuale, non è chiaro quale sia la tecnica diagnostica più utile per l’identificazione della mieloencefalopatia equina da herpesvirus.
Data la differenza di patogenicità di EHV-1 ed EHV-4,
è importante identificare il tipo di virus durante un’epizoozia di malattia respiratoria. Poiché i due virus presentano una reattività antigenica crociata, la sierodiagnosi tipospecifica risulta difficile.1 Si può ricorrere all’isolamento
del virus, che però richiede tempo. Recentemente, per
trattare un’epizoozia di aborto da EHV-1 è stato utilizzato
un test ELISA specifico per gli anticorpi per questo
virus.54 Nel trattamento delle epizoozie della forma neurologica o respiratoria dell’infezione da EHV, la tecnica
ELISA può essere utile per identificare il tipo di virus
responsabile ed i cavalli infetti.
TRATTAMENTO
Dal momento che esistono le prove che la mieloencefalopatia equina da herpesvirus è una forma immunomediata di vasculite, per il trattamento viene spesso raccomandata la somministrazione di corticosteroidi (solitamente,
desametazone alla dose di 0,05-0,25 mg/kg ogni 6-12
ore).25, 29, 59-63 I benefici effetti di questi farmaci in altre
vasculiti (come la porpora emorragica) possono essere
impressionanti. I vantaggi dell’azione antiinfiammatoria
dei corticosteroidi devono essere confrontati con il rischio
di immunosoppressione, infezione prolungata e laminite
che questi farmaci possono indurre. La riattivazione del
virus utilizzando dosi terapeutiche di questi agenti è stata
incostante e per provocare la riattivazione sembrano essere necessarie dosi superiori.64
Dato il naturale decorso della malattia, è difficile valutare
l’efficacia dei corticosteroidi. Secondo l’opinione degli autori, i vantaggi di questa terapia superano i potenziali rischi.
Gli autori hanno trattato cavalli con mieloencefalopatia
equina da herpesvirus con infusione endovenosa di desametazone alla dose di 0,05-0,10 mg/kg ogni 12 ore, seguita da
dosi progressivamente minori per una settimana.
In letteratura veterinaria è stato suggerito l’impiego del
dimetilsulfossido (DMSO) nei cavalli con affezioni neurologiche, ma l’efficacia di questa terapia non è stata convalidata scientificamente. La valutazione del DMSO nel trattamento dei traumi o delle ischemie di SNC sperimentalmente indotti ha portato a risultati incostanti.65. I potenziali vantaggi di questa terapia nei pazienti con mieloencefalopatia equina da herpesvirus sono rappresentati da inibizione dell’aggregazione piastrinica, protezione del tessuto ischemico e dell’endotelio, eliminazione dei radicali
liberi ed attività antiinfiammatoria.66
Nonostante la mancanza di una valutazione critica dell’efficacia del DMSO, gli autori lo includono nel tratta-
Ippologia, Anno 10, n. 1, Marzo 1999
mento dei pazienti con mieloencefalopatia equina da herpesvirus. Per la terapia dell’edema cerebrale nel cavallo, è
stata suggerita la somministrazione endovenosa di questo
agente (1 g/kg diluito in soluzione fisiologica fino ad una
concentrazione del 10%, una volta al giorno per 3 giorni).67 Anche se la dose di DMSO necessaria a determinare
un effetto antiinfiammatorio è sconosciuta, per il trattamento delle condizioni flogistiche sono stati somministrati
anche bassi dosaggi per via endovenosa (200 mg/kg sotto
forma di soluzione al 10% ogni 8 ore).68
I farmaci antiinfiammatori non steroidei sono utili per il
trattamento della vasculite del SNC e dei traumi dei tessuti molli associati al decubito. Dal momento che esiste il
rischio di polmonite, cistite o infezione delle ulcere da
decubito, negli animali che non riescono ad alzarsi e sono
trattati con corticosteroidi può essere indicata la terapia
antibiotica. Nei soggetti disfagici o in decubito è necessario monitorare strettamente l’idratazione e ripristinare i
fluidi perduti mediante infusione endovenosa lenta o servendosi di una sonda rinogastrica. Molti pazienti in decubito continuano a mangiare; i veterinari devono essere
consapevoli delle maggiori esigenze caloriche determinate
dallo stress e dall’infezione sistemica.69
La cosa più importante nel trattamento di un cavallo
con mieloencefalopatia equina da herpesvirus è fornire
all’animale delle buone cure infermieristiche. Poiché la
malattia può essere accompagnata da atonia vescicale, può
essere necessario effettuare due volte al giorno la cateterizzazione urinaria. Occorre agire con una tecnica asettica; se
si utilizza un catetere urinario permanente, è importante
impiegare un sistema chiuso, per evitare le infezioni ascendenti. È utile applicare una pomata a base di vaselina sull’area perineale per prevenire le scottature da urina associate all’incontinenza. Gli animali che non riescono ad
alzarsi devono essere tenuti in decubito sternale il più a
lungo possibile, facendo loro cambiare posizione più volte
al giorno. La capacità di un cavallo di tollerare il decubito
dipende dal suo temperamento. Risulta utile anche l’impiego di una struttura di sostegno soprattutto se, una volta
in piedi, l’animale è in grado di sostenere il proprio peso.
Si deve prendere il considerazione il trattamento dei cavalli in decubito al pascolo nell’azienda di origine.18
Per il trattamento della encefalite virale da herpes simplex (HSV) è stato utilizzato un agente antivirale, l’aciclovir. Quest’ultimo è scarsamente tossico nell’uomo; la complicazione più comune è una disfunzione renale transitoria
associata alla rapida somministrazione endovenosa in soggetti scarsamente idratati. Le concentrazioni dell’aciclovir
nel liquor sono approssimativamente 1/3 o 1/2 di quelle sieriche; di conseguenza, per il trattamento dell’encefalite da
HSV nell’uomo si utilizzano dosaggi più elevati (10
mg/kg) per infusione nell’arco di 1 ora ogni 8 ore.70
Le preparazioni per uso endovenoso possono essere
troppo costose per l’impiego nel cavallo, ma si trovano in
commercio delle formulazioni per uso orale. L’aciclovir
viene somministrato per os alla dose di 10 mg/kg cinque
volte al giorno per il trattamento dell’herpes zooster oftalmico nell’uomo70 e alla dose di 40 mg/kg ogni 6 ore per la
terapia dell’infezione da herpes virus felino.71 Poiché il farmaco viene scarsamente assorbito dopo la somministrazione per via orale e le concentrazioni nel liquor sono più
basse di quelle sieriche, per il trattamento della mieloence-
11
falopatia equina da herpesvirus possono essere necessarie
dosi elevate. Anche se la tossicità e la farmacocinetica dell’aciclovir nel cavallo non sono state stabilite, il farmaco è
stato somministrato per os alla dose di 10 mg/kg cinque
volte al giorno per 10 giorni senza riscontrare evidenti
effetti indesiderati.a
PROGNOSI
La prognosi nei cavalli che mostrano segni di mieloencefalopatia equina da herpesvirus dipende dalla gravità dei
deficit neurologici. In una segnalazione, 3 su 4 fattrici in
decubito non sopravvissero, mentre tutti e 9 i cavalli colpiti in modo lieve o moderato presentarono una guarigione
parziale o completa. 18 Little e Thorsen hanno riferito
un’indagine sul campo su 14 casi sospetti (ma non confermati) di mieloencefalopatia degli equini da herpesvirus in
cui 9 cavalli migliorarono entro una settimana e 12
mostrarono un completo recupero entro un mese.5 In
generale, nei cavalli colpiti che restano in stazione o possono alzarsi con un certo aiuto la prognosi relativa alla
sopravvivenza è buona. Poiché la guarigione può avvenire
nell’arco di settimane o mesi, non si deve ricorrere prematuramente all’eutanasia.
PREVENZIONE
I vaccini attualmente disponibili contro l’infezione da
EHV non vengono indicati per la protezione dalla forma
neurologica della malattia. I risultati di uno studio condotto su pochi animali, tuttavia, suggeriscono che la vaccinazione con un prodotto inattivato riduce la frequenza della
paresi dopo infezione sperimentale intranasale con EHV1.46 Sono state segnalate epizoozie di malattia in animali
vaccinati.28
La vaccinazione anti-EHV diminuisce la gravità e la
durata della malattia respiratoria. Anche se i cavalli vaccinati sono ancora infetti, l’eliminazione nasale del virus
risulta diminuita e la viremia può essere meno probabile.1
La vaccinazione dei cavalli colpiti non è consigliata, a
causa della natura immunomediata della mieloencefalopatia equina da herpesvirus. La razionalità della vaccinazione
dei cavalli non esposti durante un’epizoozia è discutibile.
La vaccinazione può prevenire la viremia e ridurre il
rischio di sviluppo della sindrome neurologica; tuttavia, è
anche possibile che aumenti le concentrazioni anticorpali
o che una precedente infezione da EHV-1 o EHV-4 possa
avere un ruolo nella patogenesi della mieloencefalopatia
equina da herpesvirus.7 Non sono stati segnalati casi di
malattia neurologica indotta da EHV-1 associati ai vaccini
attualmente disponibili.
Le misure di controllo dell’infezione da EHV indicate
per i casi di aborto si applicano anche alla prevenzione
delle mieloencefalopatia equina da herpesvirus.72 Oltre
alla vaccinazione, le pratiche di gestione aziendale impor-
a
Madigan J.E.: Comunicazione personale, School of Veterinary
Medicine, University of California , Davis, CA, 1997.
12
Mieloencefalopatia equina da herpesvirus
tanti per la profilassi dell’infezione sono rappresentate da
riduzione dello stress, segregazione degli animali in base
all’età e quarantena per i soggetti di nuova introduzione.
Le epizoozie di mieloencefalopatia equina da herpesvirus
sono spesso attribuibili ad una fattrice che ha abortito o
all’introduzione di un nuovo cavallo nell’allevamento. Il
virus può essere eliminato nelle secrezioni nasali per almeno due settimane dopo l’infezione.3 Si raccomanda la pulizia delle strutture con iodofori o disinfettanti fenolici.
Per almeno 3 settimane dall’identificazione dell’ultimo
caso di malattia nessun cavallo deve entrare o uscire dall’azienda. Alcune epizoozie possono durare anche 3 mesi.18 La
valutazione sierologica di tutti gli animali dell’allevamento
permette di identificare quelli con infezione subclinica.18
Durante una sospetta epizoozia di mieloencefalopatia equina da herpesvirus, i cavalli devono essere tenuti in segregazione negli stessi gruppi dell’azienda. Poiché il virus viene
eliminato attraverso le secrezioni nasali, gli equini ospedalizzati per una mieloencefalopatia equina da herpesvirus devono essere tenuti in isolamento per almeno una settimana
dopo l’insorgenza delle manifestazioni neurologiche.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
FUTURE RICERCHE
20.
In futuro, gli studi sull’epizootologia della mieloencefalopatia equina da herpesvirus si serviranno probabilmente
delle tecniche di biologia molecolare per verificare la possibilità di trovare un ceppo neurovirulento di EHV-1. Inoltre,
per sviluppare un vaccino capace di proteggere da questa
malattia sarà necessario conoscere meglio la risposta immunitaria dell’ospite nella patogenesi della mieloencefalopatia
equina da herpesvirus. La prevenzione della malattia verrà
aumentata dall’adozione di adeguate pratiche di gestione
aziendale e dall’uso di tecniche diagnostiche rapide.
21.
22.
23.
24.
25.
26.
27.
Note sugli Autori
I Dr. Donaldson e Sweeney sono affiliati al Department of
Clinical Studies, New Bolton Center, School of Veterinary
Medicine, University of Pennsylvania, Kennett Square,
Pennsylvania. La Dr.ssa Sweeney è Diplomate of the
American College of Veterinary Internal Medicine.
28.
29.
30.
31.
32.
Bibliografia
1.
2.
3.
4.
5.
6.
7.
Ostlund EN: The equine herpesviruses. Vet Clin North Am Equine Pract
9:283-294, 1993.
Meyer H, Thein P, Hübert P: Characterization of two equine herpesvirus
(EHV) isolates associated with neurologic disorders in horses. J Vet Med
B 34:545, 1987.
Allen GP, Bryans JT: Molecular epizootiology, pathogenesis and prophylaxis of equine herpesvirus-1 infections. Prog Vet Microbiol Immunol
2:78-144, 1986.
Edington N, Welch HM, Griffiths L: The prevalence of latent equid herpesviruses in the tissues of 40 abattoir horses. Equine Vet J 26:140-142,
1994.
Little PB, Thorsen J: Disseminated necrotizing myeloencephalitis: A herpes-associated neurological disease of horses. Vet Pathol 13:161-171,
1976.
Charlton KM, Mitchell D, Girard A, Corner AH: Meningoencepha-lomyelitis in horses associated with equine herpesvirus 1 infection. Vet Pathol
13:59-68, 1976.
Edington N, Bridges CG, Patel JR: Endothelial cell infection and thrombosis in paralysis caused by equid herpesvirus-1: Equine stroke. Arch
33.
34.
35.
36.
37.
38.
39.
40.
Virol 90:111-124, 1986.
Hamir AN, Moser G, Rupprecht CE: A five-year retrospective study of
equine neurological diseases with special reference to rabies. J Comp
Pathol 106:411-421, 1992.
Wada R, Kanemaru T, Yokota S, et al: Pathological observations on 2
horses of myeloencephalopathy associated with equine herpesvirus 1
(EHV-1) infection. Bull Equine Res Inst 28:21, 1991.
Dinter Z, Klingeborn B: Serological study of an outbreak of paresis due
to equid herpesvirus 1 (EHV 1). Vet Rec 99: 10-12, 1976.
Saxegaard F: Isolation and identification of equine rhinopneumonitis
virus (equine abortion virus) from cases of abortion and paralysis. Nord
Vet Med 18:504-512, 1966.
Thorsen J, Little PB: Isolation of equine herpesvirus type 1 from a horse
with an acute paralytic disease. Can J Comp Med 39:358-359, 1975.
Carroll CL, Westbury HA: Isolation of equine herpesvirus 1 from the
brain of a horse affected with paresis. Aust Vet J 62:345-346, 1985.
Platt H, Singh H, Whitwell KE: Pathological observations on an outbreak
of paralysis in broodmares. Equine Vet J 12:118-126, 1980.
Bitsch V, Dam A: Nervous disturbances in horses in relation to infection
with equine rhinopneumonitis virus. Acta Vet Scand 12:134-136, 1971.
Pursell AR, Sangster LT, Byars TD, et al: Neurologic disease induced by
equine herpesvirus 1. JAVMA 175:473-474, 1979.
Greenwood RES, Simson ARB: Clinical report of a paralytic syndrome
affecting stallions, mares and foals on a Thoroughbred studfarm. Equine
Vet J 12:113-117, 1980.
McCartan CG, Russell MM, Wood JLN, et al: Clinical, serological and
virological characteristics of an outbreak of paresis and neonatal foal
disease due to equine herpesvirus- 1 on a stud farm. Vet Rec 136:7-12,
1995.
Slater JD, Gibson JS, Barnett KC, et al: Chorioretinopathy associated
with neuropathology following infection with equine herpesvirus-1. Vet
Rec 131:237-239, 1992.
Whitwell KE, Blunden AS: Pathological findings in horses dying during
an outbreak of the paralytic form of equid herpesvirus type 1 (EHV-1)
infection. Equine Vet J 24:13-19, 1992.
Patel JR, Edington N, Mumford JA: Variation in cellular tropism between
isolates of equine herpesvirus-1 in foals. Arch Virol 74:41, 1982.
Carman S, Nagy E, Caldwell D, van Dreumel TA: Equine herpesvirus type
1 neurological disease and enterocolitis in mature Standardbred horses.
J Vet Diagn Invest 5:261-265, 1993.
Stumbo JA: A suspected case of equine herpesvirus 1 encephalomyelitis.Aust Vet J 64:350-351, 1987.
de Lahunta A: Veterinary Neuroanatomy and Clinical Neurology.
Philadelphia, WB Saunders Co, 1983, pp 227-233.
Kohn CW, Fenner WR: Equine herpes myeloencephalopathy. Vet Clin
North Am Equine Pract 3:405-419, 1987.
Rebhun WC, Jenkins DH, Riss RC, et al: An epizootic of blindness and
encephalitis associated with a herpesvirus indistinguishable from equine
herpesvirus 1 in a herd of alpacas and llamas. JAVMA 192:953-956,
1988.
Jackson TA, Osburn BI, Cordy DR, Kendrick JW: Equine herpesvirus 1
infection of horses: Studies on the experimentally induced neurologic
disease. Am J Vet Res 8:709-719, 1977.
Thomson GW, McCready R, Sanford E, et al: An outbreak of herpesvirus
myeloencephalitis in vaccinated horses. Can Vet J 20:22-25, 1979.
Kortz G: Equine herpes myeloencephalopathy, in Robinson NE (ed.):
Current Therapy in Equine Medicine. III. Philadelphia, WB Saunders Co,
1992, pp 550-552.
Moyer W, Rooney JR: An epidemic of central nervous system disease in
horses. Pr.oc AAEP 18:307-311, 1972.
House JA, Gregg DA, Lubroth J, et al: Experimental equine herpesvirus-l
infection in llamas (Llama glama). J Vet Diagn Invest 3:137-143, 1991.
Montali RJ, Allen GP, Bryans JT, et al: Equine herpesvirus type I abortion
in an onager and suspected herpesvirus myelitis in a zebra. JAVMA
187:1248-1249, 1985.
Scott JC, Dutta SK, Myrup AC: In vivo harboring of equine herpesvirus-1
in leukocyte populations and subpopulations and their quantitation from
experimentally infected ponies. Am J Vet Res 44:1344-1348, 1983.
Jackson T, Kendrick JW: Paralysis of horses associated with equine herpesvirus 1 infection. JAVMA 158:1351-1357, 1971.
Slater JD, Borchers K, Thackray AM, et al: The trigeminal ganglion is a
location for equine herpesvirus latency and reactivation in the horse. J
Gen Virol 75:2007-2016, 1994.
Slater JD, Borchers K, Field HJ: Equine herpesvirus-1: A neurotropic
alpha herpesvirus. Vet Rec 133:239-240, 1994.
Welch HM, Bridges CG, Lyon AM: Latent equid herpesviruses 1 and 4:
Detection and distinction using the polymerase chain reaction and cocultivation from Iymphoid tissues. J Gen Virol 73:261-268, 1992.
Matsumura T, Yokota S, Imagawa H, et al: Sero- and molecular-epizootiological studies on equine herpesvirus type I (EHV-I) infection among
race horses: An occurrence of respiratory disease with nervous disorders. J Equine Sci 5:59-67, 1994.
Chowdhury Sl, Kubin G, Ludwig H: Equine herpesvirus type 1 (EHV-1)
induced abortions and paralysis in a Lipizzaner stud: A contribution to
the classification of equine herpesviruses. Arch Virol 90:273-288, 1986.
Engles M, Nowotny N, Metzler AE, et al: Genomic and antigenic comparison of an equine herpesvirus 1 (EHV-1) isolate from the 1983 Lippizan
Ippologia, Anno 10, n. 1, Marzo 1999
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
52.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
63.
64.
65.
66.
67.
68.
69.
70.
71.
72.
abortion storm with EHV 1 reference strains. Microbiologica 9:221-234,
1986.
Studdert MJ, Fitzpatrick DR, Horner GW, et al: Molecular epidemiology
and pathogenesis of some equine herpesvirus type 1 (equine abortion
virus) and type 4 (equine rhinopneumonitis virus) isolates. Aust Vet J
61:345-348, 1984.
Whitwell KE, Gower SM, Smith KC: An immunoperoxidase method
applied to the diagnosis of equine herpesvirus abortion, using conventional and rapid microwave techniques. Equine Vet J 24:10-12, 1992.
Liu KM, Castleman W: Equine posterior paresis associated with equine
herpes virus 1 vaccine in California. J Equine Med Surg 12:397-401,
1977.
Bridges CG, Edington N: Innate immunity during equid herpesvirus
(EHV-1) infection. Clin Exper Immunol 65: 172-181, 1986.
Gibson JS, Slater JD, Awan AR, Field HJ: Pathogenesis of equine herpesvirus-1 in specific pathogen-free foals: Primary and secondary infections and reactivation. Arch Virol 123:351-366, 1992.
Moore BO, Koonse HJ: Inactivated equine herpesvirus 1 vaccinePneumabort-K. Proc AAEP 24:75-88, 1978.
Smith KC, Whitwell KE, Mumford JA, et al.: An immunohistological
study of the uterus of mares following experimental infection by equid
herpesvirus 1. Equine Vet J 25: 36-40, 1993.
Little PB, Thorsen J: Virus involvement in equine paresis. Vet Rec
95:575, 1974.
Corey L: Herpes simplex viruses, in Isselbacher KJ (ed): Harrison’s
Principles of Internal Medicine, ed 13. New York McGraw-Hill Book Co,
1994, pp 782-787.
Storts RW: Central nervous system, in Carlton WW, McGavin MD
(eds):Thomson’s Special Veterinary Pathology, ed 2. St. Louis, CV
Mosby, 1995, pp 332-392.
Divers TJ, VanMetre DC: Alterations in urinary function in Smith BP (ed):
Large Animal Internal Medicine, ed 2. St. Louis, CV Mosby, 1996, pp
196-208.
Blythe LL, Mattson DE, Lassen ED, Craig AM: Antibodies against equine
herpesvirus 1 in the cerebrospinal fluid in the horse. Can Vet J 26:218220, 1985.
Granstrom DE: Diagnosis of equine protozoal myeloencephalitis:
Western blot analysis. Proc 11th ACVIM Forum: 587-590, 1993.
Drummer HE, Reynolds A, Studdert MJ, et al: Application of an equine
herpesvirus 1 (EHV 1) type-specific ELISA to the management of an outbreak of EHV 1 abortion. Vet Rec 136:579-581, 1995.
Doll ER, Bryans JT: Development of complement-fixing and virus-neutralizing antibodies in viral rhinopneumonitis of horses. Am J Vet Res
23:843-846, 1962.
Sharma PC, Cullinane AA, Onions DE, Nicholson L: Diagnosis of equid
herpesviruses-1 and -4 by polymerase chain reaction. Equine Vet J
24:20-25, 1992.
Wagner WN, Bogdan J, Haines D: Detection of equine herpesvirus type 1
from type 4 by the polymerase chain reaction. Can J Microbiol 38:11931196, 1992.
Blunden AS, Whitwell KE, Pegler KM: An outbreak of paralysis associated with equine herpesvirus type 1 infection in a livery stable. Prog Vet
Neurol 3:95, 1992.
Cox JH, Murray RC, DeBowes RM: Diseases of the spinal cord, in Kobluk
CN (ed): The Horse: Diseases e Clinical Management. Philadelphia, WB
Saunders Co, 1995, pp 453-455.
MacKay RJ, Mayhew IG: Diseases of the nervous system, in Colahan PJ
(ed): Equine Medicine and Surgery, ed 4. Goleta, CA, American
Veterinary Publications, 1991, pp 723-845.
Wilson JH, Erickson DM: Neurological syndrome of rhinopneumonitis.
Proc ACVlM Forum 9:419, 1991.
Mayhew IG: Large Animal Neurology: A Handbook for Veterinary
Clinicians. Philadelphia, Lea & Febiger, 1989, pp 272-274.
George LW: Diseases of the nervous system, in Smith BP (ed): Large
Animal lnternal Medicine. St. Louis, CV Mosby, 1990, pp 901-1045.
Edington N, Bridges CG, Huckle A: Experimental reactivation of equid
herpesvirus 1 (EHV 1) following the administration of corticosteroids.
Equine Vet J 17:369-372, 1985.
Alsup EM, DeBowes RM: Dimethyl sulfoxide. JAVMA 185:1011-1014,
1984.
Brayton CF: Dimethyl sulfoxide (DMSO): A review. Cornell Vet 76:61-90,
1986.
Reed SM: Spinal cord trauma, in Robinson NE (ed): Current Therapy in
Equine Medicine. Il. Philadelphia, WB Saunders Co, 1987, pp 374-376.
Holbrook TC, Moore JN: Anti-inflammatory and immune support in
endotoxemia and septicemia. Vet Clin North Am Equine Pract 10(3):535547, 1994.
Spurlock SL, Ward MV: Parenteral nutrition in equine patients: Principles
and theory. Compend Contin Educ Pract Vet 13(3):461-469, 1991.
Dolin R: Antiviral chemotherapy, in Isselbacher KJ (ed): Harrison’s
Prineiples of lnternal Medicine, ed 13. New York, McGraw-Hill Book Co,
1994, pp 782-787.
Plumb DC: Acyclovir, in Plumb DC (ed): Veterinary Drug Handbook, ed
2. Ames, IA, Iowa State University Press, 1995, pp 10-11.
Ostland EN, Powell D, Bryans JT: Equine herpesvirus 1: A review. Proc
MEP 36:387-395, 1990.
13