Large Animals Review, Anno 10, n. 5, Ottobre 2004
51
INFEZIONE DA HERPESVIRUS EQUINO TIPO 1
IN UN ALLEVAMENTO IN PUGLIA
GABRIELLA ELIA, MARCO CAMPOLO, ELEONORA LORUSSO, NICOLA DECARO,
COSTANTINA DESARIO, VITO MARTELLA, CANIO BUONAVOGLIA
Dipartimento di Sanità e Benessere Animale - Facoltà di Medicina Veterinaria di Bari
Strada per Casamassima Km 3 - 70010 Valenzano (BA)
Viene descritto un focolaio di aborto da equid herpesvirus tipo 1 (EHV1) in un allevamento di cavalli mezzosangue in Puglia. L’episodio ha interessato quattro delle 5 fattrici gravide che hanno abortito senza presentare altri sintomi clinici.
L’esame anatomo-istopatologico dei feti abortiti ha evidenziato la presenza di emorragie e focolai di necrosi a livello epatico,
con i caratteristici inclusi intranucleari. Dai campioni di organi di 2 feti abortiti è stato possibile isolare su cellule renali di coniglio uno stipite erpetico tipizzato come EHV1 mediante la polymerase chain reaction (PCR).
Summary
The authors report an outbreak of abortion by equid herpesvirus type-1 in a herd of half-breed horses. No symptoms were
observed in four out of the five pregnant mares that aborted.
Macroscopic and histopathological lesions in the aborted foetuses revealed the presence of hemorrhages, necrotic areas in
the liver and characteristic intranuclear inclusion bodies. From the tissues of two foetuses, an herpesvirus strain was isolated
on rabbit kidney cell cultures. The isolated virus was identified as EHV1 using polymerase chain reaction (PCR).
INTRODUZIONE
Equid herpesvirus tipo 1 e tipo 4 (EHV1, EHV4) sono considerati patogeni di rilievo nell’allevamento equino, a causa delle ingenti perdite economiche di cui sono
responsabili.
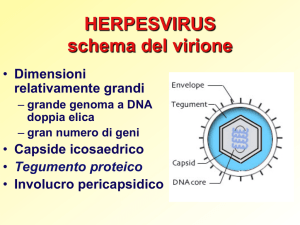
Si tratta di α-herpesvirus, appartenenti alla famiglia
Herpesviridae, genere Varicellovirus. I virioni sono provvisti di envelope e posseggono un genoma costituito da
DNA lineare a doppia elica in grado di codificare per almeno 13 glicoproteine.
Come tutti gli α-herpesvirus, EHV1 e EHV4 sono in
grado di stabilire nell’ospite infezioni latenti, con localizzazione preferenziale nei tessuti linfoidi, nervosi e nei leucociti circolanti1,2,3. La riattivazione delle infezioni latenti con
successiva escrezione virale oltre a costituire un importante
meccanismo di conservazione dei virus in natura, giustifica
la possibile comparsa di focolai di infezione anche in scuderie in cui non sono stati introdotti nuovi soggetti.
Per lungo tempo EHV1 ed EHV4 sono stati considerati
varianti del medesimo virus; studi molecolari hanno in seguito evidenziato differenze di ordine genetico e biologico
tra i due virus, che attualmente si configurano come due
distinti sierotipi4,5.
EHV4 è principalmente implicato nel determinismo di
forme respiratorie, mentre EHV1 viene frequentemente isolato da feti abortiti, tanto da essere considerato tra le più co-
muni cause di aborto infettivo nei cavalli6. Più di rado
EHV1 è responsabile di una sintomatologia nervosa (encefalite)7,8, generalmente preceduta, come avviene per l’aborto,
da episodi più o meno appariscenti di malattia respiratoria.
Per entrambi i sierotipi la trasmissione si realizza per via
aerogena con conseguente localizzazione primaria alle vie respiratorie superiori, cui segue una sintomatologia alquanto
simile. L’aborto nelle fattrici gravide e i disturbi neurologici
in individui di tutte le età sono legati alla capacità di EHV1
di invadere il torrente circolatorio ed infettare i leucociti,
raggiungendo così altri siti di replicazione tra cui gli endoteli
vasali dell’endometrio e del sistema nervoso centrale.
Nella fattrice gravida, in particolare, dopo una sintomatologia respiratoria di varia entità, l’aborto può insorgere
dopo un periodo estremamente variabile compreso tra 9
giorni e 4 mesi9. Tuttavia le stesse fattrici possono abortire
anche a distanza di anni da un’infezione primaria, a seguito della riattivazione di una infezione latente9.
Sono due i possibili meccanismi coinvolti nella patogenesi dell’aborto. Nel primo entrano in gioco le lesioni virus
indotte a carico degli endoteli con successiva vasculite,
trombosi e danni ischemici all’endometrio10,11. Questo giustificherebbe il reperto di feti abortiti virologicamente negativi anche in corso di infezioni sperimentali con
EHV111,12. Il secondo meccanismo implica invece una infezione diretta del feto e/o della placenta, come dimostrato
dai numerosi isolamenti del virus dagli organi ed invogli fe-
ALTRE SPECIE
Riassunto
52
Infezione da herpesvirus equino tipo 1 in un allevamento in Puglia
tali. Sebbene l’infezione del feto sia stata per lungo tempo
attribuita ad una accidentale migrazione di leucociti materni infetti attraverso la placenta13,14, recenti studi hanno invece dimostrato una diretta diffusione di EHV1 dalle cellule endometriali a quelle trofoblastiche, con conseguente
passaggio del virus nel torrente circolatorio fetale15,16.
L’infezione al termine della gestazione può esitare nella
nascita di puledri vivi, ma disvitali che muoiono dopo pochi giorni per patologie intercorrenti o per i danni tissutali
indotti da EHV117,18.
Generalmente l’aborto si verifica negli ultimi 4 mesi di
gestazione, in assenza di sintomi premonitori e con espulsione della placenta. La cavalla si riprende rapidamente
senza ulteriori sequele per l’attività riproduttiva. Il feto
abortito può presentare edema sottocutaneo, liquido nella
cavità toracica, edema polmonare, necrosi epatica puntiforme. Istologicamente sono molto caratteristiche, sebbene rilevabili in una piccola percentuale di feti abortiti, le
necrosi multifocali a carico del polmone e del fegato. Alla
periferia dei foci necrotici sono generalmente evidenziabili
inclusi intranucleari eosinofili di grande ausilio diagnostico, se si considera che l’isolamento del virus dagli organi
fetali è difficoltoso. Nella presente nota si descrive un focolaio di infezione da EHV1 osservato in un allevamento
di cavalli mezzosangue in Puglia.
ne e fegato sono stati frammentati ed omogenati al 10% in
D-MEM. Dopo centrifugazione a 4000 x g per 20 minuti a
+4°C, il surnatante di ciascun campione è stato trattato con
antibiotici (5000 UI/ml penicillina, 2500 µg/ml streptomicina, 10 µg/ml anfotericina B), quindi utilizzato per inoculare i
monostrati cellulari. Le cellule sono state incubate a 37°C in
termostato a CO2 e sottoposte ad osservazione quotidiana
per rilevare l’eventuale comparsa di effetto citopatico (ecp).
In presenza di ecp i monostrati infetti sono stati sottoposti a 3 cicli di congelamento e scongelamento ed i criolisati sono stati inoculati su monostrati di RK-13 sviluppati
in piastre a 12 pozzetti con vetrino, utilizzando 3 pozzetti
per campione. Gli stessi criolisati sono stati impiegati per
effettuare passaggi successivi.
A diversi intervalli di tempo, i monostrati cellulari infetti
sono stati sottoposti a colorazione con ematossilina-eosina.
PCR
Da ciascun campione in esame è stata effettuata l’estrazione del DNA virale con il kit Dneasy Tissue Kit (Qiagen
GmbH, Germania). Il primo step di amplificazione ha
previsto l’utilizzo di una coppia di primer, FC2/RC (Tab.
1), in grado di amplificare una regione della glicoproteina
B in entrambi gli herpesvirus equini EHV1 e EHV419.
MATERIALI E METODI
Descrizione del focolaio
Nell’allevamento oggetto dell’indagine, ubicato a 50 km
da Bari, erano presenti 10 cavalli: 1 stallone, 7 fattrici di
cui 5 gravide e 2 puledre di 1 anno. Lo stallone era sistemato separatamente dal resto del gruppo. Tutte le femmine gravide erano state montate dallo stallone dell’azienda,
ad eccezione di una acquistata già gravida ed introdotta
nell’allevamento nel mese di novembre 2003. Gli animali
non erano stati sottoposti ad alcun trattamento vaccinale.
Lo stallone era risultato negativo all’esame sierologico per
EHV1/EHV4 effettuato agli inizi del mese di novembre.
Nel periodo compreso tra dicembre 2003 e marzo 2004
4 fattrici hanno abortito, tutte all’incirca al 10° mese di gestazione. Tra le cavalle abortite era inclusa la fattrice introdotta di recente nell’allevamento che, in ordine di tempo,
era stata la seconda ad abortire. Gli aborti non erano stati
preceduti da alcun segno premonitore e non vi era stata ritenzione della placenta. L’anamnesi non ha rilevato alcun
episodio di malattia respiratoria.
FIGURA 1 - Fegato: emorragie e focolai di necrosi.
Esami virologici
È stato possibile eseguire gli esami di laboratorio solo su
due feti abortiti (gli ultimi due in ordine di tempo).
L’esame anatomo-patologico ha evidenziato edema sottocutaneo di vario grado associato a versamento in cavità
toracica. Nel fegato erano visibili emorragie e focolai di
necrosi (Fig. 1). In un feto erano presenti emorragie a carico della superficie epicardica (Fig. 2).
Per le prove di isolamento in vitro sono state utilizzate cellule di rene di coniglio in linea continua (RK-13), sviluppate
in terreno minimo essenziale di Dulbecco (D-MEM), con
aggiunta del 10% di siero fetale bovino. Campioni di polmo-
FIGURA 2 - Emorragie sulla superficie epicardica.
Large Animals Review, Anno 10, n. 5, Ottobre 2004
53
La reazione di amplificazione ha previsto 30 cicli: denaturazione a 94°C per 1’, allineamento a 60°C per 1’ e
estensione a 72°C per 1’. La fase finale di estensione è stata realizzata a 72°C per 7’.
L’amplificato PCR (1 µl) è stato sottoposto ad un secondo
round di amplificazione per l’identificazione del sierotipo,
utilizzando il primer sense FC3 ed i primer antisense R1 ed
R4 (Tab. 1), rispettivamente specifici per EHV1 e EHV419.
Dopo ciascuna reazione di amplificazione, i prodotti della PCR sono stati sottoposti ad elettroforesi in gel di agarosio e poi visualizzati previa colorazione con etidio bromuro.
Esami istologici
Sezioni di fegato ottenute al criostato sono state sottoposte a colorazione con ematossilina-eosina ed osservate al
microscopio ottico.
FIGURA 3 - Effetto citopatico da herpesvirus equino su RK-13.
Esami sierologici
ALTRE SPECIE
I sieri delle fattrici che avevano abortito e degli altri soggetti presenti in allevamento sono stati sottoposti al test di
virusneutralizzazione (VN) per EHV1, utilizzando cellule
RK-13 e lo stipite virale isolato nel corso dell’indagine.
La lettura dei risultati è stata effettuata dopo 4 giorni di
incubazione a 37°C.
RISULTATI
Nei monostrati di cellule RK-13 inoculati con gli omogenati di fegato e polmone dei due feti è stato evidenziato
un tipico ecp da herpesvirus, caratterizzato dalla comparsa
di focolai di cellule arrotondate, con tendenza alla formazione di sincizi e successiva lisi dei monostrati (Fig. 3).
La colorazione con ematossilina-eosina ha permesso di
evidenziare nei monostrati infetti i caratteristici corpi inclusi intranucleari (Fig. 4).
Il test PCR ha prodotto un amplificato di ampiezza attesa pari a 1181 bp in tutti i campioni esaminati di entrambi
i feti. Il secondo round di amplificazione con primer antisense specifici ha permesso di caratterizzare il virus come
EHV1 in base all’ampiezza dell’amplificato ottenuto, pari
a 188 bp (Fig. 5).
Il test VN per EHV ha confermato la sieronegatività
dello stallone così come delle due puledre; tutte le fattrici,
FIGURA 4 - Corpi inclusi intranucleari in cellule RK-13 (ematossilinaeosina).
Tabella 1
Sequenze nucleotidiche dei primer
Primer
Specificità
Sequenza (5’-3’)
FC2 sense
EHV1-EHV4
CTTGTGAGATCTAACCGCAC
FC3 sense
EHV1-EHV4
ATACGATCACATCCAATCCC
RC antisense
EHV1-EHV4
GGGTATAGAGCTTTCATGGG
R1 antisense
EHV1
GCGTTATAGCTATCACGTCC
R4 antisense
EHV4
CCTGCATAATGACAGCAGTG
FIGURA 5 - Elettroforesi dei prodotti della PCR (linee 2-4) e della n-PCR
(linee 6-8) su campioni di feto abortito. 1: Marker Gene Ruler 1kb DNA
Ladder; 2: Controllo positivo EHV1 (gentilmente fornito dal dott. Cavaliere, Istituto Zooprofilattico di Puglia e Basilicata); 3: Fegato; 4: Polmone; 5: Marker Gene Ruler 100bp DNA Ladder; 6: Controllo positivo
EHV1; 7: Fegato; 8: Polmone.
54
Infezione da herpesvirus equino tipo 1 in un allevamento in Puglia
fezione da EHV1 che tutti i nuovi soggetti prima dell’ingresso in allevamento vengano sottoposti ad accertamenti
di laboratorio specifici e ad un periodo di quarantena.
Parole chiave
Equino, herpesvirus tipo 1, aborto.
Key words
Equine, herpesvirus type-1, abortion.
FIGURA 6 - Corpi inclusi intranucleari negli epatociti.
Bibliografia
tranne una non gravida, sono risultate sieropositive con titoli variabili da 1:2 a 1:32.
L’esame istologico del fegato ha evidenziato fenomeni di
congestione dei sinusoidi, ampie aree di necrosi ed inclusioni eosinofiliche tipo Cowdry A (Fig. 6).
DISCUSSIONE
L’infezione da EHV1 può causare gravi perdite economiche, essendo responsabile di patologie respiratorie,
aborti e mieloencefalopatia con paralisi. Indagini sierologiche volte a svelare anticorpi specifici verso EHV1 hanno
attestato una significativa circolazione del virus tra gli
equini con una sieroprevalenza del 30%20.
Tra le possibili sequele di una infezione da EHV1, una
delle più temute dagli allevatori è certamente l’aborto. Nel
focolaio descritto nella presente nota, 4 delle 5 fattrici gravide hanno abortito. È stato stimato che l’aborto da EHV1
rappresenti da solo il 40% delle cause di aborto infettivo
negli equini21. Da un punto di vista epidemiologico esso assume una notevole rilevanza laddove l’elevata carica virale
del feto e degli invogli fetali rende possibile una marcata
diffusione del virus agli altri animali dell’allevamento. Nel
caso descritto, come in molti altri, il primo aborto verificatosi in azienda non è stato oggetto di un approfondimento
diagnostico in quanto gli allevatori, in assenza di particolari
manifestazioni cliniche collaterali, avevano sottostimato il
problema. Questo ha chiaramente compromesso ogni possibile tentativo di controllo dell’infezione in allevamento, rendendo pressoché inevitabile l’aborto nelle altre fattrici gravide. Da ciò consegue che ogni episodio abortigeno, seppure non associato ad altri segni clinici, dovrebbe essere attentamente valutato al fine di individuare eventuali cause infettive per limitare la diffusione sia all’interno dello stesso allevamento che al di fuori di esso. In quest’ottica il supporto
di una diagnosi di laboratorio rapida ed efficace assume un
ruolo fondamentale. Attualmente la PCR rappresenta la tecnica di elezione, consentendo di rilevare in tempi brevi anche piccole quantità di acido nucleico virale; i due cicli di
amplificazione descritti nella presente nota consentono tra
l’altro di identificare contestualmente il sierotipo coinvolto
e di aumentare la sensibilità del test.
Considerata l’entità delle perdite economiche e l’elevata
diffusione di EHV1, è indispensabile predisporre adeguati
piani di controllo prevedendo, se necessario, la vaccinazione. Risulta però fondamentale ai fini della profilassi dell’in-
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
Welch HM, Bridges CG, Lyon AM, Griffiths L, Edington N. Latent equid
herpesvirus-1 and -4 detection and distinction using the PCR and cocultivation from lymphoid tissue. J. Gen. Virol., 73: 261-268, 1992.
Chesters PM, Allsop R, Purewall A, Edington N. Detection of latencyassociated transcripts of equid herpesvirus 1 in equine leucocytes but
not in trigeminal ganglia. J. Virology, 71: 3437-3443, 1997.
Carvalho R, Oliveira AM, Souza AM, Passos LM, Martins AS. Prevalence of equine herpesvirus type 1 latency detected by polymerase
chain detection. Arch. Virol., 145: 1773-1787, 2000.
Sabine M, Robertson GR, Whalley JM. Differentiation of sub-types of
equine herpesvirus-1 by restriction endonuclease analysis. Aust. Vet.
J., 57: 148-149, 1981.
Studdert MJ, Simpson T, Roizman B. Differentiation of respiratory and
abortigenic isolates of equine herpesvirus 1 by restriction endonucleases. Science, 214: 562-564, 1981.
Allen GP, Yeargan MR, Turtinem LW, Bryans JT. A new field strain of
equine abortion virus (equine herpesvirus –1) among Kentucky horses. Am. J. Vet. Res., 46: 138-140, 1985.
Saxeagard F. Isolation and identification of equine rhinopneumonitis
virus (equine abortion virus) from cases of abortion and paralysis.
Nord. Vet. Med., 18: 504-512, 1966.
Wilson WD. Equine Herpesvirus 1 myeloencephalopathy. Vet. Clin.
North Am. Equine Pract., 13: 53-72, 1997.
Allen GP, Kydd JH, Stater JD, Smith KC. Advances in understanding of
the pathogenesis, epidemiology and immunological control of equine
herpesvirus abortion. Proceedings 8th International Conference on
Equine Infectious Diseases, Dubai, 1998; 129-146.
Edington N, Smyth B, Griffiths L. The role of endothelial cell infection
in the endometrium, placenta and foetus of equid herpesvirus-1 (EHV1) abortions. J. Comp Pathol., 104: 379-387, 1991.
Smith KC, Whitwell KE, Binns MM, Dolby CA, Hannant D, Mumford
JA. Abortion of virologically negative foetuses following experimental
challenge of pregnant pony mares with equid herpesvirus 1. Equine
Vet. J., 24: 256-259, 1992.
Smith KC, Whitwell KE, Mumford JA, Gower SM, Hannant D, Tearle JP.
An immunohistological study of the uterus of mares following experimental infection by equid herpesvirus 1. Equine Vet. J., 25: 36-40, 1993.
Bryans JT, Prickett ME. A consideration of the pathogenesis of abortigenic disease caused by equine herpesvirus-1. Proceedings the 2nd International Conference on Equine Infectious Diseases, Paris, 1970; 34-40.
Glesson LJ, Coggins L. Response of pregnant mares to equine herpesvirus 1 (EHV-1). Cornell Vet., 70: 391-400, 1980.
Mukaiya R, Kimura T, Ochiai K, Wada R, Umemura T. Demonstration of
equine herpesvirus-1 gene expression in the placental trophoblasts of naturally aborted equine fetuses. J. Comp Pathol., 123: 119-125, 2000.
Smith KC, Borchers K. A study of the pathogenesis of equid herpesvirus-1 (EHV-1) abortion by DNA in-situ hybridization. J. Comp Pathol.,
125: 304-310, 2001.
Murray MJ, Del Piero F, Jeffrey SC, Davis MS, Furr MO, Dubovi EJ,
Mayo JA. Neonatal equine herpevirus type 1 infection on a thoroughbred breeding farm. J Vet Intern Med., 12: 36-41, 1998.
Perkins G, Ainsworth DM, Erb HN, Del Piero F, Miller M, Wilkins PA,
Palmer J, Frazer M. Clinical haematological and biochemical findings
in foals with neonatal Equine herpesvirus-1 infection compared with
septic and premature foals. Equine Vet. J., 31: 422-426, 1999.
Kirisawa R, Endo A, Iwai H, Kawakami Y. Detection and identification
of equine herpesvirus-1 and -4 by polymerase chain reaction. Vet. Microbiol., 36: 57-67, 1993.
Crabb BS, MacPherson CM, Reubel GH, Browning GF, Studdert MJ,
Drummer HE. A type-specific serological test to distinguish antibodies
to equine herpesviruses 4 an 1. Arch. Virol., 140: 245-258, 1995.
Petzoldt K, Merkt H, Müller E, Kirpal G. Neue Beobachtungen bei der
Diagnostik des EHV-abortes. Tierärztl. Prax., 155: 393-397, 1987.