Spettroscopia IR
Spettroscopia IR
Spettroscopia IR
Spettroscopia IR
Spettroscopia IR
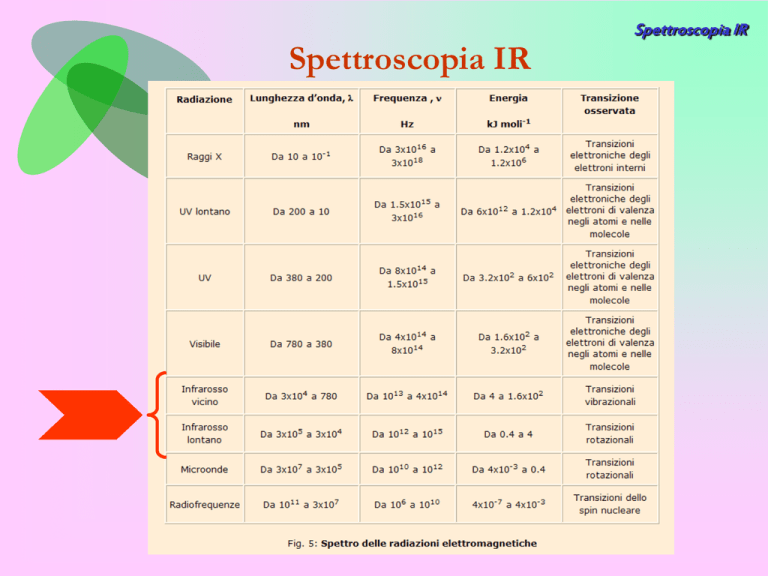
La radiazione infrarossa (e in particolar modo quella nel vicino IR)
può essere assorbita dalle molecole e convertita in
Energia Vibrazionale.
Gli atomi all'interno di una molecola non stanno fermi, ma
compiono oscillazioni intorno alla posizione di equilibrio, che
vengono dette VIBRAZIONI.
Queste possono essere classificate come variazioni della lunghezza
di legame (stretching) e variazioni degli angoli di legame
(bending).
Spettroscopia IR
Modi vibrazionali
Spettroscopia IR
Bending (Piegamento)
Nel piano
Asimmetrico : Scissoring (forbice)
Simmetrico: Rocking (dondolo)
Fuori del piano
Asimmetrico: Twisting (torsione)
Simmetrico : Wagging (agitare)
Modi vibrazionali
Spettroscopia IR
Modi vibrazionali
Stretching (stiramento)
Asimmetrico
Simmetrico
Spettroscopia IR
Le vibrazioni delle molecole
Spettroscopia IR
E’ possibile valutare quanti sono i possibili modi di
vibrare (gradi di libertà vibrazionali) di una molecola
composta da N atomi?
3N - 6 (molecola non lineare)
3N - 5 (molecola lineare)
MOLECOLA NON LINEARE
3N
MOLECOLA LINEARE
gradi di libertà totali
3N
il grado di libertà di una molecola costituita da un numero N di
atomi viene utilizzato per descrivere in modo completo il
movimento di ogni singolo atomo facendo riferimento a una
terna di assi cartesiani ortogonali (x,y,z).
Ogni atomo, dunque possiede 3 gradi di libertà e la molecola
possiede complessivamente 3n gradi di libertà. Questo valore
comprende tutti i possibili movimenti della molecola:
traslazionali, rotazionali, vibrazionali
MOLECOLA NON LINEARE
3N
MOLECOLA LINEARE
gradi di libertà totali
3N
gradi di libertà traslazionali
3
servono ad indicare la posizione della molecola in blocco (del
suo centro di massa) e quindi a descrivere il suo moto
traslazionale
3
gradi di libertà rotazionali
3
3N-6
(servono ad indicare l'orientazione della molecola nello
spazio): 3 per le molecole non lineare e 2 per quelle lineari
(rotazioni intorno a 3 assi perpendicolari passanti per il suo
centro di massa nel primo caso e 2 rotazioni intorno ad assi
perpendicolari all'asse molecolare nel secondo caso)
2
gradi di libertà vibrazionali
3N-5
indicano le posizioni relative di un atomo rispetto all'altro e
descrivono i moti interni vibrazionali
Oscillatore armonico
Spettroscopia IR
Il comportamento di atomi vibranti può essere descritto
approssimativamente con il modello dell´oscillatore armonico della
fisica classica.
Immaginiamo che gli atomi siano uniti da molle prive di peso che
consentono agli atomi di vibrare intorno alla posizione di equilibrio.
La molla rappresenta il legame chimico;
questa similitudine può risultare più o meno
rispondente alla realtà.. Risulta poco efficace perché la
molla è qualcosa di visibile, mentre il legame (forze
elettrostatiche) è qualcosa da immaginare.
Spettroscopia IR
Oscillatore armonico
Robert Hooke
(1635-1703)
fisico, biologo, geologo e
architetto inglese.
•In meccanica e in fisica, la legge di Hooke è la più semplice relazione
di comportamento dei materiali elastici.
• Essa è formulata dicendo che l'allungamento subìto da una molla è
direttamente proporzionale alla forza applicata e alla costante di
proporzionalità, detta costante elastica, che dipende dalla molla
F=-kx
F=forza di richiamo
Oscillatore armonico
Spettroscopia IR
Il moto è:
•oscillatorio,
•periodico (con frequenza che dipende dalla costante k e dalle masse dei
due atomi)
C-C, C-N, C-O
C=C, C=N, C=O
CC, CN
C-H, N-H, O-H
1300-800 cm-1
1900-1500 cm-1
2300-2000 cm-1
3800-2700 cm-1
Un legame molto forte è assimilabile ad una
molla con una K elevata.
Oscillatore Armonico:
Spettroscopia IR
stretching e bending
quando due oscillatori condividono una atomo comune
(come nel caso della CO2) quella che si ha è
un’interazione meccanica fra i due oscillatori
Si avranno così due vibrazioni di
stiramento (stretching) fondamentali:
simmetrico e asimmetrico!
Spettroscopia IR
Oscillatore armonico
Descrizione quantistica
sono possibili solo valori discreti dell’energia totale,
dipendenti da un numero quantico vibrazionale, v, che può
avere solo valori interi:
Energie permesse, Ev
Energia
Potenziale, V
LIVELLI VIBRAZIONALI
E = (v+ ½ )h v = 0, 1, 2, ….
1.
2.
INFINITI
SPAZIATURA COSTANTE
1
ν
2π
Spostamento, x
k
μ
= frequenza vibrazionale prevista
classicamente.
Regole di selezione
Energia
Potenziale, V
Spettroscopia IR
Sono permesse solo transizioni con variazione
del numero quantico
Energie permesse,
Ev
Dv = ± 1
(vale a dire tra livelli adiacenti, Dv = + 1 in
assorbimento, Dv = - 1 in emissione).
Spostamento, x
Conseguenza: potranno essere assorbiti od emessi solo fotoni con frequenza uguale
alla frequenza di vibrazione: DE =h= hAB
Le frequenze vibrazionali corrispondono a quelle della radiazione infrarossa. In
termini di numero d'onda, tra 100 e 4000 cm-1.
Regole di selezione
Spettroscopia IR
Energia
Potenziale, V
Energie permesse,
Ev
Ci sarà interazione con la radiazione solo se
durante la vibrazione si ha variazione del
momento di dipolo elettrico
Spostamento, x
Dipolo elettrico
Spettroscopia IR
Dipolo elettrico
sistema composto da due cariche elettriche uguali e
opposte di segno (+q e –q).
Momento di dipolo (DM)=rq
(q=carica; r= distanza tra le cariche)
I dipoli possono essere impiegati per rappresentare, da
un punto di vista elettrico, sistemi naturali quali le
molecole che sono una delle unità più semplici di ogni
materiale.
Dipolo elettrico
Spettroscopia IR
Le molecole possono avere una struttura simile al dipolo
anche se non sono esposte ad alcun campo
elettromagnetico, in questo caso si parla di molecole polari.
Esse sono caratterizzate da un momento dipolare.
Il momento di dipolo è tanto più grande quanto la
differenza di elettronegatività
tra gli atomi di un legame
Altre molecole sono neutre (non hanno una carica netta in
condizioni normali) ma subiscono una polarizzazione in
presenza di un campo elettromagnetico: cariche positive e
negative, sollecitate dal campo, tendono a muoversi in
direzioni opposte. In presenza di un campo elettrico, le
molecole non polari possono essere rappresentate da un
dipolo, proprio come le molecole polari.
Regole di selezione
Energie permesse,
Ev
Energia
Potenziale, V
Spostamento, x
Spettroscopia IR
Ci sarà interazione con la radiazione solo se
durante la vibrazione si ha variazione del
momento di dipolo elettrico
le molecole biatomiche omonucleari
sono IR inattive.
Regole di selezione
Spettroscopia IR
Un legame polare aumenta il valore del suo momento dipolare, in seguito
all’assorbimento di una radiazione IR
(http://www.youtube.com/watch?v=DDTIJgIh86E)
Prima dell’assorbimento
Dopo l’assorbimento
Regole di selezione
Spettroscopia IR
Per capire perché un legame polare aumenta il valore del suo momento dipolare, in
seguito ad una deformazione, bisogna considerare che durante la vibrazione del
sistema ci saranno cariche che si avvicinano e si allontanano. Queste cariche da un
punto di vista statico creano un campo elettrico. Da un punto di vista dinamico
questo risulta anche oscillante.
Tale campo elettrico oscilla alla
frequenza con cui vibra l’oscillatore
armonico.
Anche la radiazione elettromagnetica ha un campo elettrico
oscillante che oscilla alla frequenza . Quando le due frequenze
risultano uguali, i due campi elettrici possono allinearsi e scambiarsi
energia reciprocamente.
3N-5=4
CO2
(stretching simmetrico)
1 = 1353.6 cm-1
(stretching antisimmetrico)
3 = 2396.3 cm-1
I DUE MODI POSSONO ESSERE
ECCITATI SEPARATAMENTE
(bending)
CO2
3N-5=4
(stretching antisimmetrico)
(stretching simmetrico)
3 = 2396.3 cm-1
1 = 1353.6 cm-1
lo streching simmetrico non
determina variazione del momento
di dipolo.
Variazione di momento di Dipolo
_
+
Le regole di selezione indicano
che non c’è assorbimento di
radiazione IR in corrispondenza
della frequenza dello stretching
simmetrico.
+
_
_
+
+
_
+
-
3N-5=4
CO2
Gli altri 2 modi corrispondono a
variazioni dell’angolo di legame su
due piani perpendicolari si tratta
cioè di bending. Questi due modi
sono evidentemente degeneri, cioè
hanno la stessa frequenza e quindi
daranno origine ad un’unica banda
di assorbimento.
(bending)
_
+
+
_
+
_
+
_
-
+
-
CO2
3N-5=4
% Trasmissione
Lo spettro IR della CO2 consisterà perciò
di 2 sole bande.
Spettro IR
4000
2000
0
Spettroscopia IR
CO2
Livelli energetici di CO2
Differenze di energia, cm-1
20,000
2350
1335
667
Zero
IR
IR
H2O
1 = 3835 cm-1
2 = 1648 cm-1
3 = 3939 cm-1
3N-6=3
Tutti e 3 i modi danno
origine a variazione del
momento di dipolo e sono IR
attivi.
NH3
= 3505.7 cm-1
2 = 1022.0 cm-1
3 = 3573.1 cm-1
4 = 1689.7 cm-1
Molecole Reali
Spettroscopia IR
Le molecole reali non obbediscono realmente alle leggi del moto
armonico.
•I livelli energetici vibrazionali non sono più egualmente spaziati,
(moto anarmonico) e la differenza di energia tra livelli adiacenti
diventa sempre più piccola al crescere del numero quantico
vibrazionale.
Moto armonico
Moto anarmonico
Molecole Reali
Spettroscopia IR
Le molecole reali non obbediscono realmente alle leggi del moto
armonico.
•I livelli energetici vibrazionali non sono più egualmente spaziati,
(moto anarmonico) ma la differenza di energia tra livelli adiacenti
diventa sempre più piccola al crescere del numero quantico
vibrazionale.
• La regola di selezione Dv = ± 1 non è più rispettata strettamente.
Sono, infatti, debolmente (cioè con bassa intensità) permesse
anche transizioni con v = ±2, v = ±3, …. Le bande
corrispondenti vengono dette seconde armoniche,terze
armoniche, …, e in genere armoniche superiori, mentre quella con
Dv = ±1 è detta armonica fondamentale o prima armonica.
Molecole Reali
Spettroscopia IR
Le molecole reali non obbediscono realmente alle leggi del moto
armonico.
•I livelli energetici vibrazionali non sono più egualmente spaziati,
Poiché però,
per effettoma
dell’anarmonicità,
energetici
ad
(moto
anarmonico)
la differenza dii livelli
energia
tra livellitendono
adiacenti
avvicinarsi, le frequenze delle seconde armoniche, ad esempio, non saranno
diventa
sempre
più
al crescere
numero quantico
esattamente
il doppio
dellepiccola
fondamentali,
ma un po’del
inferiori.
vibrazionale.
• La regola di selezione Dv = ± 1 non è più rispettata strettamente.
Sono, infatti, debolmente (cioè con bassa intensità) permesse
anche transizioni con v = ±2, v = ±3, …. Le bande
corrispondenti vengono dette seconde armoniche,terze
armoniche, …, e in genere armoniche superiori, mentre quella con
Dv = ±1 è detta armonica fondamentale o prima armonica.
Molecola Poliatomica
Spettroscopia IR
spostamenti simultanei di più gruppi di atomi
ciascuna coppia di atomi puó essere
considerata un oscillatore armonico
indipendente?
Frequenze di Gruppo
Spettroscopia IR
In una molecola complessa, i modi normali di vibrazione
corrispondono a spostamenti simultanei di molti atomi.
In molti casi, tuttavia,
gli spostamenti più rilevanti coinvolgono
un gruppo limitato di atomi.
Si parla allora di frequenze di gruppo, cioè caratteristiche delle
vibrazioni di un particolare gruppo di atomi, i cui valori sono
abbastanza simili in tutti i composti in cui quei gruppi sono
presenti.
Spettroscopia IR
IR vicino (NIR) → 13.000 – 4.000 cm-1- NIR, 0,7-5 µm
IR medio (MIR) → 4.000 – 200 cm-1- MIR o intermediate-IR, 2,5-30 µm
IR lontano (FIR) → 200 – 10 cm-1-FIR, 30-1000 µm
Spettro IR
Spettroscopia IR
Lo spettro IR di un composto viene solitamente suddiviso in due regioni:
•quella a numeri d'onda superiori a ~ 1500 cm-1 (la regione dei gruppi
funzionali), in cui si osservano appunto frequenze di gruppo caratteristiche, e
che possono essere usate per determinare la presenza di tali gruppi in un
composto incognito. Si tratta, con pochissime eccezioni, di vibrazioni di
stretching.
•La regione al di sotto di 1500 cm-1 è nota come regione dell'impronta
digitale. La regione è molto complessa ed è veramente "unica" per un dato
composto. In questa regione si osservano tutti gli stretching di legami singoli
(che non coinvolgono H) e praticamente tutti i bending.
Spettroscopia IR
Zona dei gruppi funzionale
Zona delle impronte digitali
Zona dei gruppi funzionale
Zona delle impronte digitali
Spettroscopia IR
Intensità di una banda IR
Spettroscopia IR
dipende dalla variazione del momento dipolare
provocata dalla vibrazione.
(grande variazione del momento dipolare intensità maggiore)
Sono intensi gli assorbimenti relativi a vibrazione di legami
polarizzati (es. C=O)
Se la vibrazione è simmetrica, il momento dipolare non varia e
l'assorbimento è debole o assente.
Spettroscopia IR
Larghezza di una banda IR
Natura delle bande:
Nello spettro infrarosso l’assorbimento di radiazione dà
origine a bande piuttosto che a righe strette perché ogni
transizione vibrazionale è accompagnata da molte transizioni
rotazionali (corrispondenti ai diversi livelli rotazionali dello
stato vibrazionale fondamentale di partenza e dello stato
vibrazionale eccitato di arrivo): si ha cioè un allargamento
disomogeneo
Spettroscopia IR
Posizione di una banda IR
Spettroscopia IR
Posizione di una banda IR
Esempio:
Gli stretching O-H si osservano:
intorno a 3600 cm-1 se il gruppo è "libero";
tra 3600-3200 cm-1, con bande larghe, in alcoli e fenoli in
presenza di ponti ad H;
in acidi carbossilici la banda è larghissima ed arriva fino a
2700 cm-1.
2-Butanone
overtone
C-H
CH bend
O
C=O
CH3 C
CH2 CH3
Propanammide
C-H
NH2
O
C
C=O
CH CH
CH bend 3 2
NH2
Riepilogo
Spettroscopia IR
1090 cm-1:
vibrazione di stretching simmetrico del
gruppo fosfato
1225 cm-1:
vibrazione di stretching antisimmetrico del
gruppo fosfato
1053 cm-1:
vibrazione del riboso
1575 cm-1:
vibrazione di C=N della guanina
1675 cm-1:
vibrazione di C=O della guanina e C=O della timina
1090 cm-1:
vibrazione di stretching simmetrico del
gruppo fosfato
1225 cm-1:
vibrazione di stretching asimmetrico del
gruppo fosfato
1053 cm-1:
vibrazione del riboso
1575 cm-1:
vibrazione di C=N della guanina
1675 cm-1:
vibrazione di C=O della guanina e C=O della timina
Cambiano :
•le posizioni degli assorbimenti dei
fosfato e delle basi
•le intesità dei segnali
Gli ioni interagiscono sia con le basi
azotate che con i gruppi fosfato
Cambia la conformazione B del DNA
1090 cm-1:
vibrazione di stretching simmetrico del
gruppo fosfato
1225 cm-1:
vibrazione di stretching antisimmetrico del
gruppo fosfato
1053 cm-1:
vibrazione del riboso
1575 cm-1:
vibrazione di C=N della guanina
1675 cm-1:
vibrazione di C=O della guanina e C=O della timina
I cambiamenti spettrali maggiori delle bande sono
osservati in presenza di ioni Cu2+.
In presenza di Ca2+ e Mn2+ sono di entità minore
Cu2+>Mn2+>Ca2+
Cu2+
Intensità della
banda a 1090 cm-1
Per tutte le bande di assorbimento è
osservato un aumento di intensità al
crescere della concentrazione di
metallo
Ca2+
Mn2+
Effetti di aggregazione o
condensazione del DNA