Termodinamica:
cenni sui gas perfetti
1
Definizione di Gas Perfetto
Un gas perfetto è un gas ideale il cui comportamento approssima quello
dei gas reali a densità sufficientemente basse.
Sia dato del gas perfetto in un recipiente.
Il gas perfetto è:
1) Formato da N corpuscoli puntiformi di
massa m* in moto continuo e
disordinato
2) Il Volume dei corpuscoli è molto minore
del volume occupato dal gas
3) I corpuscoli NON sono soggetti a forza
di gravità
4) Non ci sono urti tra i corpuscoli ma
solo tra i corpuscoli e le pareti del
contenitore
5) Gli urti sono elastici
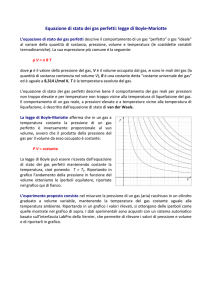
Equazione di stato dei Gas Perfetti
Un gas perfetto è un gas ideale il cui comportamento approssima quello
dei gas reali a densità sufficientemente basse.
Si trova sperimentalmente che, per un gas perfetto, le variabili
termodinamiche p, T (in K) e V soddisfano la seguente equazione, nota come
equazione di stato dei gas perfetti:
pV = nRT
Ove n è il numero di moli del gas in esame ed R = 8.31 J/(mol K)
è la costante universale dei gas.
R può anche essere espressa come:
R = kBNA kB = 1.38 * 10-23 J/K costante di Boltzmann
Equazione di stato dei Gas Perfetti
pV = nRT
Legame tra la temperatura e l’energia cinetica
molecolare media nei gas perfetti
pV ∝ EK
e inoltre
pV = nRT = nk B N A T
A misura della energia cinetica molecolare media (grandezza microscopica)
assumiamo il parametro macroscopico TEMPERATURA.
Ovvero:
la temperatura è una misura della energia cinetica molecolare media
<EK> = ½ m <v2> (TEORIA CINETICA DEI GAS)
Per un gas monoatomico:
(un atomo per molecola)
EK
3
= k BT = Eint
2
Energia interna
Calori specifici nei gas
Il calore specifico dei gas, a differenza di quello dei solidi ed in parte
anche dei liquidi, risente delle condizioni in cui avviene lo scambio
termico.
Per i gas perfetti si distinguono il calore specifico a pressione
costante cp ed il calore specifico a volume costante cv, da cui
segue :
- Isobara : Qgas = ncp(Tf-Ti)
- Isocora : Qgas = ncV(Tf-Ti)
Gas perfetti: relazione di Mayer
Le costanti (molto) importanti
n è il numero di moli
N A = Numero di Avogadro = 6.02 ⋅10 23 mol−1
k = costante di Boltzmann = 1.38 ⋅10 -23 J/K
R = Costante dei Gas = 8.314 J/mol⋅ K