Istruzioni per l’Uso
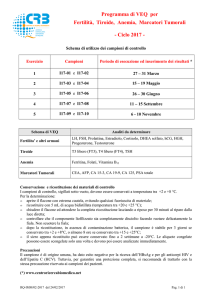
Dopamine ELISA
Dosaggio immunoenzimatico manuale ed automatico per
la diagnosi in vitro quantitativa di dopamina nel plasma
e nelle urine di individui umani.
RE59161
96
2-8°C
I B L
I N T E R N A T I O N A L
Flughafenstrasse 52a
D-22335 Hamburg, Germany
Phone: +49 (0)40-53 28 91-0
Fax: +49 (0)40-53 28 91-11
G M B H
[email protected]
www.IBL-International.com
Dopamine ELISA (RE59161)
1.
ITALIANO
USO PREVISTO
Dosaggio immunoenzimatico manuale ed automatico per la diagnosi in vitro quantitativa di dopamina nel
plasma e nelle urine di individui umani. Inoltre il test si può usare per la ricerca sui omogenati da tessuti e
supernatanti di colture cellulari.
2.
SOMMARIO E SPIEGAZIONI
Le catecolamine adrenalina, noradrenalina e dopamina sono sintetizzate nella midollare adrenergica, nel
sistema nervoso simpatico e nel cervello. Esse influenzano virtualmente tutti i tessuti e sono coinvolte
assieme ad altri sistemi ormonali e neuronali nella regolazione di una gran varietà di processi fisiologici.
Poiché le catecolamine ed i loro metaboliti, metanefrina e normetanefrina, sono secreti in quantità in
eccesso in un certo numero di patologie, possono essere utilizzate a scopo diagnostico.
In tale contesto la diagnosi ed il monitoraggio di tumori del sistema nervoso hanno notevole importanza. Ciò
vale in primo luogo per il feocromocitoma, ma anche per il neuroblastoma e per il ganglioneuroma.
Grazie alla fase di estrazione all’inizio del dosaggio, si possono usare tutti i tipi di materiali di specie animali.
Funziona per ratti, topi ed altri. La struttura chimica delle catecolamine è identica in tutti gli animali.
3.
PRINCIPIO DEL TEST
Test immunoenzimatico assorbente su fase solida (ELISA) basato sul principio sandwich. I pozzetti sono
rivestiti con anticorpi di capra anti-coniglio. L’anticorpo liquido aggiunto, diretto verso l’epitopo di una
molecola di antigene, si lega alla piastra entro il tempo d’incubazione. L’antigene del campione viene
incubato nel pozzetto rivestito assieme al secondo anticorpo coniugato all’enzima (E-Ab) diretto verso una
differente regione della molecola antigenica. Dopo reazione con il substrato l’intensità del colore sviluppato
è proporzionale alla quantità di antigene presente. I risultati dei campioni possono essere determinati
direttamente usando la curva standard.
4.
AVVERTENZE E PRECAUZIONI
1. Solo per uso diagnostico in-vitro. Solo per uso professionale.
2. Leggere attentamente le istruzioni prima di iniziare il test. Utilizzare il manuale fornito nel kit. Assicurarsi
di aver compreso tutte le indicazioni.
3. In caso di danneggiamento del kit contattare IBL o il Vostro fornitore entro 1 settimana dal ricevimento
della merce. Non utilizzare i componenti danneggiati ma conservarli per fornire prove del danno assieme
al reclamo che inoltrerete al produttore/fornitore.
4. Rispettare lotto e scadenze. Non scambiare o mescolare tra loro reagenti di lotti diversi. Non usare i
reagenti scaduti.
5. Attenersi alle Buone Pratiche di Laboratorio e alle direttive di sicurezza. Indossare camici, guanti in
lattice e occhiali protettivi se necessario.
6. Alcuni reagenti del kit contengono sostanze pericolose che potrebbero causare irritazioni a pelle ed
occhi. Consultare la sezione MATERIALE FORNITO e le etichette per i dettagli precisi. Schede di
sicurezza del prodotto sono disponibili sul sito web IBL o su richiesta specifica ad IBL/fornitore.
7. I reagenti preparati e usati e le sostanze chimiche del kit devono essere trattati come rifiuti pericolosi
secondo le normative di sicurezza e la legislazione vigente nel Paese in cui il prodotto viene usato.
8. Il personale delle pulizie dev’essere informato dal personale specializzato sui possibili rischi e sulle
procedure da adottare.
9. Evitare il contatto con la soluzione stop. Può causare irritazioni e ustioni della pelle.
10. Tutti i reagenti del kit contenenti siero umano o plasma sono risultati negativi rispetto a HIV I/II, HBsAg e
HCV. Si raccomanda tuttavia di trattarli come potenzialmente pericolosi poiché non si può escludere in
maniera assoluta la presenza di questi o di altri agenti infettivi.
5.
CONSERVAZIONE E STABILITÀ
Il kit è spedito e trasportato a temperatura ambiente e deve essere conservato a 2-8 °C. Non esporre a luce
solare diretta e ad alte temperature. Le informazioni relative a conservazione e stabilità di tutti i reagenti e
dei campioni sono riportate nel capitolo corrispondente.
La piastra microtitrata aperta è stabile fino a scadenza del kit se conservata nel suo involucro ben chiuso
riposta a 2–8 °C.
Version 2014-12
1/9
Dopamine ELISA (RE59161)
6.
ITALIANO
PRELIEVO E CONSERVAZIONE DEI CAMPIONI
Il rilascio in-vivo di catecolamine e metanefrine è influenzato da diversi cibi e farmaci. Vitamina B,
caffè e banane, alfa-metildopa, MAO e COMT inibitori e la somministrazione di tutti i farmaci
collegati all’ipertensione dovrebbero essere interrotta per almeno 72 ore prima della raccolta del
campione dal paziente.
Plasma (EDTA)
I campioni di sangue vanno conservati a 2-8°C fino al momento della centrifugazione per separare il
plasma che deve avvenire entro 2 ore dalla raccolta del sangue.
Osservare le classiche precauzioni durante il prelievo venoso. Conservare l’integrità del campione di
sangue dal momento del prelievo al momento dell’esecuzione del test. Non usare campioni emolizzati,
itterici o lipemici. I campioni torbidi devono essere centrifugati per rimuovere il materiale particolato al loro
interno.
Conservazione:
2-8°C
≤ -20°C (Aliquote)
Stabilità:
6 ore
1 mese
Non esporre alla luce solare diretta e al calore.
Evitare la ripetizione di cicli di congelamento/scongelamento.
Spedire i campioni dopo loro congelamento.
Urina
È possibile usare campioni freschi e campioni delle 24 ore. Il volume totale delle urine delle 24 ore deve
essere raccolto in un unico recipiente con aggiunta di 10-15 mL di HCl 6 N come conservante. Segnare il
volume totale per il calcolo dei risultati. Mescolare e centrifugare i campioni prima di usare nel saggio.
Conservazione:
Stabilità:
7.
≤ -20°C (Aliquote)
6 mesi
Non esporre alla luce solare diretta e al calore.
Evitare la ripetizione di cicli di congelamento/scongelamento.
MATERIALE FORNITO
I reagenti forniti da questo kit sono sufficienti per eseguire fino a 96 determinazioni singolas o fino a
48 duplicati nel plasma ed urina.
La micropiastra può essere usata sia per Adrenalina, Noradrenalina che per Dopamina.
Quantità
Simbolo
1 x 12 x 8
MTP
Componente
Micropiastra
Strisce separabili. Coniugato con anti-coniglio IgG. (capra, policlonale).
Standard A-F
1 x 6 x 2.5 mL
CAL A-F
Adrenalina: 0; 1.5; 5.0; 15; 50; 150 ng/mL (0; 8; 27; 82; 273; 819 nmol/L)
Noradrenalina: 0; 5.0; 15; 50; 150; 500 ng/mL (0; 30; 89; 296; 887; 2955 nmol/L)
Dopamina: 0; 60; 180; 585; 2300; 11470 ng/mL (0; 392; 1175; 3819; 15014; 74876 nmol/L)
Pronto/a all’uso. Contiene: [-] Adrenalina, [-] Noradrenalina [-] Dopamina
(biologicamente attiva), 0.1 M HCl.
Controllo 1+2
1 x 2 x 2.5 mL
1 x 400 µL
CONTROL 1+2
Pronto/a all’uso. Contiene: [-] Adrenalina, [-] Noradrenalina [-] Dopamina
(biologicamente attiva), 0.1 M HCl. Per le concentrazioni /gli intervalli accettabili vedere
le etichette sulle provette.
ENZCONJ CONC Coniugato Enzimatico Concentrato (50x)
Contiene: streptavidina fosfatase alcalina, Tampone Tris, HCl, 0.01 % NaN3.
Piastra di Estrazione (Piastra Macrotiter)
4x
EXTRPLATE
2 x 60 mL
EXTRBUF
2 x 1.25 mL
COMT LYO
2 x 1.25 mL
COENZ
Soluzione Coenzimatica
1 x 3 mL
ENZBUF
Tampone Enzimatico
1 x 100 mL
RELEASEBUF
Tampone di Rilascio
Version 2014-12
24 pozzetti ciascuno. Rivestito con gel di affinità di borato.
Tampone di Estrazione
Di colore rosa. Pronto/a all’uso. Contiene: 0.016 % NaN3.
COMT liofilizzato
Contiene: Catecol-O-metiltransferasi (fegato di porco), NaN3.
Pronto/a all’uso. Contiene: S-Adenosil-L-Metionina, stabilizzatori.
Pronto/a all’uso. Contiene: Tampone Tris, HCl, stabilizzatori.
Di Colore Giallo. Pronto/a all’uso. Contiene: 0.1 M HCl, indicatore.
2/9
Dopamine ELISA (RE59161)
Quantità
Simbolo
2 x 3 mL
ACYLREAG
1 x 100 mL
8.
ITALIANO
Componente
Reagente di Acilazione
Pronto/a all’uso. Contiene: dimetilformamide, Etanolo. Attenzione! Tossico. Altamente
infiammabile.
WASHBUF CONC Tampone Lavaggio Concentrato (10x)
Contiene: Tampone Tris, HCl, Tween, 0.2 % NaN3.
COMT Additivo
1 x 2 mL
COMT ADD
1 x 8.0 mL
ANTISERUM DO
1 x 25 mL
PNPP SUBS
Soluzione Substrato PNPP
1 x 15 mL
PNPP STOP
Soluzione Stop PNPP
3x
FOIL
Contiene: plasma umano, stabilizzatori, 0.01 % Thimerosal.
Dopamina Antisiero
colorazione viola Pronto/a all’uso. Contiene: anticorpi contro Dopamina (coniglio),
Tampone, stabilizzatori.
Pronto/a all’uso. Contiene: p-nitrofenil fosfato (PNPP).
Pronto/a all’uso. Contiene: 1 M NaOH, 0.25 M EDTA.
Pellicola Adesiva
MATERIALI NECESSARI MA NON FORNITI
1.
2.
3.
4.
5.
6.
Micropipette (Multipette Eppendorf o similari, < 3 % CV). Volumi: 10; 10-100; 100-1000 µL
Agitatore orbitale (200-900 rpm) (p.e. EAS 2/4, SLT)
Vortex mixer
Micropipetta 8-Canali con contenitori per reagenti
Spruzzetta per lavaggi, lavatore per micropiastre automatico o semi automatico
Lettore per micropiastre in grado di leggere ad assorbanza di 405 nm (lunghezza d’onda di riferimento
600-650 nm)
7. Acqua bidistillata o deionizzata
8. Carta assorbente, puntali per pipette e timer
9. Provette usa e getta per diluizione dei campioni
10. 0.1 M HCl, per la diluzione dei campioni (Urina)
9.
NOTE PER LA PROCEDURA
1. Qualsiasi manipolazione impropria dei campioni o modifica alla procedura può compromettere i risultati.
Rispettare rigorosamente i volumi, i tempi e le temperature di incubazione e i passaggi di pretrattamento
dei campioni indicati in metodica. Utilizzare pipette calibrate.
2. Una volta iniziato il test completare tutti i passaggi senza interruzioni. Assicurarsi che tutti i reagenti
siano stati precedentemente preparati in tempo utile. Far raggiungere la temperatura ambiente ai
campioni e ai componenti del kit (18-25 °C) e mescolare delicatamente ciascun reattivo liquido e
campione prima dell’uso. Non creare schiuma durante il mescolamento.
3. Evitare la contaminazione di reagenti, pipette, pozzetti o provette. Usare puntali di plastica nuovi per
ogni reagente, standard e campione. Non scambiare i tappi tra loro. Tappare sempre i flaconi non
utilizzati. Non riutilizzare pozzetti/provette o reagenti.
4. Si consiglia di saggiare i campioni in doppio per poter identificare eventuali errori di pipettamento.
5. Usare uno schema di pipettamento per realizzare una appropriata distribuzione sulla piastra. Uno
schema di pipettamento per campioni e pretrattamento è disponibile al sito IBL-Homepage.
6. Il tempo di incubazione influisce sui risultati. Tutti i pozzetti dovrebbero essere manipolati nello stesso
ordine e sequenza temporale. Si raccomanda una pipetta multicanale a 8 canali per pipettare le
soluzioni in tutti i pozzetti.
7. Il lavaggio della micropiastra è importante. Pozzetti lavati in modo inappropriato possono portare a
risultati erronei. Si raccomanda una pipetta multicanale o un lavatore automatico per piastre. Non far
asciugare i pozzetti tra le varie incubazioni. Non graffiare i pozzetti rivestiti durante risciacqui e
aspirazioni. Risciacquare via e versare i reagenti con cura. Durante i risciacqui assicurarsi che i pozzetti
siano ben riempiti con la soluzione di lavaggio e che non ci siano residui nei pozzetti.
8. L’umidità influisce sui pozzetti/tubi rivestiti. Non aprire l’involucro finché non ha raggiunto la temperatura
ambiente. Riporre immediatamente i tubi/pozzetti non utilizzati nell’involucro con il disseccante.
Version 2014-12
3/9
Dopamine ELISA (RE59161)
10.
ITALIANO
PROCEDURA MANUALE
10.1. ISTRUZIONI PRE-TEST
Il contenuto del kit vale per 96 determinazioni e può essere suddiviso in 2 dosaggi separati.
Durante l’estrazione notevoli quantità di gel si possono separare dalla superficie della
piastra di estrazione. Questo non influenza i risultati del test.
Si deve evitare in ogni caso la contaminazione dell’aria da parte di disinfettanti in polvere o
in soluzione, usati per la pulizia di superfici o attrezzature, che contengano perossigeno,
come ad esempio il VIRKON®. Queste sostanze sono di notevole disturbo ai fini
dell’esecuzione. VIRKON® è un marchio registrato di DuPont.
10.1.1. Diluizione dei Campioni
I campioni con concentrazioni superiori al piú alto degli standard devono essere diluti secondo lo schema
seguente:
Campione
Plasma
Urina
da diluire
> standard più elevato
> standard più elevato
con
acqua bidist.
0.1 N HCl
Note
prima del processo di estrazione
prima del processo di estrazione
10.1.2. Estrazione di Campioni, Standard e Controlli (Piastra di Estrazione) (versione manuale)
Pipettare 20 µL di ogni Standard, Controlli e campioni di urina e 500 µL di ogni campioni di
1.
plasma nei rispettivi pozzetti della piastra di estrazione. Aggiungere 500 µL di acqua bidist ad ogni
pozzetti eccetto per i campioni di plasma per correggere volumi diversi.
Pipettare 1 mL di Tampone di Estrazione in ogni pozzetto.
2.
Coprire la piastra con pellicola adesiva. Estrarre 30 min a TA (18-25°C) su un agitatore orbitale
3.
(600–900 rpm).
Durante la estrazione la superficie di liquido deve umettare il foglio adesivo, ma il livello di liquido non
deve superare 2/3 di pozetti. Gli schizzi non influenzano i risultati.
4.
Rimuovere la pellicola adesiva. Svuotare immediatamente la piastra ed eliminare il liquido residuo su
una salvietta di carta.
Pipettare 2 mL di acqua bidist in ogni pozzetto.
5.
6.
Coprire la piastra con una nuova pellicola adesiva.
Agitare 5 min a TA (18-25°C) su un agitatore orbitale (600–900 rpm). Gli schizzi non influenzano i
risultati.
7.
Rimuovere la pellicola adesiva. Svuotare immediatamente la piastra ed eliminare il liquido residuo su
una salvietta di carta. Rimuovere completamente il fluido.
Pipettare 150 µL di Tampone di Estrazione in ogni pozzetto. Aggiungere 50 µL di Reagente di
8.
Acilazione ad ogni pozzetti. Mescolare immediatamente dopo la pipettatura.
Estrarre 20 min a TA (18-25°C) (senza pellicola adesiva) su un agitatore orbitale (400–600 rpm).
9.
10. Svuotare immediatamente la piastra ed eliminare il liquido residuo su una salvietta di carta.
Rimuovere completamente il fluido.
11. Pipettare 2 mL di acqua bidist in ogni pozzetto.
12. Coprire la piastra con una nuova pellicola adesiva. Agitare 5 min a TA (18-25°C) su un agitatore
orbitale (600–900 rpm). Gli schizzi non influenzano i risultati.
13. Rimuovere la pellicola adesiva. Svuotare immediatamente la piastra ed eliminare il liquido residuo su
una salvietta di carta. Rimuovere completamente il fluido.
14. Pipettare 300 µL di Tampone di Rilascio in ogni pozzetto.
15. Agitare 30 min a TA (18-25°C) (senza pellicola adesiva) su un agitatore orbitale (400–600 rpm).
I campioni preparati devono essere dosati il giorno stesso. Se non è possibile, coprire la piastra di
estrazione con pellicola adesivo durante la notte mantenla ad una temperatura di 2-8°C.
Version 2014-12
4/9
Dopamine ELISA (RE59161)
ITALIANO
10.1.3. Preparazione di componenti concentrati
I volumi indicati di seguito si riferiscono a un’esecuzione con 6 strisce (48 determinazioni).
Diluire /
dissolvere
Componente
con
Diluente
25 mL
WASHBUF CONC 225 mL acqua bidist.
120 µL
ENZCONJ CONC 6 mL
WASHBUF
(diluito)
Rapporto
1:10
1:51
Note
Mescolare
energicamente.
Preparare freschi ed
utilizzare solo una volta.
Mescolare senza formare
schiuma.
Conservazione Stabilità
2-8°C
4 settimane
18-25°C
5h
10.2. PROCEDURA DEL TEST (versione manuale)
10.2.1. Preparazione della Soluzione con Enzima COMT
La Soluzione con Enzima COMT dev’essere preparata direttamente prima dell’uso.
Dissolvere ogni componente del kit di COMT liofilizzato in 1.25 mL di acqua bidistillata e mescolare la
soluzione COMT dissolta.*
Poi pipettare 1.25 mL di Soluzione Coenzimatica seguita da 1.25 mL di Tampone Enzimatico e
0.40 mL di additivo COMT alle fiale di COMT miscelate, per ottenere un volume finale di 4.15 mL di
Soluzione Enzimatica COMT in fiala.
Usare una (1) fiale per 48 determinazioni di dopamina. La soluzione può essere torbida. Mescolare senza
provocare schiuma. La soluzione COMT è stabile a temperatura ambiente per un’ora.
* Se è necessaria solo una parte della soluzione COMT, il resto della soluzione dev’essere
immediatamente congelata alla temperatura di -20° C. La soluzione COMT è stabile a queste condizioni
per 1-2 mesi.
10.2.2. Derivatizzazione Enzimatica di Campioni, Standard e Controlli (Micropiastra)
Se usate pipette a spostamento positivo, pipettate il fluido residuo nei pozzetti corrispondenti della
piastra d’estrazione.
E’ utile tenere la piastra d’estrazione in posizione obliqua.
10.2.3. Per l’uso ai fini della ricerca di omogenati di tessuti e supernatanti di colture cellulari
raccomandiamo genericamente:
Il lavoro con supernatanti di colture cellulari dipende dalla matrice e dalle concentrazioni previste:
Secondo il protocollo dell’urina (estrazione di almeno 20 µL di supernatante) si può prevedere una
sensibilità di 5 ng/mL. Nel caso di una matrice con aggiunta di siero (FCS), il protocollo del plasma
(estrazione di 500 µL di supernatante) si può applicare con una sensibilità circa dell’4 pg/mL.
Per omogenati di tessuti, in fase di omogeneizzazione non si deve usare acido perclorico. Per ulteriori
dettagli chiedere ad IBL.
10.2.4. Dopamina per urina e plasma
IMPORTANTE: Diluizione dello standard estratto, i controlli e campioni di urina devono essere eseguiti in
provette a parte, prima di pipettare nei pozzetti della Micropiastra.
1.
Diluire tutti Standard estratti, Controlli estratti e campioni di urina estratti in proporzione 1:51 con
Tampone di Rilascio in provette usa e getta (ad es. 10 µL di campione estratto + 500 µL di Tampone
di Rilascio).
Pipettare 75 µL di Soluzione con Enzima COMT preparato sul momento in ogni pozzetto della
2.
Micropiastra. Agitare brevemente.
Pipettare nei rispettivi pozzetti 100 µL di Standard, di Controlli e di campioni di urina estratti e
3.
prediluiti.
Pipettare 100 µL di campioni di plasma estratto direttamente (senza pre-diluzione) nei rispettivi
pozzetti della Micropiastra. Durante questa fase immergere la punta del contagocce direttamente
nella soluzione COMT. La colorazione diventa rosa. Scuotere brevemente.
Pipettare 50 µL di Antisiero Dopamina (colorazione viola) in ogni pozzetti.
4.
Coprire la piastra con pellicola adesiva. Incubare 120 min a TA (18-25°C) su un agitatore orbitale
5.
(400–600 rpm).
Version 2014-12
5/9
Dopamine ELISA (RE59161)
6.
7.
8.
9.
10.
11.
12.
13.
14.
11.
ITALIANO
Rimuovere la pellicola adesiva. Eliminare la soluzione d’incubazione. Lavare la piastra 6 x con
250-300 µL di Tampone Lavaggio diluito Rimuovere l’eccesso di soluzione picchiettando la piastra
capovolta su una salvietta di carta.
Pipettare in ogni pozzetto 100 µL di Coniugato Enzimatico preparato sul momento.
Coprire la piastra con una nuova pellicola adesiva. Incubare 60 min a TA (18-25°C) su un agitatore
orbitale (400–600 rpm).
Rimuovere la pellicola adesiva. Eliminare la soluzione d’incubazione. Lavare la piastra 6 x con
250-300 µL di Tampone Lavaggio diluito. Rimuovere l’eccesso di soluzione picchiettando la piastra
capovolta su una salvietta di carta.
Per aggiungere le Soluzioni Substrato e Stop usare, possibilmente, una micropipetta 8-canali.
Pipettare con intervalli di tempo costanti per le Soluzioni Stop e Substrato. Usare uno spostamento
positivo ed evitare la formazione di bolle d’aria.
Pipettare 200 µL di Soluzione Substrato in ogni pozetto.
Incubare 40 min a TA (18-25°C) (senza pellicola adesiva) su un agitatore orbitale (400–600 rpm).
Fermare la reazione substrato aggiungendo 50 µL di Soluzione Stop PNPP in ogni pozzetto.
Mescolare delicatamente il contenuto agitando leggermente la piastra.
Misurare la densità ottica con un fotometro a 405 nm (lunghezza d’onda di riferimento: 600-650 nm)
entro 60 min dopo aver pipettato la Soluzione Stop. Non bollas d’aria devono essere visibile.
PROCEDURA AUTOMATIZZATA
11.1. ISTRUZIONI PRE-TEST (versione automatizzata)
Il contenuto del kit vale per 96 determinazioni e può essere suddiviso in 2 dosaggi separati.
Durante l’estrazione notevoli quantità di gel si possono separare dalla superficie della
piastra di estrazione. Questo non influenza i risultati del test.
Si deve evitare in ogni caso la contaminazione dell’aria da parte di disinfettanti in polvere o
in soluzione, usati per la pulizia di superfici o attrezzature, che contengano perossigeno,
come ad esempio il VIRKON®. Queste sostanze sono di notevole disturbo ai fini
dell’esecuzione. VIRKON® è un marchio registrato di DuPont.
11.1.1. Diluizione dei Campioni
I campioni con concentrazioni superiori al piú alto degli standard devono essere diluti secondo lo schema
seguente:
Campione
Plasma
Urina
da diluire
> standard più elevato
> standard più elevato
con
acqua bidist.
0.1 N HCl
Note
prima del processo di estrazione
prima del processo di estrazione
11.1.2. Estrazione di campioni, Standard e Controlli (Piastra di Estrazione) (versione automatizzata)
Pipettare 30 µL di ogni Standard, Controllo e campione di urina e 750 µL di ogni campione di
1.
plasma nei rispettivi pozzetti del Piastra di Estrazione. Aggiungere 750 µL di acqua bidist. ad ogni
pozzetti eccetto per il campioni di plasma per correggere volumi diversi.
Pipettare 1 mL di Tampone di Estrazione in ogni pozzetti.
2.
Coprire la piastra con pellicola adesiva. Estratte 30 min a TA (18-25°C) su un agitatore orbital
3.
(600–900 rpm).
Durante la estrazione la superficie di liquido devono umettare il pellicola adesiva, ma il livello di
liquido non deve superare 2/3 di pozzetti. Gli schizzi non influenzano i risultati.
4.
Rimuovere la pellicola adesiva. Svuotare immediatamente la piastra ed eliminare il liquido residuo su
una salvietta di carta.
Pipettare 2 mL di acqua bidist in ogni pozzetti.
5.
6.
Coprire la piastra con una nuova pellicola adesiva.
Agitare 5 min a TA (18-25°C) su un agitador orbital (600–900 rpm). Gli schizzi non influenzano i
risultati.
7.
Rimuovere la pellicola adesiva. Svuotare immediatamente la piastra ed eliminare il liquido residuo su
una salvietta di carta. Rimuovere completamente il fluido.
Pipettare 150 µL di Tampone di Estrazione in ogni pozzetti. Aggiungere 50 µL di Reagente di
8.
Acilazione ad ogni pozzetti. Mescolare immediatamente dopo la pipettatura.
Version 2014-12
6/9
Dopamine ELISA (RE59161)
ITALIANO
Estratte 20 min a TA (18-25°C) (senza pellicola adesiva) su un Agitatore orbitale (400–600 rpm).
Svuotare immediatamente la piastra ed eliminare il liquido residuo su una salvietta di carta.
Rimuovere completamente il fluido.
11. Pipettare 2 mL di acqua bidist. in ogni pozzetti.
12. Coprire la piastra con una nuova pellicola adesiva. Agitare 5 min a TA (18-25°C) su un agitatore
orbital (600–900 rpm). Gli schizzi non influenzano i risultati.
13. Rimuovere la pellicola adesiva. Svuotare immediatamente la piastra ed eliminare il liquido residuo su
una salvietta di carta. Rimuovere completamente il fluido.
14. Pipettare 450 µL di Tampone di Rilascio in ogni pozetti.
15. Agitare 30 min a TA (18-25°C) (senza pellicola adesiva) su un Agitatore orbitale (400–600 rpm).
I campioni preparati devono essere dosati il giorno stesso. Se non è possible, coprire la piastra di estrazione
con pellicola adesiva durante la notte mantenla ad una temperatura di 2-8°C.
9.
10.
11.1.3. Preparazione di componenti concentrati (versione automatizzata)
I volumi indicati di seguito si riferiscono a un’esecuzione con 6 strisce (48 determinazioni).
Diluire /
dissolvere
Componente
con
Diluente
50 mL
WASHBUF CONC 450 mL acqua bidist.
190 µL
WASHBUF
ENZCONJ CONC 9.5 mL
(diluito)
Rapporto
Note
Conservazione Stabilità
1:10
Mescolare
energicamente.
2-8°C
4 settimane
1:51
Preparare freschi ed
utilizzare solo una volta.
Mescolare senza
formare schiuma.
18-25°C
5h
11.2. PROCEDURA DEL TEST (versione automatizzata)
11.2.1. Preparazione della Soluzione con Enzima COMT
La Soluzione con Enzima COMT dev’essere preparata direttamente prima dell’uso.
Dissolvere ogni componente del kit di COMT liofilizzato in 1.25 mL di acqua bidistillata e mescolare la
soluzione COMT dissolta.*
Poi pipettare 1.25 mL di Soluzione Coenzimatica seguita da 1.25 mL di Tampone Enzimatico e
0.40 mL di additivo COMT alle fiale di COMT miscelate, per ottenere un volume finale di 4.15 mL di
Soluzione Enzimatica COMT in fiala.
Usare una (1) fiale per 48 determinazioni di dopamina. La soluzione può essere torbida. Mescolare senza
provocare schiuma. La soluzione COMT è stabile a temperatura ambiente per un’ora.
* Se è necessaria solo una parte della soluzione COMT, il resto della soluzione dev’essere
immediatamente congelata alla temperatura di -20° C. La soluzione COMT è stabile a queste condizioni
per 1-2 mesi.
11.2.2. Dopamine per urina e plasma (versione automatizzata)
IMPORTANTE: Diluizione dello standard estratto, i controlli e campioni di urina devono essere eseguiti in
provette a parte, prima di pipettare nei pozzetti della Micropiastra.
1.
Diluire tutti Standard estratti, Controlli estratti e campioni di urina estratti in proporzione 1:51 con
Tampone di Rilascio in provette usa e getta (ad es. 10 µL di Campione estratto + 500 µL di Tampone
di Rilascio).
Pipettare
75 µL di Soluzione con Enzima COMT preparato sul momento in ogni pozzetto della
2.
Micropiastra. Agitare brevemente.
Pipettare nei rispettivi pozzetti 100 µL di Standard, Controlli e campioni di urina estratti e prediluiti.
3.
Pipettare 100 µL di campioni di plasma estratto direttamente (senza pre-diluzione) nei rispettivi
pozzetti della Micropiastra. Durante questa fase immergere la punta del contagocce direttamente
nella soluzione COMT. La colorazione diventa rosa. Scuotere la piastra 1 min.
Pipettare 50 µL di Antisiero Dopamina (colorazione viola) in ogni pozzetti.
4.
Coprire la piastra con pellicola adesiva. Incubare 120 min a TA (18-25°C) su un agitatore orbitale
5.
(400–600 rpm).
Eliminare la soluzione d’incubazione. Lavare la piastra 6 x con 250-300 µL di Tampone Lavaggio
6.
diluito.
Version 2014-12
7/9
Dopamine ELISA (RE59161)
7.
8.
9.
10.
11.
12.
13.
14.
12.
ITALIANO
Pipettare in ogni pozzetto 100 µL di Coniugato Enzimatico preparato sul momento.
Coprire la piastra con una nuova pellicola adesiva. Incubare 60 min a TA (18-25°C) su un agitatore
orbitale (400–600 rpm).
Eliminare la soluzione d’incubazione. Lavare la piastra 6 x con 250-300 µL di Tampone Lavaggio
diluito.
Pipettare con intervalli di tempo costanti per le Soluzioni Stop e Substrato.
Pipettare 200 µL di Soluzione Substrato in ogni pozetto.
Incubare 40 min a TA (18-25°C) su un agitatore orbitale (400–600 rpm). Se la temperatura del
sistema automatico supera 25°C, abbreviare il tempo d’incubazione a 30 minuti per evitare il
superamento del segnale.
Fermare la reazione substrato aggiungendo 50 µL di Soluzione Stop PNPP in ogni pozzetto.
Mescolare delicatamente il contenuto agitando leggermente la piastra.
Misurare la densità ottica con un fotometro a 405 nm (lunghezza d’onda di riferimento:
600-650 nm) entro 60 min dopo aver pipettato la Soluzione Stop.
CONTROLLO DI QUALITA’
I risultati del test sono validi solo se il test è stato eseguito seguendo le istruzioni per l’uso. L’utente deve
inoltre attenersi rigorosamente ai principi della BPL (Buona Pratica di Laboratorio) o a norme equivalenti. Gli
utenti e il laboratorio devono avere un sistema di formulazione della diagnosi conforme alle Buone Pratiche
di Laboratorio. Tutti i controlli devono risultare compresi entro gli intervalli accettabili indicati sulle etichette e
il Certificato QC. Se i criteri non sono soddisfatti il test non è valido e dovrebbe essere ripetuto. Ogni
laboratorio dovrebbe usare campioni noti come ulteriori controlli. Si consiglia la partecipazione a programmi
di controllo qualità periodici.
In caso di deviazioni devono essere forniti i seguenti dati: Scadenza dei reagenti (preparati), condizioni di
conservazione, pipette, strumenti, condizioni d’incubazione e metodi di lavaggio.
13.
CALCOLO DEI RISULTATI
La DO degli standard ottenuto (y-axis, linear) è tracciato in funzione della loro concentrazione (asse x,
logaritmico) o su carta per grafico semilogaritmico o con un metodo automatizzato. Un buon sistema è
costituito dalla spline cubica, dal Modello Logistico a 4 Parametri o Logit-Log.
Per calcolare la curva standard, applicare ogni segnale degli standard.
La concentrazione dei controllos di kit e dei campioni di urina si può leggere direttamente dalla curva
standard corrispondente.
I risultati della quantità di campioni di plasma in ng/mL devono essere divisi per 1275. Questo fattore di
correzione corrisponde alla differenza del volume richiesto durante la fase di estrazione ed alla predilezione
1:51 dei standard. Per converire da ng/mL a pg/mL moltiplicare per 1000.
In caso di campioni diluiti i valori devono essere moltiplicati per il fattore di diluzione corrispondente.
Campioni che presentino concentrazioni oltre gli standard massimi devono essere diluiti come descritto
nelle ISTRUZIONI DI PREPARAZIONE DEL TEST e dosati nuovamente.
Calcolare la secrezione 24 h per ogni campioni di urina: µg/24h = µg/L x L/24h
Conversione:
Dopamina (µg/L) x 6.528 = nmol/L
(OD)
Tipica Curva di Calibrazione
(Esempio. Non usare per il calcolo!)
Standard
Dopamina
DOMedia
(ng/mL)
A
0
0.135
B
60
0.287
C
180
0.500
D
585
1.113
E
2300
2.105
F
11470
2.522
Version 2014-12
Dopamin ELISA
3.000
2.250
DO/DOmax
(%)
0.0
6.4
15.3
41.0
82.5
100
1.500
0.750
0.000
1
10
100
1000
10000
100000
(ng/L)
8/9
Dopamine ELISA (RE59161)
14.
ITALIANO
VALORI ATTESI
I soli risultati non dovrebbero essere l’unica motivazione alla base di una scelta terapeutica. Devono essere
correlati ad altre osservazioni cliniche e test diagnostici.
Soggetti apparentemente sani mostrano i seguenti valori: (5 % - 95 % percentile)
Si consiglia ad ogni laboratorio di calcolare i propri valori di riferimento.
Dopamina
15.
Urina
µg/giorni
nmol/giorni
< 600
< 3917
pg/mL
< 100
Plasma
nmol/L
< 0.65
LIMITI DELLA PROCEDURA
La raccolta e conservazione dei campioni ha influenza significativa sui risultati del test. Vedere la sezione
PRELIEVO E CONSERVAZIONE DEI CAMPIONI per maggiori dettagli.
Per le reazioni crociate vedere la sezione PERFORMANCE.
I seguenti componenti del sangue non hanno effetto significativo (+/-20%) sui risultati del test fino ai livelli di
concentrazione riportati in tabella:
Emoglobina
Bilirubina
Trigliceridi
16.
2.0 mg/mL
1.0 mg/mL
91 mg/mL
PERFORMANCE
Specificità Analitica
(Reattività Crociate)
Sensibilità Analitica
(Limite di Rilevazione)
Precisione
Intra-Saggio
Inter-Saggio
Sostanza
Dopamina
Adrenalina
Noradrenalina
Metanefrina
Normetanefrina
3-MT
L-DOPA
Urina
Plasma
Urina
Plasma
Urina
Plasma
Dopamina
100
< 0.05
< 0.05
< 0.05
< 0.05
< 0.05
< 0.05
5 ng/mL
4 pg/mL
Intervallo (ng/mL)
37 - 1549
0.046 – 1.402
47 - 990
0.213 – 1.055
Intervallo (ng/mL)
Linearità
Recupero
Metodo di Paragone verso
HPLC
17.
Urina [ng/mL]
141 – 5732
Plasma [pg/mL]
0.04 – 1.3
Non si rileva effetto gancio.
Mean (%)
Urina [ng/mL]
101.5
Plasma [pg/mL]
91
Dopamina
Cross-reattività di altre sostanze
esaminate < 0.5 %
Media (Zero-Standard) + 2SD
CV (%)
7
11
10.8
16.3
Diluizioni Seriali
fino a
1:32
1:16
Range (%)
89 – 113
70 - 113
Intervallo (%)
87 - 114
100 - 135
% Recupero dopo i
picchi
IBL = 1.06 x HPLC -0.154; r = 0.985; n = 90
RIFERIMENTI BIBLIOGRAFICI SUL PRODOTTO
1. Rust MB, Faulhaber J et. al. Neurogenic Mechanisms Contribute to Hypertension in Mice with Disruption
of the K-CL Cotransporter KCC3. Circulation Research, January (2006)
2. Creces J., Appleton Ch.: Catecholamines and their Metabolites: Evaluation of a commercial ELISA. Clin.
Biochem., QML Pathology, Brisbane QLD (2004)
3. Adams, J. M. et al. Effects of 17β-Estradiol on hypoglycemia-induced increases in plasma
catecholamines in the rat. Poster Society for Neuroscience, Annual Meeting, New Orleans (2003)
4. Westermann J, Hubl W, Kaiser N, Salewski L, Simple, rapid and sensitive determination of epinephrine
and norepinephrine in urine and plasma by non-competitive enzyme immunoassay, compared with
HPLC method. Clin. Lab., 48: 61-71 (2002)
Version 2014-12
9/9
Symbols / Symbole / Symbôles / Símbolos / Símbolos / Σύµβολα
REF
Cat.-No.: / Kat.-Nr.: / No.- Cat.: / Cat.-No.: / N.º Cat.: / N.–Cat.: / Αριθµός-Κατ.:
LOT
Lot-No.: / Chargen-Bez.: / No. Lot: / Lot-No.: / Lote N.º: / Lotto n.: / Αριθµός -Παραγωγή:
Use by: / Verwendbar bis: / Utiliser à: / Usado por: / Usar até: / Da utilizzare entro: /
Χρησιµοποιείται από:
No. of Tests: / Kitgröße: / Nb. de Tests: / No. de Determ.: / N.º de Testes: / Quantità dei tests: /
Αριθµός εξετάσεων:
CONC
LYO
IVD
Concentrate / Konzentrat / Concentré / Concentrar / Concentrado / Concentrato / Συµπύκνωµα
Lyophilized / Lyophilisat / Lyophilisé / Liofilizado / Liofilizado / Liofilizzato / Λυοφιλιασµένο
In Vitro Diagnostic Medical Device. / In-vitro-Diagnostikum. / Appareil Médical pour Diagnostics In
Vitro. / Dispositivo Médico para Diagnóstico In Vitro. / Equipamento Médico de Diagnóstico In
Vitro. / Dispositivo Medico Diagnostico In vitro. / Ιατρική συσκευή για In-Vitro ∆ιάγνωση.
Evaluation kit. / Nur für Leistungsbewertungszwecke. / Kit pour évaluation. / Juego de Reactivos
para Evaluació. / Kit de avaliação. / Kit di evaluazione. / Κιτ Αξιολόγησης.
Read instructions before use. / Arbeitsanleitung lesen. / Lire la fiche technique avant emploi. /
Lea las instrucciones antes de usar. / Ler as instruções antes de usar. / Leggere le istruzioni
prima dell’uso. / ∆ιαβάστε τις οδηγίες πριν την χρήση.
Keep away from heat or direct sun light. / Vor Hitze und direkter Sonneneinstrahlung schützen. /
Garder à l’abri de la chaleur et de toute exposition lumineuse. / Manténgase alejado del calor o la
luz solar directa. / Manter longe do calor ou luz solar directa. / Non esporre ai raggi solari. / Να
φυλάσσεται µακριά από θερµότητα και άµεση επαφή µε το φως του ηλίου.
Store at: / Lagern bei: / Stocker à: / Almacene a: / Armazenar a: / Conservare a: / Αποθήκευση
στους:
Manufacturer: / Hersteller: / Fabricant: / Productor: / Fabricante: / Fabbricante: / Παραγωγός:
Caution! / Vorsicht! / Attention! / ¡Precaución! / Cuidado! / Attenzione! / Προσοχή!
Symbols of the kit components see MATERIALS SUPPLIED.
Die Symbole der Komponenten sind im Kapitel KOMPONENTEN DES KITS beschrieben.
Voir MATERIEL FOURNI pour les symbôles des composants du kit.
Símbolos de los componentes del juego de reactivos, vea MATERIALES SUMINISTRADOS.
Para símbolos dos componentes do kit ver MATERIAIS FORNECIDOS.
Per i simboli dei componenti del kit si veda COMPONENTI DEL KIT.
Για τα σύµβολα των συστατικών του κιτ συµβουλευτείτε το ΠΑΡΕΧΟΜΕΝΑ ΥΛΙΚΑ.
IBL AFFILIATES WORLDWIDE
IBL International GmbH
Flughafenstr. 52A, 22335 Hamburg, Germany
IBL International Corp.
194 Wildcat Road, Toronto, Ontario M3J 2N5, Canada
Tel.:
E-MAIL:
WEB:
Tel.:
E-MAIL:
WEB:
+ 49 (0) 40 532891 -0 Fax: -11
[email protected]
http://www.IBL-International.com
+1 (416) 645 -1703 Fax: -1704
[email protected]
http://www.IBL-International.com
LIABILITY: Complaints will be accepted in each mode –written or vocal. Preferred is that the complaint is accompanied with the test performance
and results. Any modification of the test procedure or exchange or mixing of components of different lots could negatively affect the results. These
cases invalidate any claim for replacement. Regardless, in the event of any claim, the manufacturer’s liability is not to exceed the value of the test kit.
Any damage caused to the kit during transportation is not subject to the liability of the manufacturer
Symbols Version 3.5 / 2012-01-20