COMPITO del 27/11/12
Soluzioni
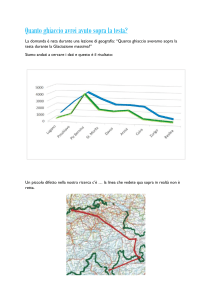
★ Per tutti: Una sfera di massa ms = 35 g e raggio r =
3 cm è mantenuta completamente immersa in acqua
da una molla il cui allungamento è pari a 4 cm. Qual
è la costante elastica della molla?
Se la sfera viene lasciata libera, quanto tempo
impiega a raggiungere la superficie del liquido
sapendo che si trova ad una profondità h = 2.5 m?
Solo per esame da 9CFU: Come cambierebbero i
risultati dell’ultima domanda se la pallina fosse
soggetta ad una forza di attrito costante da parte del
liquido e pari a FA = 0.6 N?
h
La sfera è mantenuta immersa per l’equilibro tra la
forza di Archimede e la somma tra la forza di gravità
e della molla
FArch = Fgrav+Fmolla
ρa Vs g = ms g + k Δl
con ρa densità dell’acqua, Vs volume della sfera e Δl allungamento della molla. La
densità della sfera è ρs = ms /(4/3*π*rs3) = 0.31 g cm-3. Si ottiene
k = (ρa / ρs - 1) ms g / Δl = 19.1 N/m
Se la pallina viene staccata dalla molla è soggetta ad una forza costante verso l’alto pari
a
F = FArch - Fgrav
si tratta quindi di un moto uniformemente accelerato con accelerazione
a = F/mp = (ρa / ρp - 1) g
pertanto, tenuto conto che la pallina parte da ferma, lo spazio percorso è
s = 1/2 a t2
ovvero il tempo necessario a raggiungere la superficie è
t = (2 h / a)1/2 = (2 h / [(ρa / ρp - 1) g] )1/2 = 0.48 s
Nel caso in cui sia presente la forza di attrito FA,
F = FArch - Fgrav - FA
a = F/mp = (ρa / ρp - 1) g - FA/mp
t = (2 h / a)1/2 = (2 h / [(ρa / ρp - 1) g - FA/mp] )1/2 = 1.03 s
★ Un blocco di metallo con massa m = 1.5 kg alla temperatura Tm = -150 °C, viene posto
all’interno di un calorimetro ideale che contiene 2.5 kg di acqua alla temperatura Ta = 15
°C. All’equilibrio si forma una miscela di acqua e ghiaccio. Se la massa del ghiaccio è
pari a 235 g, qual’è il calore specifico del metallo in Joule/kg/°C ?
Se all’equilibrio si ha un miscela di acqua e ghiaccio, la temperatura finale deve essere
Tf = 0 °C
per cui basta eguagliare il calore assorbito dal metallo per passare da -150 a 0 °C, al
calore ceduto dall’acqua per passare da 5 a 0 °C più il calore ceduto per far diventare
ghiaccio 250 g di acqua. Ovvero
m cm (Tf - Tm) = ma ca (Ta-Tf) + mg qf
dove mg è la massa del ghiaccio che si forma e qf è il calore latente di fusione/
solidificazione. Per cui
cm = ( ma ca (Ta-Tf) + mg qf ) / ( m (Tf - Tm) ) = ( 37.5 kcal + 18.8 kcal ) / 225 kg °C
= 0.25 kcal/kg/°C = 1047 J/kg/°C
★ Un recipiente rigido a pareti adiabatiche è diviso da una parete adiabatica in due parti
uguali che contengono rispettivamente n1=4 moli a T1=90 °C e n2=8 moli a T2=25 °C
dello stesso gas perfetto biatomico. Si toglie la parete separatrice ed il gas si rimescola
espandendosi liberamente e portandosi alla temperatura T3. Calcolare:
a) la variazione di energia interna totale del gas;
b) il valore della temperatura T3 di equilibrio;
c) la variazione di entropia del gas.
TUTTO il gas all’interno del contenitore è, complessivamente, un sistema isolato.
Quando si rimuove la parete che separa le due parti, il gas si espande LIBERAMENTE
ovvero senza compiere lavoro (si tratta infatti di una espansione libera). Pertanto la
variazione di energia interna di tutto il gas è nulla
ΔU = 0
Per trovare T3 basta scrivere la variazione di energia interna
ΔU = ΔU1+ΔU2 = n1 CV ΔT1 + n2 CV ΔT2 = n1 CV (T3-T1) + n2 CV (T3-T2)
dove si sono considerate le variazioni di energia interna dei due gas inizialmente
separati. Sapendo che ΔU = 0 si ottiene facilmente
n1 CV (T3-T1) + n2 CV (T3-T2) = 0
T3 = ( n1T1 + n2T2 )/( n1 + n2 ) = 319.8 K = 46.7 °C
si noti come, SOLO in questo caso, è indifferente l’utilizzo delle temperature in Kelvin o
gradi centigradi.
Per trovare la variazione di entropia, si può notare che si ha una trasformazione
irreversibile (è una espansione libera) in un sistema isolato pertanto ΔS>0. Per quanto
riguarda il valore esatto si può scrivere
ΔS = ΔS1+ΔS2
ovvero considerare la variazione di entropia dei due gas inizialmente separati. Poiché
l’entropia è una funzione di stato ΔS1 e ΔS2 dipendono soltanto dallo stato iniziale e
dallo stato finale e pertanto è sufficiente considerare una qualsiasi trasformazione
reversibile che porti i gas dagli stessi stati iniziali agli stessi stati finali. Per una qualsiasi
trasformazione reversibile del gas perfetto vale
ΔSif = n CV ln(Tf/Ti) + n R ln(Vf/Vi)
ovvero
ΔS = n1 CV ln(T3/T1) + n1 R ln(V3/V1) + n2 CV ln(T3/T2) + n2 R ln(V3/V2)
con CV = 5/2 R, V3 = 2V1 = 2V2 e T1, T2, T3 noti (in Kelvin) si ottiene
ΔS = ΔS1+ΔS2 = 12.5 J/K + 57.7 J/K = 70.2 J/K