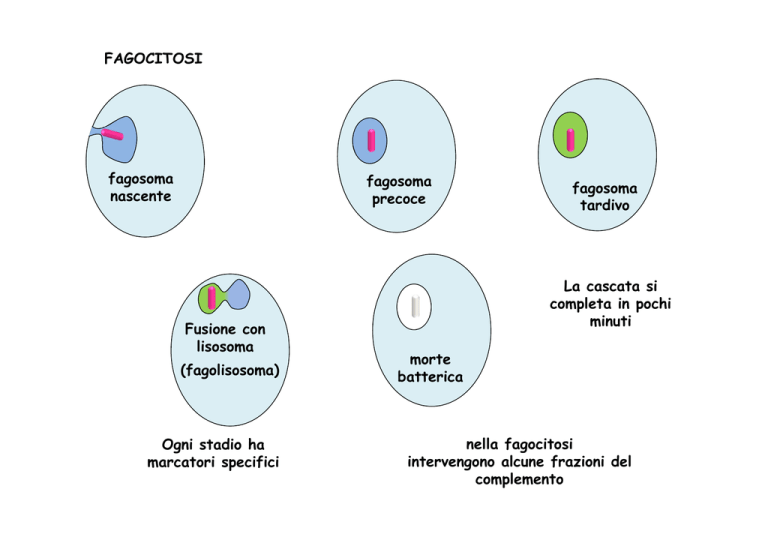
FAGOCITOSI
fagosoma
nascente
fagosoma
precoce
Fusione con
lisosoma
(fagolisosoma)
Ogni stadio ha
marcatori specifici
fagosoma
tardivo
La cascata si
completa in pochi
minuti
morte
batterica
nella fagocitosi
intervengono alcune frazioni del
complemento
COMPLEMENTO (C’): 25 proteine
plasmatiche
7 recettori diversi
riconoscono le
componenti di C’
Opsonizzazione batteri
lisi batteri
lisi cellule infettate
(da virus)
Induzione
dell’infiammazione
Normalità: OFF
ATTIVAZIONE
Chemiotassi dei
leucociti
via classica
(Complesso Ag/Ab)
RICHIEDE ANTICORPI
(RISPOSTA
ADATTATIVA)
via della lectina
Mannano (patogeno) +
lectine (siero)
via alternativa
superficie del patogeno
In realtà la più
frequente..
Attivazione del complemento
VIA ALTERNATIVA
C3
C3b
Idrolisi spontanea
(instabile in fase acquosa)
C3a
In presenza di un patogeno C3b si
lega covalentemente alla superficie
C3b
B
C3b legato si lega al “fattore B”
Il fattore B legato a C3b viene
tagliato dal fattore D (proteasi)
C3b
Bb
Ba
C3b+Bb = C3 convertasi della via
alternativa
RUOLO CHIAVE
NELL’INFIAMMAZIONE
C5b si lega e richiama
C6-C7-C8-C9
(polimerico)
Formando il MAC
(membrane attack complex )
C5b
C5a
Complesso C3bBb3b:
C5 convertasi
C7
C5b C 6 C 8 C 9
9
C 9C 9
C3b
Che provoca la formazione di fori nelle membrane
di cellule eucariotiche e batteri didermi
C3a
C3
Una molecola di C3 o C5 convertasi può catalizzare il
taglio di centinaia-migliaia di molecole bersaglio
C3 convertasi
C3b (C4b) ha un’azione
OPSONIZZANTE
CON UN MECCANISMO A CERNIERA CHE
COINVOLGE RECETTORI
e sui fagociti
Opsonine:
Legano i microbi ai
fagociti
sui batteri
C3b si lega in modo ASPECIFICO alle
superfici batteriche
Il taglio espone un legame
tioestere molto reattivo
Se C3b si lega a cellule eucariotiche è
distrutto dal fattore H (proteasi)
C3b
OH
Che reagisce con gruppi OH
di cellule vicine
I batteri non hanno il fattore H
restano opsonizzati
Sui fagociti ci sono recettori SPECIFICI che legano C3b,
stimolando la fagocitosi dei batteri opsonizzati
chemiotassine
complemento
Chemiotassine batteriche
RICHIAMO
Es. N-term rimosse
dalle proteine
N-fMet-Leu-Phe:
efficace a [10-11 M]
NORMALITÀ
ATTIVAZIONE
Fagocitosi lenta
OPSONINE
Anticorpi
MEDIAZIONE DELL’INFIAMMAZIONE +
RECLUTAMENTO DEI FAGOCITI
Chemiotassi positiva
per i leucociti
VASODILATAZIONE
DIAPEDESI
C5a-C3a-C4a
Espressione di molecole
di adesione
selectine
integrine
ATTIVITA’ ANAFILOTOSSICA
C5a-C3a-C4a si legano
anche ai mastociti
Cellule ricche di granuli citoplasmatici
situate nel tessuto connettivo,
specialmente lungo i vasi sanguigni
ne inducono la degranulazione
Rilascio di istamina
e NO
vasodilatazione
MONOCITI
RICHIAMO:
sostanze emesse
dai PMN
CELLULE A
VITA LUNGA
DIFFERENZIABILI
ARRIVANO
DOPO I PMN
I monociti possono
stabilirsi nei tessuti
citochine
citochine
MACROFAGI
ATTIVAZIONE
CITOCHINE:
molecole proteiche prodotte
da vari tipi cellulari
ELIMINANO
DETRITI E
BATTERI RESIDUI
Attivazione dei macrofagi
TLR (Toll-Like-Receptors)
Specifici per le
sottopopolazioni di MAMP
Altri sulla membrana del
fagosoma
Alcuni sulle membrane di
molte cellule
Bersagli interni
Bersagli esterni
TLR + bersaglio
NF-kB (nuclear Factor kB)
citochine
MACROFAGI: RUOLO CENTRALE NELLA RISPOSTA
IMMUNITARIA
INTERAGISCONO CON ALTRE CELLULE ATTRAVERSO
LE CITOCHINE- presentano l’antigene (APC)
INFIAMMAZIONE ACUTA
CELLULE DELL’IMMUNITA’
ADATTATIVA
Cellule delle mucose
ELUSIONE DELLE DIFESE DELL’OSPITE
IMPEDIRE l’attivazione del
complemento mimando i
tessuti dell’ospite
Es. Neisseria: acido sialico
(comune sulle cellule eucariotiche) sul
lipooligosaccaride (LOS)
REPRIMERE l’attivazione
Poxvirus: proteina che mima
quella adibita al controllo
dell’attivazione di C’
MASCHERAMENTO DEI RECETTORI
PER IL COMPLEMENTO
STRATI S
Impedire la penetrazione del
M.A.C
Es. Salmonella: rivestimenti
esterni
PREVENZIONE DELLA FAGOCITOSI
MODULAZIONE NEGATIVA DELLA
PRODUZIONE DI MOLECOLE
CHEMOTATTICHE
VARIAZIONE DI
ANTIGENI SUPERFICIALI
INIBIZIONE DEL
RICHIAMO DEI PMN
OSTACOLO AL
RICONOSCIMENTO
PARALIZZARE IL CITOSCHELETRO
DI ACTINA DEI FAGOCITI
RESTANDO ALL’ESTERNO
CIRCONDARSI DI UNA CAPSULA
VISCOSA (BATTERI DIFFUSI
DAL SANGUE)
OSTACOLO ALLA
FAGOCITOSI
microrganismi relativamente
resistenti agli enzimi lisosomiali
L’ESPLOSIONE DEI LISOSOMI
NEL CITOPLASMA
UCCISIONE DEI FAGOCITI
Sono in grado di causare..
ANCHE ENTRARE NELLE CELLULE E’ UN MODO DI
SFUGGIRE ALLA FAGOCITOSI
YERSINIA
MECCANISMO A
CERNIERA (ZIPPER)
SALMONELLASHIGELLA
MECCANISMO A
GRILLETTO (TRIGGER)
MOLECOLE DI ADESIONE
(INVASINE)
T3SS
MICRORGANISMI RELATIVAMENTE RESISTENTI AGLI
ENZIMI LISOSOMIALI
SONO IN GRADO DI CAUSARE..
L’ESPLOSIONE DEI LISOSOMI
NEL CITOPLASMA
UCCISIONE DEI FAGOCITI
VITA INTRACELLULARE
UNA STRATEGIA DIVERSA È
QUELLA DI RESTARE NEL
FAGOSOMA (O FAGOLISOSOMA)
ADATTANDOSI A RESISTERE ALLE
MUTATE CONDIZIONI AMBIENTALI
ALCUNI MICRORGANISMI CHE SOPRAVVIVONO NEI
MACROFAGI (SALMONELLA, MYCOBACTERIUM)
ATTIVANO RAPIDAMENTE SET DI GENI PER
SOPRAVVIVERE NELLE CONDIZIONI ESTREME DEL
FAGOLISOSOMA
ANAPLASMA: UN
CASO LIMITE
BLOCCO
ESPLOSIONE+
ANTIAPOPTOSI
ELUSIONE DELLE DIFESE INNATE
(DOPO LA FAGOCITOSI)
INIBIZIONE DELLA FORMAZIONE
DEL FAGOLISOSOMA
IL PATOGENO ALTERA
L’ASSETTO SUPERFICIALE DELLA
VESCICOLA LISOSOMALE
IMPEDENDO LA FUSIONE CON IL
LISOSOMA
FUGA DAL FAGOSOMA
ALCUNI PATOGENI LISANO
LA MEMBRANA DEL
FAGOSOMA
E SI MOLTIPLICANO NEL
CITOPLASMA
ALCUNE SPECIE (LISTERIA, SHIGELLA, RICKETTSIA) POSSONO
INTERVENIRE SUI FILAMENTI DI ACTINA DELL’OSPITE E FARSI
“SPINGERE” DA UNA CELLULA ALL’ALTRA
-SHIGELLE IN MOTOSERVIZIO FOTOGRAFICO INSTITUT PASTEUR
DIFESE ADATTATIVE
ESPOSIZIONE ALL’AGENTE
INFETTANTE
CELLULE B
SI SVILUPPANO NEL
MIDOLLO
UMORALE (anticorpi)
ANTICORPI:
IMMUNOGLOBULINE
VARIETA’ ENORME
(RIARRANGIAMENTO GENICO)
RISPOSTA SPECIFICA
CELLULE T
SI SVILUPPANO NEL TIMO
CELLULO-MEDIATA
RISPOSTA A MOLECOLE
ESTRANEE
ANTIGENE: SOSTANZA NON
RICONOSCIUTA COME “SELF”
INDUCE LA FORMAZIONE DI ANTICORPI
ANTIBODY GENERATOR
APTENE
“απτομαι” LEGARE
STRINGERE
UN APTENE NON INDUCE LA
FORMAZIONE DI ANTICORPI
MA E’ IN GRADO DI LEGARLI
ANTIGEN
“ANTIGENE INCOMPLETO”
Linfocita B
ANTIGENI
Proliferazione
clonale
Cellule della memoria,
quiescenti a vita lunga
Maturazione in
plasmacellule
Ig(1)
Ig(2)
Ig(3)
IMMUNITA’ CELLULO-MEDIATA
I PATOGENI INTRACELLULARI NON SONO
RAGGIUNTI DA ANTICORPI, C’, FAGOCITI
INTERVENTO DEI LINFOCITI T
CD4
HELPER
CD8
KILLER
LE CELLULE SOMATICHE HANNO
IL COMPLESSO MHC
MANTENGONO GLI ANTIGENI IN
CONFORMAZIONE TALE DA
ESSERE RICONOSCIUTI
APC: ANTIGEN PRESENTING CELL
ES. UN MACROFAGO
1
2
3
1) TH interagisce con MHC-II
2) Reagisce a IL1
3) Produce IL2
4) Produce citochine che
inducono la proliferazione dei
linfociti B e T
Proliferazione
Risposta umorale
4
Proliferazione
Risposta cellulo-mediata
DIFESE A PONTE
Cellule natural killer
cellule T primitive
MENTRE LA RISPOSTA
ADATTATIVA SI ESPLICA
UCCIDONO LE CELLULE CHE NON
RICONOSCONO COME SELF
CON BASSI LIVELLI DI
MHC-I
ES. CELLULE INFETTATE DA
VIRUS/CELLULE TUMORALI
cellule B B1: sottopopolazione di B
Producono “anticorpi naturali” (IgM)
Che si mantengono nel siero senza
stimolazione antigenica
B B1
Reagiscono con i
carboidrati tipici dei
patogeni
Anticorpi: formati da
diversi frammenti
Catena pesante
(variabile)
Cerniera
(hinge)
Catena leggera
(variabile)
Fab
Catena leggera
(costante)
Catena pesante
(costante)
Fc
Tenuti insieme da
ponti disolfuro
FUNZIONI
Sono divisi in 5 classi
IgA, IgD, IgE, IgG, IgM
Neutralizzazione (es. tossine)
opsonizzazione
AggregazioneÆ allontanamento
IgD, E, G monomeriche
IgD: recettore per Ag
sulle cellule B non
esposte all’antigene
IgE: implicate nei
fenomeni allergici
istamina
allergene
Mast-Zellen
IgG: principali
circolanti, legano C’
Via classica
4 forme (IgG, IgG2, IgG3, IgG4)
Passano il filtro placentare
(immunità passiva al feto)
IgA circolanti
monomeriche
IgA secrete
dimeriche
Presenti nelle secrezioni
Interazioni con C’ solo
via alternativa
IgM monomeriche
legate alle cellule B
IgM, secrete, pentameriche
legano C’ (Via classica)
Prime a comparire, garantiscono la protezione
finchè il livello di IgG non è sufficiente
VIA DELLA LECTINA
VIA CLASSICA
C1q
Legame con superficie
patogeno o anticorpi
Mannan Binding Protein MBP(lectina)
C1q cambia
conformazione
MBL-associated serine protease
MASP1 e MASP 2 simili a C1r, C1s
M
Attiva C1r
(proteasi)
MBP
Complesso
C1qr2s2 Attivazione di
MASP1/Masp2
Attiva C1s
(proteasi)
C2
C2a
C4
C4b
C2b
Complesso
C4bC2b
C3 convertasi
C4a
Risposta primaria
IgM
Risposta secondaria
Ig-totali
IgG
Le percentuali relative di IgM e IgG sono diverse
Elusione difese adattative
PRODUZIONE SUPERANTIGENI
I superantigeni attivano i linfociti in modo aspecifico
Linfocita T
TRC
MHC-II
Macrofago
% attivazione
1: 10.000
Produzione abnorme di
immunomodulatori
Linfocita T
TRC
MHC-II
Macrofago
% attivazione
1: 5
Attivazione delle cellule BÆ molti
anticorpi aspecifici (inutili)
Elusione difese adattative
Inattivazione immunoglobuline
Alcuni patogeni mucosali (es. Neisseria)
producono IgA proteasi
Elusione difese adattative
Blocco della presentazione dell’antigene
Es: Salmonella
PhoP/PhoQ Æ sopravvivenza
intracellulare/interferenza con la
presentazione degli antigeni batterici
Es: Legionella
Attraverso T4SS, blocca la sintesi di
MHC-I e MHC-II Æ assenza di
presentazione
BATTERI ALL’ATTACCO: LE TOSSINE
LE TOSSINE CAUSANO DIRETTAMENTE DANNO:
TOSSINE
ESOTOSSINE
ENDOTOSSINA
CITOLISINE
TOSSINE
SUPERANTIGENE
TOSSINE A,B
FRAZIONE LIPIDICA
della membrana
esterna
TOSSINE PROTEICHE (ESOTOSSINE)
proteine solubili prodotte da batteri vivi durante la fase
esponenziale di crescita sono i veleni più potenti per l’uomo
Letalità delle tossine proteiche in confronto a quelle di alcuni veleni
Dose
Tossica
(mg/Kg)
Tossina
ospite
(X) Rispetto alla dose tossica di:
stricnina
endotossine
Veleno di
serpente
botulinica
0,8 x 10-8
topo
3 x 106
3 x 107
3 x 105
tetanica
4,0 x 10-8
topo
1 x 106
1 x 107
1 x 105
2,3 x 10-6
coniglio
1 x 106
1 x 107
1 x 105
6,0 x 10-5
cavia
2 x 103
2 x 104
2 x 102
Neurotossina
Shigella
difterica
Le specie batteriche che producono esotossine causano in genere
malattie in cui la tossina ha un ruolo importante
Le tossine proteiche sono fortemente antigeniche
ANTITOSSINE
anticorpi specifici che possono bloccarne l’attività
TOSSOIDI
Esotossine che hanno perso l’attività tossica per
invecchiamento; restano antigeni Æ vaccini
ANATOSSINE
Tossoidi ottenuti con trattamenti artificiali
(vaccini antitetanico e antidifterico)
MOLTE TOSSINE HANNO UNA STRUTTURA A,B
B
A
subunità A: responsabile
dell’attività biologica
subunità B: lega il recettore,
e trasporta “A” nella cellula
La componente biologica della tossina resta inattiva
finchè non si libera dalla tossina nativa
Sito di taglio
A/B: tossina sintetizzata in un singolo polipeptide, dominio A
e il dominio B coesistono e sono separati da una proteasi
A+B tossina sintetizzata e secreta in subunità indipendenti
che interagiscono direttamente sul bersaglio
LF
S
S
NH2
EF
PA
PA
63
63
COOH
Uno dei componenti della tossina dell’antrace si lega alla membrana
della cellula e lega uno degli altri due componenti
A-B : le subunità sono sintetizzate separatamente ma si
associano prima del legame al loro bersaglio
A
“A-5B” indica che il dominio di legame è
formato da 5 subunità identiche
Es. enterotossina di V. cholerae
e altre enterotossine
La maggior parte delle tossine di tipo A/B è esportata
attraverso il sistema di secrezione di tipo II
Tossine che agiscono nella cellula:
INGRESSO
DIRETTO
INGRESSO
INDIRETTO
A
la subunità B si lega al recettore e
forma un poro attraverso cui la
subunità A entra nel citoplasma
(es. Colera)
A
la tossina nativa entra nella cellula in un
endosoma. Il pH si abbassa causando la
separazione di A e B; la subunità B provoca
il rilascio di A nel citoplasma attraverso la
membrana dell’endosoma
(es. Antrace)
Ogni esotossina ha un meccanismo d’azione
caratteristico
La tossina tetanica e la tossina botulinica hanno struttura
simile e agiscono entrambe sul tessuto nervoso
Ma provocano effetti opposti
TETANO
BOTULISMO
Blocco dei neuroni
inibitori
Blocco della placca
motrice
Paralisi spastica
Paralisi flaccida
Altre esotossine
DIFTERITE
COLERA
ADPRIBOSILAZIONE
DI EF2
(fattore di
allungamento)
ATTIVAZIONE
DELL’ADENILCICLASI
Blocco della sintesi
proteica
Morte cellulare
Perdita massiva di
elettroliti e acqua
Esterno
Per essere efficaci le tossine secrete
devono attraversare la membrana
Attraverso la membrana
interna:
-SEC (sistema generale di
traslocazione)
-TAT /twin arginine traslocase
Periplasma
Traslocazione attraverso la
membrana esterna (didermi)
SEC-dipendenti
T2SS, T5SS (T4SS)
Traslocano proteine che
sono state portate al
periplasma da SEC
SEC-indipendenti
T1SS T3SS (T4SS)
Traslocano proteine
direttamente senza
l’intervento di SEC
Le specie che modificano il citoscheletro
delle cellule dell’ospite
Shigella, Salmonella e EPEC
(uno dei virotipi di E. coli)
Possiedono in genere uno o più sistemi di
secrezione di tipo III (TTSS)
Citoscheletro
EPEC/EHEC: restano all’esterno
della cellula ospite
ma intimamente connessi alla
superficie cellulare
Salmonella: invade
attivamente gli enterociti
dirigendo gli effetti sul
citoscheletro dell’ospite dall’interno
di un vacuolo legato alla membrana
Salmonella, Shigella E e. coli EPEC utilizzano
T3SS per riarrangiare il citoscheletro di actina
Shigella: entra nelle cellule M
si replica nel citoplasma
diffonde da cellula a cellula
polimerizzando l’actina dell’ospite
Un esempio di tossina secreta attraverso un T4SS è
CagA di Helicobacter pylori
CagA dà due tipi di segnale alla
cellula: provoca la formazione di
un piedistallo per H. pylori, ed il
rilascio di citochine proinfiammatorie
Formazione del
piedistallo
CagA
Polimerizzazione
Actina
Trascrizione
IL-8
P
Stimoli
“Growth-factor-like”
EVASIONE DALLE DIFESE ADATTATIVE
Modificazione antigenica
E. coli 6ac.
Es. catene LPS meno acilate,
sfuggono ai TLR
Salmonella
7-ac.
Bacteroides
Bacteroides ha una forma PENTA-acilata che non induce risposte
infiammatorie e sembra antagonizzi le forme tossiche
5-ac.
In alcuni patogeni enterici i sistemi di
secrezione di tipo III traslocano
nell’enterocita le proteine responsabili
delle alterazioni del citoscheletro