Brønsted Acid (A) to a Brønsted Base (B)
WORKSHOPS
RIMINI 26-27 AGOSTO 2008
PROGETTO FISR VETTORE IDROGENO
SISTEMI INNOVATIVI DI PRODUZIONE DI IDROGENO DA ENERGIE
RINNOVABILI
LINEA DI RICERCA 6: OTTENIMENTO DI IDROGENO DA BIOMASSE RESIDUE
Prof. F.Rossi, Ing. N.Corsi, Ing. M.Giuliobello, F. Strangis
U.O. 1: IPASS (Ingegneria Per l’Ambiente e lo Sviluppo Sostenibile)
Via G. Guerra 23 - 06127 Perugia
INTRODUZIONE
L’interesse sociale verso i problemi ambientali e l’attuale crisi economica mondiale, con conseguente aumento dei prezzi
degli idrocarburi e delle energie in generale, ha indirizzato la ricerca verso la maturazione di tecnologie alternative per la
produzione di elettricità da fonti rinnovabili e pulite. Dopo il trattato di Kyoto inoltre si è cercato di limitare non solo le
emissioni in atmosfera di gas serra, ma anche di regolarizzare ogni aspetto della produzione industriale al fine di preservare
l’ambiente. Da qui nasce l’attenzione verso nuovi sistemi di produzione e fonti di energia, assai suggestivi ma ancora lontani
dal dare risposte quantitativamente adeguate ai reali e crescenti fabbisogni mondiali di energia e, di conseguenza, il parallelo
interesse per impianti di produzione tradizionale, in grado di minimizzare i consumi di combustibile.
E’ opinione diffusa a livello mondiale che le celle a combustibile siano una delle tecnologie-chiave per affrontare la sfida
della produzione energetica “sostenibile”. Questa tesi si propone di indagare e studiare una nuova tipologia di cella a
combustibile: un dispositivo elettrochimico basato sui liquidi ionici ed in particolare su una loro sotto classe: quella dei liquidi
ionici protici (Protic Ionic Liquids PILs). Si è dunque cercato di integrare la tecnologia già evoluta delle celle a combustibile
polimeriche (PEM - Polymer Electrolyte Membrane), con l’impiego di PLIs come elettroliti in sostituzione della membrana
polimerica elettrolitica.
Il presente studio ha avuto come obiettivo primario la verifica pratica dell’utilizzazione di PILs come elettroliti per celle a
combustibile. I liquidi ionici usati sono stati scelti sulla base di pubblicazioni che individuano nella famiglia degli imidorazoli i
PILs con maggiori prospettive di impiego come elettroliti, e forniti dal dipartimento di chimica dell’università di Perugia.
Il lavoro ha previsto, in una prima fase, la sperimentazione di liquidi ionici protici con un primo reattore già utilizzato in
passato per la sperimentazione di liquidi ionici aprotici. Si è quindi proceduto alla progettazione e realizzazione di un secondo
reattore specifico per la sperimentazione dei PILs.
LIQUIDI IONICI
B + A → HB+ + A-
Definizione
I liquidi ionici sono composti chimici costituiti
esclusivamente di ioni e di loro combinazioni, ma a
differenza dei sali sono liquidi anche a temperatura
ambiente, senza la presenza di un solvente molecolare. Una
definizione dei liquidi ionici è quella che li descrive come
dei sali di “onio” costituiti da una parte cationica ed una
anionica.
La porzione cationica è generalmente un catione (figura
1) tipo fosfonio (a), solfonio (b) o ammonio (c).
H
H
H
H
P
Furono chiamati base e acido Brønsted da colui che ne
definì il comportamento secondo cui:
- un acido è una sostanza capace di donare uno ione H+
ad un'altra specie chimica
- una base è una sostanza capace di accettare uno ione H+
da un'altra specie chimica
Questo porta a caratteristiche distintive, in quanto tutti i
PIL hanno un protone disponibile per l’incollaggio di
idrogeno.
+
H
H
S
+
(a)
H
H
+
N
(b)
H
Proprietà Fisico-Chimiche dei PIL
Le proprietà fisico-chimiche dei liquidi ionici, così come
per tutti gli altri materiali, dipendono dalle forze molecolari
e intermolecolari e di conseguenza nel nostro caso anche
dalla struttura di anioni e cationi. Un significativo numero di
indagini sono state effettuate per gli AIL, sul rapporto tra le
loro proprietà fisico chimiche e la struttura dei loro cationi e
anioni. Al contrario poche sperimentazioni sono state fatte
per i PIL e benché sia prevedibile un comportamento
similare, non ne è data per ora la certezza.
H
(c)
H
Figura 1: tipologie di catione
Il controione del sale di -onio deve presentare una bassa
densità di carica ed essere in grado di possedere una
struttura che ne permetta la delocalizzazione. I contro ioni
possono essere: inorganici (alogenuri e alogeno derivati) e
organici (composti carbossilati o solfonati).
I liquidi ionici protici (PILs) sono un categoria dei liquidi
ionici che sono facilmente sintetizzabili da una base
Brønsted e un acido Brønsted secondo lo schema seguente:
33
punto di fusione sono quelli composti dal sale
alkylammonium nitrato, mentre quelli con punto di fusione
più basso sono quelli contenenti l’imidorazolio.
Transizione vetrosa
Il comportamento dei PILs alle varie temperature, fornisce
una buona indicazione sulle proprietà fisico-chimiche dei
sali.
In generale una bassa transizione vetrosa (valore di
temperatura al di sotto del quale un materiale amorfo si
comporta da solido vetroso) e un basso punto di fusione
sono auspicabili, mantenendo allo stesso tempo alte
temperature di decomposizione.
Per la maggior parte delle applicazioni in cui sono
utilizzati i PILs, è necessario avere una bassa viscosità. La
viscosità e la conducibilità elettrica sono funzione della
transizione vetrosa Tg.
La transizione vetrosa è indicativa dell’energia di
coesione nel sale (funzione delle forze repulsive di Pauli, di
Culomb e Wan der Waals) , di conseguenza Tg può essere
diminuita riducendo l’energia coesiva delle molecole del
sale, che viene normalmente compiuta intervenendo sugli
elementi al catodo e all’anodo del sale stesso.
Tutti I PILs di cui è nota la viscosità (in ordinata) e la Tg
(in ascissa) possono essere rappresentati nel graficodi figura
2, ed è evidente che tutti questi mostrano un comportamento
fragile dove la fragilità indica che, come la temperatura
aumenta, la viscosità diminuisce con la relazione di
Arrhenius.
Stabilità termica e range di liquidità
Il range di liquidità dei liquidi ionici può essere molto più
grande dei comuni solventi molecolari. Ad esempio l’acqua
si presenta in forma liquida tra 0 °C e 100 °C,quindi un
range di 100 °C, e così ogni sostanza ha un suo range
caratteristico. Un liquido ionico copre un range di
temperature di solito molto ampio. Il limite inferiore
dell’intervallo di temperatura, cioè la temperatura di
solidificazione, è governato dalla struttura e dall’interazione
tra ioni. I liquidi ionici che consistono di componenti
totalmente ionizzati e mostrano legami tra ioni piuttosto
deboli, hanno una tensione di vapore piccola o non
misurabile. In contrasto con i solventi molecolari, il limite
superiore della temperatura per i liquidi ionici rappresenta
usualmente la temperatura di decomposizione termica Td
piuttosto che di vaporizzazione Tb.
Per quel che riguarda il comportamento dei PILs,
riscaldandoli, in condizioni termiche minori al punto di
ebollizione, questo può decomporsi alla temperatura Td
coincidente con Tb, oppure, soprattutto per quel che riguarda
i liquidi con forte protone di trasferimento, la
decomposizione può avvenire per valori di temperatura
molto più bassi. La temperatura di decomposizione Td è
normalmente compresa tra i 120 °C e i 360 °C.
Conducibilità ionica
La conducibilità ionica è disciplinata dalla mobilità degli
ioni stessi, che dipende dalla viscosità e del numero di
cariche presenti. A loro volta queste grandezze dipendono
dal peso molare, dalla densità e dalla dimensione delle
particelle del sale.
Una qualsiasi associazioni di ioni causerà una
diminuzione della conducibilità ionica attraverso la
diminuzione del numero degli presenti e che possono ancora
interagire tra loro. Di conseguenza i PILs che avranno
scariche delocalizzate e meno interazioni avranno per certo
maggiore conducibilità.
E’ molto importante, quando si confrontano le
conducibilità tra i vari PILs, tener conto della viscosità, dato
che alcuni di essi ad alta conducibilità, sono molto
influenzati da un basso valore della viscosità.
Alcuni PILs, come i sali alkylammonium, presentano
conducibilità di oltre 10 mS/cm ad una temperatura di 25
°C, dato che ha fatto supporre un loro probabile utilizzo
come elettrolita.
Figura 2: grafici di Arrhenius
Densità
La densità di un liquido ionico è il più semplice
parametro caratteristico da determinare. Data una quantità
nota di campione ed un contenitore volumetrico graduato, la
densità di un liquido ionico può essere misurata per
gravimetria. La densità dei liquidi ionici a seconda dei tipi di
composto, varia linearmente con la percentuale in peso delle
impurezze mentre dipende molto poco dalla temperatura.
Viscosità
La viscosità dipende dall’interazione ione-ione, come
quelle di van der Waals e dai legami ad idrogeno. Per i PILs
con cationi alkylammonium, si è osservato che la viscosità
aumenta con la lunghezza della catena di alchile. Un caso
particolare è il liquido protico Tributylammonium nitrato,
che ha una particolare alta viscosità che è stata attribuita ad
un incremento delle forze di van der Waals, causata tra tre
serie di legami di idrocarburi. Tendenze analoghe sono state
riscontrate per l’altra categoria di PILs, come quelli con
imidorazolio, con la viscosità più influenzata dai
cambiamenti della struttura anionica che non dalla cationica.
Punto di Fusione
I PILs, hanno una vasta gamma di punti di fusione (da
sotto i venti gradi a sopra i cento). In generale il punto di
fusione può essere abbassato con opportune tecniche e
quindi modificato entro certi limiti. I PILs con maggiore
34
Applicazione dei PILs nelle Celle a Combustibile
E’ stato riscontrato sperimentalmente che alcuni di questi
PILs hanno notevoli prospettive di impiego come elettroliti
in cella a combustibile in virtù delle loro caratteristiche:
• sono anidri e non è necessario reintegro di acqua.
Possono quindi funzionare a temperature maggiori
di 100 °C
• molti PILs hanno buone e stabili proprietà
chimiche e termiche , tali che li rendono stabili a
temperature al di sopra dei 100 °C
• molti PILs hanno buone e stabili proprietà
chimiche e termiche , tali che li rendono stabili a
temperature al di sopra dei 100 °C
• sono economi nella sintetizzazione e nello
smaltimento
• sono atossici e non dannosi per l’ambiente
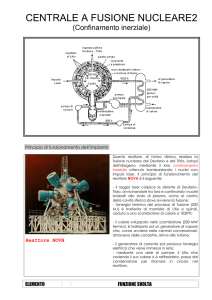
MATERIALI E METODI
Figura 4: schema di funzionamento del primo reattore
Prima Campagna Sperimentale
Il reattore costituisce una cella di nuova concezione in cui
le reazioni che avvengono sono quelle tipiche di una cella
combustibile.
L’idrogeno fornito all’anodo reagisce con gli ioni
presenti nell’elettrolita. Il prodotto di questa reazione sono e
ioni H+ ed elettroni i quali migrano al catodo e qui
reagiscono con l’ossigeno, gas che viene immesso al nella
camera anodica. Globalmente, si può dire che la
combinazione di ossigeno e idrogeno, ciascuno preso con le
giuste quantità molari, porta, nella cella a combustibile,
fornisce come prodotti acqua e elettricità.
Le reazioni che regolano il funzionamento del reattore
sono le seguenti:
Reazione anodica: 2 H2 → 4 H+ + 4 eReazione catodica: O2 + 4 H+ + 4 e- → 2 H2O
Descrizione dell’Apparato Sperimentale
Le prime prove sperimentali sono state condotte
utilizzando un reattore progettato realizzato e già testato in
una precedente sperimentazione sui liquidi ionici (figura 3)
Figura 3: foto del primo reattore sperimentato
Prove sperimentali e risultati
Il reattore, immerso all’interno di un bagno siliconico, è
stato portato alle temperature di 50, 100 e 150 °C attraverso
l’utilizzo di un sistema del riscaldamento elettrico. Per
mezzo di un voltmetro effettuato un monitoraggio a
intervalli regolari della tensione a vuoto. Al raggiungimento
delle temperature di prova è stata misurata la tensione a
vuoto e quindi il circuito è è stato chiuso su un carico
esterno variabile in modo da poter e misurare il passaggio di
corrente
Il liquido ionico protico testato è l’Etilimidororolio
idrogeno mesilato.
Il reattore è stato realizzato in politetrafluoroetilene
(PTFE) attraverso lavorazione a fresa.
Il pezzo di PTFE (a forma di cilindro pieno) è stato
lavorato in modo da ricavare al suo interno un contenitore a
forma di parallelepipedo. All’interno di tale contenitore è
stata realizzata una camera centrale, sede della soluzione
liquida elettrolitica, interposta tra un comparto anodico e
uno catodico. Ciascun comparto è delimitato da un elettrodo
e una camera laterale per il passaggio dei gas.
Gli elettrodi usati sono in carta di grafite con platino
depositato (0,01316mg/cm2).
I lati degli elettrodi non a contatto con la soluzione ionica
(quelli esterni) sono quelli lambiti dai gas (idrogeno e azoto
per il lato anodico ed aria, anidride carbonica e azoto per il
lato catodico). L’ingresso dei gas avviene in corrispondenza
della parte inferiore di ciascuna camera attraverso dei tubi in
rame.
Il principio di funzionamento del reattore viene
schematizzato in figura 4.
I valori migliori si sono avuti a una temperatura di prova
di 150 °C.
Il grafico di figura 5 riporta l’andamento di tensione e
corrente registrato in tali condizioni di prova.
35
Il reattore è costituito fondamentalmente da un comparto
catodico e un comparto anodico in acciaio. Ogni comparto è
costituito da una camera dei gas e dal relativo elettrodo.
Il comparto anodico e catodico è di forma cilindrica e su
ciascuno di essi è stata saldata una flangia per il serraggio
del reattore. Queste componenti saranno riempiti dai gas
reagenti nella sperimentazione. Ognuno di essi è quindi
provvisto di tubazioni per l’ingresso e l’uscita dei gas.
Lungo la circonferenza interna della flangia è stata
realizzata una battuta per l’alloggiamento dell’elettrodo e
del relativo supporto costituito da una lamina forata
anch’essa in acciaio.
Su uno dei due comparti è previsto l’inserimento di una
termocoppia per il monitoraggio della temperatura interna
del reattore.
Gli elettrodi sono in carta di grafite con platino depositato
(0,01316mg/cm2) sono a forma di disco di spessore 0,2 mm
e diametro 55 mm.
Vengono allocati nella battuta ricavata sulla
circonferenza interna della flangia poiché le loro scarse
proprietà meccaniche non sono in grado di garantire la
resistenza a compressione. Ogni elettrodo viene dotato di un
supporto costituito da un disco di lamiera inox forata.
I due comparti sono elettricamente separati da una
guarnizione in gomma siliconica a forma di disco di
spessore 1,5 mm e diametro 100 mm resistente alle
temperature di sperimentazione. Al centro di tale
guarnizione viene realizzato un foro del diametro di 55 mm
che, una volta assemblato il reattore, costituisce
l’alloggiamento dell’elettrolita costituito dal liquido ionico
protico delimitato dai due elettrodi.
All’interno del reattore quindi ciascun elettrodo viene
lambito sul lato esterno al reattore, dove è sostenuto dal
disco in lamiera forata, dai gas, mentre sul lato interno si
trova a diretto contatto con l’elettrolita.
La superficie dell’elettrodo interessata alle reazioni è di
23,74 cm2.
L’inserimento del liquido ionico viene effettuato una
volta assemblato il reattore attraverso un tubo del diametro
di 6 mm saldato su una delle due flange, comunicante con
l’alloggiamento interno dell’elettrolita anche grazie ad
apposite scanalature realizzate sulla guarnizione in silicone.
Oltre alla tubazione di ingresso è prevista anche una
tubazione di uscita dall’alloggiamento dei liquidi ionici in
modo da poter verificare l’effettivo riempimento del volume
interno da parte del liquido.
La camera dell’elettrolita che si viene quindi a creare una
volta assemblata la cella è ha un volume di 3,56 cm3 e la
distanza tra gli elettrodi è di circa 0,15 cm pari cioè allo
spessore della guarnizione siliconica.
Le componenti sopra descritte sono state assemblate
secondo un preciso ordine, per far si che l’ultimo passaggio,
ovvero l’ingresso del PIL all’interno della camera a lui
destinata, avvenga senza alterare le condizioni fisico
chimiche e quindi fornire dati errati alla sperimentazione.
Il sistema di serraggio è costituito da viti bullonate e
molle Bouer. Tale sistema viene isolato elettricamente
attraverso l’uso di rondelle di teflon a contatto con le flange
e guaine di teflon per le viti al fine di evitare il corto circuito
della cella. Dopo aver serrato il reattore viene inserita la
termocoppia di controllo e il liquido ionico.
La figura 7 riporta una foto del reattore assemblato.
Figura 5. Prova a 150 °C - Andamento tensione- corrente
del reattore. Elettrolita utilizzato: Etilimidororolio idrogeno
mesilato.
I risultati sperimentali mostrano una non trascurabile
reattività del liquido ionico usato ma una scarsa stabilità dei
valori di V e I. Inoltre gli andamenti ottenuti si discostano
notevolmente da quelli ideali delle celle a combustibile.
Il mancato raggiungimento dei risultati attesi poteva
essere imputabile alla struttura stessa del reattore in cui gli e,
in particolar modo, all’elevata distanza tra gli elettrodi e alla
non perfetta tenuta idraulica che ha provocato perdite
dell’elettrolita riscontrate al momento dello smontaggio del
reattore stesso.
Per tali motivi è stato progettato un secondo reattore
destinato alla sperimentazione dei PILs con caratteristiche
tali da poter superare i limiti del primo prototipo.
Seconda Campagna Sperimentale
Descrizione dell’Apparato Sperimentale
Alla luce dei risultati della sperimentazione condotta con
il reattore in teflon, sul quale nonostante i tentativi, non era
più possibile intervenire per migliorare le prestazioni, si è
progettato e realizzato un nuovo prototipo che costituisce
una cella a combustibile di nuova concezione destinata in
particolare ai liquidi ionici protici.
Tra le diverse configurazioni individuate per il secondo
prototipo, la soluzione adottata costituisce il miglior
compromesso tra semplicità di realizzazione, garanzia di
tenuta, riduzione della resistenza interna di cella e
conseguente aumento di rendimento. Nella figura 6 viene
riportato il disegno tecnico in 3D del prototipo.
Figura 6: disegno tecnico del secondo reattore
36
Figura 7: foto del reattore assemblato
Figura 9. Prove a 50 e 100 °C ripetute - Andamento
tensione-corrente del reattore. Elettrolita utilizzato:
Dietanolammonio Metansolfonato
Il principio di funzionamento schematizzato in figura 8 e
le reazioni elettrochimiche coinvolte sono gli stessi descritti
per il primo reattore.
I risultati mostrano un comportamento del generatore
simile, in termini di andamento e risposta al carico, a quello
di un generatore elettrochimico. Tuttavia i valori di tensione
e corrente sono molto inferiori rispetto a quelli teorici.
La densità di corrente misurata è comunque 5 volte
superiore a quella del primo reattore.
CONCLUSIONI
Nel presente lavoro di tesi è stata studiata la possibilità di
impiegare i liquidi ionici protici (PILs) come elettroliti in
generatori elettrochimici. A tale proposito è stato adottato un
approccio basato sulla tecnologia delle celle a combustibile
polimeriche. Dopo una prima indagine sperimentale
condotta su un reattore precedentemente utilizzato, è stato
necessario progettare e realizzare un secondo prototipo
dedicato alla sperimentazione specifica dei PILs in diversi
condizioni operative. All’interno della vasta gamma dei
PILs esistenti, la sperimentazione si è concentrata su un
numero limitato di liquidi ionici selezionati per le loro
particolari caratteristiche fisico chimiche.
I risultati delle prove condotte hanno mostrato una
modesta attività dei liquidi tuttavia il comportamento del
prototipo è quello tipico di una cella a combustibile sia per
quanto riguarda l’andamento V-I che la risposta alle
variazioni di carico.
Visti i presupposti teorici, si ritiene di dover estendere la
sperimentazione ad altre tipologie di liquidi ionici, proprio
in virtù dei benefici che questi ultimi potrebbero apportare
nei generatori elettrochimici e, in particolare, nelle celle a
combustibile.
Figura 8: schema di funzionamento del secondo reattore
Prove sperimentali e risultati
Il riscaldamento del reattore viene effettuato per mezzo di
una resistenza ceramica elettrica a fascia posizionata a
contatto con la superficie laterale delle flange. Il materiale
ceramico costituente la resistenza, essendo un isolante
elettrico, fa si che i due camparti anodico e catodico della
cella non vengano cortocircuitati
Il reattore è stato portato alle temperature di 50 e 100 °C
attraverso l’utilizzo di una resistenza ceramica elettrica a
fascia posizionata a contatto con la superficie laterale delle
flange. Il materiale ceramico costituente la resistenza,
essendo un isolante elettrico, fa si che i due camparti
anodico e catodico della cella non vengano cortocircuitati
Per mezzo di un voltmetro effettuato un monitoraggio a
intervalli regolari della tensione a vuoto. Al raggiungimento
delle temperature di prova è stata misurata la tensione a
vuoto e quindi il circuito è stato chiuso su un carico esterno
variabile in modo da poter e misurare il passaggio di
corrente
Il liquido ionico protico testato è il Dietanolammonio
Metansolfonato
Il grafico di figura 9 riporta l’andamento di tensione e
corrente registrato per le prove a 50 e 100 °C e per le prove
ripetute alle stesse temperature dopo 24 ore.
RIFERIMENTI BIBLIOGRAFICI
[1]. L.Carrette, K.A. Friedrich, U. Stimming, Fuel Cell –
Fondamentals and Applications, Wiley – VCH, 2001
[2]. M. Ronchetti, A. Iacobazzi. Celle a combustibile –
Stato di sviluppo e prospettive della tecnologia,
ENEA, 2002
[3]. EG&G Technical Services Parsons, Fuel Cell
Handbook – Seventh edition, 2004
[4]. F. Tasso, G. Pasquale, E. Ghisolfi, FN: Idrogeno e
Celle a Combustibile. Convegno ATI – UIT:
L’idrogeno vettore energetico del futuro, Torino, 7
Luglio 2006.
[6]. M. Felli, Lezioni di Fisica Tecnica – Volume Primo –
Termodinamica, macchine, impianti, Morlacchi
Editore 1998
37
[7]. P. Silvestroni, Fondamenti di chimica, CEA, 1996
[8]. Tamar L. Greaves, Calum J. Drummond, Protic Ionic
Liquids: Properties and Applications, Recensione su
ChemInform, 9 Apr 2008
[9]. H.Matsuoka, H. Nakamoto, Md. Abu Bin Hasan
Susan, M. Watanabe, Brønsted acid – base and –
polybase complexes as electrolytes for fuel cells under
non-humidifying conditions, Electrochimica Acta, ,
Pages 4015-4021, Elsevier 2005
[10]. Md. Abu Bin Hasan Susan, M. Watanabe, Brønsted
Acid-Base Ionic Liquids as Fuel Cell Electrolytes and
Factors Governing Their Proton Conduction under
Nonhumidifying Conditions, American Chemical
Society, 2005
[11]. A. Noda, Md. Abu Bin Hasan Susan, K. Kudo, S.
Mitsushima, K. Hayamizu, M. Watanabe, Brønsted
Acid-Base Ionic Liquids as Proton-Conducting
Nonaqueous Electrolytes, American Chemical Society,
2003
[12]. H. Nakamoto and M. Watanabe, Brønsted Acid-Base
Ionic Liquids for Fuel Cell Electrolytes, Royal Society
of Chemistry, 2007
38