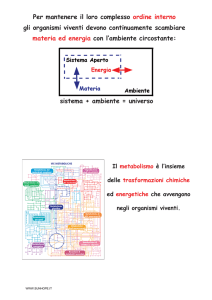
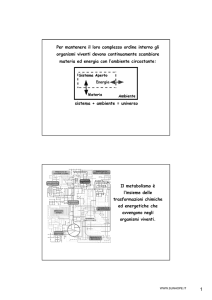
WWW.SUNHOPE.IT
IL METABOLISMO DEI
COMPOSTI AZOTATI
WWW.SUNHOPE.IT
pag. 2
LA DIGESTIONE DELLE PROTEINE
STOMACO gastrina
HCl
DENATURAZIONE PROTEINE
pepsinogeno
pepsina
PEPTIDI
INTESTINO
TENUE
secretina
PEPTIDI
progressivamente
p
g
più corti
PANCREAS
tripsinogeno
chimotripsinogeno
procarbossipeptidasi
WWW.SUNHOPE.IT
NaHCO3
tripsina
chimotripsina
carbossipeptidasi
AMINOACIDI
LIBERI
pag. 3
L’ASSORBIMENTO
L
ASSORBIMENTO DEGLI AMINOACIDI E
GLI AMINOACIDI ESSENZIALI
Mediante l’azione sequenziale degli enzimi proteolitici le proteine della dieta
vengono idrolizzate ad aminoacidi liberi. Gli aminoacidi diffondono nei villi
intestinali, entrano nei capillari e vengono trasportati al fegato per via ematica.
Nel fegato,come in tutti i tessuti, è presente un “ pool dinamico” di aminoacidi.
Nessun tessuto nell
nell’uomo
uomo è deputato a conservare aminoacidi e proteine
proteine.
8 dei 20 AA ordinari devono essere introdotti con l’alimentazione e sono quindi
essenziali.
Gli aminoacidi ESSENZIALI per l’uomo sono:
Isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptofano, valina.
WWW.SUNHOPE.IT
pag. 4
IL DESTINO METABOLICO DEGLI
AMINOACIDI NEL FEGATO
PROTEINE
sintesi proteica
CORPI
chetogenesi
CHETONICI
proteolisi
20 AMINOACIDI
ORDINARI
gluconeogenesi
l
i
GLUCOSO
ttransaminazione
i i
(interconversione)
(vit. B6PLP)
GLUTAMMATO
deaminazione
decarbossilazione
PURINE
PIRIMIDINE
26 Aprile
WWW.SUNHOPE.IT
2005
AMMINE BIOGENE
(istamina, adrenalina,
dopamina, serotonina)
NH3
ALFA-CHETOGLUTARATO
(intermedio ciclo di Krebs)
EME
CICLO
DELL’UREA
pag. 5
Gli aa. Non sono conservati nell’organismo, quelli che eccedono le necessità
biosintetiche sono subito degradati.
degradati
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
75% degli aa è usato per biosintesi, il 25% per altri
composti azotati. In una alimentazione corretta
Sarebbe sufficiente integrare questo 25% (pari circa
A 1g/Kg peso corporeo))
Al p
pool aminoacidico concorrono: aa da proteine
p
della dieta;;
aa da proteine tessutali; aa sintetizzati de novo.
Il pool è di circa 100g.
P Champe
P.
Champe, R.
R Harvey,
Harvey D.
D R.
R Ferrier,
Ferrier LE BASI DELLA
BIOCHIMICA, Zanichelli Editore S.p.A. Copyright © 2006
WWW.SUNHOPE.IT
•
•
•
WWW.SUNHOPE.IT
Gli aa. Non sono conservati nell’organismo,
quelli che eccedono le necessità biosintetiche
sono subito degradati.
75% degli aa è usato per biosintesi
biosintesi, il 25% per
altri composti azotati. In una alimentazione
corretta sarebbe sufficiente integrare questo 25%
(pari circa a 1g/Kg peso corporeo)
Al pool aminoacidico concorrono: aa da proteine
della dieta; aa da proteine tessutali; aa
sintetizzati de novo.Il p
pool è di circa 100g.
g
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
Il ricambio delle proteine: costantemente
sono degradate e biosintetizzate, e quindi
regolate.
Velocità di ricambio: 300-400g di proteine/die,
Media ottenuta da proteine a emivita molto variabile
da min a h o mesi).
D
Degradazione
d i
delle
d ll proteine:
i lisosomiale
li
i l e
proteasoma dipendente.
Segnali chimici che indicano la vita delle proteine:
alterazioni ossidative, ubiquitina,estremità N-terminale,
per esempio con la ser N-Terminale hanno emivita
lunga (fino a 20h), con l’asp di soli 3 min.
Se contengono 1 o più sequenze PEST (pro, glu,ser,tre)
sono degradate velocemente.
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
Lisosoma
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
Proteasoma
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
La digestione delle proteine comincia nello stomaco
dove HCl e pepsina (dal pepsinogeno) le attaccano,
poi nell’intestino subiscono gli enzimi pancreatici e
i fi le
infine
l amminopeptidasi
i
id i sulla
ll faccia
f i luminale
l i l delle
d ll
membrane dell’orletto a spazzola che introducono
aa singoli nel sangue portale.
Gli zimogeni pancreatici sono indotti da colecistochinina
e secretina.
L’attivazione degli zimogeni è affidata
all’enteropeptidasi secreta dalle cellule
i
intestinali
i li (orletto
( l
a spazzola).
l )
La specificità: Ciascun enzima taglia solo per
alcuni gruppi R adiacenti al legame peptidico.
Le anomalie della digestione proteica. Per es. carente
secrezione pancreatica (pancreatite cronica, fibrosi cistica,
o rimozione chirurgica del pancreas.
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
Proteasi Pancreatiche
Specificità; Secrezione degli zimogeni, colecistochinina e secretina; anomalie nella digestione delle
proteine
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
Il trasporto degli aa dallo spazio extracellulare è un trasporto
Attivo, usa ATP, sono noti almeno 7 sistemi di trasporto con
simile specificità
à per i substrati (aa).
Esistono 7 diversi sistemi di trasporto che trasportano
gli aa nelle cellule contro gradiente.
Sistema di trasporto per
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
L’ossidazione dello scheletro Carbonioso degli aa. può avvenire solo dopo l’eliminazione del gruppo aminico.
La 1^ tappa è il trasferimento all’ α chetoglutarato
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
Per essere ossidati devono
perdere il gruppo aminico:
per transaminazione o
deaminazione ossidativa.
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
AMMINOACIDI
METABOLISMO d
dell
GRUPPO AMMINICO
WWW.SUNHOPE.IT
Flusso generale
-amminoacidi
O
II
C – O–
I
-chetoacidi
O
II
C – O–
I
H–C=O
I
R
TRANSAMINAZIONE
transaminasi
piridossalfosfato
H – C – NH3+
I
R
+
+
-chetoglutarato
chetoglutarato
glutammato
l t
t
-chetoglutarato
g
glutammato
g
DEAMINAZIONE OSSIDATIVA
glutammato deidrogenasi
NAD+
NH2
NH4+
C=O
NH2
UREA
WWW.SUNHOPE.IT
AMMINOTRANSFERASI
(prendono il nome dall’a.a.
dall’a a che cede il gruppo
gr ppo -NH
NH2
all’-chetoglutarato)
1. Alanina amminotransferasi
2. Aspartato amminotransferasi
Denominate anche
•TRANSAMINASI
1. Glutammato piruvato transaminasi
2 Glutammato ossalacetato transaminasi
2.
WWW.SUNHOPE.IT
ENZIMI A PIRIDOSSALFOSFATO
MECCANISMO PING-PONG
H
I
E–C=O
COO–
I
+ H–C–NH2
I
R1
COO–
I
E–NH2 + C=O
I
R2
COO–
I
E-NH2 + C=O
I
R1
COO–
H
I
I
E–C=O + H–C–NH2
I
R2
Intermedio di reazione: base di Schiff
WWW.SUNHOPE.IT
Vitamina B6
piridossina, piridossale,
p
p
piridosammina
p
COFATTORI piridossalfosfato (PLP), piridossaminafosfato
ENZIMI A PLP
-Glicogeno fosforilasi 80-90% del totale
- Transaminasi
- Decarbossilasi (amminoacido ammina )
glutammato (glutammato decarbossilasi) -aminobutirrico (GABA)
istidina istamina
triptofano serotonina (5-idrossitriptamina)
tirosina noradrenalina
- Reazioni
R
i i di addizione-eliminazione
ddi i
li i
i
sulla
ll catena llaterale
l di a.a.
- -aminolevulinato sintasi (sintesi dell’eme)
- Metabolismo unità monocarboniosa (metionina cisteina)
WWW.SUNHOPE.IT
NH3 deriva
d i d
dall catabolismo
t b li
d
deglili
amminoacidi
basi puriniche (tramite deaminasi)
basi pirimidiniche
Animali ammoniotelici (pesci)
Animali uricotelici (rettili, uccelli)
Animali ureotelici
AMMONIACA TOSSICA:
Composto basico
- TRASPORTO EMATICO : GLUTAMMINA, ALANINA
- ELIMINAZIONE: UREA
WWW.SUNHOPE.IT
DEAMINAZIONE OSSIDATIVA
tramite
glutammato deidrogenasi
glutammato + NAD(P)+ + H2O -chetoglutarato + NADH + H+ + NH4+
Intermedio di reazione: imminoacido
COO–
I
H –C–NH
C NH3+
I
CH2
I
CH2
–
I
COO
WWW.SUNHOPE.IT
+ NAD+
COO–
I
C NH2+
C=NH
I
CH2
I
CH2
–
I
COO
+ NADH + H+
Incorporazione dell’NH4+
-chetoglutarato + NH4+ glutammato
glutammato + NH4+ + ATP glutammina + ADP + Pi
NH4+ + HCO3– + 2 ATP carbamilfosfato
O
2HN–
II
O
II
C~O–P–O–
I
O–
WWW.SUNHOPE.IT
TRASPORTO DELL’ NH3 in forma non tossica
CERVELLO
COO–
I
C=O
I
CH2 + NH +
4
I
CH2
I
C=O
O–
ATP
NH4
ADP + Pi
sintasi
COO–
I
H –C–NH3+
I
CH2
+ NH4+
I
CH2
I
C=O
O–
RENE
WWW.SUNHOPE.IT
glutammina
COO–
I
H –C–NH3+
I
CH2
I
CH2
I
C=O
NH2
glutamminasi
H2O
+
acidosi
alcalosi
azoto
amminico
azoto
ammidico
CERVELLO
Alti livelli di glutammato e glutammina per detossificazione
da NH3
altrimenti
si può abbassare il livello di -chetoglutarato e quindi
ciclo di Krebs
produzione di energia
IPERAMMONIEMIA
danno da alterazione del ciclo di Krebs e deplezione di ATP
WWW.SUNHOPE.IT
Ciclo glucosio-alanina
muscolo
glicolisi
piruvato
glucosio
transaminazione
WWW.SUNHOPE.IT
glucosio
deaminazione
proteine muscolari
alanina
Ciclo di Cori
fegato
sangue
alanina
gluconeogenesi
piruvato
NH4+
urea
NH2
UREA
NH4+ glutammato amminoacidi
C=O
HCO3–
NH2
aspartato amminoacidi
i
idi
- Gruppi
G
i ammidici
idi i non dissociabili
di
i bili
- Estremamente solubile
- eliminata 10-30 grammi/die - dipende dalle proteine alimentari
NH4+
0,4-1,2
g/die
dipende equilibrio acido-base
Acido urico
0,2-0,7
g/die
(deriva dal catabolismo delle basi puriniche)
Amminoacidi
0,3 -1,2
g/die
Creatinina
0,3-0,8
g/die
WWW.SUNHOPE.IT
dipende dalla massa muscolare (indice
del turnover proteico del muscolo)
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
Tutti gli aa con l’eccezione di lisina e treonina
vanno incontro a transaminazione.
Specificità delle aminotransferasi (transaminasi)
per il substrato.
L’alanina aminotransferasi (ALT) ex GPT (A)
L’AST, aspartato aminoTasi. (B)è un eccezione
perché l’accettore non è l’alfa-chetoglutarato, ma
l’ossalacetato, sarà portatore del gruppo aminico
nella
ll sintesi
i
i dell’urea.
d ll’
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
Meccanismo d’azione delle aminotransferasi, tutte
richiedono il piridossalfosfato (vit B6) che è legato
con legame
l
ε-aminico
i i di una lys
l del
d l sito
i attivo
i
La K di equilibrio della reazione è quasi 1, così la
reazione ppuò decorrere in tutti e due i sensi.
Dipendendo dalle condizioni della cellula.
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
Valore diagnostico delle
amminotransferasi plasmatiche
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
la GDeidrogenasi: il gruppo amminico della maggior parte degli aa è indirizzato al
glutammato per mezzo della transaminazione dell’α-chetoglutarato
La direzione della reazione dipende
p
dalle
esigenze della cellula. I regolatori allosterici
sono: ATP,GTP e ADP,GDP, e dai coenzimi
NAD e NADPH
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
Gli esseri umani usano due meccanismi per
trasportare l’NH3 dai tessuti periferici al fegato
d
dove
sii produce
d
l’
l’urea: molti
lti tessuti
t
ti attraverso
tt
la
l
glutammina (glutammina sintetasi) che funge da
tampone per l’NH3, una forma atossica per l’NH3.
Il secondo meccanismo lo utilizza essenzialmente
il t. muscolare che transamina il piruvato (dal glucosio) ad
alanina. l’ala raggiunge il fegato viene transaminata, si forma
piruvato e glutammato. (ciclo glucosio alanina)
WWW.SUNHOPE.IT
P. Champe, R. Harvey, D. R. Ferrier, LE BASI
IL METABOLISMO DEGLI AMINOACIDI:
LA TRANSAMINAZIONE
Le reazioni di transaminazione, catalizzate da transaminasi PLP - dipendenti,
consentono l’interconversione di 18 aminoacidi su 20 (lisina e treonina) e
comportano tutte come reagenti il glutamato e l’alfa-chetoglutarato.
Esempio: elevata concentrazione di alanina, bassa concentrazione di aspartato:
Alanina + alfa-chetoglutarato
1°AA
1° chetoacido
glutamato + ossalacetato
GPT
GOT
piruvato + glutamato
2° chetoacido
2°AA
alfa-chetoglutarato + aspartato
Queste reazioni sono reversibili, hanno Keq prossime all’unità e quindi la loro
direzione si sposta in dipendenza dalle concentrazioni dei reagenti.
reagenti
La presenza fissa della coppia alfa-chetoglutarato – glutamato consente di
spostare il gruppo aminico distribuendolo fra i vari aminoacidi e mantenendo così
equilibrato,
ilib
per le
l necessità
i à cellulari,
ll l i il “pool”
“
l” aminoacidico.
i
idi
26 Aprile
WWW.SUNHOPE.IT
2005
pag. 46
IL METABOLISMO DEGLI AMINOACIDI:
LA DEAMINAZIONE OSSIDATIVA
Il “pool” aminoacidico viene utilizzato principalmente per la sintesi delle proteine
e di vari composti azotati. L’eccesso di AA introdotti non può essere accumulato e
va quindi
i di incontro
i
alla
ll fase
f
catabolica
b li di deaminazione
d
i i
ossidativa
id i con grande
d
liberazione di energia.
Il glutamato può essere deaminato ossidativamente secondo la seguente reazione,
catalizzata dalla glutamato deidrogenasi NAD+ - dipendente,
dipendente molto attiva nei
mitocondri epatici:
glutamato + NAD+
alfa-chetoglutarato + NH3 + NADH+H +
In questa fase catabolica le reazioni di transaminazione “incanalano” i gruppi
-NH2 dei vari aminoacidi sul glutamato, unico aminoacido che viene deaminato
con liberazione di ammoniaca e di NADH+H +.
La transaminazione e la deaminazione, processi accoppiati nella degradazione
ossidativa degli aminoacidi grazie al glutamato, sono indicate con il termine di
TRANSDEAMINAZIONE
WWW.SUNHOPE.IT
pag. 47
LA SINTESI DI GLUTAMMINA
L’ammoniaca
L’
i
è un composto
t molto
lt tossico
t i per l’uomo,
l’
particolarmente
ti l
t per
il sistema nervoso; la maggior parte di questa base forte, generata dal
catabolismo dei composti azotati, è presente sotto forma di ione ammonio
NH4+ (acido debole).
debole)
La reazione, catalizzata dalla glutammina sintetasi (ATP-dipendente), lega
enzimaticamente NH4+ al glutammato formando glutammina, composto
neutro non tossico che può attraversare le membrane perché
neutro,
priva di carica, contrariamente al glutammato.
Glutammato + ATP + NH4+ glutammina + ADP + Pi
Giungendo al fegato per via ematica, la glutammina viene idrolizzata a
gglutammato e NH4+ , destinato alla sintesi dell’urea.
Glutammina + H2O glutammato + NH4+
Reazione catalizzata dalla gglutamminasi mitocondriale.
La glutammina rappresenta la principale forma di trasporto
dell’ammoniaca dai tessuti periferici al fegato ed è di norma presente nel
siero in concentrazioni più elevate degli altri aminoacidi.
WWW.SUNHOPE.IT
pag. 48
IL CICLO DELL’UREA
Gli organismi viventi, a seconda di come eliminano ll’azoto
azoto ammoniacale, si
dividono in: ammoniotelici, uricotelici, ureotelici.
I mammiferi sono ureotelici e il ciclo dell’urea ((ureogenesi)
g
) avviene nel fegato,
g ,
parte nel citoplasma, parte nel mitocondrio
La reazione complessiva che conduce alla sintesi di urea è la seguente:
CO2 + NH4+ + 3ATP + acido aspartico + 2H2O
Urea + 2ADP + 2Pi + AMP + PPi + acido fumarico
La formula di struttura dell’urea è :NH2-CO-NH2
in cui un gruppo -NH2 proviene dall’acido aspartico (citoplasma) e l’altro
dall’acido glutammico (mitocondrio); NH4+ proviene dalla reazione catalizzata
d ll glutamminasi.
dalla
l t
i i
Il costo energetico dell’ureogenesi è di 3 ATP, ma i “legami altamente energetici “
spezzati sono 4 ( PPi idrolizzato): l’alta spesa energetica è giustificata dalla
necessità di eliminazione di un composto molto tossico.
tossico
Una piccola quantità di azoto viene eliminata nell’uomo anche sotto forma di
acido urico e deriva fondamentalmente dalla degradazione dei nucleotidi purinici
AMP e GMP.
WWW.SUNHOPE.IT
pag. 49
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
WWW.SUNHOPE.IT
LE VIE ANABOLICHE
PRINCIPALI (fegato)
PROTEINE
AMINOACIDI
POLISACCARIDI
GLUCOSO
LIPIDI
GLICEROLO
ACIDI GRASSI
COLESTEROLO
PIRUVATO
PORFIRINE
MITOCONDRIO
WWW.SUNHOPE.IT
ACETIL-CoA
CITOSOL
CORPI
CHETONICI
CICLO DI KREBS
pag. 54
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 55
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 56
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 57
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 58
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 59
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 60
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 61
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 62
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 63
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 64
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 65
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 66
AMMINOACIDI:
metabolismo della
catena carboniosa
WWW.SUNHOPE.IT
BIOSINTESI DEGLI AMMINOACIDI NON ESSENZIALI
piruvato alanina
p
ossalacetato aspartato (+ glutammina) asparagina
-chetoglutarato
chetoglutarato glutammato + (NH3) glutammina
glutammato prolina, arginina
3-fosfoglicerato
3
fosfoglicerato serina glicina
metionina cisteina (vedi 8° capitolo, vitamina B12)
fenilalanina tirosina
carenza Phe idrossilasi causa fenilchetonuria: porta a ritardo mentale
1:10.000 - 2% popolazione portatori sani - screening di routine sui neonati (si formano fenilpiruvato, fenillattato, fenilacetato 1-2 g/die nelle urine)
Dieta povera in Phe e ricca in Tyr (aspartame Asp-Phe-metanolo)
WWW.SUNHOPE.IT
in giallo
a a glucosio
a.a
in celeste
a a corpi chetonici
a.a.
in rosa
a a glucosio e corpi chetonici
a.a.
arginina, glutammina,
istidina, prolina
glicina, alanina,
serina,
cisteina,triptofano
isoleucina
glutammato
piruvato
propionil~CoA
p
p
isocitrato
triptofano
leucina
acetil-CoA
isoleucina
citrato
acetoacetil-CoA
ossalacetato
leucina
lisina
fenilalanina
tirosina
WWW.SUNHOPE.IT
malato
l t
aspartato, asparagina
-chetoglutato
biotina
B12
succinil~CoA
succinato
f
fumarato
t
fenilalanina
tirosina
valina
metionina
ti i
treonina
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 70
La spesa energetica
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 71
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 72
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 73
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 74
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 75
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 76
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 77
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 78
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 79
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 80
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 81
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 82
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 83
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 84
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 85
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 86
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 87
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 88
Gli aa a catena ramificata, rappresentano circa il 35% degli amminoacidi essenziali
nelle p
proteine muscolari ed il 40% degli
g amminoacidi richiesti dai mammiferi. Sono
tra i nove amminoacidi essenziali, l'organismo non è in grado di sintetizzarli, quindi
devono essere assunti attraverso alimenti proteici come la carne, cereali e legumi,
o integratori specifici. La combinazione di questi tre amminoacidi essenziali
rappresenta circa un terzo del muscolo scheletrico nel corpo umano in forma di
proteine, anche se i BCAA sono presenti nel muscolo scheletrico in forma libera
(non proteica) in quantità marginali
Diversamente da molti altri amminoacidi
amminoacidi, i BCAA sono metabolizzati solo nel muscolo
scheletrico, poiché l'enzima BCAA amino-transferasi non è presente nel fegato dove
invece sono convertiti molti altri amminoacidi. L'enzima limitante del metabolismo dei
BCAA è l'alfal'alfa-chetoacido deidrogenasi a catena ramificata che si trova anche nel
muscolo ed è attivato dall'esercizio fisico o dal digiuno. La carenza di questo enzima è
determinata da una rara malattia genetica (MSUD), che genera un aumento dei livelli
di BCAA nel sangue con un rapido deterioramento delle funzioni cerebrali: la terapia
consiste nella riduzione complessiva dei BCCA introdotti giornalmente
giornalmente, tiamina,
tiamina
riduzione del catabolismo muscolare e promozione dell'anabolismo con l'assunzione dei
BCAA insieme a carboidrati ad alto indice glicemico, tali da creare un picco glicemico e
di insulina nel sangue.
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 89
I BCAA sono utilizzati in varie combinazioni e quantità, la leucina è il più prontamente
ossidata ed è quindi più efficace nello stimolare la secrezione di insulina da parte del
pancreas.
Sia durante un lavoro muscolare intenso e protratto sia durante la prima fase del
recupero, la concentrazione di glucosio e di insulina nel sangue diminuiscono, mentre
aumentano le catecolamine, nel muscolo e nel fegato la sintesi proteica rallenta e la
degradazione
g
delle proteine
p
viene accelerata.
L'insulina fa captare ai tessuti dal sangue anche i 5 amminoacidi (leucina, isoleucina,
valina, tirosina e phenilalanina) che hanno in comune col triptofano lo stesso carrier
per attraversare la barriera emato
emato-encefalica
encefalica e arrivare al cervello.
cervello In questo
modo, tutto il triptofano riesce a passare la barriera.
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 90
Oltre all'insulina, è opportuno considerare l'effetto del glucagone, ormoni secreti
entrambi dalle isole di Langherans del pancreas (da cellule diverse, ma non sono secreti
mai contemporaneamente).
contemporaneamente) Digiuno,
Digiuno valori stabili di insulina nel sangue (calma
insulinemica), e attività fisica stimolano la sintesi di glucagone. Il glucagone determina
l'uso preferenziale di grassi e proteine per fornire energia al posto del glucosio, e la
rottura dei legami della molecola di glicogeno in glucosio. L'assunzione di carboidrati ad
alto IG durante l'attività fisica (anche se la secrezione di insulina è bloccata), determina
lo sbalzo glicemico e la fine della produzione di glucagone: se non si è iniziata l'attività
fisica da digiuno per cui il livello di glucagone era già al massimo), viene perso l'effetto
bruciagrassi di questo ormone
ormone, fatto più rilevante nelle attività aerobiche che sono rivolte
principalmente alla diminuzione di massa grassa piuttosto che alla costruzione di massa
magra.
Sono insulinogenici, gli unici a non essere nel tempo stesso glucagonogenici. Isoleucina e
leucina sono chetogenici, leucina è pure non glucogenetica.
In medicina gli amminoacidi ramificati vengono utilizzati per aiutare il recupero delle
vittime di ustioni. Essi sono inoltre utilizzati nel trattamento di alcuni casi di
encefalopatia epatica. Un altro utilizzo frequente degli amminoacido ramificati è
nell'integrazione nel culturismo
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 91
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 92
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 93
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 94
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 95
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 96
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 97
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
La tirosina è un amminoacido polare, la sua molecola è chirale.
L'enantiomero L è uno dei 20 aa ordinari e il suo gruppo laterale è un p-idrossibenzile.
Negli esseri umani non è essenziale, poiché l'organismo umano è in grado di sintetizzarla.
La tirosina è biologicamente importante in quanto precursore di vari ormoni, quali
la tiroxina (un ormone tiroideo) e
le catecolammine (dopamina,
(dopamina noradrenalina e adrenalina),
adrenalina) e della melanina.
melanina
Essendo stata scoperta dal chimico tedesco Justus von Liebig all'interno della caseina, la
tirosina deve il suo nome al vocabolo greco tyros, formaggio.
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 99
Fosforilazione e solfatazione
Alcuni residui di tirosina possono essere marcati con un gruppo fosforico (fosforilato)
da proteine chinasi
chinasi.
La fosforilazione della tirosina può essere considerata come un passaggio chiave nella
trasduzione del segnale e nella regolazione dell'attività enzimatica.
La fosfotirosina può essere rilevata tramite specifici anticorpi. I residui di tirosina
possono essere inoltre modificati tramite l'aggiunta di un gruppo solfato in una reazione
nota come solfatazione della tirosina. Come nel caso della fosfotirosina, anche la
solfotirosina può essere individuata tramite specifici anticorpi.
Tirosina come precursore di ormoni
Nella ghiandola surrenale, la tirosina è convertita in levodopa dall'enzima tirosina
idrossilasi (TH).
La TH è implicata anche nella sintesi della dopamina,
della norepinefrina (noradrenalina) e dell'epinefrina.
Gli ormoni tiroidei triiodotironina (T3) e tiroxina (T4) nella tiroide derivano dalla
tirosina grazie all'azione
all azione dell'enzima
dell enzima tiroglobulina
tiroglobulina. Due residui di tirosina iodinata della
stessa catena polipeptidica reagiscono a dare un residuo di T3 o T4, che viene
rilasciato mediante proteolisi. La iodurazione dell'anello della tirosina può essere
ostacolata da una carenza di iodio causando un patologico ingrossamento della ghiandola
tiroide detto gozzo.
Tirosina come precursori di alcaloidi
Nel Papaver somniferum, il papavero officinale, la tirosina è usata per produrre
l' l l d morfina.
l'alcaloide
f
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
Tirosina come precursore di melanina.
La sintesi delle melanine dalla tirosina ha luogo nelle cellule che producono pigmenti,
i melanociti.
Nel primo passaggio della reazione, che converte l'aminoacido nel 2,3-dopa*, è coinvolta
una perossidasi.
perossidasi L
L'enzima
enzima tirosinasi è coinvolto nel passaggio successivo della via
biosintetica che produce dopachinone. In una prima ramificazione della via, il dopachinone
viene convertito in melanine nere polimeriche, mentre la reazione con la cisteina forma
una serie di p
polimeri simili tra loro detti melanine rosse p
polimeriche.
La mancanza dell'enzima tirosinasi non permette la sintesi di melanina, dando così
l'albinismo. Gli albini sono caratterizzati una deficienza di pigmentazione della pelle, della
coroide, dei peli e dei capelli e da una maggior sensibilità alla luce solare.
*diidrossifenilalanina
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 101
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 102
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 103
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 104
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 105
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 106
+
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 107
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 108
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 109
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 110
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 111
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 112
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 113
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 114
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 115
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 116
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 117
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 118
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 119
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 120
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 121
2
WWW.SUNHOPE.IT
Maggio 2005
pag. 122
2
WWW.SUNHOPE.IT
Maggio 2005
Autore: Professoressa Carla Bovina
pag. 123
LA GLICOGENOSINTESI
Residuo di glicogeno oppure di glicogenina
come nucleo iniziatore
Glicogeno Sottoposto a regolazione ormonale
sintetasi
UDP-glucoso + PPi
pirofosfatasi
2 Pi
UTP
+
Glucoso 1-P
isomerasi
Glucoso 6-P
WWW.SUNHOPE.IT
pag. 124
LA GLUCONEOGENESI
glucoso + Pi
glucoso 6 fosfatasi glucoso 6-P
fruttoso 6-P + Pi
fruttoso 1,6 bisfosfatasi
fruttoso 1,6-P
gliceraldeide 3-P (2 molecole)
NADH+H+ NAD
1,3 BPG (2)
ATP ADP
3 fosfoglicerato (2)
2 fosfoglicerato (2)
PEP carbossicinasi ossalacetato + CO + GTP
2
PEP (2)
piruvato+ ATP + CO2
WWW.SUNHOPE.IT
piruvato
carbossilasi
mitocondrio
ossalacetato
pag. 125
I PRECURSORI GLUCONEOGENETICI
GLUCOSO-6-P
glucoso 6-fosfatasi
GLUCOSO EMATICO
enzima
i
esclusivamente
l i
t epatico
ti
DIOSSIACETONE-P
GLICEROLO FOSFATO
PEP
OSSALACETATO
piruvato
carbossilasi
PIRUVATO
SUCCINATO
ALFA-CHETOGLUTARATO
AMINOACIDI
GLUCONEOGENETICI
LATTATO
WWW.SUNHOPE.IT
pag. 126
Precursori glucogenetici
- Lattato e Piruvato
- Intermedi del ciclo di Krebs
- Gli scheletri carboniosi degli aminoacidi
(dopo deaminazione)
- Acidi grassi a catena dispari
ossalacetato
lisina e leucina sono gli unici aminoacidi che non possono essere convertiti in ossalacetato
perché il loro catabolismo porta ad acetil-CoA e negli animali non esiste una via metabolica:
A til C A
Acetil-CoA
WWW.SUNHOPE.IT
ossalacetato
l t t
L’INTERAZIONE
L
INTERAZIONE FEGATO-MUSCOLO
FEGATO MUSCOLO
GLICOGENOLISI
lattato
glicogeno
GLICOLISI
ATP
l tt t nell sangue
lattato
lattato
ATP
WWW.SUNHOPE.IT
glucoso
l
nell sangue
glucoso
GLUCONEOGENESI
pag. 128
DESTINO METABOLICO
DEGLI AMINOACIDI
PIRUVATO
AMINOACIDI
CHETOGENETICI
ACETIL-CoA
ossalacetato
succinato
citrato
alfa-cheto-glutarato
AMINOACIDI
GLUCONEOGENETICI
WWW.SUNHOPE.IT
pag. 129
I CORPI CHETONICI
glicolisi
piruvato
Acetil-CoA
Acetil-CoA
ossalacetato
MITOCONDRIO
catabolismo AA
beta ossidazione
Acetil-CoA
Acetil-CoA
Acetil-CoA Acetil-CoA
Acetil-CoA
Acetil-CoA
Acetil-CoA
citrato
succinato
alfa-cheto-glutarato
acetil-CoA + acetil-CoA acetoacetil-CoA beta –idrossi-betametilglutaril-CoA IN CIRCOLO
acetoacetato, beta-idrossibutirrato, acetone
WWW.SUNHOPE.IT
pag. 130
SINTESI E UTILIZZAZIONE DEI CORPI
CHETONICI
FEGATO
Acidi grassi
SANGUE
TESSUTI EXTRAEPATICI
Ciclo di Krebs
Beta
ossidazione
Acetil-CoA
Acetoacetato
Beta-idrossiB
t id
i
butirrato
WWW.SUNHOPE.IT
2 Acetil-CoA
A til C A
Reazioni
assenti nel
fegato ! !
Acetoacetato
Beta-idrossibutirrato
pag. 131
IL COLESTEROLO: SINTESI E RUOLI
2 Acetil-CoA
Acetoacetil-CoA
HMG-CoA
colesterolo
L’enzima HMG-COA reduttasi, NADPH-dipendente,
viene inibito dal colesterolo stesso (feed-back).
Lo stesso enzima è inibito competitivamente da farmaci
utilizzati per abbassare la colesterolemia, le statine.
I ruoli del colesterolo sono:
trasportatore di acidi grassi
costituente delle membrane
precursore di ormoni steroidi
precursore degli acidi biliari
STATINE
Il colesterolo NON è una
molecola energetica. Il
colesterolo in eccesso viene,
infatti convertito in acidi
biliari, utili emulsionanti
per la digestione dei lipidi.
isolante delle guaine mieliniche nervose
WWW.SUNHOPE.IT
pag. 132
BIOSINTESI DEGLI ACIDI GRASSI
(citoplasma)
Acetil-CoA + ATP + CO2 Malonil-CoA
Il grande complesso multienzimatico acido grasso sintetasi utilizza come
substrati tanti malonil-CoA, molecole che si differenziano dal prodotto della beta
ossidazione acetil-CoA,, e le unisce fra loro formando p
precursori di acidi ggrassi a
numero via via crescente di atomi di C.
Il coenzima utilizzato come agente riducente è NADPH + H+ a sua volta ridotto a
partire da NADP + principalmente durante le tappe della via dei pentosi .
Si ricorda che gli acidi grassi linoleico,
linoleico linolenico,
linolenico arachidonico devono essere
introdotti con la dieta poiché sono essenziali sotto il profilo nutrizionale.
WWW.SUNHOPE.IT
pag. 133